使用纳米孔和复合部分的核酸分子检测的制作方法
背景技术:
可以使用例如基于热循环的方法(例如聚合酶链反应(pcr))或等温方法(例如环介导的等温扩增)来扩增核酸分子。可在核酸分子扩增的同时或之后检测扩增产物。这可以允许鉴定感兴趣的核酸序列,如单核苷酸多态性(snp)、序列突变(包括例如缺失、插入、复制和易位)、罕见核酸分子/序列和样品中其他感兴趣的序列。此外,可以使用核酸扩增来制备用于核酸测序的核酸分子。
技术实现要素:
尽管目前存在可用于核酸扩增和序列鉴定的方法和系统,但各种限制与这类方法相关联。一些核酸序列鉴定方法是昂贵的,并且可能不会在预期应用所需的时间框架内和/或准确度下足够快速地生成序列信息。在此认识到对能够进行序列鉴定的用于鉴定核酸扩增反应产物的改进方法存在需求。
本公开内容提供了用于容易地测定生物样品中靶核酸序列或分子的存在或不存在的系统和方法。
本公开内容的一方面提供了一种在具有或疑似具有靶核酸分子的样品中测定靶核酸分子的存在的方法,该靶核酸分子与复合部分偶联。所述方法包括(a)促使样品流过邻近或靠近电极而设置的膜中的至少一个纳米孔,该电极适于在具有与所述复合部分偶联的靶核酸分子的复合物移动穿过所述至少一个纳米孔时检测电流或其变化,其中所述移动花费的停留时间长于当靶核酸分子不与所述复合部分偶联时,靶核酸分子移动穿过所述至少一个纳米孔所花费的停留时间;以及(b)在促使所述样品流过所述至少一个纳米孔时,用所述电极测量电流或其变化;以及(c)在没有获得靶核酸分子的核酸序列的情况下,从(b)中测得的电流或其变化检测所述样品中的所述复合物,从而测定所述样品中靶核酸分子的存在。
另一方面提供了一种在具有或疑似具有靶核酸分子的样品中测定靶核酸分子的存在的方法,该靶核酸分子与除聚合酶之外的蛋白质偶联。所述方法包括(a)促使样品流过邻近或靠近电极而设置的膜中的至少一个纳米孔,该电极适于在具有与所述蛋白质偶联的靶核酸分子的复合物移动穿过所述至少一个纳米孔时检测电流或其变化,其中所述移动花费的停留时间长于当靶核酸分子不与所述蛋白质偶联时,靶核酸分子移动穿过所述至少一个纳米孔所花费的停留时间;以及(b)在促使所述样品流过所述至少一个纳米孔时,用所述电极测量电流或其变化;以及(c)根据(b)中测得的电流或其变化检测所述样品中的所述复合物,从而测定所述样品中靶核酸分子的存在。
另一方面提供了一种在具有或疑似具有靶核酸分子的样品中测定靶核酸分子的存在的方法,该靶核酸分子在使得酶不具有酶促活性的条件下与该酶偶联。所述方法包括(a)促使样品流过邻近或靠近电极而设置的膜中的至少一个纳米孔,该电极适于在具有与所述酶偶联的靶核酸分子的复合物移动穿过所述至少一个纳米孔时检测电流或其变化,其中所述移动花费的停留时间长于当靶核酸分子不与所述酶偶联时,靶核酸分子移动穿过所述至少一个纳米孔所花费的停留时间;以及(b)在促使所述样品流过所述至少一个纳米孔时,用所述电极测量电流或其变化;以及(c)根据(b)中测得的电流或其变化检测所述样品中的所述复合物,从而测定所述样品中靶核酸分子的存在。在一些实施方案中,所述条件选自样品的盐浓度和样品的温度。在一些实施方案中,该盐浓度包括mg2+的浓度。在一些实施方案中,该浓度小于1摩尔/升(m)。在一些实施方案中,该浓度小于0.1m。在一些实施方案中,该浓度小于0.01m。在一些实施方案中,该浓度小于0.001m。
在一些实施方案中,所述复合部分、蛋白质或酶与所述膜偶联。在一些实施方案中,所述复合部分、蛋白质或酶与所述膜共价偶联。
在一些实施方案中,所述复合部分、蛋白质或酶与所述纳米孔偶联。在一些实施方案中,所述复合部分、蛋白质或酶与所述纳米孔共价偶联。
在一些实施方案中,所述复合部分是蛋白质。在一些实施方案中,该蛋白质是内切核酸酶或外切核酸酶。在一些实施方案中,该蛋白质与靶核酸分子结合的结合强度大于针对任何其他核酸分子的结合强度。
在一些实施方案中,所述复合部分是引物。在一些实施方案中,该引物是通用引物。
在一些实施方案中,所述样品包含复合物。在一些实施方案中,所述样品具有小于1m的mg2+浓度。在一些实施方案中,该浓度小于0.1m。在一些实施方案中,该浓度小于0.01m。在一些实施方案中,该浓度小于0.001m。
在一些实施方案中,所述复合部分、蛋白质或酶与靶核酸分子可逆地偶联。在一些实施方案中,所述复合部分、蛋白质或酶在施加电场和/或压力脉冲后可从靶核酸分子上移除。
在一些实施方案中,在上文提及的步骤(a)之前,进行以下步骤:(i)提供反应混合物,其包含具有或疑似具有模板核酸分子作为靶核酸分子的前体的生物样品,与该模板核酸分子互补的至少一种引物,和聚合酶,以及(ii)在产生所述样品中的靶核酸分子的条件下使所述反应混合物经历核酸扩增反应。在一些实施方案中,在所述核酸扩增反应期间或之后提供所述复合部分、蛋白质或酶。在一些实施方案中,所述样品包含靶核酸分子。在一些实施方案中,该靶核酸分子是作为所述核酸扩增反应的扩增产物的多个拷贝中的拷贝。在一些实施方案中,所述引物具有一个或多个限制酶切位点或针对所述复合部分、蛋白质或酶的结合位点。在一些实施方案中,所述核酸扩增反应是聚合酶链反应(pcr)。在一些实施方案中,所述核酸扩增反应是等温扩增。在一些实施方案中,该等温扩增是环介导的等温扩增(lamp)。在一些实施方案中,所述至少一种引物包括至少两种引物。
在一些实施方案中,所述复合部分、蛋白质或酶与靶核酸分子特异性结合。在一些实施方案中,上文提及的步骤(b)包括测量电流变化,该变化指示所述复合物的存在。在一些实施方案中,该电流变化是电流相对于时间的一阶导数(firstmomentofcurrentwithtime)。
在一些实施方案中,在促使所述样品流过所述至少一个纳米孔之后测量电流。在一些实施方案中,所述复合部分、蛋白质或酶与靶核酸分子可逆地偶联。在一些实施方案中,所述至少一个纳米孔具有约0.5纳米(nm)至30nm的横截面尺寸。在一些实施方案中,该横截面尺寸为约1nm至20nm。在一些实施方案中,该横截面尺寸为约2.5nm至3.4nm。
在一些实施方案中,所述膜是脂双层。在一些实施方案中,所述膜是固态膜。在一些实施方案中,该固态膜包含半导体或非金属。在一些实施方案中,该固态膜包含选自碳、硅、锗和砷化镓的材料。在一些实施方案中,该固态膜由石墨烯形成。
在一些实施方案中,所述至少一个纳米孔是所述膜中的成孔蛋白质。在一些实施方案中,该成孔蛋白质是α溶血素或mspa孔蛋白。
在一些实施方案中,所述促使包括跨所述至少一个纳米孔施加电位。在一些实施方案中,该电位是可逆的。在一些实施方案中,该电位相对于参比为约1v至10v。
在一些实施方案中,所述方法进一步包括跨所述至少一个纳米孔施加压降或电位脉冲,以使所述复合部分、蛋白质或酶从靶核酸分子上解偶联,该脉冲在促使所述样品流过所述至少一个纳米孔之后施加。在一些实施方案中,所述至少一个纳米孔邻近或靠近附加电极。在一些实施方案中,靶核酸分子通过以下步骤进行检测:(i)在所述样品流过至少一个纳米孔时测量电流或其变化,以及(ii)将该电流或其变化与参考值进行比较。在一些实施方案中,所述复合部分、蛋白质或酶在所述复合部分、蛋白质或酶与所述至少一个纳米孔相互作用后增加停留时间。
在一些实施方案中,所述至少一个纳米孔包括多个纳米孔。在一些实施方案中,所述多个纳米孔是可单独寻址的。在一些实施方案中,在所述样品流过所述至少一个纳米孔时,在没有获得靶核酸分子的核酸序列的情况下,从电流或其变化的连续测量检测靶核酸分子。在一些实施方案中,在指示存在靶核酸分子的停留时间时检测电流或其变化。在一些实施方案中,靶核酸分子包含至少5个连续的核苷酸碱基。在一些实施方案中,靶核酸分子包含至少10个连续的核苷酸碱基。在一些实施方案中,靶核酸分子包含至少20个连续的核苷酸碱基。在一些实施方案中,靶核酸分子是单链的。在一些实施方案中,靶核酸分子是双链的。在一些实施方案中,靶核酸分子是脱氧核糖核酸(dna)或核糖核酸(rna)。
本公开内容的另一方面提供了一种用于在具有或疑似具有靶核酸分子的样品中测定靶核酸分子的存在的系统,该靶核酸分子包含至少5个连续的核苷酸碱基。所述系统包含:邻近或靠近电极而设置的膜中的至少一个纳米孔,其中该电极适于在样品流过所述至少一个纳米孔时检测电流;与所述至少一个纳米孔流体连通且适于保持所述样品的至少一个样品支持体;以及计算机处理器,其可操作地耦合至所述电极并被编程为(i)促使所述样品从所述至少一个样品支持体流过所述至少一个纳米孔,(ii)测量单个核酸分子在所述纳米孔中或穿过所述纳米孔的停留时间,以及(iii)当所述停留时间落入参考阈值之内时,将所述单个核酸分子鉴定为靶核酸分子。
在一些实施方案中,所述计算机处理器被编程为测量所述单个核酸分子穿过所述纳米孔的第一停留时间,并且如果第一停留时间长于当靶核酸分子不与复合部分偶联时,靶核酸分子在所述至少一个纳米孔中或穿过所述至少一个纳米孔的第二停留时间,则将所述单个核酸分子鉴定为靶核酸分子。
在一些实施方案中,所述复合部分是蛋白质。在一些实施方案中,该蛋白质不是聚合酶。在一些实施方案中,该蛋白质是内切核酸酶或外切核酸酶。
在一些实施方案中,所述复合部分是引物。在一些实施方案中,该引物是通用引物。
在一些实施方案中,靶核酸分子包含至少10个连续的核苷酸碱基。在一些实施方案中,靶核酸分子包含至少20个连续的核苷酸碱基。在一些实施方案中,靶核酸分子是单链的。在一些实施方案中,靶核酸分子是双链的。
在一些实施方案中,所述计算机处理器被编程为在没有获得所述单个核酸分子的核酸序列的情况下,将所述单个核酸分子鉴定为靶核酸分子的至少一部分。
在一些实施方案中,所述样品具有小于1m的mg2+浓度。在一些实施方案中,该浓度小于0.1m。在一些实施方案中,该浓度小于0.01m。在一些实施方案中,该浓度小于0.001m。
在一些实施方案中,所述计算机处理器被编程为(a)测量电流或其变化,以及(b)从该电流或其变化确定停留时间。在一些实施方案中,相对于基线测量电流或其变化。在一些实施方案中,所述计算机处理器被编程为在促使所述样品流过所述至少一个纳米孔之后测量电流或其变化。在一些实施方案中,所述计算机处理器被编程为在将所述电流或其变化与参考值进行比较后确定停留时间。
在一些实施方案中,所述至少一个纳米孔具有约0.5纳米(nm)至30nm的横截面尺寸。在一些实施方案中,该横截面尺寸为约1nm至20nm。在一些实施方案中,该横截面尺寸为约2.5nm至3.4nm。
在一些实施方案中,所述膜是脂双层。在一些实施方案中,所述膜是固态膜。在一些实施方案中,该固态膜包含半导体或非金属。在一些实施方案中,该固态膜包含选自碳、硅、锗和砷化镓的材料。在一些实施方案中,该固态膜由石墨烯形成。
在一些实施方案中,所述至少一个纳米孔是所述膜中的成孔蛋白质。在一些实施方案中,该成孔蛋白质是α溶血素或mspa孔蛋白。
在一些实施方案中,所述计算机处理器被编程为跨所述纳米孔施加电位。在一些实施方案中,该电位是可逆的。在一些实施方案中,该电位相对于接地电极为约1v至10v。在一些实施方案中,所述计算机处理器被编程为跨所述纳米孔施加电位脉冲,其中该脉冲使与靶核酸分子偶联的复合部分解偶联。
在一些实施方案中,所述纳米孔邻近或靠近附加电极。在一些实施方案中,该附加电极是参比电极。在一些实施方案中,所述至少一个纳米孔包括多个纳米孔。在一些实施方案中,所述多个纳米孔是可单独寻址的。
在一些实施方案中,所述至少一个纳米孔是芯片的一部分。在一些实施方案中,所述计算机处理器与该芯片分开。在一些实施方案中,所述计算机处理器是移动电子设备的一部分。
在一些实施方案中,所述计算机处理器是具有所述电极的电路的一部分。在一些实施方案中,所述计算机处理器与具有所述电极的电路分开。在一些实施方案中,所述计算机处理器为专用集成电路(asic)。
基于仅示出和描述了本发明的说明性实施方案的以下详述,本发明的其他方面和优点将变得对本领域技术人员而言显而易见。将会认识到,本发明能够包括其他不同的实施方案,并且能够在各个明显的方面对其若干细节进行更改,所有这些均不背离本公开内容。相应地,附图和说明书将被视为在本质上是说明性的,而非限制性的。
援引并入
本说明书中提到的所有出版物、专利和专利申请均通过引用而并入本文,其程度犹如特别地且单独地指出每个单独的出版物、专利或专利申请通过引用而并入。
附图说明
本发明的新颖特征在所附的权利要求书中具体阐述。通过参考以下对利用本发明原理的说明性实施方案加以阐述的详细描述和附图(本文中也称为“图”),将会获得对本发明的特征和优点的更好的理解,在这些附图中:
图1示出了用于检测靶核酸分子的一般工作流程。
图2示出了包含具有纳米孔的膜的纳米孔传感器。
图3a示出了与纳米孔传感器的具有纳米孔的膜偶联的复合部分,和邻近该膜的靶核酸分子;图3b示出了穿透纳米孔并与图3a的复合部分偶联的靶核酸。
图4示出了由纳米孔传感器测量的随时间变化的电流(i)的图。
图5示出了被编程或以其他方式被配置用于实现本文提供的方法的计算机控制系统。
具体实施方式
尽管本文中已经示出并描述了本发明的多个实施方案,但对于本领域技术人员来说显而易见的是,这些实施方案仅以示例的方式提供。本领域技术人员在不背离本发明的情况下可想到多种变化、改变和替代。应当理解,可以使用本文所述的本发明实施方案的各种替代方案。
本文所用的术语“膜”通常是指将至少两个体积的流体隔开的结构。膜的实例包括但不限于固态膜和脂双层。膜可以是有机膜如脂双层,或合成膜如由固态材料(例如,半导体、金属、半金属或非金属)或聚合材料形成的膜。
本文所用的术语“纳米孔”通常是指在膜中形成或以其他方式提供的孔、通道或通路。纳米孔可设置成邻近或靠近传感电路或与传感电路耦合的电极,例如,互补金属氧化物半导体(cmos)或场效应晶体管(fet)电路。在一些实例中,纳米孔具有0.1纳米(nm)至约1000nm数量级的特征尺寸(例如横截面、宽度或直径)。一些纳米孔是蛋白质。α溶血素是蛋白质纳米孔的一个实例。
本文所用的术语“核酸”通常是指包含一个或多个核酸亚单位的分子。核酸可包含一个或多个选自腺苷(a)、胞嘧啶(c)、鸟嘌呤(g)、胸腺嘧啶(t)和尿嘧啶(u)或其变体的亚单位。核苷酸可包含a、c、g、t或u,或其变体,包括但不限于肽核酸(pna)。核苷酸可包含能够掺入到生长中的核酸链内的任何亚单位。这样的亚单位可以是a、c、g、t或u,或对于一个或多个互补a、c、g、t或u是特异性的或与嘌呤(即,a或g,或其变体)或嘧啶(即,c、t或u,或其变体)互补的任何其他亚单位。亚单位可以使单个核酸碱基或成组碱基(例如,aa、ta、at、gc、cg、ct、tc、gt、tg、ac、ca或其尿嘧啶对应物)能够得到解析。在一些示例中,核酸是脱氧核糖核酸(dna)或核糖核酸(rna),或其衍生物。核酸可以是单链或双链的。核酸可包含一种或多种修饰的核苷酸,如甲基化核苷酸和核苷酸类似物。
本文所用的术语“聚合酶”通常是指能够催化聚合反应的任何酶。聚合酶的示例包括但不限于核酸聚合酶、转录酶或连接酶。聚合酶可以是聚合反应酶。
本文所用的术语“复合部分”通常是指与核酸分子偶联(例如,附接)的任何原子或分子物质。复合部分可以是蛋白质,如酶。复合部分可以具有与给定靶核酸分子相互作用的活性位点。该相互作用可以是可逆的或不可逆的。
本文所用的术语“受试者”通常是指动物或其他生物体,如哺乳动物物种(例如,人)、禽类(例如,鸟)物种或植物。哺乳动物包括但不限于鼠类、猿类、人类、农场动物、运动动物和宠物。受试者可以是患有或疑似患有某种疾病或有患该疾病的倾向的个体,或者需要治疗或疑似需要治疗的个体。受试者可以是患者。
本文所用的术语“样品”通常是指含有或疑似含有核酸分子的任何样品。例如,受试者样品可以是含有一种或多种核酸分子的生物样品。该生物样品可从受试者的身体样品获得(例如,提取或分离),该身体样品可选自血液(例如,全血)、血浆、血清、尿液、唾液、粘膜分泌物、痰、粪便和泪液。该身体样品可以是受试者的体液或组织样品(例如,皮肤样品)。在一些示例中,该样品获自受试者的无细胞体液,如全血。在这样的情况下,该样品可包含无细胞dna和/或无细胞rna。在一些其他示例中,该样品是环境样品(例如,土壤、废物、环境空气等)、工业样品(例如,来自任何工业过程的样品)和食物样品(例如,奶制品、植物产品和肉制品)。
本文所用的术语“基因组变异”通常是指受试者的核酸样品或基因组中的变体或多态性。变体的实例包括单核苷酸多态性、单核苷酸变体、插入、缺失、置换、重复、可变长度串联重复、侧翼序列、结构变体、颠换、重排和拷贝数变异。
测定靶核酸分子的存在
本公开内容的一方面提供了用于测定样品中靶核酸分子的存在的方法和系统。靶核酸分子可以具有用于预期应用的感兴趣的核酸序列,该应用包括但不限于物种鉴定、环境测试、法医分析以及一般研究和疾病表征。
可使用传感器检测样品中靶核酸分子的存在。该传感器可以具有被配置用于检测电流或电流随时间的变化的一个或多个纳米孔的阵列。可以通过测量电流(c)或电流随时间的变化(或电流相对于时间的一阶导数,dc/dt),并且在一些情况下通过将这样的测量值与参考值(或基线)进行比较来检测靶核酸分子。
样品可以包含一种或多种分子,其中至少一些分子可以是靶核酸分子。任何分子在纳米孔中或穿过纳米孔的停留时间(或滞留时间)可以指示样品中靶核酸分子的存在。在一些情况下,靶核酸分子具有可检测的在纳米孔中的停留时间,其可以大于样品中的其他分子。通过测量电流或电流随时间的变化并确定停留时间,可在样品中检测靶核酸分子(如果存在)。
可以使用复合部分来增加靶核酸分子的停留时间,该复合部分与靶核酸分子偶联(例如附接)从而形成减慢靶核酸分子流过纳米孔的复合物。该复合部分可以是蛋白质,如具有与靶核酸分子的一部分偶联的活性位点的酶。该复合部分可在复合物与纳米孔或膜相互作用后或在该复合部分与靶核酸分子相互作用后增加停留时间。
复合部分与靶核酸分子的偶联可以是可逆的,使得在施加刺激后,可以去除靶核酸分子与复合部分之间的偶联。这样的刺激可以是电压,如电压脉冲(例如,10v脉冲)。
靶核酸分子可以是脱氧核糖核酸(dna)、核糖核酸(rna)或其变体。例如,可以通过使靶核酸样品断裂成片段,对靶核酸样品进行处理。靶核酸分子可以是单链或双链的。
靶核酸分子可以包含连续的核苷酸。在一些实例中,靶核酸分子包含至少5、10、30、40、50、100、200、300、400、500或1000个核苷酸。
靶核酸分子可以是样品中的模板核酸分子的扩增产物。在一些情况下,可以通过从受试者获取生物样品并使该样品经历核酸扩增以扩增模板核酸分子的至少一部分来检测靶核酸分子。如果存在感兴趣的核酸序列,那么可在被选择用于扩增模板核酸分子或其一部分的条件下进行核酸扩增。如果存在感兴趣的核酸序列,那么核酸扩增可以产生一种或多种扩增的核酸产物。这样的产物可以包括靶核酸分子。
模板核酸分子可以是dna、rna或其变体。例如,可以通过使模板核酸样品断裂成片段,对模板核酸样品进行处理。模板核酸分子可以是单链或双链的。
一旦样品经历了核酸扩增,即可检测到靶核酸分子。这可以使用本文其他地方描述的传感器来进行。可在不进行核酸测序,例如不获得样品中靶核酸分子或其他核酸分子的核酸序列的情况下检测靶核酸分子。例如,可以在不进行合成测序技术(例如,illumina、pacificbiosciencesofcalifornia、genia或iontorrent)的情况下确定靶核酸分子的存在。可在不连续测量指示靶核酸分子的至少1、2、3、4或5个核苷酸的信号(例如,光信号或电流)的情况下确定靶核酸分子的存在。
图1示出了样品处理的工作流程。在第一操作101中,制备生物样品以供检测。例如,可从受试者的体液获取生物样品,并且可从体液中分离核酸分子。该核酸分子可以是用于后续分析的模板核酸分子。在一些情况下,对该核酸分子进行处理以产生模板核酸分子,如进行片段化以产生多个模板核酸分子。
模板核酸分子随后可以经受核酸扩增条件以扩增(即,生成一个或多个拷贝)模板核酸分子。模板核酸分子的扩增产物可以是用于后续分析的靶核酸分子。
在一些情况下,提供一种反应混合物,其包含具有或疑似具有模板核酸分子作为靶核酸分子的前体的生物样品。该反应混合物还可以包含与模板核酸分子互补的至少一种引物和聚合酶。所述至少一种引物可以包括1、2、3、4、5、6、7、8、9、10、20、30、40或50种引物。每种引物可以具有为了特定类型的分析,如检测受试者中的给定疾病或基因组变异而选择的序列。该引物可以具有一个或多个限制酶切位点或针对复合部分的结合位点。
接下来,可在产生样品中的靶核酸分子的条件下使反应混合物经历核酸扩增反应。靶核酸分子可以是模板核酸分子的多个拷贝中的拷贝,该拷贝是该核酸扩增反应的扩增产物。
所述反应混合物可以包含完成核酸扩增(例如,dna扩增、rna扩增)所需的试剂,这类试剂的非限制性示例包括对靶rna或靶dna具有特异性的引物组、由rna的逆转录产生的dna、dna聚合酶、逆转录酶(例如,用于rna的逆转录)、合适的缓冲液(包括两性离子缓冲液)、辅因子(例如,二价和单价阳离子)、dntp以及其他酶(例如,尿嘧啶-dna糖基化酶(ung)等)。在一些情况下,反应混合物还可包含一种或多种报道剂(reporteragent)。该反应混合物还可以包含适合于促进核酸扩增的酶,如聚合化酶(本文中也称为“聚合酶”)。该聚合酶可以是用于扩增dna的dna聚合酶。可以使用任何合适的dna聚合酶,包括可商购的dna聚合酶。dna聚合酶可以能够以模板结合的方式将核苷酸掺入到dna链中。dna聚合酶的非限制性示例包括taq聚合酶、tth聚合酶、tli聚合酶、pfu聚合酶、vent聚合酶、deepvent聚合酶、ex-taq聚合酶、la-taq聚合酶、expand聚合酶、sso聚合酶、poc聚合酶、pab聚合酶、mth聚合酶、pho聚合酶、es4聚合酶、tru聚合酶、tac聚合酶、tne聚合酶、tma聚合酶、tih聚合酶、tfi聚合酶、platinumtaq聚合酶、hi-fi聚合酶、tbr聚合酶、tfl聚合酶、pfutubo聚合酶、pyrobest聚合酶、pwo聚合酶、kod聚合酶、bst聚合酶、sac聚合酶、klenow片段,以及它们的变体、修饰的产物和衍生物。对于某种热启动聚合酶,可能需要在94℃-95℃下2分钟至10分钟的变性步骤,这根据不同的聚合酶可能会改变热曲线。
在一些情况下,dna样品可以由rna样品生成。这可以采用逆转录酶实现,该逆转录酶可以包括在与rna模板结合时能够将核苷酸掺入到dna链中的酶。可以使用任何合适的逆转录酶。逆转录酶的非限制性示例包括hiv-1逆转录酶、m-mlv逆转录酶、amv逆转录酶、端粒酶逆转录酶,以及它们的变体、修饰的产物和衍生物。
核酸扩增反应可以包括一个或多个用于生成扩增产物的引物延伸反应。在pcr中,例如,引物延伸反应可以包括以下的循环:将反应混合物在变性温度下温育一段变性持续时间,以及将反应混合物在延伸温度下温育一段延伸持续时间。变性温度可根据例如所分析的具体生物样品、生物样品中靶核酸的具体来源(例如,病毒颗粒、细菌)、所使用的试剂和/或所需的反应条件而变化。例如,变性温度可为约80℃至约110℃。在一些示例中,变性温度可为约90℃至约100℃。在一些示例中,变性温度可为约90℃至约97℃。在一些示例中,变性温度可以为约92℃至约95℃。在另外其他的示例中,变性温度可为至少约80℃、81℃、82℃、83℃、84℃、85℃、86℃、87℃、88℃、89℃、90℃、91℃、92℃、93℃、94℃、95℃、96℃、97℃、98℃、99℃或100℃。
作为替代方案,在等温扩增中,温度可以是固定的(即,不循环),并且可以采用引物组和除了复制活性之外还具有较高链置换活性的聚合酶来生成扩增产物。可能适合用于等温扩增的聚合酶的示例为bst聚合酶。可以将温度固定在约50℃至80℃,或60℃至65℃。在环介导的等温扩增(lamp)中,例如,可以采用聚合酶和具有至少2、3、4或5种引物的引物组来扩增模板核酸分子。
在核酸扩增期间或之后,可向反应混合物中提供复合部分。该复合部分可以允许使用本公开内容的纳米孔传感器来检测靶核酸分子。
继续参见图1,在第二操作102中,在使模板核酸分子经历核酸扩增之后,可以确定作为扩增产物的靶核酸分子的存在。这可以通过检测指示存在靶核酸分子的一种或多种信号来实现,如在使用本文其他地方描述的传感器测量电流或电流随时间的变化时的靶核酸分子的停留时间。接下来,在第三操作103中,对所述一种或多种信号进行分析以确定靶核酸分子是存在还是不存在。还可以对所述一种或多种信号进行分析以确定靶核酸分子的相对量。
模板核酸分子的扩增和靶核酸分子的检测可以在同一系统如器皿中进行。在一些情况下,该系统是配置用于核酸扩增的管,如eppendorfpcr管。作为替代方案,扩增和检测在分开的系统中进行。例如,扩增在eppendorfpcr管中进行,而检测在具有纳米孔传感器的分开的芯片中进行。
纳米孔传感器
本公开内容的另一方面提供了用于检测靶核酸分子的纳米孔传感器。纳米孔传感器可以包含膜中的一个或多个纳米孔的阵列。每个纳米孔可设置成邻近测量电极,该测量电极被配置用于检测电流或电流随时间的变化,在一些情况下参考参比电极进行检测。
所述阵列可以包含至少1、2、3、4、5、6、7、8、9、10、100、200、300、400、500、1000、10000、100000或1000000个传感器。每个传感器可以包含至少1、2、3、4或5个纳米孔。每个传感器可以是可单独寻址的。纳米孔的密度可以是至少约100、200、300、400、500、600、700、800、900、1000、10000、100000、106、107、108、109、1010或1011个纳米孔/平方毫米(mm2)。
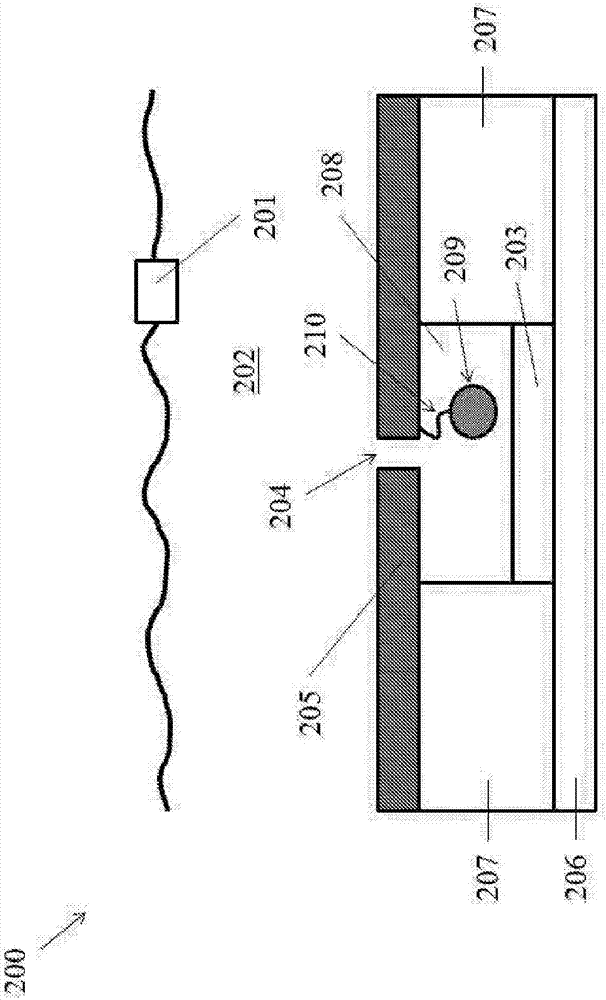
图2示出了纳米孔传感器200,其包含与导电溶液202(例如盐溶液)接触的第一电极201。传感器200包含接近、邻近或靠近膜205中的纳米孔204的第二电极203。第二电极203与具有用于信号(例如电流或电流变化)测量的电路的电路元件206相邻。膜205与至少部分由壁207限定的室208(例如阱/孔(well))相邻。壁207可由半导体如氧化硅或氧化铝(例如sio2)形成。作为替代方案,壁207由聚合材料形成。在一些实例中,壁207是可用于核酸扩增的管的一部分。
纳米孔传感器200可以在被配置用于核酸扩增的容器(例如管)如eppendorfpcr管中。该容器可以包含用于模板核酸分子的核酸扩增的顶部室和用于靶核酸分子的后续检测的底部室。该容器可以是一次性的和/或可重复使用的。
作为替代方案,纳米孔传感器200可以是包含样品支持体(sampleholder)的芯片的一部分。该样品支持体可以包含具有或疑似具有靶核酸分子的样品。该芯片可以具有用于信号检测和处理的板上电子器件(例如计算机处理器)。作为替代方案,该板上电子器件可以是芯片外的,如在与芯片相邻并与芯片通信的计算机系统中。该芯片可以是一次性的和/或可重复使用的。电路元件206可以包含使纳米孔传感器200与计算机系统通信的电流流动路径。
例如,纳米孔传感器200是可插入阅读器(未示出)中并可从阅读器中移除的容器或芯片的一部分。阅读器可以包含允许检测具有或疑似具有靶核酸分子的样品中的靶核酸分子的计算机处理器。作为替代方案,计算机处理器在与阅读器分开并与其通信的计算机系统中。阅读器可以包含将样品引导至纳米孔传感器的流体流动系统(例如,泵和致动器)。
纳米孔传感器200可以包含至少1、2、3、4、5、6、7、8、9、10、100、200、300、400、500、1000、10000、100000或1000000个传感器的阵列。每个传感器可以包含至少1、2、3、4或5个纳米孔。
膜205可以是固态膜。膜205可由半导体或非金属形成。在一些实例中,膜205由选自碳、硅、锗和砷化镓的材料形成。例如,膜205可由石墨烯形成。
作为替代方案,膜205可以是脂双层。该脂双层可以包含两层脂质分子。该脂双层可以包含具有亲水头和各两个疏水尾的磷脂。当暴露于水时,这样的磷脂可自身排列成两层薄片(双层),并且其所有尾均指向薄片的中心。该双层的中心可以含有少量水至无水,并排除分子。该脂双层的外表面可以是亲水性的,而该脂双层的内部可以是疏水性的。
纳米孔204可以是提供穿过膜205的通道的孔。作为替代方案,纳米孔204可以是膜205中的成孔蛋白质。这样的替代方案可在膜205为脂双层的情况下使用。该成孔蛋白质可以是α溶血素或mspa孔蛋白。
纳米孔204可以具有允许流体流过纳米孔204的横截面尺寸。该横截面尺寸可以允许核酸样品流过纳米孔204。该横截面尺寸可以为约0.5纳米(nm)至30nm,或1nm至20nm,2nm至15nm,3nm至10nm,或2.5nm至3.4nm。
纳米孔204可以具有各种形状和尺寸。例如,纳米孔204可以具有矩形、计时沙漏形、凹形、凸形、圆锥形或部分形状或其组合。纳米孔204可以具有跨越膜205的长度。在一些情况下,纳米孔204具有约10nm至5000nm或20nm至1000nm或30nm至1000nm的长度,并且膜205具有约10nm至5000nm或20nm至1000nm或30nm至1000nm的厚度。纳米孔204的长度可与膜205的厚度相同或不同。例如,纳米孔204可以跨越膜205的厚度的至少约50%、60%、70%或80%。
传感器200可进一步包含与膜205偶联的复合部分209。复合部分209可以通过连接体210与膜205偶联。作为替代方案,复合部分209偶联至纳米孔204,如纳米孔204的边缘或被引导穿过膜205的纳米孔204的通道的一部分。可以选择连接体210的位置以提供这样的偶联。
膜205包含反面(transside)和顺面(cisside)。复合部分209设置在膜205的反面。顺面与反面相对。
连接体210可以是包含一个或多个核酸或氨基酸部分的分子,如多核苷酸或多肽。连接体210可以是聚合物。在一些情况下,连接体210是聚合物,如肽、核酸、聚乙二醇(peg)。连接体210可以具有任何合适的长度。例如,连接体210可以具有至少约5nm、10nm、30nm、40nm、50nm或100nm的长度。连接体210可以是刚性的或柔性的。
复合部分209可以包含允许与连接体210偶联的偶联结构域。示例性偶联结构域(其可例如作为框内融合结构域或作为化学偶联结构域与复合部分209偶联)包括以下任何一种:酶的添加的重组二聚体结构域、大的外来多肽结构域、聚组氨酸标签、his-6标签、生物素、抗生物素蛋白序列、gst序列、谷胱甘肽、bitag(avitag)序列、s标签、snap标签、抗体、抗体结构域、抗体片段、抗原、受体、受体结构域、受体片段、配体、染料、接受体、猝灭剂和/或其组合。
作为替代方案,可以不包括连接体210,而复合部分209可以直接与膜205连接。复合部分209可以包含允许与膜205直接偶联(例如附接)的偶联结构域。复合部分209可偶联至膜205或纳米孔204,如纳米孔204的边缘或被引导穿过膜205的纳米孔204的通道的一部分。在一些情况下,复合部分209与纳米孔204或膜205共价偶联。
溶液202可以具有电解质。该电解质可以包括一种或多种盐,如nacl、kcl或agcl。溶液202可以具有允许使用第一电极201和第二电极203检测电流的盐浓度。在一个实例中,该浓度可以为约0.1摩尔/升(m)至10m,或2m至8m。作为另一个实例,该浓度可以为0.1mm至10mm,或0.5mm至5mm。
溶液202可以包含用于pcr的缓冲液。例如,溶液202可以包含50mm至200mmtris-hcl(例如,100mmtris-hcl)、200mm至1000mmkcl(例如,500mmkcl)和0.5mm至5mmmgcl2。
第一电极201和第二电极203可由一种或多种金属形成。在一些情况下,第一电极201和第二电极203由au、ag或pt形成。例如,第一电极201由pt形成,第二电极203由ag形成。作为替代方案,第一电极201由pt形成,第二电极203由agcl形成。
在一些情况下,第二电极203由允许在检测期间电化学消耗电极203的材料形成。例如,第二电极203可由agcl形成。在传感器200的操作期间,agcl→ag++cl-。可以通过对第二电极203施加反电位以使agcl沉积到第二电极203上从而逆转消耗来逆转这一情况。
在一些情况下,通过相对于第一电极201对第二电极203施加直流(dc)电压来操作传感器200。电压范围可以为0.5伏(v)至20v,或1v至10v。在这样的直流操作中,电压可以逆转(即,v→-v→v)。作为替代方案,通过相对于第一电极201对第二电极203施加交流(ac)电压来操作传感器。电压范围可以为0.5v至20v,或1v至10v。
在传感器200的操作期间,可在第一电极201与第二电极203之间施加电压时跨纳米孔204提供电场。该电场可被配置为将溶液202中的靶核酸分子引导至纳米孔204。该电场可以帮助靶核酸分子靠近并穿过纳米孔204。作为替代方案或除此之外,可以跨纳米孔204提供压降,这可以帮助靶核酸分子靠近并穿过纳米孔204。在一些情况下,压力衍生的力超过相对的电压衍生的力。可以使用压降和电场的组合来调节靶核酸分子的运动。例如,可通过在从膜205的反面到顺面施加电场、同时从顺面到反面施加压降,使靶核酸分子的运动减慢。作为替代方案,可通过在从膜205的顺面到反面施加电场、同时从顺面到反面施加压降,使靶核酸分子的运动加速。
在一些情况下,对压力衍生的力和电压衍生的力进行平衡,以调节(例如,增加或减少)靶核酸分子穿过纳米孔204的移位时间(或停留时间)。可以经由关系式qe=fmech从分子上的力平衡推导出电荷,其中“e”是纳米孔204中的电场,其可以是施加在电极201与203之间的电压的函数,而fmech是来自所施加的压力和/或穿过纳米孔204的流体流动在靶核酸分子上的机械力的总和。
在一些情况下,溶液202具有小于100m、50m、40m、30m、20m、10m、5m、1m、0.1m、0.01m或0.001m的mg2+浓度。提供给传感器200以供检测的样品可以具有小于100m、50m、40m、30m、20m、10m、5m、1m、0.1m、0.01m或0.001m的mg2+浓度。
复合部分209可以是蛋白质,如酶。复合部分209可以是除聚合酶之外的酶。复合部分209可以是除分子马达之外的酶。在一些实例中,复合部分209是内切核酸酶或外切核酸酶。复合部分209可以是具有降低的活性或不具有酶促活性的酶。可以选择溶液的条件,使得该酶具有降低的活性或不具有酶促活性。该条件可以选自样品的盐(或离子)浓度和温度。
在一些情况下,可以选择溶液202中的离子(例如mg2+)浓度,使得该酶不具有酶促活性。例如,复合部分209是内切核酸酶,并且溶液202具有小于约1m、0.1m、0.01m或0.001m的mg2+浓度。在另一个实例中,复合部分209是内切核酸酶,并且溶液202具有小于约1m、0.1m、0.01m或0.001m的mg2+浓度。
作为替代方案,复合部分209是具有酶促活性的酶。在这样的情况下,可以选择溶液202中的离子浓度,使得该酶具有酶促活性。
复合部分209可以是与靶核酸分子结合或以其他方式相互作用的蛋白质。在一些情况下,与这样的相互作用相关的结合强度大于与复合部分209和其他分子(如除靶核酸分子之外的核酸分子)之间的相互作用相关的结合强度。
在一些情况下,复合部分209具有被定制为与靶核酸分子相互作用的至少一个活性位点或其他相互作用结构域(例如结合结构域)。可以使用分子演化来合成或生成活性位点。例如,当靶核酸的dna或rna序列已知时,可以使用用于蛋白质演化的噬菌体展示或核糖体展示来演化活性位点。可以每轮都对蛋白质序列进行随机诱变并选择,并且一组具有高结合亲和力的蛋白质可在数轮演化后最终得以演化。
作为替代方案,复合部分209是引物。该引物可以具有对靶核酸分子特异的序列,如与靶核酸分子的至少一部分互补的序列。在一些实例中,该引物是被配置为无论靶核酸分子的序列如何都与靶核酸分子杂交的通用引物。
通过将膜205或纳米孔204暴露于复合部分209,可使复合部分209与膜205或纳米孔204偶联。作为替代方案,复合部分209不与膜205偶联,而是存在于溶液202中并与溶液202中的靶核酸分子偶联,以形成包含与复合部分209偶联的靶核酸分子的复合物。通过跨膜205施加电位,靶核酸分子被引导穿过纳米孔204,但在复合物与膜205或纳米孔204之间相互作用后停止或停滞。
在传感器200的使用期间,电路206提供跨第一电极201和第二电极203的电位。溶液202中的电解质可以通过纳米孔204转运溶液202中的离子。在使用期间,第二电极203可以经历氧化反应以在溶液202中产生第二电极203的离子,该离子可被引导穿过纳米孔移向第一电极201。可以使用溶液202中的离子,在第一电极201处发生还原反应。
在溶液202流过纳米孔204时,可以使用第一电极201和第二电极203检测可测量的电流。该电流可以随流过纳米孔204的流速的变化而变化。例如,在用靶核酸分子阻塞纳米孔204后,流速可以改变,这可以导致由第一电极201和第二电极203所测得的电流的变化。这样的电流变化可与阻塞的尺寸和时间相关。阻塞纳米孔204更长时间段的分子可在更长的时间段产生电流变化,这可与分子在纳米孔中的停留时间成比例。电流变化的强度可与阻塞的尺寸直接相关。例如,与在纳米孔204中或流过纳米孔204的较小分子相比,在纳米孔204中或流过纳米孔204的较大分子可以产生更大的电流变化。
电路206可以逆转跨第一电极201和第二电极203的电位的方向。这可以帮助逆转第二电极203的任何消耗。例如,为了在第二电极上沉积来自溶液202的离子,可以逆转跨第一电极201和第二电极203的电位,这可在第二电极203处提供还原反应(例如,ag++cl-→agcl)。
本公开内容的纳米孔传感器可用于检测靶核酸分子。通过增加靶核酸分子在纳米孔传感器的纳米孔中、与之邻近或靠近的停留时间,从而影响流体穿过纳米孔的流动,可以促进这样的检测。这可在纳米孔传感器的电极处生成可测量的电流或电流变化。可以使用复合部分来增加靶核酸分子的停留时间。
图3a-3b示意性地示出了使用纳米孔传感器300对靶核酸分子的检测。参见图3a,纳米孔传感器300包含具有纳米孔302的膜301。复合部分303经由连接体304与膜301偶联。靶核酸分子305被设置在膜301的顺面处靠近膜301。靶核酸分子305包含连续的核酸亚单位306(或核苷酸)。纳米孔传感器300包含电极(未示出),该电极可如本文其他地方所述。通过在电极之间施加电位(v)——这可以提供将靶核酸分子305引导至纳米孔302的电场,靶核酸分子305可被引导至纳米孔302。在复合部分303为酶的情况下,具有靶核酸分子305的溶液可以具有经选择使得该酶具有降低的活性的条件。例如,如果复合部分303是外切核酸酶,那么溶液可以具有小于约1m、0.1m、0.01m或0.001m的mg2+浓度。
在图3b中,如通过在电极之间施加电位,靶核酸分子305被引导穿过纳米孔302。靶核酸分子305与复合部分303相互作用,使得在靶核酸分子305与复合部分303之间形成复合物。复合部分303可与靶核酸分子305特异性结合。这样的相互作用可以减慢或停止靶核酸分子305穿过纳米孔302的流动,这增加了靶核酸分子305在纳米孔302中的停留时间。可以通过电极将增加的停留时间检测为可测量的电流(c)或电流变化(dc/dt)随时间的变化。
在样品流过纳米孔302时,可在没有获得靶核酸分子305的核酸序列的情况下,从电流或其变化的连续测量检测靶核酸分子305。可在指示存在靶核酸分子305的停留时间时检测电流或其变化。例如,从1毫秒(ms)至10ms测得的电流可以指示靶核酸分子305的存在,而在小于1ms时测得的电流可以指示溶液中可能不是靶核酸分子305的其他分子或物质。
可以通过在具有或疑似具有靶核酸分子305的样品流过纳米孔302时测量电流或其变化来检测靶核酸分子305。所测得的电流或其变化可与参考值(例如,基线电流或电流变化)进行比较。作为时间的函数的相对于这种参考值的任何差异可以指示靶核酸分子305的存在。
在检测靶核酸分子305之后,可以提供刺激以从纳米孔302去除靶核酸分子305。该刺激可以是压力脉冲、热脉冲、电压脉冲、施加剪切力(sheerforce)或其组合。该刺激可以破坏复合部分303与靶核酸分子305之间的相互作用。在一个实例中,复合物与纳米孔之间的相互作用为复合部分303赋予了剪切力,该剪切力破坏了复合部分303与靶核酸分子305之间的相互作用。这可以破坏复合物并允许靶核酸分子离开纳米孔302。
在一些实例中,所述刺激是由纳米孔传感器的电极之间提供的电压脉冲。该电压脉冲可以包括约0.5v至20v或1v至10v的电压,并提供约500纳秒(ns)至2ms或500ns至1ms的时间段。例如,该电压脉冲是约1ms时间段的5v电位。在一些情况下,脉冲持续时间小于或等于约5ms、4ms、3ms、2ms或1ms。
可对膜301和/或纳米孔302施加刺激。可在使得膜301和/或纳米孔302不被破坏的条件下将刺激引导至膜301和/或纳米孔302。
在施加刺激后,靶核酸分子305可从膜301的顺面到反面从纳米孔302流出。一旦从纳米孔302去除,纳米孔302和复合部分303就可用于检测溶液中另一靶核酸分子的存在。
图4示出了使用本公开内容的纳米孔传感器测得的电流测量值(y轴)与时间(x轴,毫秒(ms))的示例图。纳米孔传感器包含具有纳米孔的膜。在检测时间段内,溶液穿过纳米孔的流动减慢或以其他方式被破坏三次,从而产生电流信号401、402和403。电流401-403的每个变化均有停留时间(τ)。将停留时间与参考值进行比较可以导致确定电流信号403与靶核酸分子相关,而信号401和402与靶核酸分子不相关。可以通过测量指示存在复合物的电流变化(例如,
信号403可以持续到对纳米孔和/或膜施加刺激以从纳米孔去除靶核酸分子。在图示的实例中,在时间404时对纳米孔和/或膜施加电压脉冲。
与靶核酸分子不相关的信号401和402可以各自独立于刺激持续给定的时间段。信号403可以持续到在时间404时施加刺激。
信号401、402和403的振幅可以相同或不同。在一些情况下,信号403的振幅与信号401和402的振幅不同。
纳米孔传感器可以连续地或周期性地测量电流。在一些情况下,纳米孔传感器在促使含有具有或疑似具有靶核酸分子的样品的溶液流过纳米孔之后测量电流。
用于形成纳米孔的方法
本公开内容的纳米孔可以经由多种方法形成。例如,可以使用光刻法形成一个或多个纳米孔的阵列,其中在光致抗蚀剂(例如,聚(甲基丙烯酸甲酯))中限定一个或多个孔的图案,并使用光刻法将该图案转移到基底(例如,硅基底),该方法可以包括将一个或多个孔的图案暴露于各向异性化学蚀刻剂。
在一些情况下,提供基底并且邻近该基底提供光致抗蚀剂层。该光致抗蚀剂层可由例如聚(甲基丙烯酸甲酯)(pmma)、聚(甲基戊二酰亚胺)(pmgi)、酚醛树脂或基于环氧树脂的负性光致抗蚀剂(例如su-8)形成。该光致抗蚀剂可在暴露于光如紫外(uv)线后得以显影(developed)。
接下来,可使光致抗蚀剂暴露于电磁辐射或颗粒(例如,光或电子束)的图案,以在光致抗蚀剂中限定孔以暴露基底。曝光可以导致化学变化,该化学变化允许通过洗涤液去除一些光致抗蚀剂,从而留下孔。正性光致抗蚀剂在曝光时可以变得可溶于洗涤液中,而在负性光致抗蚀剂中,未曝光区可溶于洗涤液中。接下来,孔可以暴露于化学蚀刻剂。该化学蚀刻剂可以提供各向异性蚀刻。例如,该化学蚀刻剂可以是氢氧化钾(koh)。在一些情况下,聚焦离子束和/或时间缓冲氧化物蚀刻(boe)可用于提供精细蚀刻,如去除残留氧化物。
所述基底可以是半导体或聚合物基底。例如,该基底可由硅、锗、碳(例如石墨烯)或砷化镓或其氧化物或氮化物形成。作为一个实例,该基底由硅、氧化硅或氮化硅形成。作为另一实例,该基底可由诸如铜、镍或铝的金属形成。该基底可以具有约10nm至5000nm或20nm至1000nm或30nm至1000nm的厚度。在一个实例中,该基底具有约50nm至150nm的厚度。
根据本文提供的方法形成的纳米孔可以具有各种电导率。例如,具有约5nm至15nm的横截面尺寸的纳米孔可以具有约20纳西门子(ns)至150ns、50ns至120ns或60ns至110ns的电导率。这样的电导率可以相对于电解质如kcl的流动进行测量。
计算机控制系统
本公开内容提供了被编程为实现本公开内容的方法的计算机控制系统。图5示出了计算机系统501,其被编程或以其他方式被配置用于检测溶液中靶核酸样品的存在。计算机系统501可以调节本公开内容的纳米孔传感器的各个方面,例如,检测电流或电流随时间的变化。计算机系统501可与可作为芯片的一部分的纳米孔传感器进行通信。计算机系统501可以是固定的或可移动的。在一些实例中,计算机系统501是移动电子设备的一部分。
计算机系统501包括中央处理单元(cpu,本文中也称为“处理器”和“计算机处理器”)505,其可以是单核或多核处理器,或者用于并行处理的多个处理器。计算机系统501还包括存储器或存储位置510(例如,随机存取存储器、只读存储器、闪速存储器)、电子存储单元415(例如,硬盘)、用于与一个或多个其他系统通信的通信接口520(例如,网络适配器)以及外围设备525,诸如高速缓冲存储器、其他存储器、数据存储和/或电子显示适配器。存储器510、存储单元515、接口520和外围设备525通过诸如主板等通信总线(实线)与cpu505相通信。存储单元515可为用于存储数据的数据存储单元(或数据存储库)。计算机系统501可借助于通信接口520可操作地耦合至计算机网络(“网络”)530。网络530可为因特网、互联网和/或外联网,或与因特网相通信的内联网和/或外联网。在一些情况下,网络530为电信和/或数据网络。网络530可包括一个或多个计算机服务器,该计算机服务器可支持分布式计算,诸如云计算。网络530,在一些情况下借助于计算机系统501,可实现对等网络,这可使与计算机系统501耦合的设备能够起到客户端或服务器的作用。
cpu505可执行一系列机器可读指令,该计算机可读指令可体现在程序或软件中。该指令可存储在诸如存储器510等存储位置中。该指令可针对cpu505,随后可编程或以其他方式配置cpu505以实现本公开内容的方法。由cpu505执行的操作的示例可包括提取、解码、执行和回写。
cpu505可以是诸如集成电路等电路的一部分。系统501的一个或多个其他组件可包括在电路中。在一些情况下,该电路为专用集成电路(asic)。
存储单元515可存储文件,诸如驱动程序、库和保存的程序。存储单元515可存储用户数据,例如,用户偏好和用户程序。在一些情况下,计算机系统501可包括一个或多个附加数据存储单元,所述附加数据存储单元位于计算机系统501外部,诸如位于通过内联网或因特网与计算机系统501相通信的远程服务器上。
计算机系统501可通过网络530与一个或多个远程计算机系统相通信。例如,计算机系统501可与用户(服务提供者)的远程计算机系统相通信。远程计算机系统的示例包括个人计算机(例如,便携式pc)、平板或平板型pc(例如,
如本文所述的方法可通过机器(例如,计算机处理器)可执行代码的方式来实现,该机器可执行代码存储在计算机系统501的电子存储位置上,例如在存储器510或电子存储单元515上。机器可执行代码或机器可读代码可以以软件的形式提供。在使用期间,该代码可由处理器505执行。在一些情况下,可从存储单元515检索该代码并将其存储于存储器510上以备由处理器505获取。在一些情况下,可排除电子存储单元515,而将机器可执行指令存储于存储器510上。
所述代码可被预编译并配置用于与具有适于执行该代码的处理器的机器一起使用,或可在运行期间被编译。该代码可以以编程语言提供,可选择编程语言以使该代码能够以预编译或即时编译(as-compiled)的方式执行。
本文提供的系统和方法的各方面,诸如计算机系统501,可体现在编程中。本技术的多个方面可以被认为是“产品”或“制品”,其一般为在一种类型的机器可读介质上携带或体现的机器(或处理器)可执行代码和/或关联数据的形式。机器可执行代码可存储在诸如存储器(例如,只读存储器、随机存取存储器、闪速存储器)等电子存储单元或硬盘上。“存储”型介质可包括计算机的任何或全部有形存储器、处理器等,或其关联模块,诸如各种半导体存储器、磁带驱动器、磁盘驱动器等,其可在任何时间为软件编程提供非暂时性存储。该软件的全部或部分有时可以通过因特网或各种其他电信网络进行通信。这样的通信,例如,可使软件能够从一个计算机或处理器加载到另一计算机或处理器中,例如,从管理服务器或主机加载到应用服务器的计算机平台中。因此,可承载软件元素的另一类型的介质包括光波、电波和电磁波,诸如跨本地设备之间的物理接口、通过有线和光学陆线网络以及通过各种空中链路而使用的。携带这类波的物理元件,诸如有线或无线链路、光学链路等,也可以被认为是承载软件的介质。如本文所用的,除非受限于非暂时性有形“存储”介质,否则诸如计算机或机器“可读介质”等术语是指参与向处理器提供指令以供执行的任何介质。
机器可读介质,诸如计算机可执行代码,可采取许多形式,包括但不限于:有形存储介质、载波介质或物理传输介质。非易失性存储介质包括例如光盘或磁盘,诸如任何计算机中的任何存储设备等,例如可用于实现如附图中所示的数据库等。易失性存储介质包括动态存储器,诸如这样的计算机平台的主存储器。有形传输介质包括同轴电缆;铜线和光纤,包括导线,该导线包括计算机系统内的总线。载波传输介质可采取电信号或电磁信号或者声波或光波的形式,诸如在射频(rf)和红外(ir)数据通信过程中生成的那些电信号或电磁信号或者声波或光波。因此,计算机可读介质的常见形式包括例如:软盘、柔性盘、硬盘、磁带、任何其他磁性介质、cd-rom、dvd或dvd-rom、任何其他光学介质、穿孔卡片纸带、任何其他具有孔洞图案的物理存储介质、ram、rom、prom和eprom、flash-eprom、任何其他存储器芯片或匣盒、传送数据或指令的载波、传送这样的载波的电缆或链路,或者计算机可从中读取编程代码和/或数据的任何其他介质。这些计算机可读介质形式中的许多可以参与将一个或多个指令的一个或多个序列载送至处理器以供执行。
计算机系统501可包括电子显示器535或与之通信,电子显示器535包含用于随时间提供例如来自纳米孔传感器的信号的用户界面(ui)540。ui的实例包括但不限于图形用户界面(gui)和基于网络的用户界面。
本公开内容的方法和系统可通过一种或多种算法来实现。算法可在由中央处理单元505执行时通过软件实现。
实施例1
在处理室中用高能粒子辐射半导体基底(例如硅)。该高能粒子可以是氩离子(例如ar+)。使用光刻和蚀刻在半导体基底中生成至少一个纳米孔。例如,可在半导体附近提供掩模,并且暴露与纳米孔相对应的掩模的位置,并去除此位置的掩模以暴露半导体基底的一部分。使半导体基底的暴露部分与蚀刻溶液(例如,hf和hno3的混合物)接触,以在半导体基底中蚀刻出纳米孔。半导体基底中的蚀刻阻断层可以终止蚀刻。可在电极附近提供具有纳米孔的半导体基底,以提供纳米孔传感器。
可在effendorfpcr管中,包括用于pcr反应和用于检测的室中,提供纳米孔传感器。具有纳米孔的半导体可以是使两个阱(顺式阱和反式阱)分开的膜。将用于核酸扩增(例如等温扩增)的试剂加入到顺式阱中。用于核酸扩增的试剂可以包括pcr缓冲液、引物、dna聚合酶、模板核酸样品和在5’端具有限制酶切位点的引物。lamp和内切核酸酶可在约65℃的温度下进行,以生成双链靶核酸分子作为模板核酸分子的扩增产物。接下来,内切核酸酶与纳米孔共价交联。在顺式阱与反式阱之间施加电压,并用纳米孔传感器测量电流。
阱之间的电压(跨顺面和反面)诱导带负电荷的靶核酸分子进入并电泳穿过纳米孔。靶核酸分子具有内切核酸酶靶序列,该序列与内切核酸酶结合以形成增加靶核酸分子在纳米孔中的停留时间的复合物。该复合物在诸如通过纳米孔的剪切力而解离之前一直是稳定的。基于所增加的停留时间,确定靶核酸分子的存在。
实施例2
将2μm湿热氧化硅薄膜和100nm低压化学气相沉积(lpcvd)低应力(富硅)氮化硅沉积在1-20ohm·cm电阻率的500μm厚p掺杂<100>si晶片上。通过晶片的各向异性koh(33%,80℃)蚀刻(其中已通过反应性离子蚀刻在光刻图案化区域中去除薄膜)形成独立的20μm膜。使用聚焦离子束(micrion9500)去除独立膜中心的1μm平方面积中的约1.5μm氧化硅。随后的boe去除约600nm的剩余氧化物,从而在独立氧化物/氮化物膜的中心留下2μm独立氮化硅微膜。在用koh和boe处理之后,如通过椭偏测量术和横截面透射电子显微术(tem)所测量的,该氮化物膜的厚度约为80nm。使用来自jeol2010f场发射tem(jeolusa,peabody,ma)的聚焦200kev电子束在该氮化物微膜的中心形成大致沙漏形的纳米孔。纳米孔直径约为10nm。
尽管本文中已经示出并描述了本发明的优选实施方案,但对于本领域技术人员显而易见的是,这些实施方案仅以示例的方式提供。本文并不打算通过说明书中提供的具体实例来限制本发明。尽管已经参考前述说明书描述了本发明,但本文实施方案的描述和图示不应以限制性的意义来解释。本领域技术人员在不脱离本发明的情况下现将想到多种变化、改变和替代。此外,应当理解,本发明的所有方面并不限于本文阐述的具体描绘、配置或相对比例,而是取决于多种条件和变量。应当理解,本文中所述的本发明实施方案的各种替代方案可用于实施本发明。因此可以设想,本发明还应当覆盖任何这样的替代、修改、更改或等同物。以下权利要求旨在限定本发明的范围,因此覆盖这些权利要求范围内的方法和结构及其等同物。
- 还没有人留言评论。精彩留言会获得点赞!