一种抗肿瘤药物的新晶型及其制备方法和用途与流程
本发明涉及化学制药领域,尤其涉及一种抗肿瘤药物palbociclib的晶型及其制备方法和用途。
背景技术:
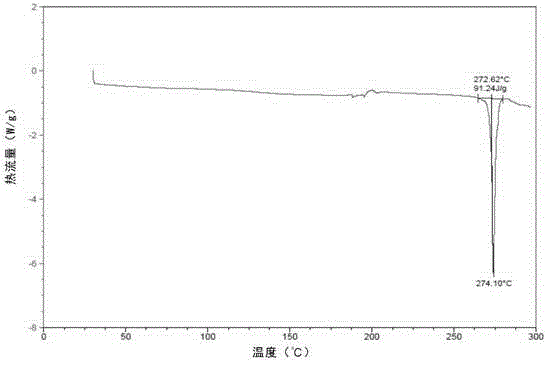
:辉瑞公司研发,目前用于治疗乳腺癌的palbociclib的化学名为6-乙酰基-8-环戊基-5-甲基-2-{[5-(哌嗪-1-基)吡啶-2-基]胺基}吡啶并[2,3-d]嘧啶-7(8H)-酮(即式Ⅰ所示的化合物)。II期临床研究表明,palbociclib与乳腺癌的金标准治疗药物来曲唑相比,其治疗活性提高3倍以上,无进展生存期(PFS)达26.1个月。palbociclib把以前对乳腺癌以“月”为标准的临床治疗效果提高到“年”的水平,取得了突破性的进展。正因为其良好的治疗活性,FDA仅仅基于II期临床数据,于2015年2月4日批准其在美国上市。目前报道的palbociclib晶型有WO2014128588A1公开的晶A和晶B,其中晶B不稳定,晶A为辉瑞的药用晶型。但晶A易存在较严重的有机溶剂残留,如苯甲醚和正丁醇这两高沸点溶剂的残留可达0.5wt%(WO2014128588A1,P17);在生产中我们也常发现苯甲醚和正丁醇残留超过0.5wt%的情况,甚至可达1.0%左右。同时,晶A的制备需要异常严格的控温条件,如需程序性降温(WO2014128588A1,P43,P44),这非常不利于工业化大生产。此外,晶A结晶溶剂苯甲醚的生产中,必须使用剧毒性的硫酸二甲酯(孙宝国,香料与香精,中国石化出版社,2000:24),因而晶A的制备势必导致严重的次级污染问题。因此,本领域迫切需要提供一种理化性质稳定、有机溶剂残留少、利于工业化生产、且制备过程无次级污染问题的palbociclib新晶型。技术实现要素:本发明旨在提供一种化合物Ⅰ的稳定的新晶型。本发明的另一个目的是提供所述化合物Ⅰ的新晶型的制备方法。本发明的再一个目的是提供所述化合物Ⅰ的新晶型的用途。本发明的第四个目的是提供一种含有所述化合物Ⅰ的新晶型的药物组合物。在本发明的第一方面,提供了一种化合物的晶型C,所述化合物结构如式Ⅰ所示,所述晶型C的X-射线粉末衍射(XRPD)有下述2θ角特征峰:5.56±0.2°、7.68±0.2°和8.67±0.2°;;较佳地,所述晶型C的X-射线粉末衍射(XRPD)还有下述2θ角特征峰:12.79±0.2°和16.36±0.2°;更佳地,所述晶型C的X-射线粉末衍射(XRPD)还有下述2θ角特征峰:11.21±0.2°、18.14±0.2°、19.86±0.2°、21.24±0.2°、23.92±0.2°和26.58±0.2°;最佳地,所述晶型C有如图1所示的X-射线粉末衍射(XRPD)图。在另一优选例中,所述晶型C的差示扫描量热法图谱(DSC)上在25~300℃的温度范围内有一特征峰,熔点为272.6℃;更佳地,所述晶型C有如图2所示的差示扫描量热法图谱(DSC)。在另一优选例中,所述晶型C的红外吸收图谱在2949±2cm-1、1694±2cm-1、1654±2cm-1、1583±2cm-1和1400±2cm-1处有特征峰;更佳地,所述晶型C有如图4所示的红外光谱。在另一优选例中,所述晶型C有一分子结晶水;较佳地,所述晶型C的TGA图在50~275℃失重约3.88%;更佳地,所述晶型C有如图3所示的TGA图。在本发明的第二方面,提供了一种如上所述的本发明提供的式Ⅰ化合物的晶 型C的制备方法,所述的方法包括步骤:(1)将4-{6-[(6-(1-丁氧基乙烯基)-8-环戊基-5-甲基-7-氧代-7,8-二氢吡啶[2,3-d]嘧啶-2-基胺基]吡啶-3-基}哌嗪-1-甲酸叔丁酯与醇和水混合,得到溶液1,所述醇选自下述的一种或一种以上:正丁醇、甲醇、乙醇、异丙醇;(2)将溶液1和选自下述的一种或一种以上的酸混合,得到反应物2:盐酸、硫酸、甲磺酸、羟乙基磺酸、三氟醋酸;(3)将反应物2冷却至出现固体,过滤得到固体3;(4)将固体3与弱碱水溶液混合,得到溶液4,所述弱碱水溶液选自下述的一种或一种以上混合:饱和碳酸氢钠、饱和碳酸氢钾、饱和碳酸钠、饱和碳酸钾;和(5)将溶液4过滤,得到如上所述的本发明提供的式Ⅰ化合物的晶型C。在另一优选例中,在步骤(2)中使用盐酸。在另一优选例中,步骤(2)中混合时间为4~24小时;更佳地,混合时间为4~8小时。在另一优选例中,步骤(3)中在0~4℃冷却。在本发明的第三方面,提供了一种如上所述的本发明提供的式Ⅰ化合物的晶型C的用途,用于制备预防或治疗乳腺癌、胃癌、肺癌、肝癌、甲状腺癌、结肠直肠癌、神经胶质瘤、卵巢癌的药物。在本发明的第四方面,提供了一种药物组合物,所述的药物组合物中含有如上所述的本发明提供的式Ⅰ化合物的晶型C和药学上可接受的载体。据此,本发明提供了一种理化性质稳定、有机溶剂残留少、利于工业化生产、且制备过程无次级污染问题的palbociclib新晶型。附图说明图1显示了本发明实施例4制备得到的化合物Ⅰ晶型C的X-射线粉末衍射图;其中有关各个峰的2θ角如下表所示:#2-ThetaI%(相对峰强度)15.56544.227.678100.038.66639.5411.21111.1512.79140.5616.36358.6718.1414.9819.8577.4921.23917.81023.92416.21126.5878.8。图2显示了本发明实施例4制备得到的化合物I晶型C的差示扫描量热法图(DSC)。图3显示了本发明实施例4制备得到的化合物I晶型C的TGA图谱。图4显示了本发明实施例4制备得到的化合物I晶型C的红外光谱(IR)。图5显示了本发明实施例6制备得到的化合物Ⅰ晶型A和晶型C混晶的X-射线粉末衍射图。图6显示了依据WO2014128588A1制备得到的化合物Ⅰ晶型A的X-射线粉末衍射图。图7显示了依据WO2014128588A1制备得到的化合物Ⅰ晶型B的X-射线粉末衍射图。具体实施方式发明人通过深入研究,发现化合物Ⅰ在醇和水中溶解后,通过酸水解获得的固体通过弱碱的水溶液处理,但无需使用苯甲醚等溶剂,便能获得一种新的晶型,即单一晶型C,是一种稳定的晶型,且这种方法无需控温,所得晶体没有有机溶剂残留。如本文所用,化学式或名称应当包括所有的光学和立体异构体,以及存 在这些异构体和混合物的消旋混合物。化合物Ⅰ晶型C本发明提供了一种如式Ⅰ所示化合物的晶型C,并采用多种方式和仪器对其性质进行了研究。“X射线粉末衍射”,又称“X射线多晶衍射(XRPD)”是目前用于测定晶型构造(即晶型)的常用试验方法。采用X射线粉末衍射仪,在X射线透过晶型时产生一系列衍射图谱,该图谱中不同的衍射线及其强度由一定结构的原子团所决定,由此确定晶型的具体晶型结构。测定晶型的X射线粉末衍射的方法在本领域中是已知的。例如使用BrukerD8Advanced型号的X射线粉末衍射仪,以2°每分钟的扫描速度,采用铜辐射靶获取图谱。本发明的化合物Ⅰ晶型C具有特定的晶型形态,在X-射线粉末衍射(XRPD)图中具有特定的特征峰。具体而言,本发明的化合物Ⅰ晶型C的X-射线粉末衍射(XRPD)图上在下述2θ角有特征峰:5.56±0.2°,7.68±0.2°和8.67±0.2°;较佳地,在下述2θ角还有特征峰:12.79±0.2°和16.36±0.2°;更佳地,在下述2θ角还有特征峰:11.21±0.2°、18.14±0.2°、19.86±0.2°、21.24±0.2°、23.92±0.2°和26.58±0.2°。最佳地,所述具有与图1基本一致的X-射线粉末衍射(XRPD)图。“示差扫描量热分析”,又称“差示量热扫描分析”(DSC)是在加热过程中,测量被测物质与参比物之间的能量差与温度之间关系的一种技术。DSC图谱上的峰位置、形状和峰数目与物质的性质有关,故可以定性地用来鉴定物质。本领域常用该方法来检测物质的相变温度、玻璃化转变温度、反应热等多种参 数。DSC测定方法在本领域中是已知的。例如可使用DSCQ20示差扫描量热分析仪,以10℃每分钟的升温速率,从25℃升温至300℃,获得晶型的DSC扫描图谱。在本发明的一个实施方式中,采用DSC测得用本发明方法获得的化合物Ⅰ晶型C在25~300℃范围内有一特征峰,熔点为272.6℃;更优选本发明的化合物I晶型C具有与图2基本一致的DSC图谱。热重分析(ThermogravimetricAnalysis,TG或TGA)在本领域中是已知的。在程序控制温度下测量样品的质量与温度变化关系。在本发明的一个实施方式中,采用TGA测得用本发明方法获得的化合物Ⅰ晶型C有一分子结晶水;优选在50~275℃失重约3.88%;更优选本发明的化合物I晶型C具有与图3基本一致的TGA图谱。也可采用红外图谱法(IR)来确定晶型结构,其测定方法在本领域中是已知的。例如可采用PESpectrumOneB,以KBr:样品=200:1压片,并在400-4000cm-1范围扫描。本发明化合物Ⅰ的晶型C的红外图谱显示以下波数有特征峰:2949±2cm-1、1694±2cm-1、1654±2cm-1、1583cm±2-1和1400±2cm-1,优选具有与图4基本一致的红外图谱。化合物Ⅰ晶型C的制备方法本发明还提供了式Ⅰ所示化合物的晶型C的制备方法。在本发明提供的一种实施方式中,式Ⅰ化合物的晶型C的制备方法包括以下步骤:第一步,将4-{6-[(6-(1-丁氧基乙烯基)-8-环戊基-5-甲基-7-氧代-7,8-二氢吡啶[2,3-d]嘧啶-2-基胺基]吡啶-3-基}哌嗪-1-甲酸叔丁酯(cas:866084-31-3)与醇和水混合,得到溶液1,所述醇选自下述的一种或一种以上:正丁醇、甲醇、乙醇、异丙醇;第二步,将溶液1和选自下述的一种或一种以上的酸混合,得到反应物2:盐酸、硫酸、甲磺酸、羟乙基磺酸、三氟醋酸;第三步,将反应物2冷却至出现固体,过滤得到固体3;第四步,将固体3与弱碱水溶液混合,得到溶液4,所述弱碱水溶液选自下述的一种或一种以上混合:饱和碳酸氢钠、饱和碳酸氢钾、饱和碳酸钠、饱和碳酸钾;第五步,将溶液4过滤,得到本发明提供的化合物Ⅰ的晶型C。在上述第一步中,所述混合在加热条件下进行,例如但不限于,在60-80℃下加热20-40分钟。在上述第二步中使用的酸优选盐酸。在上述第二步中,所述混合是水解反应,优选在加热条件下进行,例如但不限于,在60~80℃下反应4-24小时;优选4~8小时。在上述第三步中,可以使用本领域常规的方法对反应物2进行冷却,例如但不限于,在0~4℃冰箱过夜,使大量固体出现。在上述第三步中,过滤后用醇洗涤固体,所使用的醇一般与第一步中的相同;在本发明的一个具体实施例中,洗涤后置于45~55℃空气浴中干燥,得到固体3,所述固体3是palbociclib的盐酸盐、羟乙基磺酸盐等固体。在上述第四步中,所述混合在搅拌下进行,在本发明的一个具体实施例中,在15~30℃搅拌2~12小时。在上述第五步中,在本发明的一个具体实施例中,过滤后得到的固体用蒸馏水洗涤,洗涤后置于45~55℃空气浴中干燥,得到本发明提供的化合物Ⅰ的晶型C。化合物Ⅰ晶型C的用途本发明提供的式Ⅰ化合物的晶型C稳定性好,可以作为原料药,例如用于制备预防或治疗乳腺癌、胃癌、肺癌、肝癌、甲状腺癌、结肠直肠癌、神经胶质瘤、卵巢癌的药物。所述的药物包括式Ⅰ化合物的晶型C和药学上可接受的载体。所述药物可以根据不同给药途径而制备成各种剂型。这些剂型以下面方式之一施用:胶囊、片剂、口崩片、含片、缓控释制剂等。另外需要指出,本发明式Ⅰ化合物的晶型C的使用剂量和使用方法取决于诸多因素,包括患者的年龄、体重、性别、自然健康状况、营养状况、化合物活性强度、服用、代谢速率、病症的严重程度以及诊治医师的主观判断。定义如本文所用,“如式Ⅰ所示的化合物”、“式Ⅰ化合物”或“化合物Ⅰ”可以互换使用,都是指无定形态的结构式如Ⅰ所示的化合物;优选使用WO2014128588A1公开的方法制备得到的4-{6-[(6-(1-丁氧基乙烯基)-8-环戊基 -5-甲基-7-氧代-7,8-二氢吡啶[2,3-d]嘧啶-2-基胺基]吡啶-3-基}哌嗪-1-甲酸叔丁酯。如本文所用,“本发明palbociclib的晶型C”、“晶型C”或“化合物Ⅰ的晶型C”可互换使用,都是指X-射线粉末衍射(XRPD)图上在下述2θ角有特征峰:5.56±0.2°、7.68±0.2°和8.67±0.2°;优选在下述2θ角还有特征峰:12.79±0.2°和16.36±0.2°;更优选在下述2θ角还有特征峰:11.21±0.2°、18.14±0.2°、19.86±0.2°、21.24±0.2°、23.92±0.2°和26.58±0.2°。如本文所用,术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。该术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的毒性。合适的载体是本领域普通技术人员所熟知的。在Remington'sPharmaceuticalSciences(MackPub.Co.,N.J.1991)中可找到关于药学上可接受的赋形剂的充分讨论。在组合物中药学上可接受的载体可包括液体,如水、盐水、甘油和乙醇。另外,这些载体中还可能存在辅助性的物质,如崩解剂、润湿剂、乳化剂、pH缓冲物质等。本发明提到的上述特征,或实施例提到的特征可以任意组合。本案说明书所揭示的所有特征可与任何组合物形式并用,说明书中所揭示的各个特征,可以任何可提供相同、均等或相似目的的替代性特征取代。因此除有特别说明,所揭示的特征仅为均等或相似特征的一般性例子。本发明的主要优点在于:1、本发明提供的式Ⅰ化合物的晶型C具有良好的化学稳定性和晶型稳定性。2、本发明提供的式Ⅰ化合物的晶型C没有有机溶剂残留,并且重金属钯的含量很低。3、本发明提供的式Ⅰ化合物的晶型C的药代性质与晶型A药代性质相当。4、本发明提供的式Ⅰ化合物的晶型C的制备方法操作简单,适合工业化生产。5、本发明提供的式Ⅰ化合物的晶型C的制备方法中无次级污染,绿色环保。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另外说明,否则所有的百分数、比率、比例、或份数按重量计。本发明中的重量体积百分比中的单位是本领域技术人员所熟知的,例如是指在100毫升的溶液中溶质的重量。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。原料和通用测试方法实施例中所用4-{6-[(6-(1-丁氧基乙烯基)-8-环戊基-5-甲基-7-氧代-7,8-二氢吡啶[2,3-d]嘧啶-2-基胺基]吡啶-3-基}哌嗪-1-甲酸叔丁酯(cas:866084-31-3)为参考WO2014128588A1所制备。核磁共振波谱仪:VarianMercury400NMRspectrometerX-射线粉末衍射仪器:BruckerD8advanceX-射线粉末衍射仪;辐射源:铜靶在室温条件下扫描;电压:40kv;电流:40mA;起始的2θ:2.000°,扫描范围:2.0000-50.000°;步长:0.020°;测量时间:12.6秒/步。差示扫描量热法分析(DSC)仪器:美国TA公司的Q2000型,20-200℃范围内,加热速率10℃/min,氮气流速50ml/min。热重分析(TGA)仪器:美国TA公司的SDTQ600型,20-300℃范围内,加热速率10℃/min,氮气流速60ml/min。红外分光光度法(FTIR)分析仪器:Nicolet380傅立叶变换红外光谱仪;溴化钾压片法;分辨率:4.0cm-1。电感耦合等离子光谱仪:Optima5300DV。实施例1palbociclib盐酸盐的制备将4-{6-[(6-(1-丁氧基乙烯基)-8-环戊基-5-甲基-7-氧代-7,8-二氢吡啶[2,3-d]嘧啶-2-基胺基]吡啶-3-基}哌嗪-1-甲酸叔丁酯(31.5g,52.2mmoL)加入到正丁醇(548.0mL)和蒸馏水(315.0mL)的混合溶液中,于油浴70℃加热30分钟。加入浓盐酸(22.0mL),在油浴70℃反应过夜。冷却,反应体系放置0℃冰箱过夜,出现大量固体。过滤,固体用正丁醇(5.0mL)洗涤,于50℃空气浴中干燥至恒重,得纯黄色固体25.0g。1HNMR(400MHz,D2O):δ=8.94(s,1H),8.00(dd,J1=2.1Hz,J2=9.6Hz,1H),7.76(d,J1=2.0Hz,1H),7.41(d,J1=2.1Hz,J2=9.2Hz,1H),5.72(m,1H),3.48(dd,J1=4.0Hz,J2=7.2Hz,4H),3.41(dd,J1=2.4Hz,J2=6.0Hz,4H),2.43(s,3H),2.31(s,3H),2.08(m,2H),1.93(m,4H),1.64(m,2H).实施例2palbociclib甲磺酸盐的制备将4-{6-[(6-(1-丁氧基乙烯基)-8-环戊基-5-甲基-7-氧代-7,8-二氢吡啶[2,3-d]嘧啶-2-基胺基]吡啶-3-基}哌嗪-1-甲酸叔丁酯(3.15g,5.22mmoL)加入到正丁醇(55.0mL)和蒸馏水(31.50mL)的混合溶液中,于油浴70℃加热30分钟。加入甲磺酸(2.0mL),在油浴70℃反应过夜。冷却,反应体系放置0℃冰箱过夜,出现大量固体。过滤,固体用正丁醇(5.0mL)洗涤,于50℃空气浴中干燥至恒重,得纯黄色固体3.0g。实施例3palbociclib羟乙基磺酸盐的制备将4-{6-[(6-(1-丁氧基乙烯基)-8-环戊基-5-甲基-7-氧代-7,8-二氢吡啶[2,3-d]嘧啶-2-基胺基]吡啶-3-基}哌嗪-1-甲酸叔丁酯(7.25g,12.0mmoL)加入到甲醇(140mL)中,再缓慢滴加羟乙基磺酸(5.3g,42.0mmoL)、甲醇(15.0mL)和水(0.70mL,38.9mmoL)的混合溶液。滴加完毕后,体系加热至55℃,且在此温度下搅拌30分钟。滴加三乙胺(1.8g,13.0mmoL)的甲醇(3.0mL)溶液,在此过程中反应体系温度降至30℃。在30℃下滴加三乙胺(1.3g,12.6mmoL)的甲醇(20.0mL),6.0小时滴加完毕。搅拌过夜。于4℃下放置1.0小时,过滤,固体用并甲醇(2.0mL)洗涤,于55℃真空干燥1.0小时,得纯黄色固体6.8g,收率为87%。1HNMR(400MHz,DMSO-d6:δ=10.23(s,1H),8.98(s,1H),8.69(brs,1H),8.12(d,J=3.2Hz,1H),7.92(d,J=9.2Hz,1H),7.55(dd,J1=2.8Hz,J2=8.8Hz,1H),5.84(m,1H),4.46(brs1H),3.62(t,J=6.8Hz,2H),3.37(m,4H),3.27(m,4H),2.60(t,J=6.8Hz,2H),2.43(s,3H),2.32(s,3H),2.23(m,2H),1.93(m,2H),1.88(m,2H),1.63(m,2H).实施例4palbociclib晶型C的制备将实施例1所得产物(1.0g)缓慢加入到碳酸氢钠饱和水溶液(12.0mL)和蒸馏水(15.0mL)中,于室温搅拌4.0小时。过滤,固体用蒸馏水(3×5.0mL)洗涤,于50℃空气浴中干燥至恒重,得0.72g晶型C。1HNMR(400MHz, DMSO-d6+TFA):δ=11.18(brs,1H),9.01(s,3H),8.07(d,J=2.8Hz,1H),7.95(dd,J1=2.8Hz,J2=9.6Hz,1H),7.81(d,J=9.2Hz,1H),5.85(m,1H),3.43(t,J=4.8Hz,4H),3.30(s,4H),2.44(s,3H),2.35(s,3H),2.22(m,2H),1.94(m,2H),1.93(m,2H),1.60(m,2H).13CNMR(100MHz,DMSO-d6+TFA):δ=202.1,160.51,158.97,158.60,158.23,157.86,157.32,157.02,154.97,143.36,142.14,141.51,130.92,130.85,119.73,116.85,116.36,113.96,111.08,53.11,45.19,42.39,31.16,27.61,25.19,13.67.HRMS(ESI+,m/z):448.2453[M+H]+.结果对所得晶型C进行XRPD测试、DSC测试、TGA测试、FTIR测试:从图1中可以看出,在2θ值为5.56±0.2°、7.68±0.2°、8.67±0.2°、12.79±0.2°、16.36±0.2°处具有强峰;在11.21±0.2°、18.14±0.2°、19.86±0.2°、21.24±0.2°、23.92±0.2°、26.58±0.2°处具有次强峰。从图2中可以看出,在25-200℃范围内有单一吸热峰,onset约272.6℃。从图3中可以看出,在50~275℃范围内失重约3.88%,表示含有1分子结晶水。图4是本实施例制备的晶型C的FTIR图谱,从图4中可以看出,在2949±2cm-1、1694±2cm-1、1654±2cm-1、1583±2cm-1、1400±2cm-1等处有特征峰。实施例5palbociclib晶型C的制备将实施例1所得产物(1.0g)缓慢加入到碳酸氢钾饱和溶液(12.0mL)和蒸馏水(15.0mL)中,于室温搅拌4.0小时。过滤,固体用蒸馏水(3×5.0mL)洗涤,于50℃空气浴中干燥至恒重,得0.73g晶型C。结果所得晶型C的XRPD图谱、DSC图谱、TGA图谱、FTIR图谱基本同实施例4一致。实施例6palbociclib晶型A和晶型C混晶的制备将实施例3所得产物(0.72g)缓慢加入到碳酸氢钠饱和溶液(13.0mL)和蒸馏水(15.0mL)中,于室温搅拌4.0小时。过滤,固体用蒸馏水(3×5.0mL)洗涤,于50℃空气浴中干燥至恒重,得0.68g纯黄色固体。结果所得固体的XRPD图谱表明,此黄色固体为晶A和晶C的混晶。此混晶的XRPD如图5所示。实施例7palbociclib晶型C的溶剂残留研究依次采用HPLC法和GC法测量了晶型C的可能溶剂苯甲醚、正丁醇和正庚烷的残留,结果如表1所示。晶型C中未检出有苯甲醚、正丁醇和正庚烷。表1晶型C的可能溶剂苯甲醚、正丁醇和正庚烷的残留研究溶剂检测方法检测结果苯甲醚HPLC未检出正丁醇GC未检出正庚烷GC未检出实施例8palbociclib晶型C的重金属元素钯的含量研究采用EPA6010C电感耦合等离子体原子发射光谱法检测了晶型C中的重金属元素钯的含量,结果如表2所示。晶型C中的重金属钯含量很低,小于1.0ppm。表2晶型C的的重金属元素钯的含量研究样品编号检测项目检测结果(mg/kg)2015042801Pd<1实施例9palbociclib晶型C的药代研究在大鼠体内研究了晶型C和晶型A的药代性质。药代试验方法SD大鼠,180~220g。静脉注射给药溶液的配制:先将palbociclib晶型C和晶型A分别配成100mM的DMSO溶液;再分别取palbociclib晶型C和晶型A的100mM母液各为19.0μL,稀释至1.7mL(N.S:PEG400=7:3,含20μLTween80),超声3min,配制为0.5mg/mL的溶液。灌胃给药混悬液配制:分别称取palbociclib晶型C和晶型A化合物各2.72mg,加入7.30mL的CMC-Na(0.5%),配制为0.375mg/mL的混悬液体(不溶)。palbociclib晶型C给操作:SD大鼠5只,2只静脉注射给予5.0mg/kg的晶型C,分别于给药前和给药后2、5、15、30、60、90、120、240、360min于大鼠眼底静脉丛取血0.4mL。3只灌胃给予5.0mg/kg的晶型C,分别于给药前和给药后5、15、30、60、90、120、240、360min于大鼠眼底静脉丛取血0.4mL。血样于8000rpm离心5min,取血浆于离心管中4℃保存备用。血浆样品50μL,加入200μL含内标的乙腈(R822.5uM)沉淀蛋白,涡旋10min,6000g离心10min,取200μL上清6000g再次离心10min,取上清70μL于96孔板中进样,进样量5μL。静脉注射前4个时间点,用空白血浆稀释10倍后测定。palbociclib晶型A给药操作:操作同晶型C。试验结果如表3所示。表3Palbociclib晶型C和晶型A的药代研究此研究表明,palbociclib晶型C和晶型A的药代性质相当,二者无显著性差异。实施例10palbociclib晶型C的稳定性研究取实施例4所制备得到晶型C分别放置在不同温度、湿度条件下,考察其化学稳定性和晶型稳定性,结果如表4所示。表4Palbociclib晶型C的稳定性研究由上述实验可以看出,本发明制备得到的晶型C具有良好的化学稳定性和晶型稳定性,在室温及较高温度下如60℃下均能够长时间稳定保存。以上所述仅为本发明的较佳实施例而已,并非用以限定本发明的实质技术内容范围,本发明的实质技术内容是广义地定义于申请的权利要求范围中,任何他人完成的技术实体或方法,若是与申请的权利要求范围所定义的完全相 同,也或是一种等效的变更,均将被视为涵盖于该权利要求范围之中。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种抗肿瘤药物奈拉滨化合物的制造方法与工艺
- 四苯基卟啉连二胺芳基钌化合物及其制备方法和用途与制造工艺
- 一种具抗肿瘤活性的不对称双1‑取代5‑N杂靛红席夫碱类化合物的合成方法与制造工艺
- 一种具抗肿瘤活性的不对称双7‑N杂靛红席夫碱类化合物的合成方法与制造工艺
- 一种具抗肿瘤活性的不对称双取代靛红席夫碱类化合物及其合成方法与制造工艺
- 一种抗肿瘤药物奈拉滨组合物的制造方法与工艺
- 含Micranthanone A用于抗肿瘤的药物的制造方法与工艺
- 一种小分子靶向药物脂质体制剂的制备方法与制造工艺
- 一种5?溴?1H?吡咯并[2,3?b]吡啶的合成方法
- 一种作用于EGFR敏感突变激酶EGFR<sup>L858R</sup>,EGFR<sup>(d746-750)</sup>的6-取代氨基嘌呤类化合物及 ...的制作方法