齐墩果酸在诱导人胚胎干细胞分化为类生殖细胞中的用途的制作方法
本发明涉及齐墩果酸在诱导人胚胎干细胞分化为类生殖细胞中的用途。
背景技术:
近年来,由于环境污染严重、工作压力加大、饮食习惯改变、生殖系统疾病等因素对正常受孕造成不利影响,不孕症患者数量呈上升势头,发病率约为12.5%~15%,且有逐年增加趋势。因此世界卫生组织(WHO)宣布将不孕症与心血管病、肿瘤并列为当今影响人类生活和健康的三大主要疾病。自1978年全球首例试管婴儿诞生以来,以体外授精-胚胎移植(IVF-ET)为代表的辅助生殖技术(ART)的引入给不孕不育症的成功治疗提供了更大的可能。助孕的相关研究对于解决不孕不育患者的实际问题具有现实的意义。
体外受精(IVF)是指哺乳动物的精子和卵在体外人工控制的环境中完成受精过程的技术。获取合格的卵和精子,是体外受精的基础,目前,体外受精包括促排卵、卵泡检测与取卵、精子的优选与处理和体外受精步骤。诱发多个卵泡发育的促排卵是不孕治疗的重要基础,此环节早时使用自然周期排卵,但每一自然周期一般仅有一个卵泡成熟,提供卵少,导致实施以后步骤困难,且妊娠率低,现已被超排卵技术所取代。然而,超排卵技术是指应用人类促性腺激素促进更多卵泡成熟排卵的一种技术,由于此过程多个同时发育,雌二醇增加,引起反馈性的黄体生成素(LH)峰出现,导致卵早熟,质量差,妊娠率低,而且因药物过度使用引起的并发症,如卵巢过度刺激综合征(OHSS)、多胎妊娠、出生缺陷和表遗传学修饰异常等。因此,急需寻找其他合适的方法,制备生殖细胞。
同时,对于因机能衰退,生殖细胞缺乏的人群,如,绝经妇女,更需要寻找一种体外制备生殖细胞的方法。
齐墩果酸(Oleanolic acid,OA),为补肾中药女贞子的主要有效成分之一,具有降糖、降脂、抗氧化和调节免疫功能的作用。本课题组前期研究发现,OA干预小鼠ESCs后可使早期生殖标识基因Gdf9、Mvh、Stra8显著性上调,并诱导小鼠ESCs向生殖细胞方向分化。
但OA是否具有诱导hESCs体外向生殖细胞方向分化的可能,目前尚未见报道。
技术实现要素:
本发明的技术方案是提供了齐墩果酸的新用途。
本发明提供了齐墩果酸在诱导人胚胎干细胞分化为类生殖细胞中的用途。
类生殖细胞:是指大小类似卵细胞,且Gdf-9、Scp3、Vasa高表达的细胞。
本发明还提供了齐墩果酸在制备诱导人胚胎干细胞分化为类生殖细胞的诱导液中的用途
本发明还提供了诱导人胚胎干细胞分化为类生殖细胞的诱导液,它以常用细胞培养基为基础培养基,并添加有齐墩果酸。
常用细胞培养基,是指包含供给细胞营养和促使细胞增殖的基础物质的培养基,如,α-MEM培养基(又叫MEM培养基,Minimum Essential Medium)、DMEM-高糖培养基、DMEM-低糖培养基、RPMI-1640培养基、DMEM/F12培养基或M-199培养基。
优选地,所述常用细胞培养基为α-MEM培养基、DMEM-高糖培养基、DMEM-低糖培养基、RPMI-1640培养基、DMEM/F12培养基或M-199培养基。
优选地,所述齐墩果酸的终浓度为20ug/ml。
进一步优选地,它以DMEM/F12培养基为基础培养基,添加有DMEM/F12培养基1/4(v/v)的血清替代品,以及终浓度为4ng/mL的bFGF、终浓度为0.1mM的β-巯基乙醇、终浓度为1%的非必需氨基酸和终浓度为20ug/ml的齐墩果酸。
本发明还提供了一种诱导间充质干细胞定向分化为类生殖细胞的方法,其特征在于:包括如下步骤:
a、取间充质干细胞;
b、置于前述的诱导液中培养,即得类生殖细胞。
根据公知常识,干细胞分化为生殖细胞需要经过标志基因表达模式改变、细胞形态变化、减速分裂、最终成形等阶段。标志基因表达模式改变的具体表现就是生殖细胞标志基因的高表达,这个阶段是整个分化过程最为重要的阶段之一,此阶段相当于给干细胞的分化定下了轨迹,在后期只要给予合适的条件,就能最终分化得到生殖细胞。
本发明齐墩果酸可以显著提高人胚胎干细胞中生殖细胞标志基因的表达水平:Gdf-9、Scp3、Vasa,还可以促进其形态变化,说明其可以促使人胚胎干细胞向生殖细胞方向定向分化,本发明方法制备得到的类生殖细胞具有分化为生殖细胞的潜力,有可能制备成为体外受精技术的原材料,为不孕不育疾病的治疗提供了新的思路,具有重要的临床应用价值。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
图1OA对hESCs的形态学影响(DMSO为1‰DMSO干预hESCs第4天细胞照片;OA为20ug/ml OA诱导hESCs第4天细胞照片;Rat ovarian follicle为大鼠卵细胞照片)
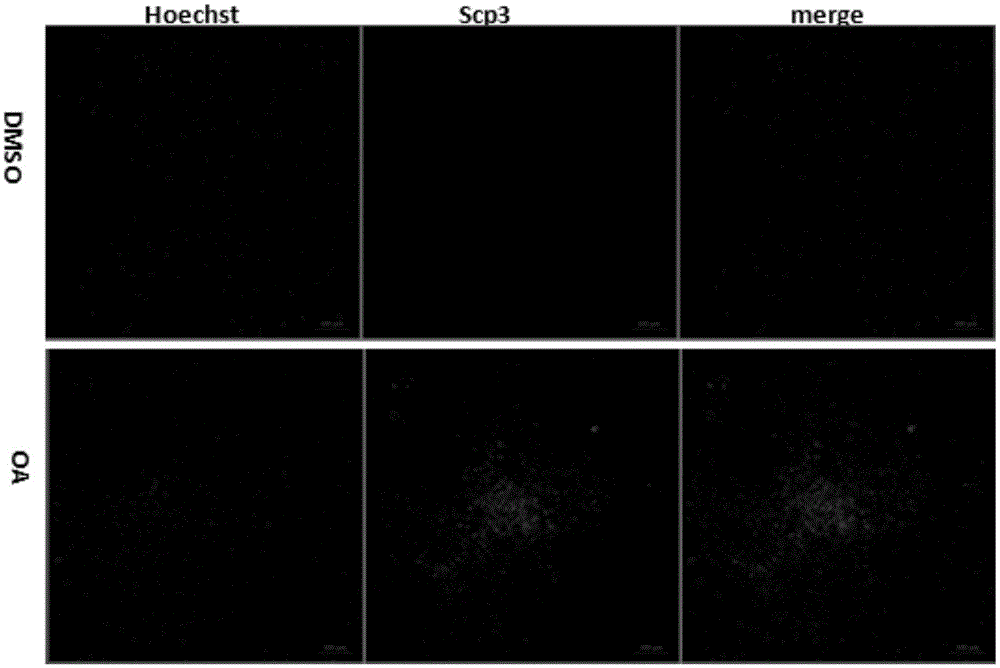
图2诱导之后生殖细胞标志物的表达情况,Scp3用绿色荧光标记,细胞核用蓝色荧光标记
图3诱导hESCs分化后卵细胞相关标志物mRNA的相对表达量
具体实施方式
以下是通过药效实验及临床实验证明本发明的有益效果。
实验例1本发明诱导液诱导脐带间充质干细胞分化为神经细胞
1材料
1.1细胞:人胚胎干细胞h9购中科院上海干细胞库,中国科学院干细胞库编号:SCSP-302,饲养层细胞NIH3T3:ATCC编号:ATCCCRL-1658
1.2药物与试剂:齐墩果酸(OA):成都中医药大学药学院制备(纯度98%),碱性成纤维细胞生长因子(bFGF)购自R&D,β-巯基乙醇购自Invitrogen,DMEM/F12、胎牛血清(FBS)、血清替代品、非必需氨基酸购自Gibco公司。一抗:anti-Scp3,二抗:山羊抗兔、购自Santa Cruz。Hoechst 33258:碧云天,cDNA合成试剂盒(Fermentas公司,K1632),qPCR试剂盒(Roche公司,04913850001)。h9培养基组成:80%DMEM/F12+20%血清替代品(此处的血清替代型号为:GIb co,lot:1347549)+4ng/mL bFGF+0.1mMβ-巯基乙醇+1%非必需氨基酸(此处的非必需氨基酸的型号为:GIb co,lot:1240196),NIH3T3饲养层细胞培养液组成:DMEM+10%FBS
2.方法和结果
2.1细胞的培养和诱导分化
2.1.1饲养层细胞NIH3T3的培养和拟胚体的制备
用NIH3T3细胞作为人胚胎干细胞的饲养层,37℃、5%CO2条件下培养,当细胞铺满培养瓶的80%时,按1:40比例加入丝裂霉素C抑制细胞生长,3h后PBS缓冲液轻柔清洗5次,将h9细胞以3×105/孔的浓度接种于NIH3T3细胞之上,采用h9完全培养液培养,每48h换液,培养5-6天后,将细胞消化后放入超低 吸附板中继续培养,24h后,肉眼可见培养板中漂浮着白色颗粒状物体,即为拟胚体,细胞在超低吸附板培养48小时。
2.1.2人胚胎干细胞h9的诱导分化:将拟胚体细胞以3×105细胞/孔的量接种于24孔板中,用h9培养基培养,后分别加入终浓度为1‰(即20ug/ml)OA及1‰DMSO干预,48h更换一次培养液,每天显微镜下观察细胞形态学变化并拍照。
2.2向生殖细胞方向诱导分化鉴定:(1)用PBS洗涤培养板细胞2次;(2)加入4%多聚甲醛固定15min;(3)用1‰PBS Triton洗涤2次;(4)加入封闭液封闭1h;(5)分别滴加适当浓度的一抗(Scp3),37℃孵育1h;(6)PBSTriton洗2次;(7)加FITC标记的山羊抗兔IgG(150:1),室温孵育1h;(8)加入Hoechst 332585min;(9)PBS冲洗2次;加入抗淬灭剂;(8)荧光显微镜下观察,拍照。
2.3生殖细胞分化相关的标记基因的检测:
诱导结束后,用Trizol提取两组细胞的RNA,按cDNA合成说明书合成cDNA,qPCR试剂盒进行qPCR实验,检测与生殖细胞分化相关的Oct4、Vasa、Scp3、Gdf9、Zp1、Zp2、Zp37种基因的表达情况,选人Gapdh基因为内参基因。针对上述基因的引物信息如表1。
表1针对7种标识基因及内参基因的引物序列
3数据分析:
所有数据均用x±s表示,统计分析软件SPSS19.0分析所有数据。P<0.05认定为具有统计学意义,运用Sigma Plot10.0画图。
4实验结果
4.1诱导之后细胞形态变化和免疫荧光染色
诱导4天后:与对照组比较,终浓度为20ug/ml的OA诱导hESCs后,细胞形态变圆、体积增大,细胞直径可达70-100um,OA组细胞和大鼠卵细胞相比,两者形态接近,而对照组DMSO诱导后则无明显变化(图1)。细胞免疫荧光显示,hESCs经OA诱导后可表达生殖细胞标志蛋白Scp3,对照组Scp3的表达为阴性(图2)。
4.2OA对生殖标记物的影响
运用EXCEL软件计算出各组各基因2-△ct,所有数据均扩大105倍。经SPSS 19.0软件统计可得,所有数据均满足正态分布与方差齐性,故采用表示,两组比较选用配对T检验
OA对Scp3、Vasa、Oct4基因表达有明显影响(P<0.05),Gdf9基因表达上调,但不具有统计学意义。OA组Gdf-9、Scp3、Vasa、Oct4mRNA分别为DMSO组的1.29倍、3.27倍、4倍和0.19倍,对Zp1、Zp2、Zp3基因表达影响不明显(表2,图3)。
表2OA对hESCs的多个生殖分化标识基因转录表达的影响
注:OA组与DMSO组比较,其中“△”表示P<0.05,“*”表示P<0.01
5讨论
近年来随着不孕不育的发病率在临床上逐渐升高,辅助生殖技术得到了广泛的应用,但针对生殖细胞缺乏的不孕不育症束手无策。胚胎干细胞可以向生殖细胞方向分化,诱导因子多为卵泡液、颗粒细胞、E2激素等,但采用中药诱导干预胚胎干细胞分化的报道较少,且未见OA的相关报道。
上述实验结果说明,hESCs经OA诱导后,细胞体积增大,和大鼠卵细胞具有类似的形状,细胞免疫荧光技术检测生殖细胞标记物Scp3表达阳性,说明OA可以诱导hESCs向生殖细胞方向分化。
Oct4在维持未分化的胚胎干细胞的自我更新中起关键作用,常被用做未分化细胞的标记基因。SCP3为减数分裂的标志蛋白,hESCs向生殖细胞方向分化方向分化需Scp3表达上调。Vasa是原生殖细胞的标记物,一般在减数分裂以后分泌,在很多物种的生殖细胞中均有特异表达。Gdf9由卵母细胞分泌而来,参与卵泡生成、成熟的各个阶段,密切影响卵母细胞的生长与发育。 ZP1、ZP2、ZP3是透明带标志物,是哺乳动物成熟卵母细胞的特异胞外基质糖蛋白。qPCR结果发现,OA对Vasa、Scp3、Oct4和Gdf9的转录表达有明显影响。经OA诱导之后Oct4的表达下调,说明诱导过程中人胚胎干细胞发生了分化。Scp3、Vasa、Gdf9表达上调,表明OA诱导后的hESCs极有可能启动了减数分裂的进程使其向生殖细胞方向分化。ZP1、ZP2、ZP3表达无明显影响,说明诱导分化的细胞还处于原始阶段,并非成熟的生殖细胞。
综上,本发明齐墩果酸可以显著提高人胚胎干细胞中生殖细胞标志基因的表达水平:Gdf-9、Scp3、Vasa,还可以促进其形态向生殖细胞方向变化,说明本发明齐墩果酸可以促使人胚胎干细胞向生殖细胞方向定向分化,本发明方法制备得到的类生殖细胞具有分化为生殖细胞的潜力,有可能制备成为体外受精技术的原材料,为不孕不育疾病的治疗提供了新的思路,具有重要的临床应用价值。
- 还没有人留言评论。精彩留言会获得点赞!