HeLa-F细胞及其用途的制作方法
本发明涉及HeLa-F细胞及其用途。
背景技术:
目前,国内生物制药企业在细胞基质的培养过程中,普遍采用传统的转瓶细胞培养工艺,该方法存在细胞密度低、病毒产率低、生产成本高、劳动强度大等缺点。诞生于20世纪60年代的悬浮培养技术可以进行大规模细胞培养,能够获得大量的、高密度细胞基质,从而获得大量的细胞培养物和/或疫苗产品,因而在国外生物制药产业中普遍应用。
悬浮培养技术是在生物反应器中、人工条件下高密度大规模培养动物细胞用于生物制品生产的技术,根据细胞是否为贴壁细胞的性质,分为悬浮细胞培养和贴壁细胞微载体悬浮培养。其中,悬浮细胞的培养非常简单,很容易实现高密度大规模悬浮培养,而贴壁细胞则由于易于贴壁,且在悬浮培养时,不易长期维持并难以达到高密度,只能采用细胞微载体悬浮培养的方式。但是,细胞微载体悬浮培养存在诸多缺陷,比如:1.需使用在培养液中添加动物血清,而血清成分复杂,增加后续纯化难度,并且由于引入了影响质量的其他物质,增加了不可控风险;2.培养固体微载体吸附血清,容易变性;3.培养后需要通过消化或球转球等手段分离细胞,操作过程易造成细胞流失;4.培养工艺复杂,劳动力消耗大,生产成本高;5.细胞易受搅拌、球珠间碰撞、流动剪切力等条件影响。
HeLa细胞,人宫颈癌细胞株,在含血清、贴壁培养下被发现具有极强的支持病毒复制的能力。然而,由于其贴壁细胞的特点,不能直接悬浮培养,在传统应用中,必须借助于微载体才能进行悬浮培养,存在前述成产成本高、产品不可控等诸多缺陷。
技术实现要素:
为了解决上述问题,本发明提供了一种HeLa-F细胞,其是由HeLa细胞驯化而来,与HeLa细胞的贴壁细胞特点不同,HeLa-F细胞具有能在悬浮状态下培养的特点,属于悬浮细胞。
本发明HeLa-F细胞,它是中国典型培养物保藏中心保藏的保藏号:CCTCC C2015138的人宫颈癌细胞HeLa-F。
本发明人宫颈癌细胞HeLa-F,于2015年10月21日保藏在中国典型培养物保藏中心,其简称为CCTCC,其地址为:中国.武汉.武汉大学,其保藏 号为:CCTCC C2015138。
其中,所述HeLa-F细胞为悬浮细胞。
本发明还提供了一种重组HeLa-F细胞,它是包含病毒的HeLa-F细胞,所述HeLa-F细胞为前述HeLa-F细胞中的细胞。
优选地,所述病毒为痘苗病毒。
本发明还提供了前述HeLa-F细胞在病毒生产中的应用。
本发明还提供了一种利用HeLa-F细胞制备痘苗病毒的方法,它包括如下步骤:
(1)取前述HeLa-F细胞,加入培养液和痘苗病毒,培养;
(2)离心,收获细胞,破碎细胞,离心,取上清,即可。
优选地,步骤(1)中,所述培养液为EMEM培养液。
优选地,步骤(1)中,加入痘苗病毒时,MOI(Multiplicity of infection,感染复数)为0.05-0.15。优选地,所述MOI为0.1-0.15。
优选地,步骤(1)中,所述培养的方法是:36~38℃、3%~10%CO2条件下培养24~96小时。进一步优选地,所述培养的方法是:37℃、5%CO2条件下培养48小时。
优选地,步骤(2)为:以1000rpm离心10min收获细胞,冻融3次破碎,3000rpm离心10min,取上清。
本发明HeLa-F细胞为悬浮细胞,可以直接高密度大规模悬浮培养,同时支持病毒复制的能力也非常强,比如,用于制备痘苗病毒时,单细胞产量高达26.8~31.8pfu/cell,因而其可用于大量的病毒产物和高质量的疫苗产品的制备,且其大规模培养非常简单,无需使用细胞微载体等辅助材料,成本低廉,工业应用前景极好。
以下通过具体实施方式对本发明作进一步的详细描述,但并不限制本发明,本领域技术人员可以根据本发明作出各种改变和变形,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。
附图说明
图1 HeLa-F细胞的连续传代培养
图2 HeLa-F细胞的生长曲线
具体实施方式
本发明涉及到的“E+”为科学记数法,例如,1E+6与106等同。
实施例1本发明HeLa-F细胞的制备
1、细胞的制备
HeLa(贴壁)细胞来源于ATCC(子宫颈癌细胞,ATCC货号:CCL-2,冻存批号:61647128)。
1.1HeLa-Adhere细胞准备
1.1.1取HeLa(贴壁)细胞1支,标记为批号ACB140724P04的HeLa细胞,复苏,在含10%FBS的EMEM中培养,批号为:标记AC140901P0401。
1.1.272小时后,取出HeLa细胞(AC140901P0401),弃去上清液,于每瓶细胞中,加入15ml的PBS溶液洗涤1次,加入2ml消化液(0.25%Trypsin-EDTA),待细胞脱落后,加入8.0ml含10%FBS的EMEM中和,轻轻吸出细胞至50ml离心管中,130xg离心5min,弃去上清液,加入30ml含10%FBS的EMEM,制备成均匀的细胞悬液,接种至1个225cm2培养瓶中,标记:AC140901P0402。
1.1.348小时后,按1.1.2的消化方法将HeLa细胞消化下来,加入90ml含10%的EMEM,制备成均匀的细胞悬液,接种至3个225cm2培养瓶中,标记:AC140901P0403。
1.1.448小时后,按1.1.2的消化方法将HeLa细胞消化下来,加入300ml含10%的EMEM,制备成均匀的细胞悬液,接种至10个225cm2培养瓶中,标记:AC140901P0404。
1.2更换无血清培养液培养
取出预先准备好的HeLa-Adhere细胞(批号:AC140901P0404),弃去旧培养液,用PBS洗涤细胞1次后,加入消化液(TyrpleTM select),消化HeLa细胞,用EMEM中和消化,将细胞悬液平分至50ml离心管中,以130×g离心5min,弃去上清液,收获HeLa细胞。加入无血清培养液,调整细胞浓度约为3.0E+5cells/ml,混匀,将细胞悬液接种至75cm2培养瓶中,每瓶接种15ml。放置于饱和湿度,37.0℃,8.0%CO2的培养箱中静置培养,经过48小时静置培养后,观察细胞生长及成团情况。
结果发现,细胞呈圆形,分散度好,呈单个细胞悬浮生长,说明获得了纯的悬浮细胞,将这种悬浮细胞命名为HeLa-F细胞。
在48-96小时后,于每瓶细胞中取样计数,并计算存活率,根据计数结果补加无血清培养,调整至细胞浓度约为3.0E+5cells/ml,接种至75cm2培养瓶或175cm2培养瓶中,放置饱和湿度,37.0℃,8.0%CO2的培养箱中静置培养。
经过第一次传代,细胞呈圆形、悬浮生长。以后每48-96小时传代一次。
结果发现,在第8代时已经能达到稳定,在第8代到第25代时,细胞倍增时间为36.0h,细胞生长良好,存活率及倍增时间均很稳定(如图1)。在第11代(P11)时冻存13支,经复苏检查,P11在复苏后能继续正常悬浮生长。
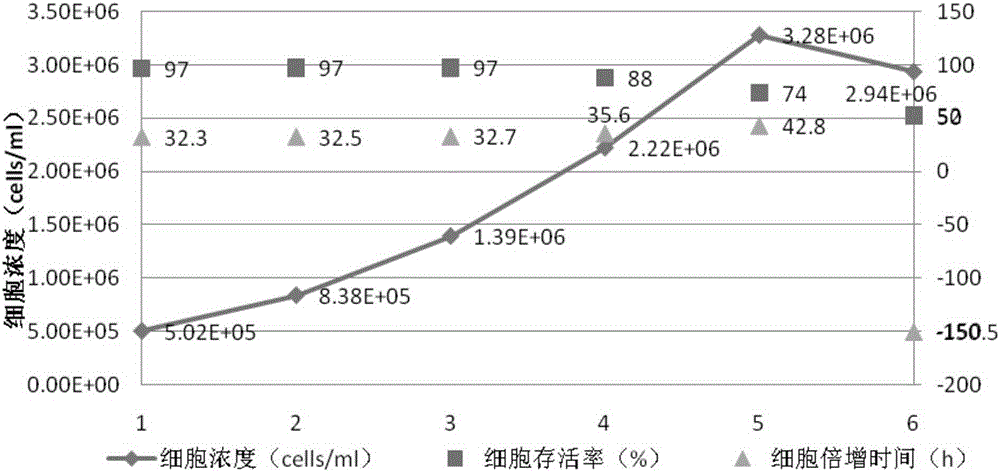
1.3生长曲线测定
取稳定生长的前述冻存的第11代细胞,经过复苏并连续传代培养后(P1121、P1122、P1123)的HeLa-F细胞,在倒置显微镜下观察,细胞应为:圆形,单个或成簇悬浮生长,生长状态良好。
将细胞悬液吸取至储液瓶中,取样计数,并计算存活率。根据计数结果补加无血清培养,调整至细胞浓度约为3.0E+5cells/ml,接种至75cm2培养瓶中,放置饱和湿度,37.0℃,8.0%CO2的培养箱中静置培养,每24小时取样计数,计算存活率,直至细胞不再生长,存活率明显下降后结束培养。
其生长曲线如下表1和图2:HeLa-F细胞在培养液中培养,细胞生长稳定,存活率大于85%,平均最高生长浓度为:2.22E+6cells/ml,倍增时间范围在32.3-35.6小时,平均倍增时间为33.3小时。当细胞达到最高生长浓度时,细胞存活率明显下降。在细胞浓度约为:1.39E+6cells/ml时,细胞存活率约为97%,为对数生长期的中后期。
表1HeLa-F细胞的生长曲线
本发明通过对HeLa细胞进行驯化,获得了一种新的细胞HeLa-F,其与传统的HeLa细胞的生长特性不同。传统的HeLa细胞为贴壁细胞,而本发明经过驯化以后得到的HeLa-F细胞为悬浮细胞。
HeLa-F细胞通过传代扩增至一定数量后建立主细胞库和工作细胞库。
取本发明冻存的工作库细胞(P44)HeLa-F细胞,命名为人宫颈癌细胞HeLa-F,于2015年10月21日保藏在中国典型培养物保藏中心,其简称为CCTCC,其地址为:中国.武汉.武汉大学,其保藏号为:CCTCC C2015138。
实施例2本发明HeLa-F细胞的大规模培养(HeLa-F细胞在波浪式反应器中培养实验)
1、实验方法
取本发明实施例1中冻存的主细胞库或工作细胞库HeLa-F细胞,在波浪式反应器中培养:
复苏来自本公司建立的HeLa-F细胞主细胞库或工作细胞库细胞1支,经过传代,待细胞扩增至20-25个175cm2培养瓶时,准备接种至波浪式反应器中。
当上述HeLa-F细胞接种至20-25个175cm2培养瓶后第二天,开启波浪式反应器,安装10L细胞袋。
通过接管机将接种瓶连接到10L细胞袋中,加入1000ml无血清培养液,定为D-1。设定摇动速度为12rpm(6rpm~30rpm),摇动角度为:6°(3°~15°),通气量:0.2Lpm(0.1Lpm~0.4Lpm),CO2浓度:8.0%(3%~10%),O2浓度:25.0%(20%~50%),温度:37.0℃(36℃~38℃)。
当上述HeLa-F细胞接种至20-25个175cm2培养瓶并培养3天后,将HeLa-F细胞接种至波浪式反应器中培养,培养袋体积为10L,初始工作体积为1500-1700ml,设定摇动速度为12rpm(6rpm~30rpm),摇动角度为:6°(3°~15°),通气量:0.2Lpm(0.1Lpm~0.4Lpm),CO2浓度:8.0%(3%~10%),O2浓度:25.0%(20%~50%),温度:37.0℃(36℃~38℃),定为D0。在接种细胞1小时后取样计数并记录。
在D1时取样计数,计算存活率,并对细胞培养进行监控。
在D2时取样计数,计算存活率,当HeLa-F细胞达到约1.0E+6cells/ml时补加500ml-700ml无血清培养液,设定摇动速度为12rpm(6rpm~30rpm),摇动角度为:6°(3°~15°),通气量:0.2Lpm(0.1Lpm~0.4Lpm),CO2浓度:8.0%(3%~10%),O2浓度:25.0%(20%~50%),温度:37.0℃(36℃~38℃),补液后1小时取样计数。
在D3时取样计数,计算存活率,当HeLa-F细胞达到约1.0E+6cells/ml时补加1000-1200ml无血清培养液,设定摇动速度为12rpm(6rpm~30rpm),摇动角度为:6°(3°~15°),通气量:0.2Lpm(0.1Lpm~0.4Lpm),CO2浓度:8.0%(3%~10%),O2浓度:25.0%(20%~50%),温度:37.0℃(36℃~38℃),补液后1小时取样计数。
每24小时进行取样计数,计算存活率。
2、实验结果
大规模培养条件下,本发明HeLa-F细胞在细胞存活率大于85%的条件下,细胞浓度最终达到2.0E+6cells/ml,基本与静置培养的细胞浓度相当。
实验结果说明,本发明HeLa-F细胞可以直接高密度大规模悬浮培养,可用于大量的病毒产物和高质量的疫苗产品的制备,且大规模培养时可以对其直接悬浮培养,无需使用细胞微载体等辅助材料,工艺简单,成本低廉。
实施例3采用本发明HeLa-F细胞制备痘苗病毒
1、实验方法
痘苗病毒,为痘苗病毒哥本哈根株。痘苗病毒液中,病毒的滴度为5.77E+7pfu/ml。
取本发明实施例1中冻存的主细胞库或工作细胞库HeLa-F细胞,130×g离心5min,离心后重悬计数,细胞总数为:4.4E+7个细胞,存活率:91%。将HeLa-F细胞分装,每瓶为8.8E+6个细胞,按下表2分别加入培养液和痘苗病毒液,放入37℃(36~38℃),5.0%(3%~10%)CO2培养箱中培养48(24~96)小时。
表2培养液和痘苗病毒液的加入方式
以1000rpm离心10min收获细胞,每个样品(每个样品为约8E+6个细胞)加入2.0ml病毒保存液,含10mM Tris/5%Sucrose/10mM NaGlu/50mM NaCl(pH8.0)。冻融将混合物投入-80℃冰箱中过夜,然后取出,在37℃水浴中不停摇动直至全部解冻,如此进行3次破碎,3000rpm离心10min取上清。
2、实验结果
本试验在制备痘苗病毒的过程中,产生了包含痘苗病毒的重组HeLa-F细胞。
本发明方法制得的痘苗病毒的数量如下表3:
表3感染痘苗病毒的实验结果
实验结果说明,用本发明HeLa-F细胞能有效支持病毒复制,用其制备 痘苗病毒时,单细胞的病毒产量高达26.8~31.8pfu/cell,其中,MOI为0.1~0.15时,单细胞产量较高,为31.4~31.8pfu/cell,MOI=0.15的单细胞病毒产量最高,为31.8pfu/cell。
综上,本发明通过驯化HeLa细胞获得了一种新的细胞HeLa-F,其为悬浮细胞,可以直接高密度大规模悬浮培养,同时支持病毒复制的能力也非常强,比如,用于制备痘苗病毒时,单细胞病毒产量高达26.8~31.8pfu/cell。因此,本发明HeLa-F可用于大量的病毒产物和高质量的疫苗产品的制备,且其大规模培养非常简单,无需使用细胞微载体等辅助材料,成本低廉,工业应用前景良好。
- 还没有人留言评论。精彩留言会获得点赞!