一种生物活性肽和体外扩增CIK细胞的方法与流程
本发明属于医药领域,涉及多肽药物的制备和应用,具体涉及一种生物活性肽和体外扩增CIK细胞的方法。
背景技术:
肺癌是全球最常见的恶性肿瘤,死亡率居恶性肿瘤之首。我国肺癌发病率呈现逐年上升趋势,年平均增长近2%。肺癌根据病理学特点的不同分为多种组织类型,肺癌组织类型不同,其治疗措施也不同。根据2004版WHO分类,常见肺癌组织病理学分型分为非小细胞癌(NSCLC)和小细胞癌(SCLC)。非小细胞癌又分为鳞状细胞癌(SCC)、腺癌(AC)和大细胞癌(LCC)。不同肺癌临床治疗方案不同,预后效果也不同。因此,为了提高治疗效果,肺癌的治疗策略已经从传统的以分期为基础的治疗模式转变为以组织学类型和基因突变为指导的个体化、精准的多学科治疗模式。个体化治疗提高了肺癌的治疗和预后效果。
生物活性肽(Biologically active peptides,BAP)是一种具有特殊生理功能的小分子活性物质,如抗肿瘤、抗菌、抗高血压、抗病毒以及提高免疫力等,这些物质广泛存在于动物、植物以及微生物中。生物活性肽主要有4种来源,分别为蛋白生物活性肽、微生物发酵代谢多肽、天然活性多肽以及化学合成多肽。知了猴又称知了龟、爬蚱等,是金蝉的成熟若虫,蛋白含量非常高,具有较高的食用和药用价值。申请人对知了猴生物活性肽进行了大量研究,已经发现不同工艺制备的基于知了猴的生物活性肽明显抑制肺腺癌A549细胞株增殖(申请号201710109721X)和抑制小细胞肺癌干细胞侵袭和转移(申请号2017101067746)的作用。
肿瘤免疫治疗是肿瘤生物治疗中的主要方法,而过继免疫治疗是肿瘤免疫治疗的一种有效方法。细胞因子诱导的杀伤细胞(cytokine-inducedkiller,CIK)兼有T淋巴细胞强大的抗瘤活性和自然杀伤(natural killer,NK)细胞非主要组织相容性复合体(major histocompatibility complex,MHC)限制性杀瘤的优点。它可以在不损伤机体免疫系统结构和功能的前提下,直接杀伤肿瘤细胞,并调节和增强机体免疫功能,在治疗恶性实体肿瘤中所取得的效果已得到广泛的认同。而获取数量足够且生物活性强的CIK细胞是取得良好疗效的基础。
传统培养CIK细胞方法需要较高的基础细胞数,需用血细胞分离机分离外周血、提取单个核细胞,繁琐耗时,污染机会大,特别不适宜异体供血。如何简化培养过程,提高CIK细胞在体外增殖效率和细胞毒活性是基础研究的一个热点问题,该问题的有效解决可以提高过继免疫治疗在肿瘤免疫治疗领域的应用。
目前尚未有研究证明知了猴生物活性肽可以提高CIK细胞体外增殖效率和细胞毒活性。
技术实现要素:
本发明的目的在于提供一种生物活性肽和体外扩增CIK细胞的方法。
上述目的是通过如下技术方案实现的:
一种体外扩增CIK细胞的方法,抽取外周静脉血分离单个核细胞,用无血清培养基制成细胞悬液,置于预先包被有抗人CD3单克隆抗体的培养瓶中培养,以后培养体系中只补充IL-2和无血清培养基,在37℃、5%CO2条件下培养14-21天,其中:包被抗人CD3单克隆抗体时还同时包被有生物活性肽,所述生物活性肽以知了猴为原料,用胰蛋白酶酶解后用超滤膜截留分子量3000-1000u的组分,冻干即得。
优选地,生物活性肽和抗人CD3单克隆抗体在培养瓶中的包被浓度分别为20μg/mL和5μg/mL,预先24小时包被。
优选地,细胞悬液置于培养瓶中开始培养24小时后,向培养体系中添加1000U/mL的IL-2继续培养,以后培养体系中只补充IL-2和无血清培养基。
优选地,所述生物活性肽的具体制备方法包括如下步骤:
将知了猴洗净后绞成肉糜,置于超纯水中,加入胰蛋白酶酶解,酶解条件为:pH值,7.8-8.2;酶解温度,43-47℃;酶解时间,10-12小时;
酶解结束后,加热使胰蛋白酶灭活,冷却至常温;
冷却后,8000-10000rpm离心20-30分钟,取上清,冷冻干燥得冻干粉;
将冻干粉用超纯水溶解,依次用截留分子量分别为10000u、5000u、3000u以及1000u的超滤膜对所得到的生物活性肽进行分离,收集截留分子量3000-1000u的组分,冻干即得。
优选地,加热使胰蛋白酶灭活的方法为:在80-90℃条件下水浴8-12分钟。
优选地,酶解条件为:pH值,8.0;酶解温度,45℃;酶解时间,11小时。
优选地,离心条件为:9000rpm离心25分钟。
优选地,所述胰蛋白酶的添加量为底物肉糜重量的0.2-0.3%。
上述方法制备的CIK细胞。
上述CIK细胞用于制备治疗肺癌的药物的用途。
本发明的有益效果:
本发明提供的生物活性肽可以高效诱导CIK细胞体外扩增,存活率高,纯度高,本发明体外扩增CIK细胞方法得到的CIK细胞具有出色的体外杀瘤效果和体内抑瘤效果;同时,本发明方法使用廉价易得的生物活性肽替代了传统培养方法中的重组人IFN-γ和IL-1α,成本低。
附图说明
图1为两种培养方法诱导的CIK细胞的增殖能力;
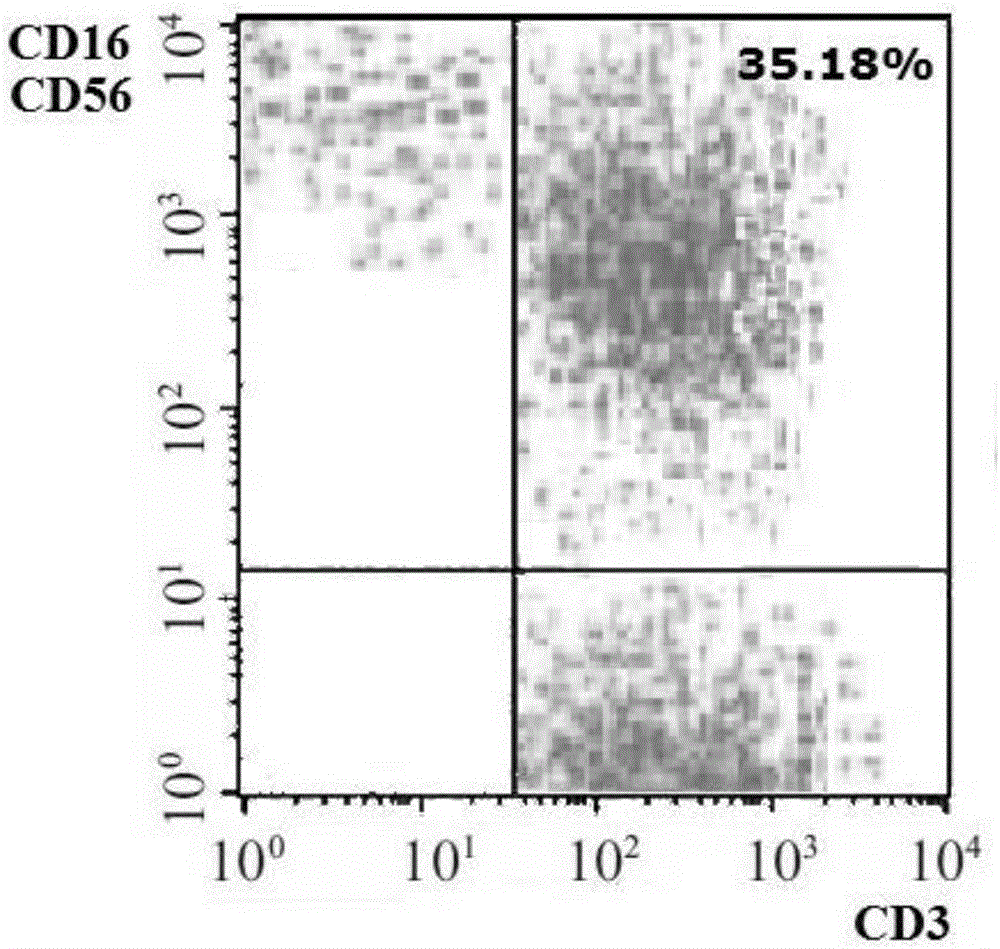
图2为生物活性肽诱导培养法第21天CD3+CD56+CD16+亚群细胞比例流式图;
图3为两种培养方法诱导的CIK细胞体内抑瘤率。
具体实施方式
下面结合具体实施例和附图详细介绍本发明的技术方案和技术效果。未注明具体条件的实验方法,通常按照常规条件,例如教科书和实验指南中所述的条件,或按照制造厂商所建议的条件,为本领域普通技术人员熟知或易于获知。
实施例1生物活性肽的制备
一、实验材料
1、仪器试剂
超滤杯和超滤膜购于上海摩速科学器材有限公司;
胰蛋白酶(1:250U/mg)购于广州市齐云生物技术有限公司。
2、实验样品
收集刚出土上树的新鲜知了猴,保存在水中,于-20℃冻存。使用前于室温条件自然化冻。
二、实验方法和结果
1、酶解方法
将知了猴洗净后绞成肉糜,取10g肉糜置于50mL超纯水中,加入胰蛋白酶进行酶解,胰蛋白酶的添加量为底物肉糜重量的0.25%,酶解条件为:pH值,8.0;酶解温度,45℃;酶解时间,11小时;
酶解结束后,在85℃条件下水浴10分钟使胰蛋白酶灭活,冷却至常温;
冷却后,9000rpm离心25分钟,取上清,冷冻干燥得冻干粉。
2、纯化方法
将冻干粉用超纯水溶解(1g冻干粉加10mL超纯水),然后依次用截留分子量为10000u、5000u、3000u以及1000u的超滤膜对所得到的生物活性肽进行分离,收集截留分子量3000-1000u的组分,冷冻干燥(含水量≤5%)即得。
超滤过程中控制CO2的压力使其小于0.25MPa。
实施例2 CIK细胞的体外培养、扩增、存活率测定及免疫表型检测
一、实验方法
1、CIK细胞的体外培养、扩增和存活率测定
抽取30例健康人外周静脉血共计150mL,用淋巴细胞分离液提取外周血单个核细胞,PBS洗涤后用KBM551无血清培养基制成细胞悬液,调整细胞浓度为1×105/mL,均分为6份,分别用本发明生物活性肽诱导培养法和传统诱导培养法培养,每种方法平行操作3份。
生物活性肽诱导培养法:培养24小时前,用含有20μg/mL生物活性肽和5μg/mL抗人CD3单克隆抗体的冰PBS 250mL置于培养瓶中,4℃过夜;24小时后,弃去PBS,加入上述细胞悬液250mL,在37℃、5%CO2条件下开始培养。培养24小时后,向培养体系中添加1000U/mL的IL-2继续培养,以后培养体系中只补充IL-2和无血清培养基。
传统诱导培养法:培养24小时前,用含有5μg/mL抗人CD3单克隆抗体的冰PBS 250mL置于培养瓶中,4℃过夜;24小时后,弃去PBS,加入上述细胞悬液250mL,在37℃、5%CO2条件下开始培养。培养当天向培养体系中添加1000U/mL的重组人IFN-γ、500U/mL的IL-1α和1000U/mL的IL-2继续培养,以后培养体系中只补充IL-2和无血清培养基。
每3天用台盼蓝染色检测细胞存活率,记录细胞绝对数。
2、免疫表型检测
分别取培养第0、7、14、21天样品6mL,离心后用PBS洗涤2遍,按照BD公司流式检测试剂盒的说明书染色操作,并采用流式细胞仪测定培养液中CD3+、CD3+CD4+、CD3+CD8+、CD3+CD16+CD56+细胞的百分比。
二、实验结果
1、两种方法诱导CIK细胞的增殖活性与存活率
如图1所示,生物活性肽诱导培养法和传统诱导培养法培养的CIK细胞均表现出非常高的增殖活性,培养第21天时,培养体系中CIK细胞数量达到最高值,生物活性肽诱导培养法中CIK细胞的增殖活力明显高于传统诱导培养法,培养第21天时,前者CIK细胞数量为后者CIK细胞数量的2.4倍,有统计学差异(P<0.05)。
检测生物活性肽诱导培养法和传统诱导培养法的CIK细胞存活率,第15天分别为(98.85±1.12)%和(94.36±1.68)%,第21天分别为(96.17±1.44)%和(90.22±2.15)%,存活率都在90%以上,生物活性肽诱导培养法中CIK细胞的存活率明显高于传统诱导培养法。
2、两种方法诱导CIK细胞免疫表型的变化
如表1所示,健康人外周血淋巴细胞经诱导及体外扩增培养后,CD3+、CD3+CD8+、CD3+CD56+CD16+细胞比例较培养前明显增加,CD3+CD4+及CD3+CD4+与CD3+CD8+的比值则明显降低,即杀伤性T细胞比例增加,辅助性T细胞减少。表面标记为CD3+CD56+CD16+的细胞被认为是CIK细胞的主要效应细胞,在体外扩增过程中可扩增至2000倍以上。图2流式结果图为生物活性肽诱导培养法第21天CD3+CD56+CD16+亚群细胞的比例。
表1两种方法诱导的CIK细胞中各亚群比例随培养天数的变化(n=3,取均值)
上述结果表明,两种培养方法中,杀伤性T细胞比例增加,辅助性T细胞减少。
实施例3 CIK细胞体外杀瘤率测定
一、实验方法
1、肿瘤细胞培养
人肺癌细胞株A549用含10%小牛血清的RPMI-1640培养基,于37℃、5%CO2条件下常规培养,传代。传代时用0.25%胰蛋白酶消化3分钟,以培养液吹打制成细胞悬液,按所需浓度接种。当与CIK细胞混合时,作为靶细胞。
2、MTT法测定CIK细胞体外杀瘤率(%)
选对数生长期的人肺癌细胞株A549,调整细胞浓度为8×104/mL,于96孔板中每孔加入100μL,37℃、5%CO2培养箱中培养4h。取培养第15天的CIK细胞为效应细胞,按效靶比20:1和40:1加入CIK细胞,设效应细胞杀伤组、效应细胞对照组、肿瘤细胞对照组,每组设6个复孔。共同培养48h后加入2.5mg/mL MTT溶液40μL后再培养4h。离心弃上清,加入150μL DMSO溶液震荡混匀,酶标仪选择570nm波长,测定各孔光密度值(optical density,OD),计算杀瘤率,计算公式为:
杀瘤率(%)=1-[(杀伤组OD值-效应细胞对照组OD值)/肿瘤细胞对照组OD值]×100%。
二、实验结果
如表2所示,生物活性肽诱导培养法和传统诱导培养法培养的CIK细胞均表现出非常强的体外杀瘤活性,且生物活性肽诱导培养法培养的CIK细胞的体外杀瘤活性显著优于传统诱导培养法培养的CIK细胞的体外杀瘤活性,有统计学差异(P<0.05)。
表2两种方法诱导的CIK细胞体外杀瘤率比较(%)
上表数据表明,生物活性肽诱导培养法培养的CIK细胞的体外杀瘤活性显著优于传统诱导培养法培养的CIK细胞的体外杀瘤活性。
实施例4 CIK细胞体内抑瘤率测定
一、实验方法
于BALB/c裸鼠的右腋皮下注射处于对数生长期的A549细胞5×106个,体积均为0.2ml/只。第16天选择荷瘤大小相似的裸鼠随机分为生理盐水对照组和CIK细胞治疗组。治疗组于肿瘤局部注射培养第15天的CIK细胞1×107个/只,体积均为0.2ml/只,对照组于肿瘤局部注射生理盐水0.2ml/只;每周治疗1次,连续治疗3次。从治疗开始每7d用游标卡尺测量肿瘤的最大纵径(a)及最大横径(b)1次,肿瘤体积=0.5×a×b2,按照如下公式计算CIK细胞体内抑瘤率:抑瘤率(%)=(对照组肿瘤体积-治疗组肿瘤体积)/对照组肿瘤体积×100%。
二、实验结果
如表3和图3所示,生物活性肽诱导培养法和传统诱导培养法培养的CIK细胞均表现出非常强的体内抑瘤活性,且生物活性肽诱导培养法培养的CIK细胞的体内抑瘤活性显著优于传统诱导培养法培养的CIK细胞的体内抑瘤活性,有统计学差异(P<0.05)。
表3两种方法诱导的CIK细胞体内抑瘤率比较(%)
上表数据表明,生物活性肽诱导培养法培养的CIK细胞的体内抑瘤活性显著优于传统诱导培养法培养的CIK细胞的体内抑瘤活性。
本发明提供的生物活性肽可以高效诱导CIK细胞体外扩增,存活率高,纯度高,本发明体外扩增CIK细胞方法得到的CIK细胞具有出色的体外杀瘤效果和体内抑瘤效果;同时,本发明方法使用廉价易得的生物活性肽替代了传统培养方法中的重组人IFN-γ和IL-1α,成本低。
- 还没有人留言评论。精彩留言会获得点赞!