基于微流控芯片的体外极低氧诱导功能性神经元形成方法与流程
本发明涉及将微流控芯片技术应用领域,具体涉及一种基于微流控芯片的体外极低氧诱导功能性神经元形成方法。
背景技术:
神经元是脑部发挥功能的重要功能成分和单元,越来越多的研究人员发现,许多脑部疾病的发生与发展被认为与神经元的功能损伤或缺失有关。随着科学研究的深入和科学技术的发展,人们发现体外功能性神经元可直接应用于脑部疾病的诊断、治疗和检测等多个方面,因此,体外培养和产生功能性神经元对脑损伤和脑部疾病的研究与治疗有着重大意义。
目前,体外神经元的培养主要集中于原代提取,即从动物脑部提取原代的功能性神经元,但随着医学的进步和伦理的局限,动物实验将逐步淡化,且动物和人体具有一定的种属差异,为了避免上述问题,认为诱导的功能性神经元越来越受到研究人员的青睐。但由于神经元生长和增殖的微环境比较苛刻,培养方法复杂,且易失活,因此寻找行之有效的体外功能性神经元的诱导和培养方法成为当今的研究热点。
微流控芯片技术作为一门迅速发展起来的科学技术,已经在生物医学领域展现了其独特的优势,更因其同细胞尺寸匹配、环境同生理环境相近、在时间和空间维度上能够提供更为精确的操控,易于通过灵活设计实现多种细胞功能研究等特点而成为新一代细胞研究的重要平台。另外,有研究表明神经元生长和增殖的微环境为低氧的,但将微流控技术与低氧培养微环境结合进行功能性神经元诱导的方法学研究尚处于空白阶段。
技术实现要素:
本发明提供了一种基于微流控芯片的体外极低氧环境诱导功能性神经元的方法,能够实现将大鼠成熟脑星形胶质细胞诱导为功能性神经元。
一种微流控芯片,该芯片主要由小皿、芯片主体组成;芯片主体上设有细胞培养池,芯片直接放置于小皿底部,细胞培养池底即为小皿底部表面。
所述芯片主体直接放置于小皿底部,无需封接,芯片主体上的细胞培养池的数量为7-15个。
一种基于微流控芯片的体外极低氧诱导功能性神经元形成方法,其特征在于:采用上述微流控芯片,构建极低氧环境活细胞培养室,将细胞直接培养在极低氧环境活细胞培养室中进行诱导,诱导时间为2-30天;细胞每24小时换液一次;2-7天时,细胞培养液为高糖DMEM培养基+3%胎牛血清(FBS);8-21天时,细胞培养液DMEM/F12培养基+3%胎牛血清(FBS)。
所述构建极低氧环境活细胞培养室的方法为为:细胞培养池中的混合气为CO2、O2与N2的混合气,通过调节O2与N2的混合气的比例以实现细胞培养盒中的O2含量,实现缺氧环境的构建。
所述构建极低氧环境活细胞培养室中O2与N2的混合气的比例可调,培养室中O2的浓度为0.2%-21%。
本发明提供了一种新颖、快捷、有效的功能性神经元的制备方法。本发明的优点在于:1)芯片制作方法简单,无需复杂的结构设计和技术集成,即可完成需求;2)诱导方法快捷、有效,无需多种诱导因子的加入和复杂诱导程序的进行,只需在低氧环境中短期诱导即可得到功能性神经元,且成熟星形胶质细胞的来源广泛,无细胞来源上的限制,因此能够大量诱导得到功能性神经元, 为临床应用提供充足的细胞来源。
附图说明
图1本发明微流控芯片整体结构示意图;其中,1为小皿,2为芯片主体,3为细胞培养池;
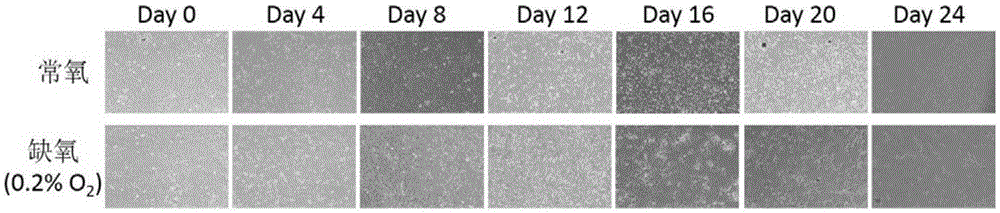
图2低氧诱导过程中脑星形胶质细胞的形态学变化,每4天采集一次图像数据,共采集24天;
图3诱导24天后,对细胞的表征情况,包括星形胶质细胞标记物(GFAP),神经干细胞标记物(Nestin)和神经元标记物(bIII-tub、NeuN、GABA、Syn);
具体实施方式
下面的实施例将对本发明予以进一步的说明,但并不因此而限制本发明。
一种微流控芯片,构型如图1所示。该芯片主要由小皿1、芯片主体2组成;芯片主体2上设有细胞培养池3,芯片主体2直接放置于小皿1底部,细胞培养池3底即为小皿1底部表面。
芯片主体2直接放置于小皿1底部,无需封接,芯片主体2上的细胞培养池3的数量为7-15个。
实施例1
体外极低氧环境诱导功能性神经元的方法
利用实验室自行设计制作的微流控芯片,体外提取的新生SD大鼠的原代脑星形胶质细胞经过连续培养10天后,体外发育为成熟的脑星形胶质细胞。将这部分细胞消化为单细胞悬液,接种于芯片的细胞培养池中,细胞悬液浓度为1×106-2×106cells/mL,静置于细胞培养箱中24小时待细胞完全贴壁,所用细胞培养液为高糖DMEM+10%FBS。细胞贴壁后,换液为高糖DMEM+3%FBS,放 置入极低氧活细胞培养室中,培养室中的氧气浓度为0.2%。连续培养7天,每24小时换液一次。从第8天开始,细胞所用培养液为DMEM/F12+3%FBS,每24小时换液一次,直至第24天结束。整个诱导过程中每4天拍照一次,结果如图2所示。
实施例2
功能性神经元标记物表征
在经过24天的极低氧诱导之后,将细胞培养芯片从极低氧活细胞培养室中取出,进行细胞免疫荧光染色,监测蛋白为星形胶质细胞标记物(GFAP),神经干细胞标记物(Nestin)和神经元标记物(bIII-tub、NeuN、GABA、Syn),方法如下:4%多聚甲醛进行细胞固定,PBS缓冲液冲洗三次,每次10min;0.1%Triton X-100致孔剂作用10min,PBS缓冲液冲洗三次,每次10min;山羊封闭血清作用1h,一抗(GFAP、Nestin、bIII-tub、NeuN、GABA、Syn)1:100稀释,4℃过夜孵育,PBS缓冲液冲洗三次,每次10min;二抗(TRITC标记的山羊抗兔IgG)1:50稀释,常温孵育1h,PBS缓冲液冲洗三次,每次10min;冲洗完毕后加入1:2000稀释的DAPI工作液,荧光显微镜下拍照,记录各种标记物蛋白的表达情况,结果如图3所示。
- 还没有人留言评论。精彩留言会获得点赞!
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- 基于水凝胶溶胀特性的可控自变形神经微电极的制造方法与工艺
- SPKP‑XI在制备Kv4.1钾通道抑制剂中的应用的制造方法与工艺
- 小驳骨提取物作为神经保护剂的应用的制造方法与工艺
- 巴戟天低聚果糖提取物在制备防治阿尔茨海默症药物、保健品或食品中的应用的制造方法与工艺