用于应力土壤的接种菌剂的制作方法
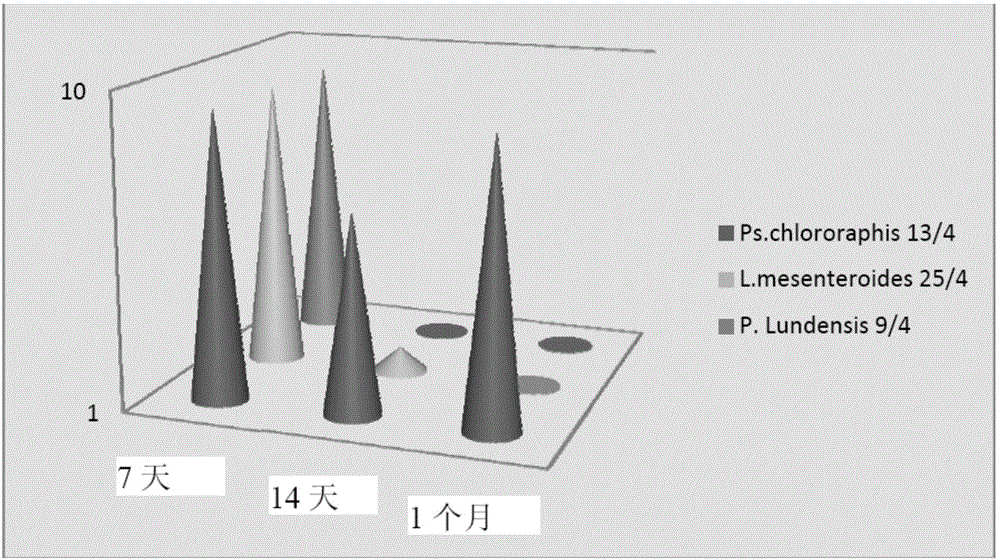
集约化农业生产以及在过去的50年化肥的使用已经使所有耕地的65%的土壤恶化,贫瘠化和盐渍化(自然,2009年)。根据有关粮农组织数据库有关于土壤质量的数据,潜在的可用于农业生产的土壤中6%的土壤含苏打和盐,15%是强酸性(pH值<4.5),另外14%(与强降雨的区域)是弱酸性。作为土壤退化的必然结果,土壤的微生物菌群贫瘠,微生物不能在干燥的土壤中生长,或因不同高度的pH值,这导致了土壤结构的解体。由于氮和磷的供应持续减少,土壤的这种解构阻碍腐殖质和土壤有机质的形成,土壤失去肥料是指日可见的事情。因为缺乏足够的结构,人造肥料不能被土壤吸收而是浸出并污染周围水生生物的栖息地。随着人口的不断增长,未来几年在非洲,亚洲和南美会有大面积的土地被划为农业用地。亚洲和非洲的大面积的土地会因为不恰当的-不可持续的-耕作和栽培方法面领着被沙化的风险。沙化的进程已经开始了。现代生物方法可以防止过度使用人工肥料以及它对土壤和自然水域所产生的不良后果,这种不良后果必将在短短几十年内发生,在非洲和亚洲,饮用水是十分珍贵的资源。土壤接种和化肥(降低使用量)的组合使用可以防止已经出现在欧洲和北美的土壤退化问题。生物土壤振兴是另外一种替代方法,它不是劳动密集型的,是安全环保的(卡普兰,1993年;杜阿等,2002)。土壤接种是现场完成的-无需运送土壤-涉及某些植物种类和吸收,绑定或分解污染物(Heitzer和Sayler,1993)和改良土壤的生命力。长远来看,生物法会让经济作物产量增加,减少化肥应用的数量,因此对环境的负荷也减少。在匈牙利-总的来说在欧洲-用于经济重要的粮食和饲料作物种植的耕地所用的土壤以相当的速度在恶化-pH值不利的低肥土壤,盐渍或引流不畅,总的来说,土壤境况堪忧。在匈牙利的土壤多为弱酸性或碳酸性,中性土壤。一个较低的比率,但在相当多面积的土地里,根据国家的农业生态潜力的调查(Várallyay等,1980),强酸性和碱性土壤盐渍都存在(Stefanovits,1963年):43%的土壤是弱酸性,13%为强酸性,38%是碳酸化和8.1%是盐渍。最近的数据显示,在匈牙利的所有土壤中,8%是强酸性(pH值KCL<4,5),18%是中等酸性土壤(PH值KCL4,5-5,5)和20%是弱酸性(pHKCl5,5-6,5)。在匈牙利,酸性土林,草甸土和沙土覆盖高达1.5亿公顷,钠质和二次盐渍化地区占700,000-800,000公顷。全国土地面积的8.1%中发现碱土。在746000公顷的区域里沙质土壤有8%。由于这些土壤在可用耕地中占有相当的比例,他们不能被排除在农业用途之外。尽管这些土壤属于低产出土壤,它们也必须以可持续和环保的方式继续用于耕作。酸化导致土壤中基本阳离子和养分贫瘠,粘合物质的缺失,粘土质矿物的分解,这些因素最终会导致土壤结构崩解和金属离子的溶解度的增加。在酸性土壤中的微生物菌群通常是变化的,菌群的组合模式变成主导。这些变化导致农作物质量降低和数量减少。土壤酸化的一个主要原因是化肥的过度使用。最常用的物质中,硫酸铵和过磷酸钙形成的酸性水溶液,这些物质增加了土壤胶体的H+聚合,导致pH值降低。阳离子交换进一步增加了土壤的酸化,从化肥中而来的阳离子-NH4+,K+,和Na+取代H+在土壤胶体的表面上被吸收,从而溶解在土壤里。酸化导致钙,镁,钠和钾离子的浸出。总之,pH降低会减轻供应给植被的可用的N和P的量,以及土壤团聚体和粘合物质的缺失导致土壤失去水份还原能力,从而引起土壤干涸固化。原发性或自然的盐化是由在母岩和富含盐的浅层地下水区域盐的沉积引起的。第二等级的盐化-在大多数情况下,属于人为的-盐化是灌溉和/或水引流不畅所致。使用不同的添加剂(如化肥),可能造成低透水性耕地盐化。高浓度的盐会抑制土壤对营养物质的吸收,也会污染植物的水源。大量的盐化会损害土壤结构,从而土壤包和一个不渗透的上层-盖或壳–就形成,从而土壤会因为缺氧而失去活性,造成土壤生态系统的不平衡。土壤中的微生物代谢的变化,会导致土壤活性受损和土地产出率迅速下降。有趣的是,钠质土壤中潜在地含有丰富的营养成分,但由于不良物理性能或高盐浓度,它们是不可用于植物的。由于高盐浓度的毒性和在土壤胶体中增加渗透压,土壤盐渍化会阻碍和损害植物生长。通常在土壤表面能观察到一种白色层,它是由可溶性盐(在碱性盐化盐土土壤中),苏打水,或者-在碱化土壤-无定形二氧化硅(SiO2)组合产生的。中性或酸性土壤盐渍化也会出现。治理酸化土壤的传统方法是用甜菜钾肥,石灰,加入石灰的湿地土壤和苔藓(在酸性森林土壤,草甸和沙质土壤,酸性土壤盐渍化的情况下)。石灰以多种方式产生作用:减少异常酸度,提供了植物的钙供应和改善土壤结构。然而,由于石灰材料越来越少,石灰法没有被广泛实行。由于成本过高的原因,在过去十年中,传统的对钠质和二级盐渍化耕地土壤的改良方法较少应用。根据最新的出版物,适用于酸性或碱性盐土的土壤接种剂以及普遍适用于多种领域的品种在世界任何地方都还没有被常规地使用。已知的单个案例是,作为在澳大利亚长期深入的研发结果,在强酸性土壤中对豆科物种的接种。然而,这些对豆科植物接种的特异性限制了它们在农业用途中的应用。酸性土壤,沙质土壤和碱性土壤的原生微生物是具体的和典型的。即使是在这样的极端条件下,某些留置的菌株还是活跃的和有效的。跟在更平衡的土壤条件下相比,这些微生物在极端土壤条件下生长,腐殖化和矿化的更加迅速。然而,劣化的土壤通常与市售土壤接种剂接种,含有只适合于“正常”条件下的菌株。一些土壤接种剂其含有不适合于在极端条件下恶化了的土壤的菌株–当它与传统的改良方法结合应用到贫瘠的土壤上时,通常这种接种是不成功的。农业实践显然表明,这种接种剂在极端土壤条件下是无效的,同时显而易见的是,在有效地增强在恶化的土壤和原本就低产出的土壤中植物的生长和土壤的活性方面,细菌制剂有着巨大需求。本发明对于土壤接种剂组合物,具体菌株和土壤接种剂组合物的制备提供了复合微生物方法,这种方法可以用于贫瘠的土壤条件并有效地提高在特定的土壤中生产的食物和饲料作物的产量。内源性/内生细菌在植物有机体中是天然存在,并且在养分运输和土壤形成过程中平衡碳和氮代谢根际菌群定植在根区是至关重要的(Morris和Haskin,1990;Bagwell等人,1998)。植物种类和共生细菌的组合使用在许多方面是有利的:植物宿主经由根分泌的营养素来促进根际微生物群体的增殖和代谢,其可生成资源丰富的刺激微生物活性的环境(Lugtenber和deWeger,1992)。植物影响和提高了土壤的物理-化学参数,并在相关的微生物和资源以及潜在的污染物之间建立联系(Aprill,1990)。另一方面,根际微生物通过产生刺激生长的生物活性物质积极地影响植物的营养供给(营养物由微生物矿化释放)和植物生长(Campbell和Greaves,1990)。土壤修复可以用工业化生产的土壤细菌接种剂,这种菌剂通过生成生长素和细胞分裂素而反作用于非生物应力相关的生长抑制。它们可促进种子萌发和提高产量。实验证明,细菌土壤接种剂提高植物的活性和含水量,维持叶绿素含量和叶绿素a/b比值,促进根系生长((Glick,2003)。某些菌株可能修复和改造天线氮气,合成铁载体其有助于从土壤中摄取铁,或溶解不溶或难溶的矿物质,给植物供应磷(Glick,2003)。这些效应有利于土壤复活进程的效果和速度。在劣化土壤的改良中关键的是要给植物提供一个稳定的,恒定的营养供给。在已知氮严重缺乏的这类土壤中,氮的供应尤为重要(莫里斯,1991年)。化学氮供应的效率低,因为贫瘠的土壤结构阻止不了肥料浸出和被洗出土壤,在地表水和地下水中造成硝酸盐污染。突然的氮缺乏和大量的氮缺乏会破坏所种植的农作物。可靠的氮供应的关键是生物固氮,这意味着固氮(固氮菌)细菌种类通过固定和减少空中氮为氨为寄主植物提供氮的来源。与化学施肥相反,固氮菌细菌群体为植物提供恒定的平衡的氮。固氮细菌物种它产生激素样物质也促进生长,而这些激素样物质在农业生物科技中有着特殊的价值。这些物种如果是内生/内源性的,不仅定植在根部的表面,而且定植在植物组织里,它们是特别有效的(Piceno等,1999;Piceno和Lowell,2000),提供丰富的并且几乎直接传输的铵和植物激素给寄主植物。在根际,即在根部的表面和在接近根部的地方,是多样化和大量细菌的寓所,通常形成微菌落。它们有些菌落简单地利用从根系分泌的营养素。其他的菌落是共生的,受生长的直接或间接刺激作用有益地作用于寄主植物。这些物种被称为“植物生长促进根际细菌'(PGPR)(Vessey,2003;Kennedy等,2004;Kloepper,1994)。植物生长促进根际细菌PGPR可以根据自己的具体效果进行分类:-固氮物种,可以被认为是在氮缺乏条件下生物肥料经由固定,转化和转移空中氮到寄主植物中;-矿物溶解物种,生成可用于植物的不溶性磷和钾矿;-刺激生长的物种,产生激素样物质,直接促进生长发育;-具有生物控制效果的物种抑制生长和破坏植物病原体(镰刀菌,腐霉,灰葡萄,黄单胞菌属等)接种固氮土壤细菌菌株可以增强氮的供给。有些固氮菌菌株是自由生活的,其它的是在与根表面或多或少紧密连接,或甚至在根组织内定居。通过生物固氮,细菌固定空气氮并将其转换为氨,供寄主植物摄取。豆科植物的根瘤由与宿主植物共生的根瘤菌定植(中华根瘤菌,根瘤菌属,慢生根瘤菌属等)(Franche等,2009)。市售的土壤接种剂中,被作为生物肥料所发现的固氮物种,是自由存在的,因此固氮菌的效力小。更有效的是联想共生固氮菌,巴西固氮螺菌和生脂固氮螺菌(谷物,玉米)和根瘤菌,大豆慢生根瘤菌,苜蓿根瘤菌(为豆科植物)。该固氮菌物种生活在根附近,但不紧密地接触到根。它们能够有氧条件下结合分子氮。固氮菌物种,虽然不相关联固氮菌,可能生活在与玉米的根部紧密接触的地方,但与此相反的,固氮螺菌,它们不与任何单个植物家族相关联,因此它们能够刺激各种植物物种非特异性的生长。它们是自由生活在土壤中,不形成与植物的关联(除雀稗固氮菌)。在国内的土壤中存在着的主要是棕色固氮菌和圆褐固氮菌物种。棕色固氮菌的氮固定量非常高,因为–跟根瘤菌和固氮螺菌物种相反-为大气中的氮的再生,它有三种类型的酶复合物(替代固氮)。然而,它与植物的根不建立直接连接,所以固氮过程中产生的氨可被植物或多或少地利用,从而使供给到植物的氮的量不显著。国民经济意义上重要农作物谷类(小麦,玉米,水稻,大麦,小米,高粱等)的根部被定植,由固氮和需氧植物促生固氮菌和微需氧固氮螺菌,他们居于根的表面,其中一些菌株能够定植在根和茎的内部组织里,其与寄主植物共存,被称为缔共生(在Dobereiner综述,1989)。固氮螺菌细菌对寄主植物的积极作用:-是激素型分子促进由细菌生产的宿主植物的生长的结果,主要是吲哚乙酸;-在微需氧情况下能够固氮,因此该植物可以从空气中获得氮;-也能够减少硝酸盐,减少该过程的中间产物,亚硝酸盐,还具有促进植物生长的效应(Tianetal,1979;Okon和mtsai.,1976;Hartmann和Zimmer,1994;Michiels和mtsai.,1994)。细菌的植物生长促进能力是多种多样的,植物激素样物质的产生在农业应用中特别重要(由Ahemad和Kibret,2013中综述)。同时,革兰氏阴性细菌,兼性厌氧例如假单胞菌属和革兰氏阳性,需氧细菌,例如孢子杆菌物种形成在两个表面上,并在根的附近产生大量的植物生长促进物质。不同的革兰氏阳性和革兰氏阴性需氧细菌,兼性厌氧细菌在根际和根表面产生吲哚-3-乙酸,赤霉素类物质,生物素和泛酸发现菌株。生长素的最重要的代表是吲哚-3-乙酸(IAA),这是在所有植物中发现的。吲哚-3-乙酸的合成发生在从色氨酸的茎尖。生长素的最显著的效果是由伸长和细胞分裂刺激生长。然而,增加的钾离子浓度使水流入细胞,使得细胞体积增加,最终导致细胞伸长。除了细胞伸长的控制,生长素也介导重力和光的作用。此外,激素调节细胞壁纤维素和果胶合成的原料和木质素的产生。生长素诱导有丝分裂和延缓叶片的脱落和果实的脱离(恰萨尔,2004年)。它积聚在种子里促进种子发芽。生长素影响所有植物生长发育的现象,主要是与其他激素的合作时产生影响。不同的植物器官需要为他们生成不同浓度的生长素。高于最佳数量,生长素就被抑制。再加上赤霉素,生长素在花的繁殖方面的作用明确,他们在运输组织的分化中一起工作。顶端优势的发生是由于与脱落酸的合作。连同细胞分裂素,它刺激细胞分裂。辅助插件和细胞分裂素的激素家族调节植物发育的多个步骤。他们通常施加在组合形成营养器官的效果,并且生长素和细胞分裂素的比率决定形态内发生的方向。该组赤霉素包括通过增加扩散,其次,通过诱导细胞肥大类似结构的许多化合物,其上施加的分生组织的效果。,在许多方面吲哚乙酸它们的活性是相似的,因此这表明它们通过生长素合成的刺激作用部分地工作。土壤细菌能够产生吲哚乙酸(IAA),在很大数量上属于生长素家族。大部分根生长促进细菌能够产生IAA,它们在植物中产生的相应的IAA效果被施用到种植环境中(Glick和Patten,2002)。生成IAA的土壤细菌可以促进作物的发芽,从而增大根系统,其随后形成更大的吸收面。与IAA缺陷突变或未接种的植物相比,用恶臭假单胞菌菌株Pseudomonasputida接种的植物的根会长50%(GlickandPatten,2001)。固氮螺菌A.brasilense通过固氮作用和IAA激素产物接种于土壤的正面效果早已被知晓,尤其是在地中海,亚地中海气候区(OKON和Labandera,1994;OKON等,1995)。固氮螺菌接种的主要效果表现在植物根系,侧根富集,从而帮助植物摄取水和矿物,利用肥料,提高植物的干旱耐受性和对疾病的抗性的密集生长和应激条件。发芽和出苗活力得到提高。成功的受精增加了植物总的氮含量和干物质含量,提高了谷物的产量。由于植物根部的较高营养吸收能力,通过接种细菌固氮和提高肥料利用率,也可以节省氮肥(Fallik等人,1994;Kapulnik等人,1985)。在地中海和亚热带欧洲温带地区使用土壤固氮螺菌Azospirillum菌株接种的效果比较差,主要是因为他们的冷敏感性。同时,欧洲温带土壤只含有少量的固氮螺菌Azospirillum。使用含有耐寒性能的固氮螺菌Azospirillum菌株的土壤接种组合物,可以增大农作物根部区域。另外一种刺激植物生长的效果是通过减少植物中的乙烯量而实现的,它经由一些植物促生细菌来促进植物生长。酶enzyme1-氨基环丙烷aminocyclopropane-1-羧酸carboxilate(ACC)脱氨酶deaminase作用降低了乙烯含量(Glick等,大约2007年)。为了解释ACC脱氨酶关于在根表面自由存在的土壤细菌对植物生长的作用,建立了下面的模型(格里克等人,1998):附着在种子或根表面上的ACC脱氨酶菌,酶化了植物所分泌的ACC,从而形成阿法酮丁酸和氨。这些细菌实际上作为“ACC捕集容器”起作用,从而降低在应力条件土壤中的植物的乙烯含量(格里克,2004)。因此,它们能够保护在抑制生长应力土壤条件下的植物,其应力状况可能是由于以下原因造成的例如土壤溢水,极端的温度,有机和无机毒素,干旱或高盐浓度,植物病原体(Sun等人综述2009年)。许多植物都存有这种情况,种子发芽和生长需要乙烯,乙烯产率在发芽和幼苗生长过程中会增加。低量的乙烯会增强根的生长和影响根的延展;高量的乙烯,其通过快速增长的根部产生,可能会抑制根的延展(Mattoon和Suttle1991;Ma等1998)。根据模型(由格里克等人,1998),PGP细菌能够降低乙烯的含量,从而刺激植物生长(格里克等,1998)。种子表面的细菌和色氨酸tryptophan或种子发芽时渗出的其他氨基酸导致吲哚乙酸(IAA)的合成和分泌。IAA可能会被种子吸收,并连同内源IAA刺激植物细胞分裂和细胞伸长,或诱导氨基环丙烷1aminocyclopropane1-1羧酸carboxylicacid(ACC)合成酶synthase的合成。这种酶催化了S-腺苷-L-甲硫氨酸S-adenosyl-L-methionine(SAM)转换成ACC,这是乙烯的直接前体(Yang和Hoffman,1984)。很有可能,所得到的ACC是由发芽的种子分泌的;它被细菌所获得,然后使用ACC脱氨酶法水解成氨和阿尔法酮丁酸alpha-ketobutyrate(Glicketal格里克等.1998;Penrose彭罗斯2000)。根据该模型,作为捕集容器,ACC的摄取和由ACC脱氨酶引起的裂解既降低了ACC也降低了在发芽的种子附近产生的乙烯,(由彭罗斯等人Penroseetal.综述,2001)。用于农业栽培的土壤含有大量的水不溶性磷,因此不能以无机化合物(磷灰石和沉淀-含磷的肥料中残留的磷酸三钙)的形式和有机化合物(肌醇磷酸盐)的形式用于种植。解磷细菌,特别是假单胞杆菌Pseudomonas,芽孢杆菌Bacillus和根瘤菌Rhizobium菌种将土壤中不溶于水的磷酸变成可溶于水的形式。由于这些特性,它们是土壤接种组合物的重要组成部分。除了增强植物的P-磷的供应,它们的使用可能会增加作物产量(罗德里格兹和弗拉加RodriguezandFraga,1999,陶等Taoetal。,2008,桑德瑞和辛哈SundaraandSinha,1962)。在给玉米接种案例中,作物产量的增加与假单胞杆菌Pseudomonas以及芽孢杆菌Bacillus菌种的溶磷活性明显相关(Kavimandan和Gaur,1971)。用无机解磷荧光假单胞mineral溶磷P.fluorescens菌株处理黄瓜种子,黄瓜的较快生长是可以实现。这样处理的另一个优点是,在植物的生命的脆弱初始阶段,密集的假单胞杆菌Pseudomonas菌群成功地远离了致病微生物(Eklund和Sinda,1971)。大部分的矿物(无机)磷酸盐的溶解是通过由细菌生成的有机酸实现的,主要是葡萄糖酸(由Rodrigez和Fraga综述,1999)。生成的有机酸酸化了细菌细胞和它们的环境。大多数有机含磷物质的矿化是由土壤中的细菌酸性磷酸酶实现的(Tarafdar和Junk,1988Tarafdar和Claassen,1987)。当与溶磷假单胞杆菌phosphate-dissolvingPseudomonas和芽孢杆菌Bacillus菌种混合使用时,土壤补充接种的有益效果会进一步增加。经过接种处理的植物对氮和磷的吸收,干物质含量和粮食产量超过了个别接种所取得的效果的总和,由于植物得到了更加平衡的营养物质供应。因此如果除了用固氮重氮固氮螺菌细菌nitrogenfixingdiazotrophicAzospirillumbacteria,再将溶磷假单胞杆菌溶磷Pseudomonas和芽孢杆菌Bacillus菌种组合起来接种,可以进一步提高土壤补充接种的有利效果。有些PGPR细菌有生物防治效果,也能抑制土壤植物病原体(Gerhardson2002)。某些假单胞杆菌Pseudomonas和芽孢杆菌Bacillus菌种通过抗菌能够打败从根部而来的植物病原细菌和真菌-生成抗生素(由萨博Szabo,1992综述)。在土壤接种组合物中生成的最重要的生物防治细菌是假单胞杆菌Pseudomonas,芽孢杆菌Bacillus和链霉菌streptomyces(韦勒Weller,1988;Haas和Defago,2005综述)。其有益效果主要是减少了妨害根的真菌和细菌,因而减少了其所造成的损失。生物防治活动包含以下几点:(1)迅速有效地消耗根际的营养物质,微量元素和主要元素,对病原体而言没有营养的环境对它是不利的(2),由于其强烈的根定植能力,它们可以从根表面驱逐病原体,(3)它们诱生了植物的所谓的全身阻力,从而能抵抗更多的病原真菌,细菌和病毒。土壤细菌生成的铁载体能够收集铁,当铁的含量低时,细菌微环境中会缺乏铁。由于根际增生的病原性细菌和真菌不能利用来自铁载体的铁,它们的生长会被抑制。铁起着专性和兼性厌氧微生物新陈代谢作用,即使它在环境中量很少。铁的低可用性主要是由于从植物中进入土壤中的羟基氧化铁聚合物的溶解度低。出于这个原因,铁和/或微量元素的浓度是一个关键因素它决定了特定栖息地的微生物菌群的微生物聚生能力。在这样的环境中,大多数物种能生存或“坐庄”,这些物种有着精心打造的,卓有成效的铁采集机制和/或微量元素机制。同时,该植物能够摄取铁载体结合的铁。当铁处于微生物的环境较少可用的情况下,许多生物开始生成低分子量代谢物,铁载体和外膜蛋白其属于物种特性并且对Fe3+具有高亲和力(后者在铁的识别-铁载体复合和铁的吸收中发挥作用)。铁载体摄取矿物和有机化合物(例如转铁蛋白,乳铁蛋白)中的微量元素。铁载体是小分子量,二价配位体分子,它主要通过氧原子从六个octaeder方向附着在铁(Ⅲ)离子上,并以螯合物的形式从环境中吸取绘Fe3+离子并把它们输送到微生物细胞。传输微量元素进入细胞的细胞质是由输送系统中一个特定的膜受体介导的,它识别了铁和铁载体复合物。因此,微生物生产铁载体是用于保持繁殖能力的一个重要现象-尤其是在应力土壤条件下。使用该细菌接种剂组合物将有利的解决土壤的主要问题之一即土壤结构恶化的问题,因为胞外多糖exopolysaccharide(EPS)很大的增强了土壤微结构的改善-土壤聚合提升了我们的接种剂的能力。土壤的结构是由土壤孔的结合,土壤聚合物和土壤的微观结构来确定。这实际上是由土壤动物(如蚯蚓)和土壤细菌通过其生物和微生物活动形成的典型的土壤显微结构(,,microfabrics”Barratt,Breweer1964)。从微生物角度来看,最重要的部分是土壤聚合物的形成。令人惊奇的是,这些涂层-生物膜-关联土壤颗粒的形成可通过土壤接种剂来促进。引入到土壤中的特定细菌能够通过他们的细胞物质,胞外多糖(EPS)物质和由铁载体的生生诱发的生物膜,将由粘土,沙子和有机材料的组合形成的土壤颗粒粘合成土壤聚合物。大量生成的土壤聚合物增加了土壤的可行性,以及保水性和植物定植能力。此外,由于所有这些作用的结果,土壤板结减少了,从而它的产能提高了。通过重复这些适当的接种,土壤的生物动力每年更新,伴以细菌的使用,土壤的发育将是连续的,可持续的。团聚体和定植的形成-群体感应(QS)效果-涉及大量芽孢杆菌Bacillus,固氮杆菌Azotobacter,假单胞杆菌Pseudomonas和微球菌Micrococcu细菌((Lynch,1981)。此外,寡养单细胞菌Stenotrophomonas和鞘氨醇杆菌属Sphingobacterium菌种对团聚体的形成非常有效,这一效果在大麦田和苜蓿田的土壤中显示出来(Caesar-TonThatetal.,2007)。细菌粘土颗粒通过形成薄膜状涂层(单层)或它们附着在植物组织残基之外的丝状菌上(放线菌,霉菌)。在细菌细胞之间的通信-群体感应(QS)-在大量繁殖的时候,细菌能够同步它们的遗传功能并产生特定的化合物。当细菌达到一定的量,它们会形成的层即“生物膜”,例如在土壤颗粒的表面。当土壤颗粒有足够多的数量时可能发生这种情况。分泌的QS信号分子的浓度增加是细菌启动集约增殖的信号。QS的分子主要是长链脂肪酸,喹咛酸,脂肪酸,N-酰基高丝氨酸化合物的甲基酯,同铁载体一样,令人惊讶的,附加到所述细菌的特异性外膜蛋白受体。根据我们的假设,这些QS分子也是铁载体,因而可以像信号分子一样发挥其作用。这有助于细菌之间的通信从而繁殖,定植和形成生物膜。接种定植能力影响其他物种的再生,因此,为了准备适当的土壤接种组合物,一个独特的特殊定植-竞争(CoCoHelp)方法被开发。使用该方法-我们寻找问题的答案,找出哪些细菌能够合作繁殖(甚至实现协同效应)的,或者相反,哪些细菌抑制对方的生长,也许他们既不合作,也不阻碍彼此,同时也可以彼此之间繁殖。所有这些回答了问题,即其积极定植或产生铁载体,从而抑制或,相反,即使是“辅助”的细菌菌株可以被接种到在相同的培养土壤中,接种土壤时它们一起行动,不阻碍彼此的繁殖,甚至某些菌株互相定殖,因而适合作为土壤接种剂组合物。在已知文献中的几个文件中,提及在防御非生物应力状况下的促进植物生长的根际菌株的生产和使用,Damodaranetal.(2013)是用于分离和对极端盐浓度耐受的根际菌株(例如芽孢杆菌菌株)表征生化的具体例子。他们研究了盐浓度高达10%的菌株。Kutasi等(2009)和Bish等(2013)透露了抗寒固氮螺菌和假单胞菌株的生成和测验-测试是在4℃下进行的。New等人隔离和测试了在极低的pH值情况下固氮螺菌菌株的耐受性。经测试pH值为pH4-8,他们还公开了申请中描述的选择生化分析。BiancoCarmen和DefezRoberto(2011)参与讨论了非生物应力的细菌菌株。TheWO03016241和WO2010109436文献公开细菌种类的混合物(例如:固氮螺菌,假单胞菌)。后者教导了一种协同组合的搜索。根据现有的发明发现,特定的土壤细菌能够有效地和谐地提高植物的生长,营养植物,改善土壤微结构(供水),通过分离和鉴定合适的细菌菌株-适应于特定的条件-这些可能被在所谓的混合型的接种,其中所述土壤接种剂组合物已经用于包含了在给定的区域迅速增殖的微生物,矿化,产生激素,铁载体和胞外多糖,以及所选择的N-定影细菌菌株。从酸性和盐碱地区分离出的菌株中筛选出的应该是在碱性能够微生物,酸,咸的土壤条件,提升腐殖化,形成土壤团聚体,养分供应-宏观和微量营养素,主要是氮和磷,铁-促进农作物的发展和生产材料。根据本发明,通过使用所谓的土壤细菌筛选系统(SBSS),我们打算通过使用细菌固氮和生成铁载体,除了刺激植物生长和改善土壤结构,来延长土壤接种的效力,为增强耗尽区但仍然多产的土壤活性,作为常量缺少(特别是氮)和内消旋元素缺少(例如铁)的补充。因此,所发明的土壤接种剂组合物是用于改善在耗尽区中的氮贫土壤,从而有助于在农业生产方面的土地列入。从在匈牙利待处理和发现的土壤中,,我们分离了存在于特定的土壤类型中的微生物(沙质土壤,强酸性棕色森林土,碱性盐土和酸性盐土,酸性草甸土和酸味冲积),并支持植被适于应力效果(盐和/或酸和/或碱性pH)和迄今未知的条件下的效果。分离的和开发的细菌菌株是尚未被使用和被建议用于土壤接种新分离物,它们具有生长促进效果,它们生成植物激素和/或擅长固氮,作为自由生活的细菌,它们能有效的协同或有助于各项宏观和微量营养素,或生成的铁载体的摄取,改善土壤结构。按照本发明,在SBSS土壤细菌筛选系统的帮助下,土壤细菌能够在温带繁殖,从春天生长季节的开始,在4-8℃,土壤温度具有高效率,适当在中欧土壤,包括那些在匈牙利,这是在给定的土壤植物天然存在的特定土壤和特性,因此对应于当前环境,并且自然相同。选择系统使来自酸性和/或碱性和/或咸和/或沙质土壤最适当的繁殖能力和微生物活性菌株。根据该方法,在第一步骤中,通过施加的pH值,盐和寒冷的选择压力,优选宽的pH和/或盐和/或冷耐受菌株可以在很短的时间从每份土壤样品中获得上百的菌株。使用最合适的选择性微生物培养基,也优选自土壤中的非人类致病微生物菌株。具有高生长能力的数百个菌株进入SBSS系统的第二阶段用于测试植物生长促进(PGP)的效果,例如:磷酸盐增溶能力提供了营养供给和磷的植物,和/或氮结合容量提供从大气中的氮增加可利用的氮的量,以该植物吸收。磷酸盐增溶的菌株能力由羟基磷灰石溶解区分析验证,该氮定影能力是由经典乙炔还原气体色谱测量验证。植物生长促进筛选固氮和/或磷酸盐增溶的培养物的作用的检测是通过测定所述吲哚-3-乙酸激素和该使用快速比色测定法抑制乙烯合成ACC脱氨生产能力下进行。的铁载体产生和/或氮固定和/或磷酸盐增溶和/或吲哚-3-乙酸生产菌株是用于抑制通过测定分解chromoazurol链球菌菌株能够产生胞外多糖的能力得到植物病原微生物有用支持土壤形成和保水性和/或铁载体产生和/或氮固定和/或磷酸盐增溶和/或吲哚-3-乙酸(EPS)制备了其含有Calcofluor介质上荧光的基础上获得的。通过获得能够产生胞外多糖的菌株(EPS),该支持土壤形成和保水性和/或铁载体产生和/或氮固定和/或磷酸盐增溶和/或吲哚-3-乙酸使用按照SBSS系统产生本发明中,最合适的和最有效的微生物是可用的,这是菌株在极端土壤pH温带在土壤类型在高细胞数生长-酸性和/或碱性-和高盐(盐水),用高pH值和盐耐受性,植物营养,生长促进,以及用于抑制土壤植物致病性微生物,并改变土壤以帮助保水的结构。该系统可在以后扩展,以获得从由油,化学品,塑料,或其它材料污染土壤制得的菌株,其能够解毒或容忍除了上面列出的土壤肥力促进和植物生长增强性能的污染。已知的在文献中所公开的菌株,菌株的组合和选择方法,有一种持续需要提供一种促进植物极端应力条件下生长的改进的土壤接种剂组合物。这一事实,一些类似的解决方案存在不呈现明显的提供皮草疗法这种菌株或应变的混合物。本发明准确提供这种新颖和特别优选的菌株。使用所公开的选择方法,几个新菌株,除菌株在土壤中孕育剂组合物中通常存在的,被确定具有非常有利的效果,无论是单独使用或作为混合物的一部分,由于其特定的特征组合。应当强调的是,本发明的几株尚未已知可用作土壤接种剂组合物的组分是有用的。我们惊喜地分离并根据本发明筛选方法鉴定这些菌株。******因此,本发明提供了应力条件下从应力土壤中分离的应力耐受(ST)的土壤接种菌株。应力土壤选自于由不饱和红砂土和饱和红砂土,泽泻醇,钠质盐土,碱土,酸性潜育土,酸性冲积土组合的土壤标本。且其中所述应力条件是指土壤选自寒冷冷,高盐浓度,高PH的土壤标本该菌株是由该方法包括以下步骤获得:a)由应力条件下的应力的土壤,其中,所述选择,应力条件的,待决选择应力耐受性的细菌,是:在10℃的冷环境中并隔离在pH值为4和并酸性隔离,在pH值为9和或碱性隔离,6%的NaCl盐浓度下盐和分离;二)研究的菌株的应力耐受性繁殖能力,其中所述的选择是根据不同应力的条件下被执行时,在下列条件下:在低温应力的情况下,温度4-8℃之间,在酸性应力的情况下,pH值3-6之间,在碱性应力的情况下,pH值7-8之间,在盐应力的情况下,在1-8%的NaCl盐浓度;和c)以下几类确定土壤孕育应变应力,其中应变为:耐寒,如果在之间繁殖,耐酸性pH值,如果pH值3-6.9之间繁殖,耐中性pH,如果它在大约pH值为7.0时繁殖,耐碱性pH,如果pH值在7.6-8.0之间时繁殖,中度耐盐,如果它在盐浓度为3-4.5%时繁殖,或高度耐盐,如果它在盐浓度为5-8%时繁殖。根据本发明,菌株是优选自菌群成晶节杆菌S153(P)NCAIMB001424皮氏芽孢杆菌S284NCAIM(P)B001430绿针假单胞菌和AgreiapratensisS47NCAIM(P)B001431根据本发明,应力土壤指的是酸性,盐性,咸和沙质土壤。这些包括不饱和红砂土和饱和红砂土,泽泻醇,钠质盐土,碱土,酸性潜育土,酸性冲积土。如本文所用,应力条件意味着极端耐寒,极端耐盐和极端pH耐受条件下。作为选择方法的最终结果,所选择的菌株被确定为适合于接种应力的土壤,其能够在酸性,碱盐性,寒冷条件下生长应力耐受菌株。在这方面,术语“能够繁殖”指的是给定的菌株在所述给定的压力条件下(例如,1-8%的NaCl盐浓度,或酸性(3-7)或碱性(7-8)的pH在28℃和中性pH值在寒冷条件下(4-8℃))在培育168小时之后应变能在改良营养琼脂中性(NA)盘上形成一个大量的,至少超过一百可能达到七百的菌落。本发明进一步提供由适当的生化测定法进一步选择作为植物生长促进Rhizobacteriaceae根际杆菌菌株(PGPR),优选具有以下属性:结合氮,生成铁载体,ACC脱氨,活化磷酸盐,和生成吲哚-3-乙酸(IAA)。在进一步优选的实施方案中,本发明提供了由用于聚合促进(AP)的适当的生化测定法进一步选择,优选为胞外多糖生产ST的菌株。本发明进一步提供一个氮结合PGPR菌株,优选自菌株组合巴西固氮螺菌NF11NCAIM(P)B001428,巴西固氮螺菌242/9NCAIM(P)B001403,巴西固氮螺菌NF10NCAIM(P)B001427,largimobile固氮螺菌B41NCAIM(P)B001402,伊拉克固氮螺菌NF6NCAIM(P)B001425,and巴西固氮螺菌NF7NCAIMB(P)001433.本发明进一步提供了一个铁载体生成PGPR菌株,优选自菌株组合成晶节杆菌S153(P)NCAIMB001424皮氏芽孢杆菌S284NCAIM(P)B001430,largimobile固氮螺菌B41NCAIM(P)B001402,伊拉克固氮螺菌NF6NCAIM(P)B001425,绿针假单细胞菌K200913/4BNCAIM(P)B001370,绿针假单细胞菌K20099/4-BNCAIM(P)B001371,和AgreiapratensisS47NCAIM(P)B001431.本发明还提供了一种磷酸盐活性PGPR菌株的生成法,优选自菌株组合乙酰短杆菌LU44NCAIM(P)B001423,假性弗里德里克变种菌S33NCAIM(P)B001429,假单胞杆菌jesseniiS125NCAIM(P)B001422,成晶节杆菌S153(P),NCAIMB001424,AgreiapratensisS47NCAIM(P)B001431,绿针假单细胞菌K200913/4BNCAIM(P)B001370,和绿针假单细胞菌K20099/4-BNCAIM(P)B001371.本发明还提供了一种ACC脱氨酶PGPR菌株的生成法,优选自菌株组合绿针假单细胞菌K200913/4BNCAIM(P)B001370,假性弗里德里克变种菌S33NCAIM(P)B001429,巴西固氮螺菌NF11NCAIM(P)B001428,巴西固氮螺菌NF10NCAIM(P)B001427,伊拉克固氮螺菌NF6NCAIM(P)B001425,假单胞杆菌jesseniiS125NCAIM(P)B001422,乙酰短杆菌LU44NCAIM(P)B001423.本发明还提供了一种IAAPGPR菌株的生成法,优选自菌株组合巴西固氮螺菌NF11NCAIM(P)B001428,巴西固氮螺菌242/9NCAIM(P)B001403,巴西固氮螺菌NF10NCAIM(P)B001427,largimobile固氮螺菌B41NCAIM(P)B001402,巴西固氮螺菌NF7NCAIMB(P)001433乙酰短杆菌LU44NCAIM(P)B001423,假性弗里德里克变种菌S33NCAIM(P)B001429,假单胞杆菌jesseniiS125NCAIM(P)B001422,成晶节杆菌S153(P)NCAIMB001424,绿针假单细胞菌K200913/4BNCAIM(P)B001370,AgreiapratensisS47NCAIM(P)B001431,玫瑰库克菌S225NCAIM(P)B001426.本发明还提供了一种胞外多糖AP菌株生成法,优选自菌株组合单纯杆菌S28NCAIM(P)B001432,玫瑰库克菌S225NCAIM(P)B,001426,明串珠菌K200925/4NCAIM(P)B001372,绿针假单细胞菌K200913/4BNCAIM(P)B001370,绿针假单细胞菌K20099/4-BNCAIM(P)B001371.本发明还提供了一种绑定氮IAAPGPR菌株生成法,优选自菌株组合巴西固氮螺菌NF11NCAIM(P)B001428,巴西固氮螺菌242/9NCAIM(P)B001403,巴西固氮螺菌NF10NCAIM(P)B001427,巴西固氮螺菌NF7NCAIMB(P)001433,largimobile固氮螺菌B41NCAIM(P)B001402.本发明还提供了一种ST菌株它是一种持久定植菌株,它定植于高酸pH4.2-4.3的土壤中,具有稳定的至少超过4个月的超强繁殖能力,优选于组合菌群largimobile固氮螺菌B41NCAIM(P)B001402,巴西固氮螺菌NF7NCAIMB(P)001433本发明还提供了一种ST菌株它可生成细胞分裂素:反式玉米素和反式玉米素核苷类似生长素和赤霉素3激素,它是选自伊拉克固氮螺菌NF6NCAIM(P)B001425.本发明还提供了一种ST菌株它是广泛的pH耐受菌株它能在pH4.5and9.5的环境里持续繁殖,它优选于组合菌群largimobile固氮螺菌B41NCAIM(P)B001402.本发明还提供了一种ST菌株它可以在pH值为6.5–9.5的碱性条件下生成吲哚-3-乙酸,它是选自玫瑰夸克菌S225NCAIM(P)B001426.本发明还提供了一种ST菌株它可以抑制植物病原真菌交链孢,禾谷镰刀菌和串珠镰刀菌,它是优选自菌群largimobile固氮螺菌B41NCAIM(P)B001402,伊拉克固氮螺菌NF6NCAIM(P)B001425,乙酰短杆菌LU44NCAIM(P)B001423,假性芽孢杆菌S284NCAIM(P)B001430,AgreiapratensisS47NCAIM(P)B001431,成晶节杆菌S153(P)NCAIMB001424,假单胞杆菌jesseniiS125NCAIM(P)B001422.根据进一步优选的实施方案,本发明提供一种革兰氏阴性或革兰氏阳性PGRP和/或AP菌株,它在人类身上无致病性,将按以下任一物质进一步显现:木糖,乳糖和/或蔗糖消极,硫化氢生产,多粘菌素抗性,甘露醇消极,卵磷脂生产,和/或消极蔗糖,硫化氢产物,抗多粘菌素,消极甘露醇,卵磷脂产物,和/或消极乳糖,这些菌株优选自菌群溶性芽孢杆菌,巨大芽孢杆菌,短小芽孢杆菌,耐寒短杆菌,乙酰短杆菌,Agreiapratensis,假单胞杆菌jessenii,,乙酰短杆菌,成晶节杆菌,玫瑰夸克菌,单纯芽孢杆菌,皮氏芽孢杆菌,假性弗里德里克变种菌,明串珠菌,生脂固氮螺菌,易拉克固氮螺菌,largimobile固氮螺菌,巴西固氮螺菌。在一个特别优选的实施方案中,本发明提供一种菌株优选自以下菌群乙酰短杆菌Agreiapratensis,假单胞杆菌jessenii,成晶节杆菌,单纯芽孢杆菌,皮氏芽孢杆菌,明串珠菌,假性弗里德里克变种菌,绿针假单细胞菌和largimobile固氮螺菌。在另一个方面,本发明提供了一种应力耐受(ST)土壤接种菌株混合物,其中,菌株容许互相繁殖,互相定植,互相帮助,此混合物是通过以下步骤经由定植竞争和协作方法而获得:a)按照1-10中的任何一项要求来检测ST菌株,-铁载体的生成,-形成抗菌的能力抗革兰氏阴性铜绿假单胞菌NCAIMB.01102和固氮土生拉乌尔NCAIMB.02149革兰氏阳性环状杆菌NCAIMB.01115典型的存在于土壤和胞外多糖产物的细菌b)研究后将菌株分成积极菌群,抗性菌群,敏感菌群c)在配对抑制试验中测试步骤b中的较少侵略性,抗性和敏感性的菌株d)鉴定适合于在混合物中使用的轻微地或部分地互相抑制或互相帮助的菌株。在这方面,如本文中所使用的,最适合于土壤接种的菌株应该很好繁殖,仅部分或略微抑制彼此比较不敏感,或者如果它们是敏感的,它们对应的助手应该存在。在进一步的实施方案中,本发明提供了一种土壤接种剂组合物,含有上述定义的菌株混合物。在进一步的实施方案中,本发明提供了一种土壤接种剂组合物,由上述菌株或菌株的混合物组成,包括以下:-至少结合一个氮,-至少生成一个铁载体,-至少一种活性磷酸盐,-至少生成一个ACC脱氨,-至少生产一个IAA,-至少生产一个外多糖,-至少一个植物病原真菌抑制,-至少一个持久土壤定植,-至少一种细胞分裂素玉米素和反式玉米素核苷生产,-至少一个赤霉素生产,-至少一个植物病原真菌抑制和至少一个应变与其他活动,-至少一个氮结合和至少一种生长素生产,-至少一个氮结合和至少一种磷酸盐,-至少一个氮结合和至少一种胞外多糖生产,-至少一个氮结合和至少一种植物致病真菌抑制,-至少一个氮结合和至少一个持久土壤定植,-至少一个氮结合和至少一种细胞分裂素玉米素和反式玉米素核苷生产,-至少一个氮结合和至少一个赤霉素生产,-至少一个氮结合和至少生成一个IAA和至少生成一种胞外多糖,-至少一个氮结合和至少生产一个IAA和至少生成一个ACC脱氨-至少一个氮结合和至少一个IAA生产和至少生成一种活性磷酸盐,-至少一个氮结合和至少一个IAA生产和至少一个铁载体生产,-至少一个氮结合和至少一个IAA生产和至少一种植物致病真菌抑制,-至少一个氮结合和至少一个IAA生产和至少一个持久土壤定植,-至少一个氮结合和至少一个IAA生产和至少一种细胞分裂素玉米素和反式玉米素核苷生产,-至少一个氮结合和至少一个IAA生产和至少一个赤霉素生产,-至少一个氮结合和至少一个IAA生产和至少一个ACC脱氨生产和至少一种胞外多糖生产,-至少一个氮结合和至少一个IAA生产和至少一种磷酸盐动员和至少一种胞外多糖生产,-至少一个氮结合和至少一个IAA生产和至少一个铁载体产生和至少一种胞外多糖生产,-至少一个氮结合和至少一个IAA生产和至少一种植物致病真菌抑制和至少一种胞外多糖生产,-至少一个氮结合和至少一个IAA生产和至少一个持久土壤定植和至少一种胞外多糖生产,-至少一个氮结合和至少一个IAA生产和至少一种细胞分裂素玉米素和反式玉米素核苷生产和至少一种胞外多糖生产,-至少一个氮结合和至少一个IAA生产和至少一个赤霉素生产和至少一种胞外多糖生产,-至少一个氮结合和至少一个IAA生产和至少生成一个ACC脱氨和至少一种胞外多糖生产和至少一种磷酸盐动员,-至少一个氮结合和至少一个IAA生产和至少一种植物致病真菌抑制和至少一种胞外多糖生产和至少一种活性磷酸盐,-至少一个氮结合和至少一个IAA生产和至少一个持久土壤定植和至少一种胞外多糖生产和至少一种活性磷酸盐,-至少一个氮结合和至少一个IAA生产和至少一种细胞分裂素-zeatin和反式玉米素核苷生产和至少一种胞外多糖生产和至少一种活性磷酸盐,-至少一个氮结合和至少一个IAA生产和至少一个赤霉素生产和至少一种胞外多糖生产和至少一种活性磷酸盐,要么-至少一个氮结合和至少一个IAA生产和至少一个ACC脱氨生产-ING和至少一种胞外多糖生产和至少一种活性磷酸盐和至少一个铁载体生成,-至少一个氮结合和至少一个IAA生成和至少一种植物致病真菌抑制和至少一种胞外多糖生产和至少一种活性磷酸盐和至少一个铁载体生产,-至少一个氮结合和至少一个IAA生产和至少一个持久土壤定植和至少一种胞外多糖生产和至少一种活性磷酸盐和至少一个铁载体生产,-至少一个氮结合和至少一个IAA生产和至少一种细胞分裂素玉米素和反式玉米素核苷生产和至少一种胞外多糖生产和至少一种活性磷酸盐和至少一个铁载体生产,-至少一个氮结合和至少一个IAA生产和至少一个赤霉素生产和至少一种胞外多糖生产和至少一种活性磷酸盐和至少一个铁载体生产,在一个特别优选的实施方案中,本发明提供了一种土壤接种剂组合物,它对接种具有中性pH值的土壤是有用的,并且是一种混合培养,适合以下土壤特定应力耐受性土壤细菌菌株:PseudomonasjesseniiS125NCAIM(P)B001422ArthrobactercrystallopoietesS153(P)NCAIMB001424KocuriaroseaS225NCAIM(P)B001426巴西固氮螺菌AzospirillumbrasilenseNF11NCAIM(P)B001428巴西固氮螺菌AzospirillumbrasilenseNF10NCAIM(P)B001427AzospirillumlargimobileB41NCAIM(P)B001402巴西固氮螺菌Azospirillumbrasilense242/9NCAIM(P)B001403在一个特别优选的实施方案中,本发明提供了一种土壤接种剂组合物,它对接种具有酸性pH值的土壤是有用的,并且是一种混合培养,适合以下土壤特定应力耐受性土壤细菌菌株:芽孢杆菌BacillussimplexS28NCAIM(P)B001432PseudomonasfrederikbergensisS33NCAIM(P)B001429AgreiapratensisS47NCAIM(P)B001431巴西固氮螺菌AzospirillumbrasilenseNF11NCAIM(P)B001428乙酰短杆菌ExiguobacteriumacetylicumLU44NCAIM(P)B001423AzospirillumlargimobileB41NCAIM(P)B001402PaeniBacilluspeoriaeS284NCAIM(P)B001430在一个特别优选的实施方案中,本发明提供了一种土壤接种剂组合物,它对接种具有碱性pH值的土壤是有用的,并且是一种混合培养,适合以下土壤特定应力耐受性土壤细菌菌株:乙酰短杆菌ExiguobacteriumacetylicumLU44NCAIM(P)B001423PseudomonasjesseniiS125NCAIM(P)B001422ArthrobactercrystallopoietesS153(P)NCAIMB001424绿针假单细胞菌K200913/4BNCAIM(P)B001370巴西固氮螺菌Azospirillumbrasilense242/9NCAIM(P)B001403AzospirillumlargimobileB41NCAIM(P)B001402伊拉克固氮螺菌AzospirillumirakenseNF6NCAIM(P)B001425本发明进一步提供了一个用在玉米,谷物,优选大麦,小麦,向日葵,豌豆,胡椒,番茄,甜菜,芥菜,大豆,油菜的早期营养阶段施加的菌株,菌株混合物或土壤接种剂组合物。根据本发明进一步优选实施方案包括使用应变,应变混合物或土壤接种剂组合物为以下:-农业上增大绿化率,根植数量,丰产丰收;-提高哪些被酸化,碱化土壤中的微生物的活性,仍然适用于农业生产;-加强盐土和钙盐土,CAL-caric黑钙土和黑钙土类型的土壤的微生物的生命和土壤补充;仍适合农业生产-在极端的pH值,盐化和寒冷的土壤条件,-刺激萌发,提高射击,刺激根系生长,形成包括侧根的,-增加叶数和花数和丰产丰收,或-帮助土壤生命和土壤水分平衡。本发明还提供了一种方法,该方法是对胁迫耐受性土壤细菌分拣系统(SBSS)的基础。该系统主要适用于能够以低肥力土壤的土壤有效接种由于不利的土壤pH值和盐分和水分平衡康迪-行动(压力土)抗逆细菌的分离,对影响植物生长的细菌的分类,土生活(生活土壤健康),以及通过微生物选择和定植竞争(CoCoHelp)菌株的相互作用的研究。同时,可以得到令人惊奇的所谓辅助细菌或真菌,它可以支持的细菌和真菌的生长,根据最近的文献可以通过植物激素的生产(吲哚-3-乙酸,IAA)发酵营养物质(有机酸)或由已知参与细菌的通信(群体感应)配位化合物。在研究SBSS土壤微生物的过程中,选出10种特别应力土壤,如不饱和及饱和红砂土,泽泻醇,钠质盐土,碱土,不饱和潜育土,不饱和冲积土,在匈牙利的不同区域得到了这些土壤样本。超过一千种细菌菌株从所收集的土壤中分离出来,其能够在应力土壤中繁殖,在给定的土壤中是具有特性的。该分离菌株保持并创造了土壤的微生物菌株SBSS集合。PGPR和EPS(胞外多糖)生成菌株从通过使用应力参数(pH和盐)进行选择所收集的菌株中被选中,一方面由合适的微生物选择不含人类致病菌株,另一方面测定植物生长刺激(PGPR),并形成土壤团聚体(AP)。同时,从应力土壤中获得了抗应力固氮菌株,检测到了它们的以下能力氮固定,生成植物激素(IAA),和/或生成ACC脱氨酶,和/或发动磷酸盐。从所研究的超过七百多的菌株中,选择了约92种潜在的合适的试验菌株。DNA测序和鉴定后,定植竞争(CoCoHelp)方法被用于选择合适的土壤接种细菌组合,其中积极生长的或敏感的,出人意料的是,所谓的适合接种的帮手细菌菌株被选定,因而生成合适的土壤发酵菌株组合有辅助效果和PGPR,AP添加剂效果。选定的土壤接种剂组合物首先在盆中的土壤中接种,然后在田间试验,通过接种种植蔬菜,单子叶谷类,玉米,双子叶植物向日葵以及大豆作物的土壤,并检验了在植物上原型接种的效果。该实验是在不同特征的具体的农业应力土壤中进行的。从接种和未接种的土壤中取了几百种样品,用菌群基因测试来确认其繁殖能力,确认所选一些耐应力土壤接种菌株的存在和存活。此外,也在应力土壤中用培养法进行了体外繁殖动态研究,展示了我们的固氮菌株的存活。工业规模的发酵技术被开发用于在原型土壤接种剂组合物的制备中所要求的细菌菌株的发酵。使用SBSS可以获得特别适合于应力土壤接种的菌株--能在酸性,碱性,盐化,碳酸钠,寒冷的环境条件下繁殖(STB)-它们是所给出的应力土壤的特征-应力容忍细菌-它们具有下列特性促进植物生长,固氮,发动磷酸盐,铁载体,生成ACC脱氨酶-被概括为PGPR-和多糖生产(胞外多糖生产EPS)-因而推动土壤聚合-支持(推动聚合,AP)-综上所述应力容忍,促进植物生长和形成聚合的细菌(应力容忍,植物促生根际细菌和形成聚合的细菌)STPGPR-AP-B菌株,或简称STPAP菌株,从这些菌株中,可复得竞争定植(CoCoHelp)菌株。所选菌株的一组具有特别的意义,它能够抑制植物病原真菌的生长。该致病性真菌抑制测试包括经济上重要的菌种,如交链孢菌Alternariaalternata,禾谷镰刀菌Fusariumgraminearum和串珠镰刀菌Fusariummoniliforme.用SBSS方法所研制的,具有应力耐受,生长刺激和促进聚合,帮助和合作的菌株被称为SBSS菌株。研究过程中开发的SBSS系统有助于分离新的细菌它在土壤接种剂组合物的开发中未公开,它比最先进的系统更有效,能在应力土壤中繁殖:活性磷酸盐和/或抗真菌铁载体和/或生产植物激素的细菌(IAA)和可能促进形成土壤团聚体的胞外多糖。特别是,应该强调的是,一些菌株在土壤接种剂组合物没有被用上,如乙酰微小杆菌乙酰短杆菌Exiguobacteriumacetylicum,假单胞菌Pseudomonasfrederiksbergensis,假单胞菌Pseudomonasjessenii,活性磷酸盐phosphatemobilizing和生成IAA生成IAA,成晶节杆菌Arthtrobactercrystallopoietes或Agreiapratensis,活性磷酸盐phosphatemobilizing和铁载体siderophore和生成IAA生成IAA,明串珠菌Leuconostocmesenteroides或芽孢杆菌Bacillus,生成单胞多糖simplexpolysaccharideproducing或玫瑰夸克菌Kocuriarose,多糖polysaccharide和IAA生成生成IAA,绿针假单细胞菌Pseudomonaschlororaphis多糖polysaccharide,铁载体siderophore和IAA生产生成IAA和类芽孢杆菌Paenibacilluspeoriae多糖polysaccharide,peoriae和铁载体siderophoreproducing微生物。发展过程中产生的接种剂还包括具有特殊性质的固氮土壤细菌,是更有效的,未在土壤接种剂组合物被使用:如耐寒和耐盐性和耐酸性pH有效地结合氮和生产植物激素(IAA)的巴西固氮螺菌巴西固氮螺菌Azospirillumbrasilense菌株,以及耐寒和耐盐有效氮固定和/或生产植物激素(IAA)伊拉克固氮螺菌伊拉克固氮螺菌Azospirillumirakense和largimobile固氮螺菌Azospirillumlargimobile菌株。这些菌株进行定植竞争辅助(HTB)的测试,其中合适的菌株互相帮助,互不抑制,但已经被选定好定植的能力,这是适合的土壤接种剂成分。从这些SBSS菌株,土壤接种剂组合物根据应力土壤的pH值组成,并且酸性,中性和碱性土壤接种剂原型已经开发,它们用于支持生长和土壤寿命,以及帮助不同场地和温室作物的土壤水分平衡。这些土壤接种剂组合物,根据小范围的研究,都能够在极端的pH值,极端盐化和寒冷的条件下发挥它们的活性,可有效刺激发芽,增加芽,强烈刺激根的生长-侧根形成,同时,是具有复合效果的土壤接种组合物,可固氮,发动磷酸和钾(化学肥料的使用减少),增加叶和花的数量,增加产量和/或特别的生成生物防治-铁载体类型的-化合物,抑制了根际致病细菌和真菌(减少除草剂的使用量),提高了土壤的微结构。以下这些是从现有的部分发明中分离形成的SBSS土壤细菌,他们于2009年10月2日被存放在布达佩斯考文纽斯大学国家农业工业微生物收藏室(1118,Budapest,Somlóiút14-16)绿针假单细胞菌PseudomonaschlororaphisK200913/4BNCAIM(P)B001370—令人惊讶的是在极冷的环境下(4-8℃)也可以繁殖生成胞外多糖,潜在地促进了土壤团聚和土壤改良。能够溶磷和生产铁载体,令人惊讶的是所有的代谢功能,即使在寒冷的气候条件下也可以持续存在。绿针假单细胞菌PseudomonaschlororaphisK20099/4-BNCAIM(P)B001371—令人惊讶的是在极冷的环境下(4-8℃)也可以繁殖生成胞外多糖,潜在地促进了土壤团聚和土壤改良。能够溶磷和生产铁载体,令人惊讶的是所有的代谢功能,即使在寒冷的气候条件下也可以持续存在。明串珠菌LeuconostocmesenteroidesK200925/4NCAIM(P)B001372—令人惊讶的生成胞外多糖,从而潜在地促进了土壤团聚和改善了土壤。与此同时,也生成IAA,因此促进了植物的生长。明串珠菌株没有在土壤接种剂被使用,然而。明串珠乳酸菌在土壤中非常普遍存在,由于产生乳酸它主要被用于食物保存。生生吲哚-3-乙酸的属性早已熟知,但它还没有被开发用于促进植物生长。我们已观察到,在大多数土壤类型中-即使是在红砂土(沙土)中-它也能存活,并能在高温(30-35℃)环境中生长并通过生成IAA促进植物植被的生长。明串珠菌株已经被称为胞外多糖(EPS)-生成葡聚糖,但它尚未被用于土壤改良。根据本发明,EPS生产可以限制土壤中与热度相关的水的流失,由于土壤颗粒在干燥土壤中聚集。此外,EPS的矩阵为其他细菌提供物质-生物膜形成-促进土壤微生物的生存能力。这些是沙漠土壤接种的有利特性,能支撑植被,保持土壤基质和水存储能力。另外,以下这些是从现有的部分发明中分离形成的SBSS土壤细菌,他们于2013年11月27日被存放在布达佩斯考文纽斯大学国家农业工业微生物收藏室(1118,Budapest,Somlóiút14-16)巴西固氮螺菌AzospirillumbrasilenseNF11NCAIM(P)B001428—出乎意料地在弱酸性和碱性条件下繁殖,在pH6.5-8.5,固氮,IAA菌株。巴西固氮螺菌Azospirillumbrasilense242/9NCAIM(P)B001403—出乎意料地在中性和碱性条件下繁殖pH7.0-8.5,固氮,IAA菌株。巴西固氮螺菌AzospirillumbrasilenseNF10NCAIM(P)B001427—令人惊奇地耐受寒冷环境(10℃)和耐盐(4%NaCl)中,固氮,IAA生产菌株,并在pH7.0-8.0的中性和碱性条件下繁殖。所有的代谢功能寒冷气候(10℃)和盐积累(4%)应力的土壤条件下都可持续发挥作用。AzospirillumlargimobileB41NCAIM(P)B001402—相对于其他固氮螺菌物种,它是在酸性土壤中持久作用的。可抑制某些植物病原体真菌的生长。固氮,IAA生产菌株在pH4.5-9.5下大范围的繁殖。属固氮螺菌。-主要是A.brasilense和A.lipoferum-已经用于土壤接种。申请WO2014160827A1和WO2014193746A1中描述A.lipoferum土壤接种,但是,它没有透露有杀菌活性或者是酸性土壤中持久性。它在宽的pH范围内繁殖-从强酸性pH值4.5到强碱性的pH9.5-,这是一种质量,使得它在PGPR和酸性和碱性土壤类型固氮接种剂是有用的。此外,它的铁载体产生能力在前面未提及。伊拉克固氮螺菌AzospirillumirakenseNF6NCAIM(P)B001425—令人惊讶的,它在耐冷(10℃)和耐盐(4%NaCl),固氮,IAA生产菌株,在pH7.0-8.0下和碱性条件下繁殖。所有的这些代谢功能在寒冷气候(10℃)和盐积累(4%)的土壤条件下能持续发挥功能。能产生铁载体,吲哚乙酸,反式玉米素和反式玉米素核苷类细胞分裂素和赤霉素-3-乙酸。一些出版物报道了A.irakense的ferroxamine型铁载体的分解能力(Winkelman的等人),但是,铁载体生产尚未在该物种中描述。应用WO/1999/009834A2透露A.irakense被用作土壤接种剂,但不是用其铁载体生成属性。在专利US20050060930andEP2233458中,A.irakense也是不协同生成铁载体.一些文献(WO/2014/079754,美国专利申请20150011389,WO/2014/147528,WO/2015/011615,WO/2014/053401)中对生物农药的报道中提到伊拉克固氮螺菌A.irakense以及有效对抗S.sclerotiorum,但是报道没有提到伊拉克固氮螺菌A.irakense杀真菌的效果.巴西固氮螺菌A.brasilense菌株能够生成吲哚乙酸,细胞分裂素和赤霉素,而A.irakense的细胞分裂素和赤霉素生成能力还没有被公开.Arkhipova等人(2006)已经研究了细胞分裂素产生细菌菌株的效果—比如巴西固氮螺菌Azospirillumbrasilense—在小麦的生长中.除了IAA,在浓度为0.001微克/毫升的激素浓液中检测到至少三个不同的细胞分裂素类物质。文献TheWO/1999/009834,美国专利申请20050060930,WO/2014/079754,美国专利申请20150011389andWO/2013/110591提到A.irakense作为土壤接种剂,但没有提及细胞分裂素和赤霉素型植物激素类物质的生成。A.irakense菌株的植物生长和促进植物健康的属性存在于固氮,吲哚乙酸和赤霉素生产能力,这些是充当植物激素和抑制病原体微生物的生长和提高的营养供给的铁结合铁载体产生能力乙酰短杆菌ExiguobacteriumacetylicumLU44NCAIM(P)B001423—令人惊讶的在寒冷的条件下(4-8℃)大量繁殖能力,以及令人惊讶的高度耐盐(8%氯化钠),并更令人惊讶的溶磷,它提供了供应给植物的富含P的土壤。令人惊讶的产生吲哚乙酸促进和支持植物的生长。应变出奇具有广泛的pH耐受性,它在pH值4-8的范围内繁殖。令人惊讶的作为一个固氮螺菌菌株的帮手协同作用。所有的这些代谢功能在寒冷的气候条件下(4-10℃)持续,并在极端的pH值和高盐的土壤里繁殖。以前微小杆菌菌株没有被用作土壤接种剂。类芽胞杆菌属PaenibacilluspeoriaeS284NCAIM(P)B001430-因其出人意料的能产生铁载体从而对致病微生物的生长起到生物防治作用。它还能产生胞外多糖从而能潜在改善土壤聚集与改良。还有它的低pH(pH4.0-6.0)增长能力。由于其在极度低酸中的传播能力,所有这些特性也都展现在强酸性土壤应力方面。令人惊讶的是类芽胞杆菌株先前还没有被用作土壤接种剂。我们已经知道EPS和铁载体能产生革兰氏阳性芽孢杆菌株,但植物根际促生细菌类芽胞杆菌株还没有从土壤中分离出来。它的孢子形成能力维持着土壤的活力,所以将它用作土壤接种菌株是非常有益的。EPS生产让土壤颗粒聚集来限制土壤的水分流失。EPS基体给其他微生物提供物质-生物膜的形成-能提高土壤菌群的活力。进一步来说,铁结合铁载体的生产能力可抑制致病菌的生长,并提高植物的营养供给。有几个研究报告称类芽胞杆菌对广泛的植物病原细菌和真菌(Weidetal.,20023,Weidetal.,2005)的生物抑制作用,但对于赤星病菌,灰霉菌,菌核菌,小麦赤霉病以及大刀镰孢的抑制作用却没有展现出来。有几个已获取专利的生物农药是基于类芽孢杆菌属的生物防治效果-蜂房芽胞杆菌,乳白色致病细菌,多粘类芽孢杆菌-但类芽胞杆菌并不包括在类。所以这种菌株尤其适合作为接种剂的成分之一用于促进植物健康和土壤改良。AgreiapratensisS47NCAIM(P)B001431-令人惊讶的是它在寒冷环境下(4-8℃)的繁殖能力以及解磷能力,这能提供植物供给所需的富含磷的土壤。它还能产生吲哚乙酸-能够提高和支持植物生长。更因其产生的铁载体而发挥生物防治效果,从而抑制病原微生物的生长。这种菌株有广泛的pH忍耐力,它能够在pH4.0-8.5的范围内繁殖。所有这些代谢功能都是在低温(4-10℃)环境和极端土壤pH环境中持续。Agreiapr在ensis菌株在之前还没有用于土壤接种。A.pr在ensis并没有被深入研究用于促进植物生长和矿物活化性能。吲哚乙酸和酸式磷酸盐的解磷性能在此之前还没有被描述出来。解磷和IAA产生A.pr在ensis菌株之前并没有从土壤里分离出来。它作为杀真菌剂用于防治赤星病菌和串珠镰刀菌。美国专利申请书20140004090A1列出了Agreiapr在ensis在微生物细菌中积极对抗人类和蜜蜂幼虫病原体,但没有报告它对于防治植物病原真菌的杀菌效果,尤其是小麦赤霉病和赤星病。这些特性使它特别有益于土壤的养分元素转移、植物生长和促进植物健康。成晶节杆菌ArthrobactercrystallopoietesS153(P)NCAIMB001424-其惊人的解磷能力可提供植物供给所需的富含磷的土壤。当然它还能产生促进植物生长的吲哚乙酸。而它产生的铁载体能抑制植物致病性微生物的生长(生物防治效果)。它是在中性和碱性条件(pH6-9)下繁殖的,所以它也能耐受碱性土壤。令人惊讶的是节杆菌菌株在之前还没有用于土壤接种剂。解磷和产生吲哚乙酸,A.Crystallopoietes菌株在之前还没有从土壤里分离出来。这两种特性也使得这一菌株特别适合调动土壤养分和促进植物生长,因此而用于土壤接种。美国专利6318023公开了A.Crystallopoietes对于促进植物生长和增产的应用,但没有描述其作用方式。其吲哚乙酸的生产能力与固氮螺菌相似,25-30微克/毫升肉汤。通过铁结合铁载体的合成,菌株不仅能抑制病菌的生长,也能改善植物的铁供给。为促进植物生长做出贡献。美国专利6318023报告了A.Crystallopoietes应用于促进植物生长的作用,但没有披露菌株对抗植物病原真菌的杀菌作用。美国专利5696094研究了基于节杆菌菌株从土壤里分离出来后木质素磺酸盐的作用,并报告了柠檬节杆菌、球形节杆菌,A.Crystallopoietes菌株的杀线虫剂效果,但没有提示抵抗植物真菌的抗真菌作用,特别是灰霉菌和大镰刀霉菌。菌株是在干旱(Boylen,1972)条件下维持活力的,所以它特别适用于促进植物生长和土壤改良接种的目的。PseudomonasfrederiksbergensisS33NCAIM(P)B001429-在寒冷(4-8℃)条件下其惊人的大量繁殖能力和耐盐力(8%)。它还能产生吲哚乙酸,所以能够促进和支持植物生长。它拥有惊人的广泛的pH耐受能力以及在pH4-8范围内的繁殖能力。这些代谢功能可在寒冷的气候(4-10℃)里、在酸性或碱性的土壤pH条件下持续。假单胞菌属很早就以植物根际促生细菌和解磷种类被人熟知,假单胞菌种类的几种菌株以植物根际促生细菌和养分调动菌株而熟知。然而,令人惊讶的是植物根际促生和矿物溶解Pseudomonasfrederiksbergensis菌株的使用还没有被披露,因为它们还没有被发现以及从土壤中分离出来,所以它们没有应用于土壤接种剂。因此这些种类菌株的使用还是罕见的。PseudomonasjesseniiS125NCAIM(P)B001422-在寒冷(4-8℃)条件下其惊人的大量繁殖能力和耐盐力(8%)。它产生的吲哚乙酸能够促进和支持植物生长。它拥有惊人的广泛的pH耐受能力以及在pH4.0-8.5范围内的繁殖能力,解磷能力。所有这些代谢功能可在寒冷的气候(4-10℃)里、在酸性或碱性的土壤pH条件下持续。意外的是假单胞菌属还没有被建议用于土壤接种剂。假单胞菌种类的几种菌株都以植物根际促生细菌和养分调动菌株而熟知。植物根际促生细菌和矿物溶解假单胞菌jessenii菌株没有被发现以及从土壤中分离出来,所以它们还没有应用于土壤接种剂。S125菌株抑制了油菜菌核病,赤星病菌,小麦赤霉病,串珠镰刀菌,以及大镰刀霉菌的生长。美国专利申请书20150030577A1andWO/2013/130680A1专利都描述了P.Jessenii是植物病原细菌,并鉴定出其有效成分,但没有报告它对于油菜菌核病,赤星病菌,小麦赤霉病,串珠镰刀菌,以及大镰刀霉菌的抗真菌作用。WIPO专利申请书WO/2014/009402A1披露了提高植物抗性对抗P.Jessenii,但没有提到这些物种的生物防治效果。Keller_Costaetal.(2014)报告了P.Jessenii抵抗串珠镰刀菌的抗真菌作用。Schreiteretal.(2014)andGuinazuetal.(2013)已经公布了他们对于P.Jessenii菌株抗水稻纹枯病的发现。Weissetal.(2007)则研究了P.Jessenii的细菌素作用对于对抗潜在的源自于蔬菜的植物病源细胞,但不对抗植物病原真菌。基于这些理论,可以得出P.Jessenii的杀菌效果对于对抗油菜菌核病,赤星病菌,小麦赤霉病,以及大镰刀霉菌到目前为止还不知道。作为土壤接种剂的来使用的菌株-基于近期对其特性的描述-已是不可能了。BacillussimplexS28NCAIM(P)B001432-它所产生的胞外多糖能潜在的促进土壤聚集和土壤改良。它拥有惊人的广泛的pH耐受能力以及在pH4.0-8.5范围内的繁殖能力。所有这些代谢功能在酸性或碱性的土壤pH条件下持续。单纯芽孢杆菌菌株之前没有被用于土壤接种剂。EPS和铁载体产生革兰氏阳性芽孢杆菌株是公认的事实,但植物根际促生细菌单纯杆菌菌株还没有从土壤里分离出来。革兰氏阳性产孢杆菌的能力可在土壤中维持长期生存能力,所以它特别适用于土壤接种剂。EPS生产能抑制因土壤颗粒聚集而造成的土壤水分流失。EPS基体给其他细菌提供物质-生物膜的形成-这能够促进土壤微生物区系的生存能力。菌株适合作为(成分之一)接种菌致力于土壤改良和土壤储水性能的改善。玫瑰库克菌KocuriaroseaS225NCAIM(P)B001426-它所产生的胞外多糖能潜在的促进土壤聚集和土壤改良。它还能产生吲哚乙酸,所以能够促进和支持植物生长。植物根际促生细菌玫瑰色库克菌菌株已经被用于土壤接种剂。由考克氏菌属菌株产生的Kocuran多糖在人类医学上已被描述为抗氧化剂和免疫刺激剂。EPS也能提高土壤颗粒聚集,防止变性土壤水分的快速流失。更进一步的说,菌株能在强碱性土壤上繁殖以及产生吲哚乙酸,因此,对于已知的玫瑰色库克菌菌株,它广泛的pH耐受力、植物激素生产能力和EPS生产(土壤结构改善)使得菌株特别适合用于土壤接种剂。AzospirillumbrasilenseNF7(寄存于10Feb2014underNo.NCAIM(P)B001433)-令人惊讶的耐寒(4-8℃)性和耐盐性(4%氯化钠)。它能够固氮和产生大量的吲哚乙酸。它能够在高酸性pH5.5-6.5)土壤里繁殖,此外在中性环境下也能繁殖。在酸性的黏土(pHKCl4,2)里能维持生存和繁殖超过一个月。所有这些代谢功能在寒冷环境下(4-10℃)或酸性环境下(pH4-5)以及高盐浓度下(4%)继续保持。这项发明在下面的例子中被进一步阐述,参照下列数据。请理解以下示例是用于披露但不限于本发明,其仅由所附权利要求的范围限定。图纸描述本应用包含至少一项彩色图。本应用带有彩色绘图(多个)的复印件必须是根据要求以及支付相应的费用后才能提供。每份数据的概述详见下列内容。图1.NF7菌株生长和KE1在酸性(ph=4.2)土壤中生长。菌株NF7保持的106CFU/g的土壤浓度计数的一个细胞,直至第38天,当细胞由KE1参考菌株计数掉至105CFU/g土壤浓度。图2.在来自于迪拜的沙质盆栽土壤里胞外多糖的生存力产生的菌株。两周后Ps.chlororaphis13/4B菌株发现于浓度为108CFU/g的土壤,一个月后,其他的两个菌株均出现了较低的细胞计数。图3.来自于迪拜沙漠的沙中胞外多糖的可行性产生的菌株。Ps.chlororaphis9/4Band明串珠菌25/4维持生存力在两周后甚至一个月后在可测浓度里生长。图4.Orczy42(Zimány)绝大部分是酸性土壤的田间试验区被指定用于末端限制性片段长度多态性学习。试验区的pH标识图揭示超过50%的区域分类为强酸(红色,ph4.1-5.0),低比例是酸性(棕色,pH5.1-5.5),弱酸(黄色,pH5.6-6.5),或中性(绿色,pH6.6-7.5)图5.场地抽样方案从一个已接种的地块用于土壤接种菌株群体遗传学研究。根据描述的实验报告,抽样次数已按照下列内容安排好:一次是土壤接种菌前,一次是紧接在土壤接种菌后,在开始的四个星期里一个星期一次,在接下来的六个星期里每两个星期一次。样品从土壤里带走,根从接种菌和未接种菌的控制地块中带走。从三个不同地点的种子排拿走样品,从第三个星期开始,接种菌样品也从行间间隔拿走。接种后第四个星期,根样品也从栽培物种(甜菜)中拿走。图6.土壤的效果-特定中性接种菌土壤,在棕色森林土壤里的白色芥末高度。中性土壤接种菌,在两个应用剂量(1l/ha菌and2l/ha)(见b3andb4)里,白色芥末平均茎高度有着显著的增长(P=0.01),在石灰性黑钙土上,同一剂量茎高度依次增长了2.5%and7%。图7.土壤的效果-特定中性土壤接种菌,大量种在棕色森林土壤上的白色芥末幼苗。与未经防护处理的土壤相比,低剂量(b3,1l/ha)使大量白色芥末幼苗具有显著的增长(p=0.01)。图8.碱性土壤接种菌的效果对于含钙盐土上大量春大麦幼苗的蛋白质含量的作用。数据显示春大麦蛋白质含量在未接种土壤(6.07%)和已进行接种菌的碱性土壤上剂量分别为1l/haand2l/ha(6.98%and6.36%蛋白质含量,分别)的不同结果,或接种完全控制的BactofilA10,剂量为1l/ha(6.31%)。图9.在不同的处理方式下,向日葵头部重量的对比。最高平均头部重量(64.01t/ha)是在1l/ha剂量的酸性土壤接种菌中实现的,远远超过所用剂量为2l/ha(55.86t/ha),以及使用完全控制BactofilB10(58.72t/ha),与未经防护处理的土壤相比(53.99t/ha),这三种接种菌方案都能显著提高作物产量。图10.在不同处理方式下,向日葵作物产量的对比。向日葵作物的最高平均产量(64.01t/ha)是在1l/ha剂量的酸性土壤接种菌中实达到的,远远超过所用剂量为2l/ha(55.86t/ha),以及使用完全控制BactofilB10(58.72t/ha)。与未经防护处理的土壤相比(53.99t/ha),这三种接种菌方案都能显著提高作物产量。图11.强酸土壤上的大豆作物产量。对酸性土壤进行1l/ha(第三列)and2l/ha(第四列)两种剂量的土壤接种菌,0.1l/ha(第五列)和0.2l/ha剂量的大豆-特定土壤接种菌都显著提高了作物产量,与此相比,控制(第一列)和标准控制(第二列)的结果,平均值在3.12-3.14t/ha。图12.酸性土壤接种菌后历经147天,菌株B41和NF11的细胞计数。菌株B41在酸性土壤中是持续不断的,在接种菌后的前8天显示出一个稳定的繁殖,之后,在略有减少后,超过三个月的时间都保持着106CFU/5g土壤平稳期。菌株NF11选择了中性土壤pH,在接种菌后,土壤检测达到103CFU/5g的水平后,细胞数便持续减少。图13.A.largimobileB41在王B繁殖中包含铬天青S中铁载体生产的检测。48小时后,一个积极的颜色反应表明在真菌培养基盘中心铁载体的合成。图14.ArthrobactercrystallopoietesS153的色谱。根据相关保留时间,节杆菌S153乙醇提取物培养包含25.3μg/ml吲哚乙酸。图15.巴西固氮螺菌Azospirillumbrasilense242/9的色谱。根据保留时间,巴西固氮螺菌Azospirillumbrasilense242/9的乙醇提取物培养包含24.4μg/ml吲哚乙酸。图16.伊拉克固氮螺菌AzospirillumirakenseNF6NCAIM(P)B001425的色谱。提取物培养包含赤霉素-3(保留因子:0.3)和吲哚乙酸(保留因子:0.55)。图17.伊拉克固氮螺菌AzospirillumirakenseNF6的高效液相色谱。根据相关保留时间,细胞分裂素类物质对等于反式玉米素和反式玉米素-核糖苷发色团。图18.A.LargimobileB41NCAIM(P)B001402介于pH4.5-9.5时的成长。图19.玫瑰库克菌KocuriaroseaS225NCAIM(P)B001426在不同盐浓度和pH值的情况下吲哚乙酸的产生。浓度为10-20μg/ml,pH值65-9.0时,菌株产生吲哚乙酸。图20.玫瑰库克菌KocuriaroseaS225NCAIM(P)B001426在不同盐浓度和pH值时产生吲哚乙酸。pH值6.5-9.0时,24小时繁殖平均细胞数是108-109CFU/ml。图21.AzospirillumlargimobileB41在双重培养(菌坪,真菌培养基盘中心)对于植物病原真菌生长的抑制效果:(I)赤星霉菌,(II)小麦赤霉菌和(III)串珠镰刀菌.I.A,赤星霉菌控制;B,B41(2x105/ml)菌坪+赤星霉菌,在室温下培养16天。II.A,小麦赤霉菌控制;B,B41(3x108/ml)菌坪+小麦赤霉菌;C,B41(3x107/ml)菌坪+小麦赤霉菌;D,B41(3x106/ml)菌坪+小麦赤霉菌;E,B41(3x105/ml)菌坪+小麦赤霉菌,在室温下培养90天。III.A,串珠镰刀菌控制;B,B41(4x106/ml)菌坪+串珠镰刀菌;C,B41(4x105/ml)菌坪+串珠镰刀菌,在室温下培养90天。图22.伊拉克固氮螺菌AzospirillumirakenseNF6在双重培养(菌坪,真菌培养基盘中心)时对于植物病原真菌核盘菌的抑制作用。I.A,核盘菌控制;B,C,D,NF6(2x105/ml)菌坪+核盘菌,在室温下培养31天。图23.乙酰微小杆菌ExiguobacteriumacetylicumLU44在双重培养(菌坪,真菌培养基盘中心)时对植物病原真菌的抑制作用。(I,)小麦赤霉菌and(II,)串珠镰孢菌.I.A,小麦赤霉菌控制;B,LU44(2x106/ml)菌坪+小麦赤霉菌,C,LU44(2x105/ml)菌坪+小麦赤霉菌,在室温下培养9天。II.A,串珠镰孢菌控制;B,LU44(2x106/ml)菌坪+串珠镰孢菌,C,LU44(2x105/ml)菌坪+串珠镰孢菌,在室温下培养15天。图24.类芽孢杆菌PaenibacilluspeoriaeS284的双重培养(菌坪,真菌培养基盘中心)对植物病原真菌的抑制作用。(I,)赤星霉菌and(II,)小麦赤霉菌.I.A,赤星霉菌控制;B,S284(2x106/ml)菌坪+赤星霉菌,C,S284(2x105/ml)菌坪+赤星霉菌,在室温下培养8天II.A,小麦赤霉菌控制;B,S284(2x106/ml)菌坪+小麦赤霉菌,C,S284(2x105/ml)菌坪+小麦赤霉菌,在室温下培养9天。图25.Agreiapr在ensisS47的双重培养(菌坪,真菌培养基盘中心)对植物病原真菌的抑制作用。(I,)赤星霉菌,and(II,)串珠镰孢菌.I.A,赤星霉菌控制;B,S47(2x106/ml)菌坪+赤星霉菌,C,S47(2x105/ml)菌坪+赤星霉菌,在室温下培育90天.II.A,串珠镰孢菌控制;B,S47(2x106/ml)菌坪+串珠镰孢菌,C,S47(2x105/ml)菌坪+串珠镰孢菌,在室温下培育15天。图26.节杆菌crystallopoietesS153的双重培养(菌坪,真菌培养基盘中心)对植物病原真菌的抑制作用。(I,)大刀镰孢.I.A,大刀镰孢控制;B,S153(2x106/ml)菌坪+大刀镰孢,C,S153(2x105/ml)菌坪+大刀镰孢,在室温下培育10天。图27.假单胞菌jesseniiS125的双重培养(菌坪,真菌培养基盘中心)对植物病原真菌的抑制作用。(I,)菌核病,(II,)赤星霉菌,(III,)小麦赤霉菌,(IV,)大刀镰孢以及(V,)串珠镰孢菌.I.A,菌核病控制;B,S125(2x106/ml)菌坪+菌核病,C,S125(2x105/ml)菌坪+菌核病,在室温下培育60天.II.A,赤星霉菌控制;B,S125(2x106/ml)菌坪+赤星霉菌,C,S125(2x105/ml)菌坪+赤星霉菌,在室温下培育8天.III.A,小麦赤霉菌控制;B,S125(2x106/ml)菌坪+小麦赤霉菌,C,S125(2x105/ml)菌坪+小麦赤霉菌,在室温下培育9天。IV.A,大刀镰孢控制;B,S125(2x106/ml)菌坪+大刀镰孢,C,S125(2x105/ml)菌坪+大刀镰孢,在室温下培育10天.V.A,串珠镰孢菌控制;B,S125(2x106/ml)菌坪+串珠镰孢菌,C,S125(2x105/ml)菌坪+串珠镰孢菌,D,S125(2x104/ml)菌坪+串珠镰孢菌,在室温下培育90天。图28.绿针假单胞菌的抑制作用13/4B双重培养(菌坪,真菌培养基盘中心)对植物病原真菌的抑制作用。(I,)菌核病,(II,)赤星霉菌,(III,)小麦赤霉菌,(IV,)大刀镰孢and(V,)串珠镰孢菌.I.A,菌核病控制;B,13/4B(2x106/ml)菌坪+菌核病,C,13/4B(2x105/ml)菌坪+菌核病,D,13/4B(2x104/ml)菌坪+菌核病,在室温下培育60天。II.A,赤星霉菌控制;B,13/4B(2x105/ml)菌坪+赤星霉菌,C,13/4B(2x104/ml)菌坪+赤星霉菌,D,13/4B(2x103/ml)菌坪+赤星霉菌,在室温下培育8天。III.A,小麦赤霉菌控制;B,13/4B(2x105/ml)菌坪+小麦赤霉菌,C,13/4B(2x104/ml)菌坪+小麦赤霉菌,在室温下培育9天。IV.A,串珠镰孢菌控制;B,13/4B(2x105/ml)菌坪+串珠镰孢菌,C,13/4B(2x104/ml)菌坪+串珠镰孢菌,D,13/4B(2x103/ml)菌坪+串珠镰孢菌,在室温下培育18天.V.A,灰霉菌控制;B,13/4B(2x105/ml)菌坪+灰霉菌,C,13/4B(2x104/ml)菌坪+灰霉菌;D,13/4B(2x103/ml)菌坪+灰霉菌,在室温下培育90天.示例1:通过SBSS和NSBSS的方法从恶化的土壤中隔离出细菌。SBSS技术过程中,应力条件直接应用-由于选择性压力-从低产、恶化的土壤中来获得酸性、中性、碱性、高渗透力或耐寒力悬液培养。模拟非生物胁迫培养条件下富含土壤悬液,从中隔离出磷酸盐和/或钾调动和/或铁载体产生菌株。SBSS的另一个实验中,将磷酸盐和和/或钾调动和/或铁载体产生菌株直接从土壤悬液中隔离出来。为了固氮菌(固氮SBSS,NSBSS),固氮菌株可通过常规隔离协议和少见的-以前没有描述过的-压力选择隔离法来隔离。在匈牙利有很多典型的低产农耕区域和土壤恶化区域,土壤样本就是从这些不同的地区取来的:泽泻醇,盐土,钙盐土,碱土,酸性潜育土和酸性冲积土。10种土壤样品将被检测:其中是棕色森林土壤-灰化,无灰化和粘土泽泻醇(强微酸),和三种盐渍土:碱土,酸性或碱性,粘土或具有高盐浓度(4.8%氯化钠)。表格1:通过SBSS方法检测的土壤样品类型、pH值和盐浓度盐化草甸土鉴定土壤pH盐浓度草甸碱土,深1c6.4High高碱土3b4.92High高粘质草甸碱土,深RF8.00High高棕色森林土鉴定土壤pH盐浓度泽泻醇,无灰化棕色森林土7a4.94Low低7b4.4low低灰化棕色森林土8a6.56low低8b4.67low低8c6.31low低8d5.84low低粘质泽泻醇,灰化(强酸性)95.69low低I.通过SBSS方法来隔离选择压力隔离法:10克土壤悬浮于100毫升水肿,2毫升制霉菌素(10mg/ml浓度)加入,用于抑制丝状真菌(常见于酸性土壤中)的生长。摇晃一个小时后(速度250转)3-3mls的悬液接种到100-100ml的酸性(pH=4),碱性(pH=9),6%盐含量或未经处理的中性(ph=7)改良营养液(2ml制霉菌素/100ml)。为达到可行的抗压细菌菌株增长,接种菌液需培育12小时。改良营养液(NB):13g营养液粉(酵母粉;批号:CM0001B),5.0g葡萄糖,5.0g蔗糖和3.0g酵母提取物(BBL酵母提取物,流式细胞仪,BD)加入到每升蒸馏水中。轻微加热至成分溶解,不需调整pH值(pH=7.4±0.2)。在120℃时进行灭菌,1.2巴气压,持续15分钟。酸性,碱性和含盐混悬液在28°时培育,中性混悬液在10°时培育一整晚,细菌混悬液划线接种到NA,CAS,KB,HPandK的琼脂培养基。培养基改良营养琼脂NA(斜面,培养)以上成分加入到一升蒸馏水中,pH值调整到7,饱和蒸气压120℃时灭菌20分钟。CAS(铁载体)琼脂培养基以上成分加入到900ml蒸馏水中,pH值调到7.0,饱和蒸气压120℃时灭菌20分钟。以下成分通过无菌过滤器过滤,在灭菌后加入。60.5mg铬天青S(CAS)染入50.0ml蒸馏水中,10.0mgFeCl3x6H2Odye,and72.9mg十六烷基三甲基溴化铵(HDTMA)放入另一份50.0ml蒸馏水中。HP(磷酸盐调动)培育基以上成分加入到一升蒸馏水中,pH值调到7.2,饱和蒸气压120℃时灭菌20分钟。硫酸铁和硫酸锰溶液在灭菌后加入到蒸馏液中。KingB,KB(荧光琼脂)培养基以上成分加入到1升蒸馏水中,pH值调整到7.2,饱和蒸气压120℃时灭菌20分钟。KP培养基(Aleksandrov培养基)以上成分加入到1升蒸馏水中,pH值调整到7.0,饱和蒸气压120℃时灭菌20分钟。II.NSBSS隔离法I.隔离1.常规隔离法2.冷藏增菌3.从碱性土壤里隔离II.示例1.泽泻醇(棕色森林土,土“B”)2.苏打盐土(I2306,5b;pH8,39)3.:北方野生稻的完整标本,带有相应的根际土壤,(示例地点:),土壤pH7.1-7.31.常规隔离法从土壤和植物样本里得来的固氮土壤细菌选择性隔离一个包含两个步骤的进程:-第一,在提供的样板里细菌种群已经提前增长,因固氮细菌在自然情况下数量是非常少的。高细菌数会提高分离效率。-第二,接种菌群实际上是从提前增长菌群的样板里隔离出来的。固氮微生物的选择性增长协议是无氮软琼脂技术(1989),使用两种不同的提前增长培养基:OK无氮最小软琼脂(Okonetal.,1976)29.0mmolKH2PO4,26.0mmolK2HPO4,37.0mmolmalicacid,75.0mmolNaOH,1.7mmol氯化钠,0.81mmolMgSO4,0.13mmolCaCl2,0.01mmolMnSO4,0.02mmolFe2SO4,0.02mmolNa2EDTA,0.004mmolNa2MoO4,4.0μmolbiotin,琼脂0.15%(w/v),1000ml蒸馏水。.pH6.8-7.0.混合无氮最小软琼脂(Rennie,1981)5.0g蔗糖,5.0g甘露醇,0.5ml(60%,v/v)Na-lact在e,0.80gK2HPO4,0.20gKH2PO4,0.20gMgSO4x7H2O,0.06gCaCl2,0.10g氯化钠,100mg酵母膏,25mgNa2MoO4x2H2O,28mgNa2FeEDTA,5.00μgbiotin,10μgPABA,琼脂1.5gpH7.0,1000ml蒸馏水。无氮苹果酸是预增长培养基,通常广泛用于隔离生存于表面或者单子叶植物根的封闭环境中的联合固氮细菌。葡萄糖/蔗糖/甘露醇补充无氮的软琼脂是常用于预先增长的自由生活的能利用糖类的土壤细菌。软琼脂技术使得它能够同时丰富固氮菌株-在同一土壤样本里-它们在固氮和氮依赖生长时对氧气需求的不同。选择性增长是趋氧性细菌的结果,也就是根据软琼脂里的氧浓度渐变曲线来移动的(基于氧气的扩散速度)。因软琼脂是无氮,氮需求只能通过固定大气中的氮来满足。细菌被定位在软琼脂培养基区域,在这里本地氧浓度对于固氮和氮依赖的生长是最理想的。浓缩协议按照以下步骤来执行:被选择的软琼脂培养基是备在一个可密封的密封小玻璃瓶里。土壤/根的一些颗粒放置在小瓶里或20-30微升土悬浮液滴进小瓶里。在此建议不要超过此容量,因样品的高氮浓度可能会覆盖住固氮的信号。实际上每个样品同时开启10-15个测量。小瓶子在28℃培育3-5天。可视菌膜,位于中间的扩散的或不同的环数表明菌群的排列。培育后,固氮酶的活性是通过乙炔还原法来测定。小瓶表达出的酶活性在确定临界值之上,继续由一组新的包含无氮软琼脂培养基的小瓶传代培育。没有可测酶活性的小瓶子将被排除。显示出低水平酶活性的样品将被继续检测。如果要求,至少可以执行4-6传代。由预浓缩样品里隔离出来的固氮菌:当分离微需氧菌时,预先浓缩培育基被划线到包含化学键氮和酵母提取物(若要求)的固体琼脂板。发达菌落根据形态分类,并接种到无氮的软琼脂,3-4次传代并覆盖。目的是为了获得纯培养基,每次传代后检查培养基是否保留其最初的固氮能力。从纯培养基里面分离出来的菌株将被测量其固氮能力。测量固氮能力(Burris,1972)无氮软琼脂先准备在一个可密封的密封小玻璃瓶里。经挑选的菌株逐渐形成...经过数晚,最小的营养液里包含化学键和氮。浓缩的培养液在小营养液里清洗并悬浮,将包含1-2x108CFU/ml细胞数,10-20..l被接种入软琼脂。小瓶子是密封起来的,并添加了5%乙炔(volacetylene/volair)。小瓶子在28℃时培育2-3天。固氮能力测试固氮酶活性的测定是通过乙炔的酶催化还原效果,此还原效果则是通过乙烯和乙炔的气相色谱量化来确定的。固氮能力是通过测量乙烯的数量和nmolC2H4/107CFU/ml培养的细胞数量来确定的。因缺少乙烯标准,固氮能力被描述为每个单位细胞数(Et%/107CFU/ml)里乙烯/乙炔的比例(Et%)。培养的细胞数是在同一个培养基里确定的,初始培养是通过扩散平板法。2.冷藏增菌预先浓缩演示如下:经过挑选的软琼脂培育基是准备在密封的小瓶子里。土壤/根的一些颗粒放置在小瓶里或20-30微升土悬浮液滴进小瓶里。在此建议不要超过这些容量,因样品的高氮浓度可能会覆盖住固氮的信号。实际上每个样品进行10-15平行测量。小瓶子在6-8℃培育3-5天。可视菌膜,位于中间的扩散的或不同的环数表明菌群的排列。培育后,固氮酶的活性是通过乙炔还原法来测定。小瓶表达出的酶活性在确定临界值之上,继续由一组新的包含无氮软琼脂培养基的小瓶传代培育。没有可测酶活性的小瓶子将被排除。显示出低水平酶活性的样品将被继续检测,如果要求。6-8℃时进行了两次传代。之前提到过,更进一步的3-4传代在28℃时做完。3.从碱性土壤中分离考虑到菌株的特性(生长,固氮,养分利用率),协议的安排是基于之前描述的方法和培养基。预先浓缩软琼脂的准备是根据土壤生态环境下的固氮菌群(土壤pH,盐浓度)。样品的培育是在碱性盐渍土中提取的,可以在包含一个双倍浓缩的氯化钠/NaHCO3无氮软琼脂里进行。渗透剂浓度在培育阶段得到提高,但不切实际,因为固氮是不能在连续传代培养过程中检测到的。与更低浓度的渗透剂合作是切合实际的,还可研究分离纯培养的固氮耐盐度。II.NSBSS从低产、恶化土壤中分离1.高活性强酸土(棕色森林土,土“B”)这个土壤样品不包含植被。预浓缩是从土壤颗粒开启的,并行的18个小瓶。5个培养已被传代五次,在此期间培养基变得更清晰,有不同的范围模式,根据丰富的细菌种群的氧需求。不同模式的存在表明固氮菌群包含几个物种,他们的代谢需求不同。通过预培养,为固氮酶活性获取并测量了300个纯培养基。我们获得了48个固氮菌隔离,固氮酶活性测量的结果已记录在实验室记录上。除48外,11个菌株存放在实验室菌株保藏(温度在–70℃),还有6个菌株则被用于进一步的分析。固氮的检测和固氮能力的测量。发酵剂菌株培养的条纹-根据菌株要求和测量的目的-营养琼脂,补充糖营养琼脂,Okon最小琼脂或联合的最小琼脂。培养皿在28℃时培养24-48小时。经过培养,带有相似培养基的摇晃培育已准备好,28℃时培养一整晚,并不断的通风。细胞数将达到1-2x109/ml.细胞计数通过平板计数法做好。专性厌氧菌株通过它们的氧气和生长需求来培育。细胞计数则通过适当的方法完成了。固氮培养的准备,固氮酶活性的测量(Burris,1972)以及固氮能力。在有氧和微氧生物环境下,在软琼脂培养基上(1989)无氮软琼脂培养基已在密封小瓶子里备好。浓缩培养液经过整晚培育放在无氮小液中清洗,重悬并包含1-2x108CFU/ml细胞计数。10-20...1被接种入软琼脂。密封小瓶全部密封着,并加入了5%乙炔(volacetylene/volair),28℃室温小瓶子需培养2-3天。固氮能力测量固氮酶活性的测定是通过乙炔的酶催化还原效果,此还原效果则是通过乙烯和乙炔的气相色谱量化来确定的。固氮能力是通过测量乙烯的数量和nmolC2H4/107CFU/ml培养的细胞数量来确定的。因缺少乙烯标准,固氮能力被描述为每个单位细胞数(Et%/107CFU/ml)里乙烯/乙炔的比例(Et%)。培养的细胞数是在同一个培养基里确定的,初始培养是通过扩散平板法。在硬琼脂培养基上,在需氧和厌氧的情况下,固氮的准确量化是禁用的,因测量的数值不能被每一个细胞计数来确认。通过乙烯/乙炔比例的对比学习和控制菌株(已知特性),容量可以评估出来。2.钙盐土(I2306kódszámú,5b;pH8,39)土壤样品包含植被,因此预浓缩的样品包含土壤颗粒,根际土壤,根面,表面灭菌根系组织和草茎。28个样品已被平行培养。培养已传代六次。根据丰富菌群的氧气需求,繁殖成为不同模式的波段,变得更清晰可见。不同模式的呈现表明固氮菌群有好几个种类组成,表现在它们的代谢需求不同。在预富集培养基中获取并测量了200个个体培养基用于检测固氮活性。我们获取了120个固氮隔离,固氮酶活性测定结果已登记在实验室记录上。有着显著高固氮能力的20菌株已被储存在实验室菌株保藏室(在–70℃)。来源于表面灭菌根和干样品培养基表示没有检测到固氮水平。那么想必就不会将固氮菌联想到根组织和茎。分离菌株则要么是根际,要么就联想到跟面。3.:北方野生稻的完整标本与相关的根际土壤(示范地点:土壤样品pH:pH7,1-7,3固氮菌的预增是在10℃和28℃完成的。在冷增过程中使用了根和根际土壤样品,传代培养两次,3-4天的培育。之前提到预增是在28℃时完成的,从根际土壤始发,根和茎样品都来自于最底节。样品没有进行表面灭菌。冷处理的结果5个样品平行进行培育。培育已传代三次。繁殖成为不同模式的波段,变得更清晰可见。根据丰富菌群的氧气需求。不同模式的呈现表明固氮菌群有好几个种类组成,表现在它们的代谢需求不同。在预富集培养基中获取并测量了160个个体培养基用于检测固氮活性。我们获取了60个固氮隔离,固氮酶活性测定结果已登记在实验室记录上。有着显著高固氮能力的28菌株已被储存在实验室菌株保藏室(在–70℃)。28℃出现的预增结果。26个样品平行培育。培育已传代6此。培育成为不同模式的波段,变得更清晰可见。根据丰富菌群的氧气需求。不同模式的呈现表明固氮菌群有好几个种类组成,表现在它们的代谢需求不同。在预富集培养基中获取并测量了260个体培养基用于检测固氮活性。我们获取了60-80固氮隔离,固氮酶活性测定结果已登记在实验室记录上。有着显著高固氮能力的12菌株已被储存在实验室菌株保藏室(在–70℃)。其他菌株的纯化正在进行中。示例2:适合土壤接种的菌株筛选,SBSS筛选系统我们分离了1000多个抗逆菌株,能够在极端条件下低产、退化的土壤上生长。分离出的菌株持续包含在土壤微生物SBSS菌株应变集合中。在这个集合里,菌株还可以进行一系列筛选:抗逆(pH,盐),人类致病菌(阳性菌株被排除在潜在接种之外),植物生长促进(植物根际促生细菌)和促进土壤团粒结构的形成(EPS)。与此并行的还有,新型固氮菌株会从低产土壤里分离出来,用于促进植物生长特性的研究。表格2:SBSS注意事项和相关的测量方法在SBSS筛选系统里的菌株按得分来归类。酸性pH-,盐-和耐寒菌株(最广范围耐受力)的最高得分是6分。在植物生长和健康促进方以及土壤团聚体形成方面最活跃的菌株得到了最高分是36分。表格3:SBSS筛选系统里菌株的得分示例3:耐盐性测试根据示例1分离出的菌株经受改良营养琼脂(NA)的传代培养,含盐浓度分别为:0.1%;1;2%;3%;4%;5%;6%;7%and8%。菌株能集中增长的最高浓度已被登记。改良营养琼脂(NA)琼脂平板标记着”NA”准备如下:28g营养琼脂粉(酵母粉;分类编号:CM0003),5.0g葡萄糖和5.0g蔗糖和3.0g酵母提取物(BBL酵母提取物,流式细胞仪,BD)加入到每升蒸馏水中。稍微加热各成分就溶解,没必要调整pH值(pH=7.4±0.2)。达到121℃,气压1.2巴时即可灭菌15分钟。表格4:从低产土壤中分离出来的耐盐,适当耐盐和不耐盐的菌株的数量和分布。一共测试了206个菌株。我们将菌株分类为“耐盐”(5-8%氯化钠),“适度耐盐”(3-4%氯化钠)和“不耐盐”(1-2%氯化钠)。证实45-45%的菌株都耐盐或适度耐盐,仅有10%对高浓度盐敏感。除了这206个菌株,大概186个菌株能耐更高浓度盐含量:1-2%氯化钠里有20菌株,2-5%氯化钠里有92个菌株,6-8%氯化钠里有94个菌株能生长。示例4:酸碱度耐受研究据示例1中分离出的菌株用于不同pH值(pH3,4,5,6,7and8)营养液(NB)培育基的培养。增长信号和培养的pH值在24小时后做好登记。记录(+)接种时的细胞计数,增长率则分类为四组(-,+,++,+++)。大范围的酸碱耐受力或有效的缓冲作用都是潜在土壤接种的有利特性。营养液的酸碱度是根据土壤的酸碱度来调整的,给出的菌株也是源自于此土壤并灭菌杀菌。每个菌株都接种到装有4ml营养液培育基的试管中,在旋转体里保持28℃培育整晚。营养液的pH梯度系列已准备好,在灭菌前调整pH3,4,5,6,7和8。4ml-4ml滴到试管里并与0.5ml(整晚增长的营养液培育并在旋转体里保持28℃培育整晚)接种。24小时候,选择显示增长信号的培育基,测量培育基的pH值。如果增长信号不明显,那么试管就再培育24小时。测试并登记48小时培育基的pH值。我们已观察到菌株往往会将它们所处环境的pH值调整为酸性,中性或碱性。考虑到缓冲效果,基于培育基的pH值和控制液,菌株可以被归为三类(没有缓冲能力,适度的缓冲能力和良好的缓冲能力)。就增长速度来说,菌株也被归类为三类(广泛的pH耐受力:可以在所有酸碱值里面增长,小范围pH耐受力:在有限范围酸碱值里增长,或在任何酸碱值里都不增长)。在所有酸碱值里都增长的菌株被归类为拥有广泛的酸碱耐受力,只在特定酸碱值内生长的菌株则归类为拥有小范围酸碱耐受力。表格5:从低产土壤里分离出来的酸化菌株的缓冲作用和酸碱耐受力。有着适度和良好的缓冲作用的菌株能够将培育基的酸碱度从中性降到酸性。相对应的,没有缓冲作用的菌株不能更改培育基的酸碱度。表格6:从低产土壤里分离出来的碱化菌株的缓冲作用和酸碱耐受力有着适度或良好缓冲作用的菌株能将培育基的酸碱度从酸性提高到中性。相比而言,没有缓冲作用的菌株则不能改变培育基的酸碱度。表格7:从低产土壤中分离出来的中性菌株的缓冲作用和酸碱耐受力。有着适度或良好缓冲作用的菌株能将培育基的酸碱值从中性提升到碱性。示例5:耐寒力测试根据示例1和SBSS系统分离得来的菌株在琼脂培育基中进行调查,在4-8℃时接种。分离的菌株放在营养琼脂盘上并放入4-8℃的冰箱里培育4天。表格8:从低产土壤里分离出来的耐寒和不耐寒菌株的数量和分布。324个菌株经受着耐寒测试。39.5%是耐寒的,即324个菌株中的128个菌株能在4-8℃中增长。示例6:根据SBSS筛选系统做出的品种分类和人类致病菌的排除。根据SBSS方法来确认和排除人类致病菌株是很重要的。MYP,XLD,MC,CFC固体琼脂培养基和LSB液体用于选择性培养的菌株。MYP琼脂适用于发现枯草芽孢杆菌,奇异变形杆菌和金黄色葡萄球菌。XLD琼脂用于发现大肠杆菌,肠杆菌属,气单胞菌,克雷白杆菌,沙雷氏菌,哈夫尼亚菌,柠檬酸杆菌,变形杆菌,志贺氏菌和沙门氏菌属。选择CFC培养基用于发现UV-荧光假单胞菌。基于革兰检测法、相衬显微镜法、菌落形态学、过氧化氢酶-氧化酶试验检测法,根据常规微生物做法来确认分离菌。大肠杆菌检测月桂基硫酸液(LSB)将一升蒸馏水加入到以上成分中,pH值调整到6.8,此液体达到饱和蒸汽压,在120℃时灭菌15分钟。此菌株的种类根据生长特性来确认:快速增殖,气体形成:大肠杆菌,克雷白杆菌,柠檬酸菌;中速增长:沙门氏菌,普通变形杆菌,粪肠球菌,沙雷氏菌;低速增长:金黄色葡萄球菌,藤黄微球菌。表格9:根据SBSS原则,从低产土壤里分离出来的菌株数量和分布显示了LSB培育基中大肠杆菌型生长,LSB++++++-菌株数量合计161192168106627百分比(%)26%31%27%17%100%106个菌株显示无增长信号,627个分离菌能在为选择性培养大肠杆菌的月桂基硫酸培育液中繁殖。发现161个菌株密集增长。芽孢杆菌,变形杆菌和葡萄球菌的检测:MYP琼脂培育基将23gMYP琼脂添加到450ml蒸馏水里加热至溶解,此液体达到饱和蒸汽压,在120℃时灭菌15分钟。冷却至45℃时,加入8.2ml多粘菌素和25ml蛋的瘁取物。多粘菌素溶解至5ml的无菌水中。MYP琼脂培养基把23克的MYP琼脂加入到450毫升的蒸馏水中直至溶解,然后把培养基在120摄氏度以饱和蒸气压的状态下消毒15分钟。当温度冷却至45摄氏度的时候,加入8.2毫升的多粘菌素和25毫升的鸡蛋提取物。(加入之前)这种多粘菌素将会在5毫升的消毒水中被溶解。生成物的种类根据菌落的颜色和沉淀物的出现(卤基)进行识别。杆菌:红色菌落,卤基。枯草芽胞杆菌:黄色或者粉色菌落,路基。奇异变形杆菌:红色菌落,无卤基。葡萄球菌:黄色菌落,卤基。表十:根据SBSS筛查方案,分离于低肥力土壤的多粘菌素抗性和多粘菌素敏感性,甘露醇阴性,卵磷脂酵素生成,形态类芽孢杆菌和金黄色葡萄球菌的数字和分布。在所有636种可以在MYP培养基中生长的菌株里,含多粘菌素抗性572,含多粘菌素敏感性64,甘露醇阴性121,卵磷脂酵素生成185,形态类芽孢杆菌115,金黄色葡萄球菌菌落肠道病原菌的觉察(主要是志贺氏菌和沙门氏菌)XLD琼脂培养基XLD培养基可选择性运用于治疗肠道病原菌,主要针对于志贺氏菌和沙门氏菌。准备工作:1升蒸馏水,已经经过消毒的1个表面皿和1个量匙。用量匙称重55克的XLD琼脂放于表面皿中,然后置于无菌室的蒸馏水中,加热至沸腾,最后倒出来使其形成琼脂平板。表十一:根据SBSS筛查方案,分离于低肥力土壤的木糖,乳糖,蔗糖负/正,硫化氢生成物,革兰氏阴性兼性病原菌的数量分布和分类。被研究的菌株中,有43种可以利用木糖,乳糖,蔗糖作为碳源。这些菌株在MC培养基中通过菌落形态确认为是E型大肠杆菌,肠杆菌,气单胞菌,沙雷氏菌,柠檬酸细菌属,变形杆菌的属类。在XLD培养基中,有502种菌株没有呈现生长态势。35种是典型的沙门氏菌,志贺氏菌,假单胞菌,其中存在着有益的假单胞菌。紫外荧光假单孢菌的检测在324种菌株中,有26种可被归类于紫外荧光假单孢菌。肠病原体种类的分类把这些混合物加入到一升蒸馏水中,把ph值调整至7.1,煮沸直至溶解。在饱和蒸气压状态下,120摄氏温度下进行消毒15分钟。根据菌落形态把菌株进行分类:志贺氏菌,沙门氏菌:无色透明的菌落,中期呈现黄色;E型大肠杆菌:更大,红色菌落伴随乳白色光区,中期呈现红色;肠杆菌,克雷白氏杆菌:更大,粉红色,粘液菌落;肠球菌,葡萄球菌:小,不透明,分离出来的菌落。表十二:根据SBSS筛查方案,分离于低肥力土壤,培植于MC培养基的乳糖负和革兰氏阴性兼性病原菌的数量,分配和分类。呈现生长的223种菌落是格兰氏(染色)阴性。其中没有识别出E型大肠杆菌。12种菌株属于变形杆菌,志贺氏菌,沙门氏菌,这一点是通过在XLD培养基培植得到确认。27种菌属于肠杆菌属,克雷白氏杆菌,这一点也是通过在XLD培养基培植得到确认。32种分离物属于乳糖负。表十三:根据SBSS筛查方案,菌株的的数量,分配和分类。经过选择性的分离或者非选择性的分离的菌株可以分为十一类。在722种菌株里,24%的菌株未能确认。30%的菌株属于杆菌属。假单细胞菌和伯克霍尔德菌占相对高的百分比。示例7:通过对于植物根茎组织进行冷处理或者浓缩处理,在寒冷或者耐盐的状况下进行分离,所呈现出的氮的固定性能的描述和试管内的影响。根据SBSS筛查方案,下列菌株被分离出来。_菌株B41/8:即B41:固氮螺菌属平均固氮值(每毫升集落生成单位):45.6,微需氧链球菌菌株B146:即NF2,非脱羧勒克菌。平均固氮值(每毫升集落生成单位):39.4;有氧的菌株B149:即NF3,阴沟肠杆菌平均固氮值(每毫升集落生成单位):49;微需氧链球菌菌株B162/2-1:即NF4,非脱羧勒克菌平均固氮值(每毫升集落生成单位):42.7;微需氧链球菌菌株B147平均固氮值(每毫升集落生成单位):33.5;微需氧链球菌菌株B159,即NF14,非脱羧勒克菌平均固氮值(每毫升集落生成单位):39.8;有氧代谢。菌株242/9torzs:即242/9种类:巴西固氮螺菌。根据16SrRNA基因测序分离于基层表面平均固氮值(每毫升集落生成单位):53.9,微好氧微生物菌株241/10-3:即NF1种类:巴西固氮螺菌。根据16SrRNA基因测序分离于基层表面平均固氮值(每毫升集落生成单位):49.9,微好氧微生物菌株NF1在根部生长方面引导介质改善速度可作为单一接种剂。我们监测到它与环状芽孢杆菌结合后可促使植物的根和茎干发育显著增长。展示的样本在接种植株根围中活跃的固氮作用,Et%/0.5cm土壤根围参数63.1菌株641/1-1:即NF5种类:固氮螺菌。根据16SrRNA基因测序分离于:北部野生稻根际土壤和根抗寒性(10摄氏度以上)平均固氮值(每毫升集落生成单位):49.9,微好氧微生物展示的样本在接种植株根围中活跃的固氮作用,Et%/0.5cm土壤根围参数44.9菌株638/1-1:即NF6种类:固氮螺菌irakense.根据16SrRNA基因测序分离于:北部野生稻根际土壤和根抗寒性(10摄氏度以上)平均固氮值(每毫升集落生成单位):49.9,微好氧微生物展示的样本在接种植株根围中活跃的固氮作用,Et%/0.5cm土壤根围参数51.1菌株616/1-4:即NF7种类:巴西固氮螺菌。根据16SrRNA基因测序分离于北部野生稻根际土壤和根-抗寒性(10摄氏度以上)-平均固氮值(每毫升集落生成单位):49.9,微好氧微生物展示的样本在接种植株根围中活跃的固氮作用,Et%/0.5cm土壤根围参数38.8菌株453/7:即NF10-种类:巴西固氮螺菌.根据16SrRNA基因测序分离于北部野生稻根际土壤和根-抗寒性(10摄氏度以上)-平均固氮值(每毫升集落生成单位):65.1,微好氧微生物菌株672/1-1:即NF11-种类:巴西固氮螺菌.根据16SrRNA基因测序-平均固氮值(每毫升集落生成单位):49.9,微好氧微生物-分离于表面没有进行消毒的北部地区的野生稻的最低节间的茎和根颈地。-在ph值6-7的酸性条件下,呈可生长性的固氮和吲哚乙酸的生成。-NF11:对于根群,剂量效应有着相当大的显著改良效应菌株672/3-1:即NF12-种类:弯曲假单胞菌。根据16SrRNA基因测序-分离于表面没有进行消毒的北部地区的野生稻的最低节间的茎和根颈地。-平均固氮值(每毫升集落生成单位):42.3,微好氧微生物铜绿假单胞菌的系统分类在2000年有发生变化,后来归入嗜麦芽窄rRNA类(参考Anzaietal.,2000,Int.J.Syst.Evol.Microbiol.,50:1563-1589菌株672/5-1:即NF15种类:未确认-分离于表面没有进行消毒的北部地区的野生稻的最低节间的茎和根颈地。-平均固氮值(每毫升集落生成单位):49.9,微好氧微生物.例八:在高强性强酸土砂性土和耐压性土壤下细菌菌株的接种以及培育生长检测。在低肥力状况下的离体接种,培育无生命耐压性的固氮螺菌的土壤呈酸性。此项研究的目的是监测用培育方法在低肥力土壤状况下的固氮螺菌NF7菌株的生长状况,用以预测在酸性土壤状况下就地接种的生长率。酸性粘性土的PHKCI是4.2.来自于匈牙利沃申洲的瑙吉拉科什。菌株NF7:菌株对于PH值的容忍度有一个小范围的变化,适于生长的最佳PH值是4.2(在NB培养基中)。基于在NB培养基的观测我们已经研究了在酸性Okon土壤中菌株的生长模式,以便确定进行扩散的最佳PH值。与NB培养基形成对比的是,Okon介质中不含糖,此介质是缓冲的。在培养基里生长的最佳PH值是6.0+0.5或者是6.0-0.5.尽管有添加的缓冲,菌株存在有缓冲影响,增加了培养基的PH值。在OK培养基中不同酸性PH值对菌株的生长的研究,我们发现在试管内监控酸性土壤中的生长是可行的。参考菌株(非耐压力)平行培养:螺菌KE1NCAIM(P),B001324生长最理想的是在一个中性的pH值(6.8--7.0)的培养基。取约150克的无菌土壤放入200毫升培养罐,灭菌后悬吊于OK培养基中。接种结合物NF7:整晚摇瓶在28℃培养基中培养,细胞计数约。1-2x109CFU/毫升KE1:整晚摇瓶在28℃培养基中培养,细胞计数约。1-2x109CFU/毫升土壤接种剂量:1-2x107CFU/g以下抽样日(接种为Day0)细胞计数的样本需在OK培养基中KE1和NF7的细胞计数的样本是在接种后间隔38天之后)数据1所示。显示的细胞计数NF7Day10只有10%的菌株接种剂量,和保持细胞计数直到Day38106CFU/5g的土壤。(细胞计数在第一天视为接种剂量)。KE1应变显示的细胞计数下降——类似于应变NF7前10天,随后迅速扩散到达Day16接种剂量。Day38细胞计数再次下降,只有105CFU/5g的土壤。这是一个数量级的细胞计数低于NF7在同一时间点。细胞计数下降10天的样品可能是接种体的结合物适应的结果,它通常是类似的实验中观察到。临时增加的细胞计数KE1应变可能是由于细胞间养分储存设备的关系。琼脂板用于细胞计数显示逐步增加粘液,可能对不恰当的反应的培养基。粘液的产生在NF7菌落中没有被观察到。结果证实NF7菌落在增加的可行性和酸碱耐受度都高于KE1.后者更喜欢中性pH值。接种38天后,细胞计数保持在106CFU/5g的土壤的能力是一个值得利用的优良性能。实验的结果证实了菌株适合酸性土壤使用。接种非生物耐压力的胞外多糖菌株于酸性的红沙土壤我们选择两个革兰氏阴性和一个革兰氏阳性菌(非产芽孢厌氧菌),胞外多糖产生的菌株得益于病原菌的吃水耐受性不会让芽孢形成。:明串珠菌属K200925/4NCAIM001372,假单胞菌K200913/4BNCAIM001370和假单胞菌K20099/4-BNCAIM001371明串珠菌属K200925/4NCAIM001372,假单胞菌K200913/4BNCAIM001370和假单胞菌K20099/4-BNCAIM001371取自迪拜的两种类型的砂土样品——arensol盆栽土壤类型和沙漠里的沙子,pH值5.5–接种在菌株结合物里,1毫升的结合物/10g的土壤,4-5x109CFU/毫升,样本在38℃培育14天(直到干燥),然后维持在35℃14天。持久性的菌株的基础上确定活细胞计数(平皿计数法),显示在图2。和3。盆栽土壤中(图2)假单胞菌菌株显示活跃的增殖,细胞计数达到土壤的8.1x108CFU/g.明串珠菌属的细胞多糖类物质K200925/4NCAIM001372和/或假单胞菌K200913/4BNCAIM001370提供粘液坚持土壤颗粒和在这些土壤骨料含水率和温度连续提供胶粘剂材料的生物降解和细胞增殖。产生的胞外假单胞菌促进土壤形成的聚合物,对干燥有抵抗力的,这种方式显然是干涸的土壤仍然拥有足够的水来维持细菌生命-因此,假单胞菌的生长能够增殖并丰富红砂壤类型土壤微生物活动。令人惊讶的是,从迪拜沙漠砂产生的菌株胞外多糖(图3)显示高存活率。明串珠菌属K200925/4NCAIM001372出现在细胞计数4.1x104CFU/g的土壤和2.5x102CFU/g的土壤接种后在14日和30日。很明显,细胞计数超出了本机的微生物群(1.3x102CFU/g(土壤)由两个数量级,在一段时间内至少两个星期。假单胞菌K20099/4-BNCAIM001371也持续生存能力(4.4x103CFU/g。很可能多糖类明串珠菌属的细胞壁有可增殖性,假单胞菌K20099/4-B可扩展性。表明这两个菌株之间存在协同作用。假单胞菌的右旋糖苷和多糖类衍生物K200913/4B和9/4B和明串珠菌属K200925/4可以促进土壤形成在沙漠土壤或土壤恶化先锋——的降解能力,使种类丰富微生物种群较低。研究菌株B41在强酸性粘性土中的聚合力B41菌株对土壤的聚合力和生存能力测试可参考螺菌NF11,其喜欢在中性pH值土壤中生长。维持土壤106CFU/5g细胞计数在接种140天内是一个有利的能力。实际上,140天是春夏植物的生长周期。土样:取自沃什州,粘性土,酸性pH值(pHKCl4,37)类似于以前的研究,用约200毫升的锅,装土壤150克/罐)。使用冷冻的土壤。接种菌菌株答:B41菌株:碱化能力高,在试管内最佳PH值8。螺菌NF11菌株:在中性空间最佳pH值6,8–7,0.接种混合物:B41:整晚摇瓶培育在28℃的OK培养基,细胞计数约。1-2x109CFU/毫升NF11:整晚摇瓶培育在28℃的OK培养基,28℃细胞计数约。1-2x109CFU/毫升接种剂量被设定为约。1-2x107CFU/毫升。每个菌株接种2个。取样时间(接种日为Day0:):1.Day12.Day83.Day164.Day285.Day566.Day827.Day147细胞计数在Ok培养基(平板计数法)。表15.B41和NF11平均细胞计数细胞计数第1天开始接种剂量。B41接种剂量一个数量级低于NF11菌株。这种差异可能是由于液体变质剂絮凝的影响了适当调整剂量。菌株B41增殖到第8天后轻微下降,细胞计数到第16天开始维持一个均衡水平,140天内如此。NF11的细胞计数从接种开始逐渐减少。在第28天,它降低了一个数量级,Day56,这是近两个数量级低于接种的时候。82天后,细胞计数低于检出极限(<103CFU/5g的土壤)(图12)。示例9:溶磷作用烃基磷灰石;磷酸盐增溶的活动可以在含烃基磷灰石的培养基中检测,依据SBSS筛查草案。同之前的示例。检测的原理是,培养基的发乳白光的不溶性磷酸清除,在聚合物的周边形成透明带(SundaraSinha,1963;VaramMathur,1989;Kopoor,1989)。菌株的溶磷性在修改的琼脂培养基中被研究过,含有1%的羟基磷灰石和磷酸三钙及碳源。如果菌株增溶两种形式的磷酸盐,它将会有良好的溶磷能力。表16:溶磷能力及非生物压力下的病原体研究溶磷作用++++++-研究菌株数量总计136155444636百分比(%)0%6%24%70%100%病原体11291647病原体的百分比(%)100%3%19%4%7%30%的菌株能使磷酸不同程度的移动。最佳溶磷为菌株S298,然而,基因鉴别显示它包含病原体。36种菌株都有良好的溶磷能力:ES1,ES2,胡,ES10,ES11,ES17,ES18,ES19,ES22,ES23,ES24,ES25,ES26,ES27,ES28,ES29,ES30,ES31,ES33,ES35,ES36,ES41,ES176,ES187,ES282,ES283,S25,S30,S33,S34,S37,S47,S125,S153,S275,S301,LU36,LU44,LU4713/4B。病原菌株比例大约19%,他们的溶磷能力较差。假单胞菌K200913/4BNCAIM001370a,假单胞菌K20099/4-BNCAIM001371和明串珠菌属K200925/4NCAIM001372菌株测试有良好的调控作用。除了芽孢杆菌M326NCAIM/P/B。透明带在28度,3-4天培育后在琼脂板上对比明显。表17:对比研究的磷酸盐增溶的bmegateriumvar.phosphaticum,Ps。chlororaphisK20099/4B13/4B和L。mesenteroidesK200925/4菌株最高的磷酸盐增溶的活动观察pchlororaphisK200913/4BNCAIM001370参考菌株Bmegateriumvar.phosphaticum,其他假单胞菌菌株和明串珠菌属菌株表现出较低的活动。示例10:研究多糖类物质的产生多糖的产生通过菌株选择相衬显微镜根据胶囊的存在或粘性物质研究。研究采用SatchII液体培养基。SatchII液体培养基检测多糖的产生:蔗糖8%;0.51%硝酸钾;0.1%K2HPO4;0.08KH2PO4;0.04%MgSO4x7H2O;FeSO4x7H2O0.002%;0.001%氯化钙;MnSO40.001%;0.1%氯化钠;0.01%的酵母提取物;0,01%triptone;大豆蛋白胨0.01%;1毫升/l微量元素,杀菌前pH值:7.0;杀菌在121℃,25分钟。微量元素的合成解决方案:0.3gH3BO3;0.2gCoCl2.6H2O;0.1gZnSO4.7H2O;30毫克Na2MoO4.2H2O;20毫克NiCl2.6H2O;10毫克CuSO4.5H2O,1升1n盐酸。测试的菌株在100毫升SatchII液体培养基28℃培育,摇动300rpm,共7天。培养液的细胞计数:至少109CFU/毫升,接种率3%。培育后,接种物以30分钟的离心机,转动频率为9000rpm。上层清液稀释到两倍体积的蒸馏水和在40℃摇动2小时。2-丙醇添加到混合物在上层清液的数量的三倍。丙醇将多糖类的基质析出,不会产生聚苯乙烯测试的菌株中有9株能够产生多糖类:ES17,S17,S28,S62,S120,S127,13/4B,25/4,S284多糖产生的类型是由接种到荧光增白剂介质决定,需培育整晚。荧光增白剂被多糖类物质凝固,在UV光线下发光,它是UVP文件系统的一部份。周围的介质胞外多糖也发光。如果多糖被细胞壁吸收,只有聚合物发出荧光。研究的菌株当中有两种有相当程度的荧光反应:假单胞菌K200913/4BNCAIM001370和明串珠菌属K200925/4NCAIM001372。示例11.铁载体的检测及菌株筛选铁载体的侦测可用细菌铁载体检测方法,用包含铬天青的金氏固体培养基。铁载体的检测基于铁与三价铁离子的高关联性,而与自身结构无关。将强力配体加在亮色的含铁容器中,含铁载体的综合物慢慢变色,呈现出桔色。5IL的铁细胞菌株培养在金氏B培养基溶液里,不超过24小时,接好菌的溶液置入琼脂板的凹槽。经过温度28度,48小时的培养后,桔色区域与原始的蓝色培养基清楚地显现出来。含铁细胞测试方法含铁细胞培养基如下将以上混合物加入900ML蒸馏水,PH调至7.2,在120℃温度下灭菌处理20分钟,使蒸汽压充分饱和。混合物过滤后加入以下再除菌:60.5mg铬天青S溶入50ml蒸馏水,10.0mgFeCl3x6H2O,72.9mg三甲基十六烷基溴化铵(HDTMA)溶入50ml蒸馏水。含铁载体以包含了培养基的铬天青S来研究。检测及测试含铁载体容量的方法如下:方法一:将24小时后的溶合物注入含铁细胞培养基,培养72小时。菌落周围的圆环清晰地环绕着菌株的铁载体。不论结构如何,含铁细胞与三价铁离子显示出高亲和力。由于结合到铁,铁载体从结合物释放铁。围绕在铁细胞产生菌株的周围的培养基从原先的蓝色变成了桔色。以下菌株被证实可产生嗜铁素,沙雷氏菌(ER180),巨大芽胞杆菌(S41,ES217),皮尔瑞俄类芽孢杆菌(S284),弗雷德里克斯堡假单胞菌(S33),草地阿格蕾氏菌(S47),成晶节杆菌S153),节杆菌(S177)绿针假单胞菌(13/4Bés9/4B),固氮螺菌B41NCAIM(P)B001402,生脂固氮螺菌NF6NCAIM(P)B001425表18,生成铁载体的应力容忍土壤细菌ES215Pseudomonaschlororaphissubsp.aurantica绿针假单胞菌,桔黄亚种ES217Bacillusmegaterium巨大芽胞杆菌S153Arthrobactercrystallopoietes成晶节杆菌S33Pseudomonasfrederiksbergensis弗雷德里克斯堡假单胞菌S41Bacillusmegaterium巨大芽胞杆菌ER180Serratiaplymuthica沙雷氏菌S284Paenibacilluspeoriae皮尔瑞俄类芽孢杆菌S47Agreiapratensis草地阿格蕾氏菌S177Pseudomonasbrassicacearum节杆菌13/4BPseudomonaschlororaphis绿针假单胞菌9/4BPseudomonaschlororaphis绿针假单胞菌铁载体的产生也可通过金氏B培养基抑大肠杆菌测试。在无铁琼脂培养基上隔绝大肠杆菌的发展,使其控制在一定范围内生长。(见King1984,Kloepper,1980)铁载体检测也可通过接种已研究好的菌株到金氏B培养基,喷洒大肠杆菌MC1061到结合物中。同时培养的含铁介质也开始进行,以确认抗生素在铁细胞产生的过程中是否起到作用。大肠杆菌的抑制可通过35℃,48小时培养后体现出来。含铁细胞的产生主要存在于绿针假单胞菌K20099/4-B,然而绿针假单胞菌K200913/4B在两种培养基起强烈的抑制作用,表明抗生素效果并不完全是因为含铁细胞产生,还有其他生物机制在起作用。表19.绿针假单胞菌k2009菌株及串珠菌K200925/4在对含铁细胞生产能力的增长和抑制大肠杆菌的测试作用的对比示例12:能产生植物生长素促进吲哚乙酸(IAA),细胞分裂素,玉米素及核糖甙的菌株的选择根据SBSS协议选择吲哚乙酸菌株形式,借助于不添加色氨酸的胰蛋白胨大豆琼脂培养基(TSB)。显色反应试剂离心法处理后加入样本。试剂在吲哚乙酸作用下变红。浸入水中的吲哚乙酸浓度测定准备如下:4-4ml营养肉汤注入试管,灭菌处理后灌入有菌株的接种环,此结合物在28度下培养一天作为一个循环。24小时后取0.5ml注入4ml的无菌TSB清汤。每个菌珠做4个平行接种。装入试管后在28℃下培养96小时做为一个循环。对于盲样,1ml的营养肉汤加入2ml的S试剂,平行IAA测量结果的平均值在校准曲线的帮助下被转换成1ìg/ml的浓度。校准曲线来源于连续测量的IAA持续稀释。连续稀释的浓度范围保持在0.1-0.001ìg/ml。在测试的631个菌株样本中有121个(约21%)可产生吲哚乙酸。其中10个样本浓度较高,17个样本浓度中等,100个样本浓度较低。测试的样本中有27个被证实产生吲哚乙酸能力较强,16个则不行。将近60%的样本产生病原菌。理想的产生吲哚乙酸的菌株样本如下:ES330,S116,S177,S273,LU44,ES307,ES343,ES344,S33,S47,S125,S153,S225,S158,S162,B41,NF10,NF11,242/9,NF7,NF6.表20:IAA产生比率及病株比率薄层色谱法发现生长素和吲哚乙酸将一种名为A.irakense的兼性内生固氮菌的NF6菌株放在内含100毫升改良营养肉汤的500毫升锥形烧瓶中培育,并且要在28℃、250rpm下振摇48小时。通过摇晃提供需氧土壤微生物氧气,氧气允许需氧土壤微生物在48小时内达到固定相增长。将20-20毫升样品放在离心管中,在4500rpm/rcf(HermleZ300)下离心10分钟。用1NHCl将离心机的pH值调整到2.8。加20-20ml的乙酸乙酯到分液漏斗中提取样品,并且用无水亚硫酸钠脱水。过滤干燥剂。用旋转蒸发器除去过量的溶剂,并将得到的晶体溶解于1ml甲醇中。用5554型号的硅胶60薄层层析板检测吲哚衍生物,在汉密尔顿注射器中发现了5μl的样品。为了检测生长素氯仿:乙酸乙酯:使用甲酸的溶剂体系。板固定在45℃下5分钟,在Ehrlich试剂中跑板并在100℃保持5分钟。用高效液相色谱法测定吲哚-3-乙酸(IAA)高效液相色谱法从所提取的丁醇相检测生长素(图14-15)。固定相:Kinetex-C18(2.6微米的颗粒大小,核壳技术)(Phenomenex公司.)柱尺寸:直径4.6毫米,长度50mm流动相和溶剂显影:开始的“A”流动相:0,1v/v%的三氟乙酸(浓度>99%,Sigma-Aldrich公司)开始:A”流动相:0.1v/v%三氟乙酸(浓度>99%,Sigma-Aldrich有限公司.)限制的“B”流动相:90%的乙腈/10%含0.1v/v%三氟乙酸的蒸馏水(高效液相色谱质量乙腈,Sigma-AldrichKft.)梯度洗脱:0-10分钟5%B→100%B,10-11分钟100B,11-12分钟100%B→5%B,12-20分钟5%B色谱运行时间:12分钟总周期时间(包括平衡时间):20分钟分离温度:室温色谱系统:Waters2695(Alliance)线性梯度洗脱,0,5毫升/分钟流速,5微升注射体积海域996光电二极管阵列检测器,215nm和254nm的双通道监控波长通过薄层色谱法检测赤霉素-3-羧酸和吲哚-3-乙酸将一种名为A.irakense的兼性内生固氮菌的NF6菌株接种于盛有100ml改良营养肉汤的500毫升锥形瓶中里孵育,28℃下以250rpm振荡48小时,通过振荡,需氧微生物得到氧气,使微生物在48小时内达到增长的固定相。取20-20毫升样品到离心管中,以4500rpm/RCF(赫姆勒Z300)离心10分钟。用1NHCl将离心样品pH值调至2.8,将样品置于分液漏斗中,以20-20毫升乙酸乙酯进行萃取,然后用无水亚硫酸钠脱水,过滤除去脱水剂并用旋转蒸发器除去过量的溶剂,将结晶溶解在1ml甲醇中,使用与生长素相同的溶剂系统,在5554型号的硅胶60F254薄层层析板上进行检测赤霉素。检测板在45℃下固定5分钟,在硫酸和乙醇混合物中继续反应,在100℃下固定5分钟后,赤霉素在366nm的波长的紫外光下显现蓝绿色荧光(图16.)。薄层色谱和高效液相色谱法检测细胞分裂素将A.irakense的NF6株接种于盛有100ml改良营养肉汤的500毫升锥形瓶中里孵育,28℃下以250rpm振荡48小时,通过振荡,需氧微生物得到氧气,使微生物在48小时内达到增长的固定相。取20-20毫升样品到离心管中,以4500rpm/RCF(赫姆勒Z300)离心10分钟,检测玉米素和t型玉米素核苷类细胞分裂素。薄层色谱细胞分裂素类化合物在或丁醇萃取水相被发现。在5554型号的硅胶60F254薄层层析上板点样观察并放置在溶剂中跑板。经过100℃固定后,细胞分裂素在波长为254nm的紫外线可视。高效液相色谱法细胞分裂素中的玉米素和t型玉米素核苷从或丁醇萃取相中被发现。(如图17.)固定相:Kinetex-C18(2.6微米的颗粒大小,核心壳技术)(Phenomenex公司.)柱尺寸:直径4.6毫米,长度50mm流动相和溶剂显影:开始的“A”流动相:0,1v/v%的三氟乙酸(浓度>99%,Sigma-Aldrich公司)开始:A”流动相:0.1v/v%三氟乙酸(浓度>99%,Sigma-Aldrich有限公司.)限制的“B”流动相:90%的乙腈/10%含0.1v/v%三氟乙酸的蒸馏水(高效液相色谱质量乙腈,Sigma-AldrichKft.)梯度洗脱:0-10分钟5%B→100%B,10-11分钟100B,11-12分钟100%B→5%B,12-20分钟5%B色谱运行时间:12分钟总周期时间(包括平衡时间):20分钟分离温度:室温色谱系统:Waters2695(Alliance)线性梯度洗脱,0,5毫升/分钟流速,5微升注射体积海域996光电二极管阵列检测器,215nm和254nm的双通道监控波长示例13:较宽的pH耐受性菌株在碱性pH下的增长和吲哚乙酸的生产从Azospirillumlargimobile,B41NCAIM(P)B001402中取100毫升/500毫升肉汤营养培养液。烧瓶中接种1速冻样品并培养一夜。3x8瓶含有已消毒的100-100毫升营养液。该液的pH值分别调整到3,4,5,6,7,8,9,10.碱性营养液并不稳定,杀菌降低pH值。因此灭菌后调整pH值到8,9,10的水平.培养2天后处理。用相差显微镜检查的培养物的纯度,并登记任何形态的变化。测量600个菌株的pH值和OD值(图18)。从KocuriaroseaS225NCAIM(P)B001426取100毫升/500毫升营养培养液。烧瓶中接种1速冻样品并培养一夜。3x8瓶含有已消毒的100-100毫升营养液。该液的pH值分别调整到3,4,5,6,7,8,9,10.碱性营养液并不稳定,杀菌降低pH值。因此灭菌后调整pH值到8,9,10的水平.培养2天后处理。用相差显微镜检查的培养物的纯度,并登记任何形态的变化。测量600个菌株的pH值和OD值。(图19和20)示例14:在双重培养实验中细菌对真菌增长的抑制(菌苔,居中真菌琼脂盘)真菌菌株保养:在双重培养之前,将PH值为5.0的马铃薯葡萄糖琼脂(PDA5)转移到PDA6(pH为6)或胰蛋白胨-大豆-琼脂(TSA,6,pH为6)板,在环境温度下孵育10-14天。细菌菌株保养:补充糖营养板(NC)。转移到营养板之前进行一周的双重培养,培养24-48h。双重培养的准备:将菌株接种在10毫升PDA6或TSA6营养液并在28℃下经一夜培养,震荡。从孕育培养物和PDA6或TSA6板条纹进行连续稀释(每次稀释4块平行板)从真菌PDA6或TSA6板切0.6mm直径的琼脂盘并在无菌室中将其放置在细菌和未接种的对照板的中心。假设大豆菌核病(一种菌核)被放置在细菌和对照板的中心。将板覆盖并在室温下温育。真菌菌丝的生长在7天内每天监测,然后一个星期一次。评价:平均从在四个平行培养物中观察和对比控制(差别在于给定控制值的比例)。如图21-28,由于细菌培养的影响(板B,C,D,E)的全盘真菌生长的区域的直径是不同的,这是相对于未接种的对照组(板A)的区的直径的效果。抑制程度与稀释的程度有关。示例15:筛选生产PGPR菌株的ACC脱氨酶根据第1例和SBSS筛选系统,ACC脱氨酶的生产首次检测是在富氮介质,随后是在含有ACC作为氮源的基本培养基中。培养条件诱导ACC脱氨酶活性(PenroseandGlick,2003)作为富氮培养基,胰蛋白胨大豆培养液是一个不错的选择。每个菌株在2x7.5毫升营养液中接种。在震荡中培养该菌株达到中期或后期相的增长。(200转,一夜,适当的温度)细胞悬浮液(2×7.5毫升是统一的)8000克在4℃离心10分钟。将上清液倒出,将细胞放在5ml的DF培养基,接着离心8000克在4℃10分钟进行洗涤。将沉淀悬浮在7.5ml的DF培养基并加入45微升的0.5MACC溶液(终浓度3.0毫摩尔),并如前面所述,24小时在摇动培养物中孵育。将得到的细胞悬浮液8000克在4℃离心10分钟。将上清液倒出,沉淀用5ml0.1摩尔的Tris-HCl(pH为7或6)洗涤,进行ACC脱氨酶活性的测量或者在0.03硫酸镁中进行高效液相色谱法测量,或者进行植物接种。重复洗涤两次。将沉淀物保存在-20℃直到脱氨酶测定,或在4℃下进行高效液相色谱法测定或进行植物的研究情况。酶活性测定酶的活性是按照HonmaandShimomura(1978)的方法测定。酶水解ACC得到α-酮丁酸。α-酮丁酸的量在540nm处吸收计算,称α-酮丁酸吸收校正的数值范围,范围是0.1-1.0mmol。制备100毫摩尔α-酮丁酸菌株溶液于0.1mol1molTris-HCl。pH为8~5的缓冲液,并且在4℃的tároljukand下储存。使用前,用缓冲液稀释该菌株溶液,用于准备。该系列稀释样品:200μLα-醋酸乙脂稀释后加入300μl2,4-二硝基苯肼试剂(2mol/LHCl0.2%2,4-二硝基苯肼),涡旋并在30℃培养30分钟。用2.0毫升2.0mol的氢氧化钠溶液使苯腙显色,测量在540nm处的旋涡和吸收。如先前所述制备的丸粒悬浮在pH值为7.6的1.0毫升0.1摩尔的Tris-HCl中。将悬浮液在16000克离心5分钟,将上清液倒出,并再悬浮于pH值为7.6的600微升0.1摩尔的Tris-HCl中。加30微升甲苯到悬浮液,并在最高转速涡旋30秒。100μl等分的甲苯加入悬浮液中用于分离蛋白质含量测定并储存于4℃的环境中。剩余的200微升甲苯悬浮液的中加到20微升0.5摩尔ACC溶液中,30℃下涡旋并培育15分钟。将1毫升0.56摩尔盐酸加到该悬浮液,并且在室温下16000克离心5分钟。在1.0ml上清液溶液中加入0.56摩尔/800μl的HCl和300微升的2,4-二硝基苯肼试剂(0.2%2,4-二硝基苯肼在2mol的HCl),并在30℃下培育30min.加入2.0毫升2摩尔的NaOH,在540nm处测量吸收。制备不加入ACC的样品作为盲样(控制)。下列菌株被评为ACC脱氨酶阳性对照:阴沟肠杆菌NF3固氮菌株ACC脱氨酶的活性:1-3毫米α-酮丁酸/1010CFUCFU荧光假单胞菌NCAIMB01677-ACC脱氨酶的活性:3-5毫米α-酮丁酸/1010CFU测定了如下菌株ACC脱氨酶的活性13/4绿针假单胞菌-5毫米α-酮丁酸/毫克/小时,强烈的显色反应S177P.假单胞菌–没有检测酶活性NF6固氮螺菌-<1毫米α-酮丁酸/毫克/小时NF10巴西固氮螺菌-<1毫米α-酮丁酸/毫克/小时NF11巴西固氮螺菌-<1毫米α-酮丁酸/毫克/小时S125假单胞菌jessenii-<1毫米α-酮丁酸/毫克/小时S33假单胞菌frederiksbergensis-<1毫米α-酮丁酸/毫克/小时LU44乙酰微小杆菌-<1毫米α-酮丁酸/毫克/小时PGPR的ACC脱氨酶活性是高度可变的。即使是一个非常低的α-酮丁酸约20nmol/毫克/小时-ACC脱氨酶可以在ACC的存在,作为氮源促进生长和代谢活动。具有较高的酶活性的菌株不一定产生更高的增长如根伸长的促进作用,高于低ACC脱氨酶活性的菌株。除了IAA生产菌株,NF6,NF10,nf11,s125,S33和lu44也产生可衡量的ACC脱氨酶活性,改善植物生长促进效率。示例16:潜在土壤接种菌株在促进植物生长应力的耐受性及土壤的形成的最优分类菌株是根据非生物胁迫耐受性(ST),促进植物生长(PGPR)和土壤聚集形成(AP)潜力分类,从分类排除潜在的人类病原体菌株。选定(60株)与非生物胁迫的耐受范围最广泛的菌株(STB:耐菌)。它们中的14株被证明是潜在的人类病原体。43株具有最佳的耐盐性、酸性的pH值和耐冷性。它们中有些有广泛的pH耐受性,表现在所有pH值和优良的耐盐性有最大的增长,以7%和8%的NaCl浓度增长。表21:根据SBSS系统筛选STB菌株具有最佳的抗逆性选取92株具有最佳的促进植物生长的特性(PGPR-AP-B:促进植物生长根瘤杆菌和促聚杆菌)这些菌株是固氮菌,产生外多糖,能够溶磷和生产吲哚-3-乙酸。表22:根据SBSS筛选系统具有最佳的促进植物生长(PGPR)和促进土壤团粒(AP)的属性的菌株(植物促生根瘤杆菌和促聚杆菌)细胞因子的TLC和HPLC探测A.irakense的NF6菌株放入100ml改良营养接种液并在500毫升锥形瓶中温育,以250rpm的转速在28℃环境中摇动48小时。有氧土壤中的微生物通过摇晃被提供氧气,允许48小时内到达生长固定相。20-20毫升样品量到离心管中,以4500rpm/rcf的速度离心分离10分钟(HermleZ300).探测到玉米素与T-玉米素-roboside型细胞分裂素。TLC色谱丁醇提取阶段探测到细胞分裂素类化合物。得到的样品滴在5554型TLC硅胶60F254板上,放置在溶剂中。在固定100℃后,细胞分裂素在254纳米波长的紫外光中可视,Rf.HPLC色谱细胞分裂素-玉米素和T-玉米素,核苷类-从提取丁醇阶段探测到。(表17.)固定相:Kinetex-C18(2.6μmparticlesize,coreshelltechnology)(PhenomenexInc.)柱尺寸:直径4.6mm,长50mm流动相和溶剂显影:开始A流动相:0.1v/v%trifluoroaceticacid(>99%purity,Sigma-AldrichLtd.)限制B流动相:acetonitrile90%/water10%containing0.1v/v%trifluoro-aceticacid(HPLCqualityacetonitrile,Sigma-AldrichKft.)梯度程序:0-10min5%B→100%B,10-11min100B,11-12min100%B→5%B,12-20min5%B.色谱运行时间:12分钟总循环时间(包括平衡)):20分钟分离温度:环境温度色谱系统:Waters2695(Alliance)线性梯度洗脱,0,5毫升/分钟流速,5微升注射体积海域996光电二极管阵列检测器,215和254nm的双通道监控波长范例.13.:宽pH耐受菌株在碱性PH条件下的生长和吲哚乙酸的生成备好取自菌株Azospirillumlargimobile,B41NCAIM(P)B001402的100ml/500ml营养浆接种液。将烧瓶中接种1速冻样品并温育过夜。消毒3X8瓶含100-100毫升的营养浆。营养浆的pH值分别调整为3,4,5,6,7,8,9和10。碱性营养浆不稳定,杀菌降低pH值。灭菌后pH值8,9和10因而被调整。2天后处理培养物。培养物的纯度通过相差显微镜检查,并且还注册任何形态变化。测定菌株的pH和OD600值。(表18.)备好取自菌株KocuriaroseaS225NCAIM(P)B001426的100ml/500ml营养浆接种液。将烧瓶中接种1速冻样品并温育过夜。消毒3X8瓶含100-100毫升的营养浆。营养浆的pH值分别调整为3,4,5,6,7,8,9和10。碱性营养浆不稳定,杀菌降低pH值。灭菌后pH值8,9和10因而被调整。2天后处理培养物。培养物的纯度通过相差显微镜检查,并且还注册任何形态变化。测定菌株的pH和OD600值。(图19和20)范例.14.:在双重培养试验中真菌生长的细菌抑制(菌苔,居中的真菌琼脂盘)真菌菌株的维护:马铃薯葡萄糖琼脂(PDA5),PH值5.0。双重培养之前10-14天转移到PDA6(pH为6)或胰蛋白胨-大豆-琼脂(TSA,6,pH为6)板,在环境温度下温育。细菌菌株的维护:加糖营养板(NC)。双重培养前一周转移到NC板,温育24-48小时。双重培养物的准备:细菌菌株在10毫升PDA6或TSA6浆中接种,在28℃温育一晚,摇晃它。连续稀释这种接种培养物,滴在PDA6或TSA6板上(每次稀释物平行放4板)。直径0.6mm的琼脂盘从真菌PDA6或TSA6板上切下来并放置在细菌中心,未接种的板放在无菌室中。在Sclerotinasclerotiorum菌核病的情况下,菌核被放置在细菌和对照板的中心。将板覆盖并在室温下温育。每天监测真菌菌丝的生长,共监测7天,然后再一周监测一次。评价:平均值是源自四个平行培养物中观察到的生长速率和对照未接种的速率(按控制值的比例给出差异)。图21-28显示,由于细菌培养物的效果(B,C,D,E板块)围绕盘的真菌生长区域的直径被改变,这是相对于未接种的(板块A)。抑制程度与稀释的程度有关。范例.15.:ACC-脱氨酶生成PGPR菌株的选择根据实例1和SBSS筛选系统,ACC脱氨酶的生产是通过在富氮培养基中首先培养随后在含有ACC作为氮源的培养基中探测到的。培养条件诱导ACC脱氨酶活性(PenroseandGlick,2003)作为富氮培养基,胰蛋白胨大豆液是一个好选择。每个菌株在2x7.5毫升的溶液中接种。该菌株通过摇晃(200rpm,过一夜,充足的温度)培养,以达到生长的中期或后期阶段。细胞悬浮液(2×7.5毫升是统一的)在8000克4℃离心分离10分钟。将上清液倒出,将细胞放入5ml的DF培养基,接着8000克4℃离心10分钟。将沉淀悬浮在7.5ml的DF培养基中,并加入45微升的0.5MACC溶液(最后浓度3.0毫摩尔),如前面所述,24小时在摇动培养物中温育。将得到的细胞悬浮液8000克4℃离心10分钟。将上清液倒出,将沉淀在ACC脱氨酶活性的测量的情况下,或在0.03硫酸镁用0.1摩尔的Tris-HCl(pH为7,6)将5ml用于HPLC或植物接种。洗涤重复两次。将沉淀物保存在-20℃,直到脱氨酶测定,或在4℃的HPLC或用于植物研究。测量酶活性酶的活性是根据Honma和Shimomura(1978)的发法决定的.酶将ACC水解成alpha-ketobutyrate.alpha-ketobutyrate的数量在540nm吸收时被计算出来,如alpha-ketobutyrate吸收校准刻度所指,范围从0.1-1.0毫摩尔mmol.100毫摩尔alpha-ketobutyrate菌株溶液制备于0.1摩尔的1molTris-HClpH8,5缓冲,和贮存于4℃环境中。在使用前,用缓冲液稀释菌株溶液。稀释的样品:200微升稀释的alpha-ketobutyrate中加入300μl2,4-二硝基-苯基-肼试剂(0.2%2,4-二硝基苯-在2摩尔的HCl中的肼),涡旋并在30℃温育30分钟。所形成的苯腙的颜色与2.0毫升2.0摩尔的NaOH被开发,涡旋,在540nm处测得吸收。如先前所述制备的丸粒悬浮在1.0毫升0.1摩尔的Tris-HClpH7.6中。将悬浮液按16000克离心分离5分钟,将上清液倒出,并再悬浮于600微升0.1摩尔的Tris-HClpH7.6中。30微升甲苯被加入到悬浮液,并以最高转速涡旋30秒。为测定蛋白质含量,分离100μl等分的加甲苯悬浮液并储存于4℃环境中。加甲苯悬浮液的其余部分中的200微升中加入20微升0.5摩尔ACC溶液,涡旋并在30℃条件下温育15分钟。加入1毫升0.56摩尔HCL盐酸,并将该悬浮液在室温下按16000克离心分离5分钟。1.0ml上清液溶液中加入0.56摩尔的HCl中的800微升和300微升2,4-二硝基苯肼试剂(0.2%2,4-二硝基苯-在2摩尔的HCl中的肼),并在30℃温育30分钟.加入2.0毫升2摩尔的NaOH,测量到吸收了540nm。不加入ACC的制备的样品作为盲样(控制)。下列菌株被选中作为ACC脱氨酶阳性控制:EnterobactercloaceaNF3diazotrophstrain-ACC脱氨酶活性:1-3mMalpha-ketobutyrate/1010CFUPseudomonasfluorescensNCAIMB01677–ACC脱氨酶活性:3-5mMalpha-ketobutyrate/1010CFU为ACC脱氨酶活性,以下菌株被测量13/4绿针假单胞杆菌Pseudomonaschlororaphis-5mMalpha-ketobutyrate/mg/h,强烈的显色反应S177P.brassicacearum–没有明显的酶活性NF6伊拉克固氮螺菌Azospirillumirakense-<1mMalpha-ketobutyrate/mg/hNF10巴西固氮螺菌Azospirillumbrasilense-<1mMalpha-ketobutyrate/mg/hNF11巴西固氮螺菌Azospirillumbrasilense-<1mMalpha-ketobutyrate/mg/hS125假单胞杆菌jessenii-<1mMalpha-ketobutyrate/mg/hS33假单胞杆菌frederiksbergensis-<1mMalpha-ketobutyrate/mg/hLU44乙酰短杆菌Exiguobacteriumacetylicum-<1mMalpha-ketobutyrate/mg/hPGPR的ACC脱氨酶活性变化很大。即使是非常低的-大约20nmolalpha-ketobutyrate/mg/h-ACC脱氨酶可以促进生长和代谢此时ACC作为氮源存在。对比具有较低ACC脱氨酶活性的菌株,具有较高酶活动的菌株不一定会产生更高的生长促进效果例如对根的延展来说。除了生产IAA,菌株NF6,NF10,NF11,S125,S33和LU44也发挥出可测量的ACC脱氨酶活性,它提高它们的植物生长促进效果。范例.16.:具有最佳植物促生效果,最佳耐应力,最佳土壤形成效果的潜在土壤接种菌株的分类菌株是根据它的非生物应力耐受性(ST),促进植物生长(PGPR)和土壤聚集形成(AP)的潜力进行分类的,潜在的人类病原体菌株不包括在其中。具最宽范围非生物应力耐受性(STB:应力耐受细菌)的菌株被选中(60株。)。其中14种被证明是潜在的人类病原体。43种具有最佳耐盐,耐酸性pH和耐寒性。其中有些有广泛的pH耐受性,所有pH值条件下最大程度的成长和优良的耐盐性,在7%和8%的NaCl浓度条件下生长。表21:根据SBSS筛选系统具有最佳耐应力的STB菌株92种具有最佳促生性质的菌株被选中(PGPR-AP-B:植物促生根际细菌和促进团聚细菌).其中有些菌株是固氮菌,产生胞外多糖,能够溶磷和生产吲哚-3-乙酸。菌株/4B碱性PH最佳-2%NaCl/9碱性PH最佳-2%NaClB41碱性PH最佳ES202酸性PH最佳-8%NaCl耐寒ES204酸性PH最佳-8%NaCl耐寒ES207碱性PH最佳-8%NaCl耐寒ES209酸性PH最佳-8%NaCl耐寒ES211酸性PH最佳-8%NaCl耐寒ES216碱性PH最佳-8%NaCl耐寒ES228中性PH最佳-8%NaCl耐寒ES231酸性PH最佳-8%NaCl耐寒ES232碱性PH最佳-8%NaCl耐寒ES233中性PH最佳-8%NaCl耐寒ES235中性PH最佳-8%NaCl耐寒Es236酸性PH最佳-8%NaCl耐寒ES249碱性PH最佳-8%NaCl耐寒ES253酸性PH最佳-8%NaCl耐寒ES266酸性PH最佳-8%NaCl耐寒ES272碱性PH最佳-8%NaCl耐寒ES274碱性PH最佳-8%NaCl耐寒ES275碱性PH最佳-8%NaCl耐寒ES283酸性PH最佳-8%NaCl耐寒ES289中性PH最佳-8%NaCl耐寒ES297酸性PH最佳-8%NaCl耐寒ES305酸性PH最佳-8%NaCl耐寒LU19酸性PH最佳-8%NaCl耐寒LU22酸性PH最佳-8%NaCl耐寒LU25酸性PH最佳-8%NaCl耐寒LU44大范围耐pH-8%NaCl耐寒LU5中性PH最佳-8%NaCl耐寒LU56中性PH最佳-8%NaCl耐寒NF10碱性PH最佳-5%NaClcold-selectedNF11碱性PH最佳-2%NaClNF6中性PH最佳-5%NaClcold-selectedNF7酸性和中性PH最佳-5%NaCl耐寒S125中性PH最佳-5%NaCl耐寒S153碱性PH最佳S225中性PH最佳S28酸性PH最佳S284酸性PH最佳-2%NaClS314中性PH最佳-8%NaCl耐寒S33酸性PH最佳-8%NaCl耐寒S47酸性PH最佳-2%NaCl耐寒表22:根据SBSS筛选系统具有积极促生(PGPR)和促进土壤团聚(AP)效果的菌株(植物促生根际细菌和促进团聚细菌)所研究的636种菌株有192种能够溶磷,其中36种不是病原体及能很好地增溶不溶解的羟基磷灰石(HP)。89种致病性菌株是溶磷的。631种菌株中有127种能够生成吲哚-3-乙酸,其中37种是没有病原体并具有良好的激素产生能力。所有91种病原体菌株能产生吲哚-3-乙酸,630种菌株中的21种正在生成铁载体。100种菌株中有16种能固氮(乙炔还原试验)。所有的菌株都根据实例2中描述的得分协议来获得评分,26株得分最高的(应力耐受-植物促生根瘤杆菌,促进团聚杆菌)是由16rRNA基因序列分析和BLAST数据库鉴定而来的。表23最佳的应力耐受-植物促生根瘤杆菌,促进团聚杆菌菌株按照SBBS筛选系统分类,有26种菌株被发现适合接种低产恶化了的土壤由于非生物应力耐受性(ST),促进植物生长(PGPR),固氮,溶磷,铁载体和产生多糖(聚合促进AP)的属性。菌株的鉴定是按以下进行的16SrRNA基因测序为微生物的分类学鉴定常用的方法。它是基于匹配与在NCBI细胞核-潮核苷酸BLAST(http://www.ncbi.nlm.nih.gov/blast/)数据库中的序列的身份不明的分离物的16SrRNA基因序列。98-99%以上的序列相似性被认为是可鉴定的。该方法的简要说明:基因组DNA的提取和纯化,16SrRNA区域PCR扩增-引物施加:27F(5'GAGTTGATCCTGGTCAG3'),1525r(5'AGAAAG-GAGGTGATCCAGCC3'),通过使用BigDye终止循环测序反应试剂盒将该PCR直接测序(所申请的生物系统/Perkin-Elmer)和ABIPRISM310遗传分析仪,引物施加:519r(5'G(T/A)ATTACCGCGGC(T/G)GCTG3'),所获得的序列与BLAST数据库匹配。样本第17号定植-竞争-COCOHELP-研究为了找到用于多株接种剂的最佳组合物,为了它们在双重培养物的相互作用,对所识别的菌株进行了测试。铁载体和exoploysacharide分别被视为为细菌的生长和定植能力的潜在抑制因素。该菌株为其可能的抗生素效力(抑制生长)被筛选,抗活土革兰氏阴性荧光假单胞菌及其可能的影响抗生素NCAIMB.01102和固氮菌土生拉乌尔B.NCAIM和02149革兰氏阳性环状杆菌NCAIMB.01115。将菌株基于抗菌研究的结果分类为侵入性的,性能稳定的或敏感的。表24:侵入性菌株对抗生素的影响Pseudomonas,芽孢杆菌BacillusandRaoultella生长抑制生物测试铁载体生成或以其他方式抗生素生成菌被认为是侵略性的.菌株13/4B和ES225抑制R.terrigena的生成,theES215,ES317,25/4,13/4B,S28,9/4B,ES113和S30抑制B.circulans的生成.Psfluorescens的生成没有受到任何菌株的抑制.表25:革兰氏阳性抵抗菌株在生长抑制生物测验中没有抑制Pseudomonas,芽孢杆菌Bacillus和Routella的生成。革兰氏阳性,胶囊生产,多糖生产和/或抗生素耐药菌株在生物测验中被发现抵抗性。敏感菌株表26:Pseudomonas,Bacillus和Routella菌株在生长抑制生物测试中被证明是敏感的固氮生物巴西固氮螺菌AzospirillumbrasilenseNF7,NF10,NF11和242/9菌株,theAzospirillumlipoferumNF5,theAzospirillumlargimobileB41和伊拉克固氮螺菌AzospirillumirakenseNF6菌株被列为非抑制性的,非抗性敏感菌株。抑制,部分抑制性或辅助性的相互作用通过定值竞争研究被论证(CoCoHelp).12h(28C)接种物培养物(改性营养肉汤(NB)培养基)接种/划线接种到改性营养琼脂(NA)的平板上。施行并行接种。直径为10毫米的孔被从接种的琼脂平板切割。所研究的菌株的离心12小时后的培养物(在NB培养基)在接种后的琼脂平板的孔中发现0.2毫升。在168小时温育后进行了检查,孔周围的抑制或辅助区的存在区域的直径被登记。增长的孔周围的较低速度记录为部分抑制,而密集的细胞增植的区域被认为是一个帮手起协同作用。最具有侵略性的对大部分菌株起抑制和部分抑制作用的是菌株是S33,S284和13/4B.菌株巴西固氮螺菌AzospirillumbrasilenseNF10,NF11,NF7,242/9,菌株伊拉克固氮螺菌AzospirillumirakenseNF6,菌株AzospirillumlargimobileB41和AgreiapratensisS47菌株是对侵入性菌株的抑制效果最敏感的。菌株乙酰短杆菌ExiguobacteriumacetylicumLu44已经被证明是促进菌株巴西固氮螺菌Azospirillumbrasilensestrains(NF7,NF10,NF11and242/9)生成的.具有良好的增长速度,没有抑制作用或只是部分抑制作用,低敏感性的菌株被认为是接种的好选择。在敏感菌株的情况下,需要一个辅助菌株的存在。根据CoCoHelp研究的结果,15种菌株最适于接种:表27:从CoCoHelp研究中选取的抑制和协同作用的菌株表28:根据SBSS筛选系统和定植竞争(CoCoHelp)研究结果,被选为适合土壤接种的菌株的描述样本18.:群体遗传研究.硅片模型系统的开发和验证开发模型系统的概念是为了在监测土壤的微生物群落时从多菌株中识别个体菌株接种。该模型系统是基于T-RFLP和在16SRRN的基因的不同可变区的硅片限制性分析。我们已经搜索了限制性内切酶的组合,这是能够区分在T-RFLP电泳三个接种菌株的可变区的可靠性和所选择的系统的实际可行性,两者均是在考虑到对所有所识别的菌株进行测试。1.土壤细菌的多样性和接种的效力表明基于菌株分化的T-RFLP被成功地付诸实践,下一步骤是映射目标土壤类型的微生物群。我们的目的是比较通过T-RFLP指纹图谱控制的微生物种群和接种的土壤。我们的目的是监测接种菌株的相对丰度的增加,并在土壤中的微生物接种后在给定的时间的任何其他变化。3.菌株样本和DNA分离从所研究的农业用地的土壤样本被冷冻存放置于-20C直到进一步分析.样本,他们的识别码和数据在表29中有显示.没有接种的土壤样本被标为'W0',作为控制样本.派生样本分别被标为W1-W2-W3-W4-W5,如表29所示,接种剂的不同组合是用大写字母和数字进行编码,,DNA基因组从共26个样品中分离。表29.:从Zimány(Z)从控制和从接种后的玉米甜菜田里所取土壤样本的识别和特征。表30:除了正面控制Bactofil和BactofilH,不同应力耐受土壤接种菌株组合的识别DNA遗传基因通过使用UltraCleanTM土壤DNA分离盒系统(MoBio),在分层的地方,使用了冷冻样本中的0.5g。纯化的基因组DNA样品在40微升缓冲液洗脱。DNA分离物的成功分离和它的数量是在琼脂凝胶(1%)中电离子透入法来确认的。电泳即电离子投入是在100V在1×TBE缓冲液中实施20分钟(LambdaDNA/EcoRI+HindIIIMarker-3,Fermentas,Vilnius,Lithuania[125-21226bprange]),2微升分子量标准作为参考。3.T-RFLP分析T-RFLP法(terminalrestrictionfragmentlengthpolymorphism末端限制性片段长度多态性)是基于限制性内切酶水解PCR产物的分离,根据其长度.在PCR中,模板的扩增是用特殊的引物完成,荧光灯以导致荧光5'末端标记的PCR产物。在PCR产物中限制酶切割位点的数量和位置是不同的。水解用限制性内切酶导致了末端标记片段的不同长度(Liu等,1997).通过高效毛细管凝胶电泳分离水解的扩增,能够在荧光终端检测。基于T-射频长度,最高点提供系统发育参考,曲线下的面积为评估相对量的基础。DNA样本从所研究的菌株培养物中分离,每种菌株小亚单位核糖体RNA基因的碱基序列(16SrDNA)被认定.鉴于获得的核苷酸序列,可用的通用真菌引物的确认位点,限制性内切酶的切割位点,限制性片段长度,由硅片方法理论上确定。表31.:用不同的引物酶组合获得的TRF应力耐受菌株的长度荧光末端片段的电泳分离(CGE:毛细管凝胶电泳)是通过使用ABIPRISM310GeneticAnalyzer(AppliedBiosystems,FosterCity,CA,USA)来实施的.调整后的参数如下:8秒注射,在60℃和15kV条件下,30分钟POP-4TM聚合物的运行时间(性能优化聚合物4,AppliedBiosystems)每个样品发起了至少3个平行运行。按甲酰胺和TA-MRA500标准,样品被添加。所制备的样品放置于98℃也置于冰上变性。软件GeneMappers(AppliedBiosystems,version3.7)被用于分析T-RFLP色谱图.分离峰的片段长度的精确测定是基于所述TAMRA500长度标准,用不同的荧光标记。作为样本在相同的电泳力之中长度标准的片段补偿可能的注射差异。标准的片段均匀地分布在给定的尺寸范围内,这使峰值得以精确的被测定。运行标准有助于评估电泳的质量,因为该软件不能在部分分离的情况下,正确地检测出长度标准。软件GeneMapper关联以下数据为标准峰值:i)测定时间(从时间和数据的角度),ii)峰值高度(按荧光强度单位给出)iii)曲线下面积(按荧光强度单位给出).结果评估统计是由T-REX(T-RFLPAnalysisExpedited)在线软件统计出的(Culmanetal.,2009).从获得的数据矩阵分级分类是按BrayCurtis指数法和UPGMA(平均无重配对法)由PAST软件进行(Hammeretal.,2001)4.在应力容忍中性土壤中DNAT-RFLP研究假单胞杆菌chlororaphis13/4B和9/4B和民串珠菌Leuconostocmesenteroides25/4K菌株取样方法:由螺旋土壤取样器,标记采样点,接种,从接种图表:在-20℃时接种,贮存事先采取的土壤样本进行比较。表32.:在中性土壤接种后,取样后7周里给出微生物的百分比,以下应力耐受菌株Ps.chlororaphis绿针假单细胞菌9/4B和13/4B以及民串珠菌Leuconostocmesenteroides25/4K呈现接种1-3周后菌株绿针假单细胞菌P.chlororaphis的DNA片段被探测到.绿针假单细胞菌P.chlororaphis的DNA片段的比例是相当大的,大约占整个微生物群的4%.接种7周后菌株L.mesenteroides也被探测到,占有整个微生物群的1-1.5%应力耐受菌株绿针假单细胞菌9/4B,13/4B和Leuconostoc25/4K在中性土壤中持续存在5.在酸性土壤中对应力耐受菌株DNAT-RFLP,绿针假单细胞菌chlororaphis13/4B和9/4B以及Leuconostocmesenteroides25/4K的研究图表4显示样品参数(Orczy42,Zimány):强酸:pH5.0,低磷酸盐区域,包含壤土,粘土壤土,中等腐殖质含量图表Figure5.显示采样方法:由螺旋土壤取样器,标记着采样点,采样的行和行间的空间,从接种和未接种的地块,土壤,根际和根。样品保存在-20℃。表33:基于DNAT-RFLP结果,在酸性(pH5.5)土壤中接种,采样6个月后,微生物百分比,以下应力耐受菌株呈现接种的酸性土壤中发现Ps.chlororaphis9/4和13/4的相对发生率比未接种的高.接种后1个月,成行和行间空间的相对比例是2.5%,接种后6个月,行间空间比例为3.5%.在未接种的土壤中L.mesenteroides没有出现和被探测到,但在接种1个月后,在行间空间按相对低的比例出现T-RFLP关于在接种的土壤中所探测到的菌株13/4B,9/4Band25/4K的峰值,显著地高于未接种的土壤T-RFLP跟踪法适用于在土壤中监测土壤菌株的持续存在,但是,某些天然和方法上的因素会影响到结果的可靠性。范例19.土壤接种菌株的发酵培养NA琼脂斜面制备如下:营养琼脂(Oxoid)是根据制造商的处方制备25分钟,在121℃灭菌之前补充0.5%酵母提取物0.5%葡萄糖和0.5%蔗糖。琼脂斜面接种具有下列菌株:绿针假单细胞菌K200913/4BNCAIM(P)B001370绿针假单细胞菌K20099/4-BNCAIM(P)B001371LeuconostocmesenteroidesK200925/4NCAIM(P)B001372巴西固氮螺菌AzospirillumbrasilenseNF11NCAIM(P)B001428巴西固氮螺菌Azospirillumbrasilense242/9NCAIM(P)B001403巴西固氮螺菌AzospirillumbrasilenseNF10NCAIM(P)B001427Azospirillumlargimobile,B41NCAIM(P)B001402巴西固氮螺菌AzospirillumbrasilenseNF7NCAIM(P)B001433伊拉克固氮螺菌AzospirillumirakenseNF6NCAIM(P)B001425乙酰短杆菌ExiguobacteriumacetylicumLU44NCAIM(P)B001423Paeni芽孢杆菌BacilluspeoriaeS284NCAIM(P)B001430AgreiapratensisS47NCAIM(P)B001431ArthrobactercrystallopoietesS153(P)NCAIMB001424PseudomonasfrederiksbergensisS33NCAIM(P)B001429PseudomonasjesseniiS125NCAIM(P)B001422芽孢杆菌BacillussimplexS28NCAIM(P)B001432巴西固氮螺菌AzospirillumbrasilenseNF7NCAIMKocuriaroseaS225NCAIM(P)B001426并在28℃环境下培养72-96小时.存放在4℃环境下,培养物3个月可见。用无菌生理盐水将细菌的悬浮液从琼脂斜面洗掉加入10二甲亚砜或20%甘油存放在-40℃的环境中–一年可见.起始培养物制备菌株从琼脂斜面转移到100mlNB灭菌培养基,按以下制备:营养琼脂(Oxoid)中加入0.5%酵母提取物,0.5%葡萄糖,0.5%蔗糖,并在121℃条件下灭菌25分钟前调节至pH7.0-7.5之前。该菌株在30℃环境中在250rpm震荡培养物中生长,24小时。它的成长是通过显微镜监测。在24小时内计算细胞数,培养物达到约1.0-2.0×109CFU/ml,除了以下培养物乙酰短杆菌ExiguobacteriumacetylicumLU44NCAIM(P)B001423Paeni芽孢杆菌BacilluspeoriaeS284NCAIM(P)B001430芽孢杆菌BacillussimplexS28NCAIM(P)B001432KocuriaroseaS225NCAIM(P)B001426Azospirillumlargimobile,B41NCAIM(P)B001402巴西固氮螺菌Azospirillumbrasilense242/9NCAIM(P)B001403巴西固氮螺菌AzospirillumbrasilenseNF7NCAIM(P)B001433它们的细胞数值为4.0–5.0x108CFU/ml.100l发酵的接种制备在3000ml锥形瓶中将30ml起始培养放在1000mlNB灭菌琼脂中接种,在营养琼脂中加入0.5酵母提取物,0.5%葡萄糖和0.5%蔗糖并在121℃灭菌前调节至pH6.7-7.0,制备25分钟。该菌株在28-30℃以250rpm震荡培养物中生长,24-48小时。增长是通过显微镜监测。在24小时培养细胞计数达到1.0-2.0×109CFU/毫升,除了以下培养物乙酰短杆菌ExiguobacteriumacetylicumLU44NCAIM(P)B001423Paeni芽孢杆菌BacilluspeoriaeS284NCAIM(P)B001430芽孢杆菌BacillussimplexS28NCAIM(P)B001432KocuriaroseaS225NCAIM(P)B001426Azospirillumlargimobile,B41NCAIM(P)B001402巴西固氮螺菌Azospirillumbrasilense242/9NCAIM(P)B001403巴西固氮螺菌AzospirillumbrasilenseNF7NCAIM(P)B001433它们的细胞数是4.0–5.0x108CFU/ml.在100μl体积主要发酵灭菌主要1号媒介在100l工作量搅拌生物反应器与1000ml的培养物接种SterilizedMain1mediuminworkingvolumestirredtankbioreactorsareinoculatedwiththecultures.主要1号媒介:玉米浆0.5%,糖蜜0.5%,葡萄糖0.5%,KH2PO40.5%,K2HPO40.1%,碳酸钙0.2%,硫酸镁0.02%,酵母提取物0.2%,异葡萄氨糖0.1%。在121℃灭菌之前调节PH值到7.2-7.5,在1.2ATM条件下制备25分钟。0.5%灭菌葡萄糖溶液(50%)灭菌后加入。空气流速被调节至300升/小时,叶轮的速度为300RPM(1体积/体积/米)。培养物在28-30℃生长24小时。最终PH值:6.5-7.5。血氧饱和度迅速降低,5-6小时后降低至50%,承接短滞后期,那么密集的细胞增殖开始。叶轮速度设定在250-300转,空气流速平均为5-6立方米/小时/100L(0.8-1体积/体积/米)。24小时后细胞数达到CFU/毫升,除了以下培养物乙酰短杆菌ExiguobacteriumacetylicumLU44NCAIM(P)B001423Paeni芽孢杆菌BacilluspeoriaeS284NCAIM(P)B001430芽孢杆菌BacillussimplexS28NCAIM(P)B001432KocuriaroseaS225NCAIM(P)B001426Azospirillumlargimobile,B41NCAIM(P)B001402巴西固氮螺菌Azospirillumbrasilense242/9NCAIM(P)B001403巴西固氮螺菌AzospirillumbrasilenseNF7NCAIM(P)B001433它们的细胞数为4.0–8.0x108CFU/ml..发酵开始时培养物的pH轻微地增加(pH6.2-7.0),15-20个小时后再增加(pH6.6-7.0).不需要缓冲。生成的最后样品冰冻储存留待以后进一步检测体积1000l主要发酵(Main2)用显微镜检查到100l的接种剂中有50L传递到1000lK3培养物媒介,在28-30℃条件下发酵.K3培养物媒介:玉米浆1.5%,糖蜜0.5%,葡萄糖0.5%,KH2PO40.1%,K2HPO40.1%,碳酸钙0.2%,(NH4)2SO40.1%,硫酸镁0.02%,痕量元素溶液1ml/100ml微量元素溶液:FeSO4x7H2O300mg,CoCl2x6H2O10mg,Na2MoO4x2H2O10mg,Na2SeO30.01mg,MnSo4x7H201mg,Na2B4O7x10H2O1mg,SnCl20.01mg,Bi(NO3)3x5H2O0.1mg,TiCl30.01mg,KI1mg,phosphotungsticacid1mg,蒸馏水1000ml.在121℃灭菌前PH值调节到7.2-7.5,1.2bar,25分钟.空气流速被调节至300升/小时,叶轮的速度为300RPM(1V/V/M)。培养物生长24小时。最终PH值:6.5-7.5。如前所述监测生长速率。血氧饱和度迅速降低,达到4-5个小时后,50%以下的短滞后期,那么密集的细胞增殖开始。搅拌速度为最小200rpm,更有效的aeriation系统需要比100升发酵罐的气流更少。平均空气流量为立方米/小时/千升(0.5V/V/M)。24小时后细胞计数达到CFU/毫升,除了以下培养物乙酰短杆菌ExiguobacteriumacetylicumLU44NCAIM(P)B001423Paeni芽孢杆菌BacilluspeoriaeS284NCAIM(P)B001430芽孢杆菌BacillussimplexS28NCAIM(P)B001432KocuriaroseaS225NCAIM(P)B001426Azospirillumlargimobile,B41NCAIM(P)B001402巴西固氮螺菌Azospirillumbrasilense242/9NCAIM(P)B001403巴西固氮螺菌AzospirillumbrasilenseNF7NCAIM(P)B001433它们的细胞数是4.0–8.0x108CFU/ml.为取得最佳生长率需要适当的饱和氧气Properoxygenstaurationisrequiredforoptimalgrowthrate(搅拌器转速rpm和无菌空气流通).培养物的pH变为6.8-7.5,不像100l发酵.生成的最后样品冰冻储存留待以后进一步检测范例No.20.用应力耐受土壤细菌菌株培养物模式接种的玉米作为植物测验作为潜在的接种剂,分离物在植物生物量产中的效果被用于研究温室中培育的玉米,植物分别用单独的菌株,分离物的混合培养物来接种。杂交玉米温室盆栽试验生物量产效果玉米种子进行表面消毒并在室温下在液体琼脂培养基发芽。三日龄幼苗用发酵培养(主发酵)接种菌株细胞数是2-3x107CFU.重复四次这种试验(3种植物/实验)来计算平均值.植物在花盆中,在砂中,具有受控温度,光线和湿度条件下生长。4周龄植物的地上部和根系的植物干质量可测量,用百分比给定对照(未接种)的植物。接种:表34:菌株培养模式组合4周龄植物的地上部和根系的植物干质量用单菌株和混合接种的效果在表35中归纳.表35.4周龄玉米用单菌株和混合接种的效果L.mesenteroides25/4(50xdilution)–接种方式1:中度改善根和茎的伸长,~丰富细胞外多糖的生产,~耐受高温,为arenosol区,碱性盐碱地区和沙漠土壤可选择性地接种。Ps.chlororaphis9/4–接种方式2:在确定能改进根伸长,~中度强化茎伸长,~由于溶磷,提高了对arenosol区域的供磷~耐受高温~在arenosol区,碱性盐碱地区和沙漠土壤可选接种Ps.chlororaphis13/4–接种类型3:-优异的根茎促生效果-在arenosol区,碱性盐碱地区和沙漠土壤可选接种双重组合:Ps.chlororaphis13/4+Ps.chlororaphis9/4-接种类型7.-优异的根茎促生效果-生产多糖和促进土壤团粒-~胞外多糖是PSchlororaphis的潜在碳源。-~溶磷-在arenosol区,碱性盐碱地区和沙漠土壤可选接种双重组合:L.mesenteroides25/4+Ps.chlororaphis9/4–接种类型8.-平衡的根茎促生效果-生成多糖和活性磷酸盐(大量供应磷酸盐)-多糖的微生物降解能增加土壤中的碳,它是可用于植物的,改善土壤中碳/氮比率-在arenosol区,碱性盐碱地区和沙漠土壤可选接种双重组合:L.mesenteroides25/4(50xdil.)+Ps.chlororaphis13/4–接种类型9.-在根部无促生效果,茎部中等促生效果-不适合接种三重组合:L.mesenteroides25/4+Ps.chlororaphis13/4+Ps.chlororaphis9/4(接种类型5.)-中等但平衡的根茎促生效果-多糖生产~-溶磷(增加磷的供给)~-多糖作为其它两种菌株的碳和能量源~-多糖的微生物降解增加土壤中的碳其可用于植物,土壤碳/氮比改善~arenosol,通风区,钠质及盐渍化土壤可选接种三重组合:L.mesenteroides25/4(50xdil.)+Ps.chlororaphis13/4+Ps.chlororaphis9/4(接种类型6.)-在根部无促生效果,茎部中等促生效果-不适合接种范例.21.:固氮菌株应力耐受固氮螺菌在盆栽玉米上的效果在玉米试验物上,对比固氮螺菌在生物量产的植物上的接种效果与市售固氮螺菌在温室盆栽上接种的效果根据给定的接种细胞计数,将培养物用磷酸钾缓冲盐水或无菌水稀释。玉米种子表面消毒,并在室温下在液体琼脂或滤纸发芽。2-3日龄的秧苗用结构疏松的沙质土壤种植在花盆(3株/盆)。土壤接种1毫升2-3×107CFU/ml的浓度土壤接种剂/测试厂。植物在受控温度,光照条件,和用自来水灌溉生长。每株执行四个平行接种。对比8周龄植物的根和枝条发芽率,与所述未接种对照进行比较。表36:在玉米测试植物中比较固氮螺菌菌株与市售固氮螺菌的接种效果菌株NF10的根促生效果远远超过了市售菌株菌株242/9andB41的根促生效果轻微地超过了positivecontrol.菌株NF6和NF11与Azospirillum具有同等的根促生效果.所有实验中茎芽的促生效果属中等,不明显。范例22.用于接种的土壤特别应力耐受土壤细菌组合以下菌株的培养物按表37所示比例混合为中性土壤:PseudomonasjesseniiS125NCAIM(P)B001422ArthrobactercrystallopoietesS153(P)NCAIMB001424KocuriaroseaS225NCAIM(P)B001426AzospirillumbrasilenseNF11NCAIM(P)B001428AzospirillumbrasilenseNF10NCAIM(P)B001427Azospirillumlargimobile,B41NCAIM(P)B001402Azospirillumbrasilense242/9NCAIM(P)B001403为酸性土壤:BacillussimplexS28NCAIM(P)B001432PseudomonasfrederiksbergensisS33NCAIM(P)B001429AgreiapratensisS47NCAIM(P)B001431AzospirillumbrasilenseNF11NCAIM(P)B001428ExiguobacteriumacetylicumLU44NCAIM(P)B001423Azospirillumlargimobile,B41NCAIM(P)B001402PaenibacilluspeoriaeS284NCAIM(P)B001430为碱性土壤:ExiguobacteriumacetylicumLU44NCAIM(P)B001423PseudomonasjesseniiS125NCAIM(P)B001422ArthrobactercrystallopoietesS153(P)NCAIMB001424PseudomonaschlororaphisK200913/4BNCAIM(P)B001370Azospirillumbrasilense242/9NCAIM(P)B001403Azospirillumlargimobile,B41NCAIM(P)B001402AzospirillumirakenseNF6NCAIM(P)B001425表37.:为酸性,中性和碱性土壤接种的SBSS菌株混合物(混合比率)范例.23:黑钙土和沙质棕色森林土中种植白芥,菌株对它的促生效果1.土壤pH-specific菌株组合–为酸性,中性,碱性土壤,如范例.22所描述–被施用.2.测试植物参数2.1.物种白芥(SinapisalbaL.)2.2.播种时间:2013.04.12.2.3.种子数量:白芥:60颗/盆2.4.接种时间:2013.04.12.2.5.收获时间:2013.05.13.3.2.土壤参数3.2.1.黑钙土pHKCl=6.93KA=43Humus=2.10%Ca,Mg,Ksalts:0,04m/m%CaCO3=6%Minerals:P2O5=544mg/kgK2O=203mg/kgMg=181mg/kgNa=97.7mg/kgN(nitriteandnitrate)=36mg/kgCu=2.48mg/kgZn=2.4mg/kgMn=74.8mg/kgSO4-S=16.1mg/kg3.2.2.棕色森林土(白沙)-(Vajszló)pHKCl=7.08humusz=0.87%KA=30Ca,Mg,Ksalts:<0.02%CaCO3=1,3%Minerals:P2O5=212mg/kgK2O=170mg/kgMg=44.8mg/kgNa=85.4mg/kgN(nitriteandnitrate)=19.4mg/kgCu=1.42mg/kgZn=0.838mg/kgMn=83.7mg/kgSO4-S=4.47mg/kg4.实验布局4.1.场地尺寸:160cm2/pot4.2.重复次数:4--------------------------------------------------------4.3.设计(示意图)4.4.菌株参数:表38.:用接种的黑钙土和沙质棕色森林土在盆中种植白芥接种温度:25,4℃相对湿度:65,3%--------------------------------------------------------------植物性药害︰在任何一种实验中都没有观察到5.监测的参数和方法、时间和物候期的采样/测量5.1.在温室间的温度和相对湿度——每周平均值(附录1)从计算机数据库收集到的数据5.2.萌发率(发芽种子数量/播种后第6天破土)(附录:2)算上所有单叶植物和单叶发芽以及双子叶植物样本5.3.平均株高(厘米)/盆(附录︰3.)在收获时测量的平均株高5.4.大量播种克/盆(附录:4.)植物生物量,除了收割时根部测量值6.对高活性强酸土(棕色森林土)的影响棕色森林土的中性土壤细菌孕育剂︰在应用的两种浓度试验中,孕育剂显著提高白芨的平均株高(P=0.01)两次孕育剂试验都显著地提高了白芥在棕色森林土中的发芽率(P=0.05)在低浓度时,孕育剂显著提高了春大麦在棕色森林土壤中发芽率(P=0.01)碱性土壤细菌孕育剂对泽泻醇的影响实验(棕色森林土)对棕色森林土使用1升/公顷浓度实验中,孕育剂(P=0.01)大大地提高了株高。2升/公顷实验中将株高提高了13%。与普通的白芨相比,孕育剂有显著(P=0.01)提高白芨发芽率。7.对黑钙土土壤的影响中性土壤孕育剂︰实验浓度为2升/公顷增加株高7%(图6)。相同浓度下白芨发芽率增加了12%。(图7)碱性土壤孕育剂︰实验中应用较高的浓度下,孕育剂增加了白芨(P=0.01)的平均株高,低浓度下株高增长了9%。白芨发芽率增加了7%。酸性土壤孕育剂︰在2升/公顷浓度下有显著(P=0.05)增加白芨平均株高以及增加8%的发芽率。示例24:在盐沼土壤盆栽中,土壤细菌剂对春大麦的促生长作用耐受性实验。1.在碱性土壤中,ph值特定应变组合,如示例22中所述。2.植物参数测试2.1.物种︰春大麦(大麦L.)'Maresi'2.2.播种时间︰2013.04.12。2.3.种子数量︰60种子/盆2.4.接种时间︰2013.04.122.5.收割时间︰2013.06.203.2.土壤参数3.2.1.钙盐沼土壤(琼格拉县,Kistelek)pHKCl=8,04KA=29Humus=1.65%钙、镁、钾盐:<0,02碳酸钙=12%矿物质︰P2O5=232mg/kgK2O=108mg/kgMg=240mg/kgNa=75.6mg/kgN(nitrite+nitrate)=28.8mg/kg4.4.接种参数︰表39︰在盐沼土壤中对春大麦试验盆栽的接种协议。5.监测参数、方法、时间和物候期的采样/测量5.5.蛋白质含量的测定N-总植物生物量依照每个实验进行测定。获得的结果用百分比计算出来,粗蛋白(f=6.25)。N测量值由植物保护和水土保持实验室(NFCSO)在韦伦采完成。6.5.嫩枝的蛋白质含量接种1升/公顷浓度有显著(P=0.05)增加春大麦的蛋白质含量。图8中显示效果的碱性土壤孕育剂大大地增加了春大麦蛋白质含量。实验剂量物候期方法灌溉升/公顷1.管控组---asrequired2.BactoFilA101.0升/公顷播种前喷洒,内翻200-4003.碱性土壤中使用细菌接种剂1.0升/公顷播种前喷洒,内翻200-4004.碱性土壤中使用细菌接种剂2.0升/公顷播种前喷洒,内翻200-400示例25︰小块地研究酸性土壤中的向日葵。1.2.孕育剂︰酸性土壤中,如示例22所描述,应用了土壤的ph值特定应变组合。2.植物参数测试2.1.物种︰向日葵(向日葵)'NKNeoma'2.2.播种时间︰2013.04.15。2.3.播种密度︰55,000植物/公顷2.4.播种深度︰5厘米2.5.以前作物︰玉米2.6.行和茎距离︰76x24厘米2.7.其他参数、均匀性、感染︰播种后干燥的天气减缓了植物的发展早期。五月份雨水改善了植物的长势。温暖的春天有利于于害虫的繁殖。病原体或虫害在研究过程中的没有造成问题。2.8.时间和收获的方法︰2013.09.113.行距,手工采摘修枝剪3.1.土壤类型:黑钙土3.2.土壤参数KA:30pHKCl:5,44.实验布局:4.1.绘图尺寸︰50平方米4.2.重复次数︰64.3.接种参数表40︰在酸性土壤上对小块地的向日葵的田间使用接种剂的浓度,时间和方法的研究。5.农业技术措施收割玉米后,按照以下步骤耕种︰2012.11.25.耙地2012.12.10.秋犁(22-25厘米)2013.03.26.平耕2013.04.08施肥2013.04.12.组合耕2013.04.15.播种6.植物保护措施2013.05.04.Pulsar40SL1,2l/公顷2013.06.26.松土除草机机械除草2013.07.05.太阳预警实验(AlertSolo+Tanos50DF)2013.08.06Air-One2升/公顷7.主要的物候期发生时间︰4叶期DC142013.05.09.R-1阶段DC512013.06.20.开花DC652013.06.27.花期结束DC692013.08.03.R-9DC892013.08.30.收割DC992013.09.11.8.研究的参数1.向日葵盘的平均重量(克)2.作物产量(吨/公顷)相比较管控组,接种浓度为1升/公顷,平均向日葵盘的重量增加了16.5%(图9)。第26示例︰略酸性/中性土壤中大豆小块地现场试验1.2.孕育剂︰酸性土壤中,如示例22所描述,应用了土壤的ph值特定应变组合,辅以大豆共生固氮菌慢生根瘤菌日本的孕育剂栽培。2.植物参数测试2.1.物种︰大豆(大豆)'Izidor'2.2.播种时间︰2013.05.08。2.3.以前作物︰玉米3.1.土壤类型︰黑钙土3.2.土壤参数KA:42pHKCl:6,6Humus:2,4m/m%4.实验布局4.1.绘图尺寸︰50平米4.2.重复次数︰64.3.接种参数︰在中性/微酸性土壤上对小块地的大豆的田间使用接种剂的浓度,时间和方法的研究。5.植物保护与农业技术措施︰植物保护措施:2013.05.09.Pledge50WP2013.05.09.spectrum720EC2013.06.18.Pulsar40SL1,2升/公顷2013.06.18.Refine50Sx6.研究参数︰豆荚数量中性土壤孕育剂浓度2升/公顷的实验结果是导致了作物产量达到了最高值(106.9%)。接种浓度在1升/公顷和大豆特定孕育剂大幅度提高了作物产量比(分别是103.5%、103.3%和102.6%)。表42︰中性/微酸性土壤上大豆作物的豆荚数量27号示例:小块地大豆对泽泻醇(拉曼型棕色森林土壤)试验1.2.孕育剂︰酸性土壤中,如示例22所描述,应用了土壤的ph值特定应变组合,辅以大豆共生固氮菌慢生根瘤菌日本的孕育剂栽培。2.植物参数测试2.1.物种︰大豆(大豆)'Izidor'2.2.播种时间︰2013.05.08。2.3.以前作物︰玉米3.1.土壤类型︰草甸黑钙土3.2.土壤参数KA:41pHKCl:4.37Humus︰1.32m/m%4.实验布局4.1.绘图尺寸︰50m24.2.重复次数︰64.3.接种参数︰表43︰在酸性土壤上对小块地的大豆的田间使用接种剂的浓度,时间和方法的研究。5.植物保护与农业技术措施︰植物保护措施︰2013.05.06.WingP2013.05.06.DualGold960EC1升/公顷剂量的中性土壤接种剂,结合大豆共生孕育剂(0.1升/公顷),实验结果是大豆作物产量达到了最高值。相较于2升/公顷剂量或仅大豆共生免役(分别为0.1和0.2升/公顷)。(图11)。示例28:使用土壤特定孕育剂酸性土壤棕色森林土大块地豌豆实验试验是在一片豌豆地里进行的,用于生产种子。整个试验区划分为一排排的试验田。在整个区域用同一种植物保护与施肥协议。如第22号示例中所述,土壤特定ph值应变组合的酸性土壤使用接种剂浓度为1升/公顷,除了不接受实验控制实验田之外。在苗床准备的同时进行了接种。栽培技术︰~上一季作物—秋小麦~秋犁时间︰2012.11.8。~圆耙︰2013.04.13。区域平均土壤ph值是6.4。该区域内的ph值变化区域在5.8-7.11之间,不同的区域具有强酸性(非生物胁迫)。腐殖酸含量为1.8%。化肥︰2013.04.14。~~TimacEPNPK34200kg/ha~钾肥64公斤/公顷~MAP50公斤/公顷苗床准备︰2013.04.15播种︰2013.04.16。品种︰Susan175公斤/公顷除草︰2013.04.18。利谷隆除草剂︰2升/公顷DualGold960EC:1.6升/公顷植物保护︰2013.05.30杀菌剂︰AmistarXTRA:0.8升/公顷杀虫剂︰KarateZeon5CS:0.2升/公顷叶面施肥和驱虫治疗︰2013.06.14。叶面肥︰FertileaderVital:1升/公顷杀虫剂:KarateZeon0.2升/公顷收割︰2013.07.22。表44.:接种对豌豆作物在不平衡ph值土壤中的产量影响(部分强酸性)在整个区域,整个生长期间,农作物显示出相等的成长率。没有发生相当大的经济损失。接种(BioFilAcid)区比普通区域作物产出率高出了12.8%。期间的降雨量和开花后的雨量对作物产量起决定性作用。在后来的生长期,以及开花期,次优的降雨量阻碍了种子发育和植株生长,开花的时间。值得注意的是,多年来每年作物产量年平均降水量为34000公斤/公顷,更好的天气里可以达到5-6000公斤/公顷。除掉干旱少雨因素外,土壤接种显著地提高了作物产量。示例29:棕色森林土的大豆的大块田试验,接种土壤特定中性土壤接种剂试验是在一片大豆地里进行的,用于生产种子。在整个区域内使用同一种植物保护与施肥协议。如第22号示例中所述,接种的中性土壤,土壤ph值特定应变组,辅以大豆共生固氮菌接种剂Bradyrhizobiumjaponicum(BJ)培养。除了对照,试验田接种与中性土壤孕育(1升/公顷)辅以Bradyrhizobiumjaponicum接种剂(0.1升/公顷)和两个市售接种剂——B10(1升/公顷)+BJ(0.1升/公顷)和PZ(10升/公顷),在苗床制备的同时进行了接种。栽培技术︰~上一季作物:秋小麦~秋犁时间︰2012.11.9。~盘耙︰2013.04.13。6.4。该区域内的ph值变化区域在5.8-7.11之间,不同的区域具有强酸性(非生物胁迫)。腐殖酸含量为1.8%。化肥︰2013.04.14.-15。TimacEPNPK34200kg/ha钾肥64公斤/公顷MAP50公斤/公顷硝酸铵基化肥︰300公斤/公顷苗床准备︰2013.05.06。-播种︰2013.05.06。-品种︰玛蒂娜-播种同时:RadistartTurbo10公斤/公顷除草︰2013.05.10。~利谷隆除草剂︰2升/公顷~DualGold960EC:1.6升/公顷叶面施肥和植物保护︰2013.06.14。~叶面肥︰FertileaderVital︰1升/公顷~杀虫剂︰KarateZeon0.2升/公顷~杀菌剂︰AmistarXTRA0.8升/公顷收割︰2013.10.26。表45︰接种对大块不平衡ph值实验田(部分强酸性)中大豆作物产量的影响。大豆田在整个植被期间是没有杂草的。害虫化学防治防止作物出现任何相当大的经济损失。早期发展的阶段,治疗的疗效已经比较明显了。基于收获前观察数据来看,中性孕育剂+BJ、B10+BJ和PZ试验田的豆荚/株数分别平均为20-24,12-15和8-10,而普通组的豆荚/植物株数是4-6。相较于普通的试验田,特定的土壤孕育剂与大豆共生组合试验将作物产量提高到最高值309%,相较于另外两组商业土壤接种剂作物,数据分别为139和197%。示例30:泽泻醇对大块地向日葵田间试验,特定棕色森林土酸性土壤孕育剂接种试验试验是在一片向日葵地里进行的,用于生产种子。在整个区域内使用同一种植物保护与施肥协议。整个试验区划分为一排排的试验田,如第22号示例中所述,土壤特定ph值应变组合的酸性土壤使用接种剂浓度为1升/公顷,除了不接受实验控制实验田之外。在苗床准备的同时进行了接种。区域平均土壤ph值是6.1。该区域内的ph值变化区域在4.8-6.7之间,不同的区域具有强酸性(非生物胁迫)。腐殖酸含量为1.5%。栽培技术︰~上一季作物:玉米~秋耕时间︰2012.11.12~盘耙︰2013.04.26施肥:2013.04.27.-Potash125kg/ha-MAP100kg/ha-硝酸铵基化肥100kg/ha苗床准备:2013.04.28.播种:NKFortini-第一雄性行:2013.04.29.除草:2013.04.30.-Racer2,6升/公顷-GardoprinPluszGold4升/公顷第二雄性行和雌性行:2013.05.04.同时进行播种:-TimacEPNPK38150kg/ha-RadistartTurbo15kg/ha除草:2013.06.15-Pulsar1升/公顷施肥:2013.06.18.-硝酸铵基化肥200kg/ha病虫害防治:2013.06.28.-杀菌剂:AmistarXTRA0.8升/公顷-杀虫剂:KarateZeon0.2升/公顷叶面施肥和杀菌剂:2013.07.14.-FertileaderVital1升/公顷-FertileaderGold1升/公顷-杀菌剂:AmistarXTRA0.8升/公顷Rouring:2013.07.20-2013.07.22.除苗:2013.08.05.干燥:2013.09.09.-敌草快Air2升/公顷收割:2013.09.22.表46:接种剂对不平衡ph值(部分强酸性)土壤的影响以及向日葵大块试验田产量的影响,由于有效的病虫害防治措施以及除草措施,整个试验田没有出现杂草以及大的损失。试验结果没有观察到明显的差异。从酸性土壤孕育剂试验田来看,最高产出率为9.1%和6.7%。示例31:泽泻醇对大块地玉米田间试验,特定(棕色森林土)酸中性土壤孕育剂接种试验试验是在甜玉米地里进行的。在整个区域内使用同一种植物保护与施肥协议。整个试验区划分为一排排的试验田,如第22号示例中所述,土壤特定ph值应变组合的酸性土壤使用接种剂浓度为1升/公顷,除了不接受实验控制实验田之外。在苗床准备的同时进行了接种。区域平均土壤ph值是6.1。该区域内的ph值变化区域在5.8-6.5之间,不同的区域具有强酸性(非生物胁迫)。腐殖酸含量为1.5%。栽培技术︰上一季作物︰甜菜秋耕时间︰2013.11.18-2013.11.19盘耙︰2013.04.24。施肥︰2013.05.03。钾125公斤/公顷硝酸铵基化肥250公斤/公顷苗床准备︰2013.05.04。播种︰2013.05.09。NKOktet72000种子/公顷在播种的同时︰-TimacEPNPK38150kg/ha-RadistartTurbó15kg/ha除草剂:2013.05.29.施肥:2013.06.16。硝酸铵基化肥200公斤/公顷行间种植︰2013.06.18。收割︰2013.11.09。表47:接种剂对整大块向日葵不平衡PH值(部分强酸性)试验田的影响整个实验田在整个生长期没有杂草。两个特定的土壤孕育剂-酸性及中性土壤ph值分别提高产出率12.3%和11.4%。试验证明在土壤遭受非生物胁迫(不均匀和部分非常低ph值)现场条件下,土壤特定孕育剂可以促进植物生长。商业上可用的孕育剂已经相当程度上增加了作物产量(7.1%)。收割时,实验组和普通组的水分含量并无多大差异。引用参考书:AnzaiY.,KimH.,ParkY.J.,WakabayashiH.和OyaizuH.(2000年)Int.J.Syst.Evol.Microbiol《微生物系统演化50年:1563-1589年》。《假单胞菌基于16SrRNA序列的系统发育加入》。《微生物系统演化50年:1563-1589年》比安科卡门和Defez罗伯托(2011年)。《土壤细菌支持和保护植物对非生物胁迫》、《非生物胁迫的植物-机制和适应》,教授阿伦·申克(主编),国际标准书号︰978-953-307-394-1,新技术研究所《假单胞菌分离的喜马拉雅植物根际的比SC等人本战略》。2013年12月12日;2:667伯里斯.R.H.1972《固氮的测定方法和技术》,24B:415-431。兰T.et人《通过自然选择和有前途的筛查盐耐受内生与根际细菌分离植物促生(PGPR)和生长势在碱性环境下番茄》微生物学研究卷Af波多黎各杂志7(44)页5082-5089,72013年11月,德贝赖纳,J.(1989年)《分离和鉴定的根相关固氮》。斯金纳etal(编)固氮与非豆科植物,页103-106,华香园出版社埃克伦,E.和达,E.(1971年)《设立介绍假单胞菌的泥炭种植的黄瓜植株国槐失踪》。植物和土壤,35:495-504。Fallik,E.,瑞格,S.和OkonY.(1994年)《形态和生理的植物根与螺》,p.77-85相关联。在Y.Okon(ed),螺/植物协会。CRC出版社,博卡拉。C.,弗朗什和埃尔默里克,C.(2009年)《固氮菌与豆科和非豆科植物相关联》。植物土壤,321:35-59。耶哈德松B.(2002)《生物替代农药》。《生物的趋势》。20:338-343。GlickBR(2004)《细菌活性碳酸钙脱氨酶与植物胁迫的缓解》。Adv李波微生物56:291-312。格里克BR郑ZCzarnyJ、段J(2007a)《促进植物生长的ACC脱氨酶含有土壤细菌》。EurJ植物阑尾119:329-339。格里克BR,彭罗斯DM和李J(1998年)《A模型为降低植物乙烯浓度的植物生长促进细菌》。J理论生物学与190:63-68。哈特曼,A.和齐默,W.(1994年)《生理的螺》。在Y.Okon(ed),螺/植物协会、页1540.CRC新闻、博卡拉。Kapulnik,保华,OkonY.和Henis,《根系形态的小麦由螺接种引起的Y.(1985年)变化》。《能做到J.微生物.》,31:881。Kavimandan、S.K.和《野牛、玉米产量和种子接种单胞菌对磷酸盐的吸收与交流(1971年)影响》。科尔40:439-440。Khammas,K.M.,阿热龙,E.,Grimont,P.A.D.和凯撒,(1989年)螺P.irakensesp。11月,《固例平衡与水稻根系和根际土壤的氮》。Res.微生物.,140:679——693。汗,M.R.,菲舍尔,美国,伊,D.,督汉,F.M.(2006)《生物控制的枯萎病苗枯病的小麦和大麦》。Phytopathol.,96:386-394。Kloepper,J.W.(1994年)《植物格罗斯促进细菌》,p.137166。在螺/植物协会Y.Okon(主编)。CRC出版社,博卡拉。Kutasi,J.等人(2009)《生源冷应激耐受l-3》,11-12Azospiril1um《固氮螺菌菌株有效土壤接种》。Acta微生lmmunol。金融56:61。Levenfors摩根、埃伯哈德T.H.、LevenforsJ.J.、耶哈德松B.和雪模具(Microdochiumnivale)在冬季谷物由铜绿假单胞菌brassicacearumHokebergM.(2008)生物控制。生物防治53:651-665。马JH、姚JL、科恩D和莫里斯B(1998)《乙烯抑制剂提高体外形成》从苹果拍摄文化。植物细胞众议员17:211-214。·马图、A.K.和净重,C.S.1991。《植物激素乙烯》。CRC出版社,佛罗里达州博卡拉体育337。K.,MichielsVanderleyden,J.和埃尔默里克、C.(1994年)《遗传学和分子生物学的螺》,p.41-56。在Y.Okon(ed),螺/植物协会。CRC出版社,博卡拉。OkonY.和Labandera-冈萨雷斯,螺C.A.(1994年)《农艺应用︰评价20年来全球领域接种》。土壤-1601年。生物生化。26:1591Okon,保华,阿尔布雷希特,S.L.伯里斯,R.H.1976。《生长和固氮的螺旋杆菌影响的因素》。J.霉菌.,127:1248-1254年。Okon,保华,阿尔布雷希特,S.L.伯里斯,R.H.1976。《生长和固氮的螺旋杆菌影响的因素》。J.霉菌.,127:12481254年。Y.,OkonItzigsohn,R.,Burdman,美国和Hampel,M.(1995年)《农学和螺/植物协会》,635-640页生态学研究进展。在吉洪诺维奇I.A.普罗沃罗夫、N.A.、罗曼诺夫、五.一,牛顿,W.E.(主编)《氮修复信息︰基本原理和应用》。Kluwer学术出版社,德雷赫特。B.oldal,Jevcsák,主持人安德烈斯·I.Kecskés,M.(2002年)Aképességszerepe《铜绿假单胞菌》antagonistahatásánakbiológiaivizsgálatában。Biokémia,357-63。彭罗斯DM(2000年)的《ACC脱氨酶在植物生长的促进作用》。博士学位论文,滑铁卢大学。彭罗斯DM、照应坝和格里克BR(2001)《测定-aminocycopropane-1-羧酸(ACC)来评估ACC脱氨酶含有细菌对油菜幼苗根系的影响》。《J.微生物能做到》47:77-80。彼得·新和伊万·肯尼迪《区域分布和pH敏感性的螺关联无线th小麦根在东部澳大利亚"微生物生态学卷17》,第3(5月-6月,1989年),299-309页。景,R.J.(1981)A《单乙炔减少土壤(固氮酶)细菌的分离介质》。加拿大学报微生物学,27:8-14。罗德里格斯,H.和弗拉加,R.(1999年)《磷酸溶解细菌以及它们在促进植物生长的作用》Biotechnol.Adv.17:319-339。坤都在美国,塞尔万库马G.Joshi体育,前须S.·古普塔A.D.和古普塔H.S.(2010)《促进生长的小麦幼苗的Exiguobacteriumacetylicum1P》(MTCC8707)从北阿坎德邦喜玛拉雅山抗寒细菌品系。工业J.微生物。50:50-56。史泰龙,L.I.和Stackebrandt,E.(1999年)描述的Skermanellaparooensis将军11月,螨。以容纳Conglomeromonaslargomobilis亚种parooensisConglomeromonaslargomobilis亚种largomobilis转移到螺属之后。Int。J.系统霉菌49:541.-544。孙YZ和格里克BR(2009年)《1-氨基环丙烷-1-羧酸(ACC)脱氨酶删除墓塔化的存在改变生理的内生植物生长促细菌》唐菖蒲phytofirmansPsJN.金宏微生物Lett296:131-136。SundaraRaoW.V.B.和SinhaM.K.(1962)《磷酸溶解在根际土壤中的微生物》。工业J.农业。33:272-278。绍博I.M(1992年)Az股份talajtanmikrobiológiaialapjai。p.303。匈牙利Kiadó陶G.C.、田S.J.、蔡M.Y.和谢国华(2008年)《磷和矿化能力的细菌分离土壤》。土壤圈18(4):515-523。Tarafdar和垃圾,A.(1987年)《磷酸酶活性在根际土壤及其对土壤有机磷的枯竭》,《化肥设备用无缝钢管土壤》3:199-204。Tarafdar和Claassen,N.(1988)《有机磷化合物作为高等植物通过磷酸生产的植物根系和微生物活性磷源》。《化肥设备用无缝钢管土壤》5:308-312。田北俊,T.M.,加斯金斯,H.M.和哈贝尔公司,D.H.(1979)《植物生长物质由螺固氮螺菌和其对生长的珍珠粟(美洲狼尾草属)的影响》。《应用环境微生物》,37:1016-1024年。WeidI.、阿尔维亚诺D.S.、桑托斯a.l.s.,苏亚雷斯R.M.A.、阿尔维亚诺C.S.SeldinL.(2003)《抗菌活性的芽孢peoriae对植物病原细菌和真菌的广谱应变》NRRLBD-62。J.应用微生物.,95:1143-1151年。温克尔曼G,BuschB,哈特曼A、KirchhofG、SüssmuthR,G.《生物︰荣格金属》。1999Sep;3:255-64。温克尔曼G,施米特孔茨K,雷尼足总杯。生物金属。1996Jan;1:78-83。温克尔曼G;施米特孔茨K;雷尼FA、金属︰在生物学、生物化学和医学[金属]ISSN金属离子的作用的国际杂志︰0966年-0844,1996Jan;第9(1),卷页78-83;出版者︰华香园出版社;PMID:8574095杨SF,和霍夫曼NE(1984)《乙烯生物合成和高等植物及其调控》。《统治者启植物产酸》35:155-189。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1