成骨细胞的制备方法及成骨细胞诱导剂与流程
本发明涉及一种成骨细胞的制备方法及成骨细胞诱导剂。进而,本发明涉及一种用于将体细胞诱导为成骨细胞的试剂盒。
背景技术:
在骨质疏松症所伴随的骨折、类风湿性关节炎所伴随的关节破坏、重度创伤或骨肿瘤切除所伴随的广范围骨缺损、重度牙周病所伴随的牙槽骨吸收等各种各样的疾病中,有骨的重塑不能充分地起作用、骨破坏进行或骨缺损残存的实例。特别是在高龄者中,骨折后的骨再生延迟而陷入障碍或长期卧床的实例也很多,成为医疗上、社会上的很大的问题。
成骨细胞为在骨的形成和重塑中起到核心作用的细胞。在骨质疏松症或类风湿性关节炎中,破骨细胞活化,从而骨密度及强度降低,但如果可以使成骨细胞数或功能增强,则可以成为有用的预防或治疗法。另外,一直在进行将自身骨髄细胞移植到骨缺损病变的治疗,认为由骨髄间充质干细胞分化成的成骨细胞促进骨再生。但是,现状是骨髄采取时对患者的侵袭大、另外得到的细胞数不充分的实例有很多。如果可以制备较多的源自患者的成骨细胞并自体移植到骨缺损部位,则有可能成为对上述疾病的有效的治疗法。
非专利文献1中,对人ES细胞进行Osterix的慢病毒(Lentivirus)载体导入+用成骨(Osteogenic)培养基进行成骨细胞的分化诱导,但这种利用基因导入进行的成骨细胞的诱导存在癌变的危险性。
报道有ES细胞或MC3T3-E1细胞、骨髄间质细胞等成骨细胞的前体细胞通过各种化合物而诱导向成骨细胞的分化、钙化、骨相关蛋白的产生。
非专利文献2、3中记载有使他汀化合物与作为成骨细胞的前体细胞的MC3T3-E1作用而分化诱导为成骨细胞。
非专利文献4中记载有使辛伐他汀与小鼠ES细胞作用而分化诱导为成骨细胞。
非专利文献5中记载有使羟固醇与小鼠骨髄间质细胞作用而分化诱导为成骨细胞。
非专利文献6中记载有使非那米尔(Phenamil)与小鼠骨髄间质细胞作用而诱导向成骨细胞的分化和钙化。
非专利文献7中记载有辛伐他汀和阿托伐他汀促进原代人成骨细胞及骨肉瘤细胞株(MG63)中的I型胶原及骨钙蛋白的产生。
非专利文献8中记载有辛伐他汀诱导人牙根膜干细胞向成骨细胞的分化。
非专利文献9中公开有各种他汀化合物使骨密度增大。
这些现有技术文献公开的均为将ES细胞、骨髄间质细胞、牙根膜细胞之类本来具有分化为成骨细胞的能力的细胞诱导为成骨细胞的技术、或者均为使作为成骨细胞的细胞的骨形成能力增强的技术。
现有技术文献
非专利文献
非专利文献1:Karner E et al.J Cell Physiol.2009.
非专利文献2:T.Maeda et al.Journal of Cellular Biochemistry 92:458-471(2004)
非专利文献3:T.Maeda et al.Biochem Biophys Res Commun 280:874-877(2001)
非专利文献4:Ling Juan Qiao et al.Mol.Cells 32,437-444(2011)
非专利文献5:Tara L.Aghaloo et al.Journal of Ortho paedic Research 2007,1488-1497
非专利文献6:Kye Won Park et al.Mol.Cell.Biol.vol.29,2009,p.3905-3914
非专利文献7:Silvia Ruiz-Gaspa et al.Journal of Cellular Biochemistry 101:1430-1438(2007)
非专利文献8:Bing-jiao Zhao et al.Fundamental&Clinical Pharmacology(2013),1-10
非专利文献9:B.Uzzan et al.Bone 40(2007)1581-1587
技术实现要素:
发明所要解决的课题
本发明的目的在于,提供一种不进行基因导入而将经分化的体细胞变换为成骨细胞的技术。
用于解决课题的技术方案
关于使用他汀化合物等低分子化合物将本来不具有成为成骨细胞的能力的正常体细胞重编程而制成成骨细胞,尚没有报道。即使他汀化合物等将具有分化为成骨细胞的能力的细胞诱导为成骨细胞、或者使已经为成骨细胞的细胞的骨形成能力增强是公知的,是否可以将本来没有成为成骨细胞的能力的体细胞进行重编程而成为成骨细胞也是另外的问题,本发明是不能从上述的非专利文献预料到的。即,具有向成骨细胞分化的能力的细胞分化为成骨细胞的机制、和将无关的细胞强制地命运转换为成骨细胞的机制是相同的这一点并无保证,因此,不尝试进行实验是无法获知相同的化合物是否可以进行两者的。实际上已知有例如将ES细胞分化诱导为心肌细胞的化合物,但没有使用该化合物将成纤维细胞转换为心肌细胞的报道(Minami I,et al.Cell Rep.2012Nov 29;2(5):1448-60.)。
本发明包含以下的成骨细胞的制备方法、成骨细胞诱导剂及试剂盒。
项1、一种制备成骨细胞的方法,其特征在于,将哺乳动物的经分化的体细胞,在培养基中在选自由下述(1)~(4)构成的组中的至少1种化合物的存在下进行培养,将所述体细胞变换为成骨细胞,
(1)他汀化合物、
(2)酪蛋白激酶1抑制剂、
(3)cAMP诱导剂、及
(4)组蛋白甲基转移酶抑制剂。
项2、根据项1所述的方法,其中,所述体细胞为成纤维细胞、牙龈细胞或脂肪细胞。
项3、根据项1或2所述的方法,其中,所述培养基为成骨细胞的诱导培养基。
项4、一种诱导剂,其用于将经分化的体细胞诱导为成骨细胞,其包含选自由下述(1)~(4)构成的组中的至少1种化合物,
(1)他汀化合物、
(2)酪蛋白激酶1抑制剂、
(3)cAMP诱导剂、及
(4)组蛋白甲基转移酶抑制剂。
项5、一种试剂盒,其用于将经分化的体细胞诱导为成骨细胞,其包含选自由下述(1)~(4)构成的组中的至少1种化合物、以及培养基,
(1)他汀化合物、
(2)酪蛋白激酶1抑制剂、
(3)cAMP诱导剂、及
(4)组蛋白甲基转移酶抑制剂。
项6、根据项5所述的试剂盒,其中,所述培养基为成骨细胞的诱导培养基。
发明效果
本发明能够通过低分子化合物的作用由经分化的体细胞在短期间内提供成骨细胞。该成骨细胞可以由移植的本人的体细胞容易地诱导,因此,在将成骨细胞自身或由其制作的骨组织进行移植的情况下,也不产生免疫学的排斥反应等问题。另外,能够不经由iPS细胞或ES细胞而直接由体细胞诱导成骨细胞,因此,能够避免癌变等起因于多能性干细胞的问题。另一方面,也可以预先制作而库(bank)化,用于从其中向患者的同种异体移植或异种移植。
附图说明
图1表示茜素红(Alizarin Red)S染色像。(28天)
图2表示茜素红S染色像。(28天)
图3表示茜素红S染色强度。
图4表示茜素红S染色像。(28天)
图5表示茜素红S染色强度。
图6表示茜素红S染色像及染色强度。
图7表示茜素红S染色像及染色强度。
图8表示通过实时RT-PCR获得的Runx2、骨钙蛋白(Osteocalcin,OC)及ALP的mRNA表达量。图中,分别示出添加FBs:成纤维细胞、OBs:成骨细胞、SS:辛伐他汀进行培养的细胞,添加SS+D:辛伐他汀和D4476进行培养的细胞。
图9表示DNA微阵列的结果。
图10表示茜素红S染色强度。(28天)
图11表示茜素红S染色像及强度。(28天)
图12表示茜素红S染色像及强度。(28天)
图13表示通过实时RT-PCR获得的ALP mRNA的表达量。(28天)
图14表示通过实时RT-PCR获得的ALP mRNA的表达量。(28天)
图15表示通过实时RT-PCR获得的ALP mRNA的表达量。(28天)
图16表示通过实时RT-PCR获得的骨钙蛋白(OC)的表达量。(28天)
图17表示通过实时RT-PCR获得的Runx2的表达量的测定结果。(28天)
图18表示通过实时RT-PCR获得的Osterix的表达量的测定结果。(28天)
图19表示茜素红S染色像及强度。(28天)
图20表示DNA微阵列的结果。图中,分别示出添加FBs:成纤维细胞、OBs:成骨细胞、SS:辛伐他汀进行培养的细胞,添加SS+D:辛伐他汀和D4476进行培养的细胞。
图21表示活体内骨形成(μCT图像)。(左图:成纤维细胞)制作骨缺损之后,将成纤维细胞进行了移植的大腿骨。箭头表示在制作人工骨缺损并进行了移植的部位残存骨缺损。(右图:SS+D)制作骨缺损之后,将添加辛伐他汀和D4476而培养的细胞进行了移植的大腿骨。黑箭头表示在制作人工骨缺损并进行了移植的部位制作再生骨并修复缺损。白箭头表示在骨、周围移植的部位制作再生骨。箭头表示在制作人工骨缺损并进行了移植的部位骨缺损残存。
图22表示活体内骨形成(HE染色及茜素红S染色)。FBs:制作骨缺损之后,将成纤维细胞进行了移植的大腿骨。SS+D:制作骨缺损之后,将添加辛伐他汀和D4476而培养的细胞进行了移植的大腿骨。三角印表示制作人工骨缺损并进行了移植的部位,骨缺损残存。箭头表示制作人工骨缺损并进行了移植的部位,制作再生骨并修复缺损。
图23表示茜素红S染色像。(人正常白色脂肪前体细胞、21天)
具体实施方式
本发明的特征在于,通过在经分化的体细胞的培养基中使选自由(1)他汀化合物、(2)酪蛋白激酶抑制剂、(3)cAMP诱导剂及(4)组蛋白甲基转移酶抑制剂构成的组中的至少1种低分子化合物共存,而由经分化的体细胞得到成骨细胞。
作为用本发明的方法直接重编程为成骨细胞的、经分化的体细胞,只要不含有成骨细胞,就没有特别限定,可举出例如:成纤维细胞、角质化细胞、口腔粘膜上皮细胞、气道粘膜上皮细胞、胃粘膜上皮细胞、肠道粘膜上皮细胞、血管内皮细胞、平滑肌细胞、脂肪细胞、牙龈细胞(牙龈成纤维细胞、牙龈上皮细胞)、白细胞、淋巴细胞、肌细胞、结膜上皮细胞、破骨细胞等,优选列举成纤维细胞、角质化细胞、口腔粘膜上皮细胞、牙龈细胞、白细胞、淋巴细胞、破骨细胞、脂肪细胞等。
可以在本发明的方法中进一步并用其它化合物而促进向成骨细胞的直接重编程。作为这种化合物,可举出:(i)促进iPS细胞诱导或细胞重编程的低分子化合物、(ii)诱导Oct4的化合物、(iii)甲基转移酶抑制剂、组蛋白脱甲基化酶抑制剂、组蛋白脱乙酰化酶抑制剂等表观遗传控制化合物。
作为他汀化合物,广泛包含HMG-CoA还原酶抑制剂,没有特别限定,可举出例如:辛伐他汀(simvastatin)、阿托伐他汀(atorvastatin)、洛伐他汀(lovastatin)、氟伐他汀(fluvastatin)、普伐他汀(pravastatin)、西立伐他汀(cerivastatin)、匹伐他汀(pitavastatin)、罗苏伐他汀(rosuvastatin)、二氢康帕汀(dihydrocompactin)、康帕汀(compactin)、柏伐他汀(bervastatin)、卡巴他汀(carbastatin)、克伐他汀(crilvastatin)、达伐他汀(dalvastatin)、格仑伐地汀(glenvastatin)、氟吲他汀(fluindostatin)、维洛他汀(velostatin)、美伐他汀(mevastatin)、立伐他汀(rivastatin)、西立伐它汀(cirivastatin)、CI-981等。今后开发的他汀化合物全部包含在本发明的他汀化合物中。
并不限制本发明,但认为他汀化合物特别介导Runx2基因的表达量增大等而促进向成骨细胞的直接重编程。另外,认为也有助于钙沉积的促进。
酪蛋白激酶抑制剂广泛包含对存在酪蛋白激酶1、酪蛋白激酶2等亚型的酪蛋白激酶的抑制剂。从诱导成骨细胞的效果高的观点出发,作为优选的方式,可举出酪蛋白激酶1抑制剂。
作为酪蛋白激酶1抑制剂,作为优选的实例,可举出:D4476、IC261、CK1-7、A3、SB-431542、DRB、HYMENIALDISINE、马台树脂醇、5-碘代杀结核菌素、Meridianin、SB-203580等化合物(包含特异性地抑制酪蛋白激酶1的化合物。)。
此外,也可举出法舒地尔、羟基法舒地尔、芬维A胺、PKZ-ζ肽伪底物、二甲基鞘氨醇、CVS-3989、AG1024、648450、K252a、C3转移酶、553502、LY333531、盐酸鲁伯斯塔、Go-6976、IWR-1-endo(IWR1e)、IWP-2等具有抑制酪蛋白激酶1的活性的化合物。
作为酪蛋白激酶2抑制剂,可例示CX-4945。
作为酪蛋白激酶1抑制剂,也可以使用其衍生物替代上述的化合物。衍生物可以不一定具有抑制酪蛋白激酶的活性。例如替代作为酪蛋白激酶1抑制剂的D4476(4-[4-(2,3-二氢-1,4-苯并二噁英-6-基)-5-(2-吡啶基)1H-咪唑-2-基]-苯甲酰胺;英语原文:4-[4-(2,3-dihydro-1,4-benzodioxin-6-yl)-5-(2-pyridinyl)1H-imidazol-2-yl]-benzamide),可以使用WO00/61576号中记载的下述式(I)表示的D4476的衍生物:
【化学式1】
[式中,R1为可以被选自由卤素、C1-6烷氧基(-O-C1-6烷基)、C1-6烷硫基(-S-C1-6烷基)、C1-6烷基、-O-(CH2)n-Ph、-S-(CH2)n-Ph、氰基、苯基(Ph)、及CO2R(在此,R为氢或C1-6烷基,n为0、1、2或3)构成的组中的1个或1个以上的取代基取代的萘基、蒽基、或苯基;或R1为与可以含有2个以下独立地选自N、O及S中的杂原子的5~7元的芳香环或非芳香环缩合的苯基;
R2为H、NH(CH2)n-Ph或NH-C1-6烷基(在此,n为0、1、2或3);
R3为CO2H、CONH2、CN、NO2、C1-6烷硫基、-SO2-C1-6烷基、C1-6烷氧基、SONH2、CONHOH、NH2、CHO、CH2OH、CH2NH2、或CO2R(在此,R为氢或C1-6烷基);
X1及X2中的至少一个为N或CR’,另一个为NR’或CHR’(在此,R’为氢、OH、C1-6烷基、或C3-7环烷基);或X1及X2中的至少一个为N或CR’时,另一个可以为S或O]。
作为C1-6烷基,可举出直链状或支链状的碳数1~6的烷基,具体而言,可举出:甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、正己基、异己基。
作为C3-7环烷基,可举出:碳数3~7的环丙基,具体而言,可举出环丙基、环丁基、环戊基、环己基、环庚基。
R1为与后述芳香环或非芳香环缩合的苯基的情况下,前述芳香环或非芳香环为可以含有独立地选自N、O及S中的至多2个杂原子的5~7元的芳香环或非芳香环,作为具体例,可举出:苯并[1,3]二氧环戊烯基(benzo[1,3]dioxolyl)、2,3-二氢苯并[1,4]二噁英基(2,3-dihydrobenzo[1,4]dioxynyl)、苯并噁唑基(benzoxazolyl)、苯并噻唑基(benzothiazolyl)、苯并[1,2,5]噁二唑基(benzo[1,2,5]oxadiazolyl)、苯并[1,2,5]噻二唑基(benzo[1,2,5]thiadiazolyl)、二氢苯并呋喃基(dihydrobenzofuranyl)。
作为这种D4476的衍生物,可例示下述的化合物:
4-[4-(4-氟苯基)-5-(2-吡啶基)-1-羟基-1H-咪唑-2-基]苯甲腈
(4-[4-(4-fluorophenyl)-5-(2-pyridyl)-1-hydroxy-1H-imidazol-2-yl]benzonitrile);
4-[4-(4-氟苯基)-5-(2-吡啶基)-1H-咪唑-2-基]苯甲腈
(4-[4-(4-fluorophenyl)-5-(2-pyridyl)-1H-imidazol-2-yl]benzonitrile);
4-[4-(4-氟苯基)-5-(2-吡啶基)-1H-咪唑-2-基]苯甲酸
(4-[4-(4-fluorophenyl)-5-(2-pyridyl)-1H-imidazol-2-yl]benzoic acid);
4-[4-(4-氟苯基)-5-(2-吡啶基)-1H-咪唑-2-基]苯甲酸甲酯
(4-[4-(4-fluorophenyl)-5-(2-pyridyl)-1H-imidazol-2-yl]methyl benzoate);
4-[4-(4-氟苯基)-5-(2-吡啶基)-1H-咪唑-2-基]苯甲酸乙酯
(4-[4-(4-fluorophenyl)-5-(2-pyridyl)-1H-imidazol-2-yl]ethyl benzoate);
4-(4-苯并[1,3]二氧环戊烯-5-基-1-羟基-5-吡啶-2-基-1H-咪唑-2-基)苯甲腈
(4-(4-benzo[1,3]dioxol-5-yl-1-hydroxy-5-pyridin-2-yl-1H-imidazol-2-yl)benzonitrile);
4-(4-苯并[1,3]二氧环戊烯-5-基-5-吡啶-2-基-1H-咪唑-2-基)苯甲腈
(4-(4-benzo[1,3]dioxol-5-yl-5-pyridin-2-yl-1H-imidazol-2-yl)benzonitrile);
4-(4-苯并[1,3]二氧环戊烯-5-基-5-吡啶-2-基-1H-咪唑-2-基)苯甲酸
(4-(4-benzo[1,3]dioxol-5-yl-5-pyridin-2-yl-1H-imidazol-2-yl)benzoicacid);
2-[4-苯并[1,3]二氧环戊烯-5-基-2-(4-硝基苯基)-1H-咪唑-5-基]吡啶
(2-[4-benzo[1,3]dioxol-5-yl-2-(4-nitrophenyl)-1H-imidazol-5-yl]pyridine);
3-(4-苯并[1,3]二氧环戊烯-5-基-5-吡啶-2-基-1H-咪唑-2-基)苯基胺
(3-(4-benzo[1,3]dioxol-5-yl-5-pyridin-2-yl-1H-imidazol-2-yl)phenylamine);
4-[4-(4-氟苯基)-2-(4-硝基苯基)-1H-咪唑-5-基]吡啶
(4-[4-(4-fluorophenyl)-2-(4-nitrophenyl)-1H-imidazol-5-yl]pyridine);
4-[4-(4-氟苯基)-5-吡啶-2-基-1H-咪唑-2-基)苯基胺
(4-[4-(4-fluorophenyl)-5-pyridin-2-yl-1H-imidazol-2-yl phenylamine);
4-(4-苯并[1,3]二氧环戊烯-5-基-5-吡啶-2-基-1H-咪唑-2-基)苯基]甲醇
(4-(4-benzo[1,3]dioxol-5-yl-5-pyridin-2-yl-1H-imidazol-2-yl)phenyl]methanol);
4-(4-苯并[1,3]二氧环戊烯-5-基-5-吡啶-2-基-1H-咪唑-2-基)苯甲酰胺
(4-(4-benzo[1,3]dioxol-5-yl-5-pyridin-2-yl-1H-imidazol-2-yl)benzamide);
4-[4-(2,3-二氢-苯并[1,4]二噁英-6-基)-5-吡啶-2-基-1H-咪唑-2-基]-苯甲腈
(4-[4-(2,3-dihydro-benzo[1,4]dioxin-6-yl)-5-pyridin-2-yl-1H-imidazol-2-yl]-benzonitrile);
4-[4-(2,3-二氢-苯并呋喃-5-基)-5-吡啶-2-基-1H-咪唑-2-基]苯甲酰胺
(4-[4-(2,3-dihydro-benzofuran-5-yl)-5-pyridin-2-yl-1H-imidazol-2-yl]benzamide);
3-[4-苯并[1,3]二氧环戊烯-5-基-5-吡啶-2-基-1H-咪唑-2-基)苯甲腈
(3-[4-benzo[1,3]dioxol-5-yl-5-pyridin-2-yl-1H-imidazol-2-yl)benzonitrile);
4-[4-(2,3-二氢-苯并呋喃-6-基)-5-吡啶-2-基-1H-咪唑-2-基]苯甲腈
(4-[4-(2,3-dihydro-benzofuran-6-yl)-5-pyridin-2-yl-1H-imidazol-2-yl]benzonitrile);
4-[4-(2,3-二氢-苯并呋喃-6-基)-5-吡啶-2-基-1H-咪唑-2-基]苯甲酰胺
(4-[4-(2,3-dihydro-benzofuran-6-yl)-5-pyridin-2-yl-1H-imidazol-2-yl]benzamide);
3-(4-苯并[1,3]二氧环戊烯-5-基-5-吡啶-2-基-1H-咪唑-2-基)苯甲酸
(3-(4-benzo[1,3]dioxol-5-yl-5-pyridin-2-yl-1H-imidazol-2-yl)benzoicacid);
4-[4-(4-甲氧基苯基)-5-(2-吡啶基)-1H-咪唑-2-基]苯甲腈
(4-[4-(4-methoxyphenyl)-5-(2-pyridyl)-1H-imidazol-2-yl]benzonitrile);
4-[4-(2,2-二氟-苯并[1,3]二氧环戊烯-5-基)-5-吡啶-2-基-1H-咪唑-2-基]苯甲酰胺
(4-[4-(2,2-difluoro-benzo[1,3]dioxol-5-yl)-5-pyridin-2-yl-1H-imidazol-2-yl]benzamide);
4-[4-(2,3-二氢-苯并[1,4]二噁英-6-基)-1-甲基-5-吡啶-2-基-1H-咪唑-2-基]苯甲酰胺
(4-[4-(2,3-dihydro-benzo[1,4]dioxin-6-yl)-1-methyl-5-pyridin-2-yl-1H-imidazol-2-yl]benzamide);
4-[5-(2,3-二氢-苯并[1,4]二噁英-6-基)-1-甲基-4-吡啶-2-基-1H-咪唑-2-基]苯甲酰胺
(4-[5-(2,3-dihydro-benzo[1,4]dioxin-6-yl)-1-methyl-4-pyridin-2-yl-1H-imidazol-2-yl]benzamide);
4-(5-苯并[1,3]二氧环戊烯-5-基-4-吡啶-2-基-噁唑-2-基)苯甲腈
(4-(5-benzo[1,3]dioxol-5-yl-4-pyridin-2-yl-oxazol-2-yl)benzonitrile);
4-(5-苯并[1,3]二氧环戊烯-5-基-4-吡啶-2-基-噁唑-2-基)苯甲酰胺
(4-(5-benzo[1,3]dioxol-5-yl-4-pyridin-2-yl-oxazol-2-yl)benzamide);以及
4-(4-苯并[1,3]二氧环戊烯-5-基-5-吡啶-2-基-1H-吡咯-2-基)苯甲酰胺
(4-(4-benzo[1,3]dioxol-5-yl-5-pyridin-2-yl-1H-pyrrol-2-yl)benzamide)。
并不限制本发明,但认为酪蛋白激酶1抑制剂特别介导ALP(碱性磷酸酶)的表达量增大而促进钙沉积的促进等向成骨细胞的直接重编程。
作为cAMP诱导剂(也可以换句话说为腺苷酸环化酶激活剂。),广泛包含通过腺苷酸环化酶的活化作用使细胞内的cAMP(环状AMP)水平上升的化合物,可举出例如毛喉素(FRK)、异丙肾上腺素等。
并不限制本发明,但认为cAMP诱导剂特别介导Runx2基因的表达量增大等而促进向成骨细胞的直接重编程。另外,认为也有助于钙沉积的促进。
作为组蛋白甲基转移酶抑制剂,可举出DZNep(3-deazaneplanocin A)、BIX-01294等。
并不限制本发明,但认为cAMP诱导剂特别介导钙沉积的促进等而促进向成骨细胞的直接重编程。
作为培养基中的他汀化合物的浓度,只要可以诱导成骨细胞,就没有特别限定,为例如100pM~10μM左右、优选500pM~5μM左右、更优选1nM~1μM左右、进一步优选10-100nM左右。
作为培养基中的酪蛋白激酶1抑制剂的浓度,只要可以诱导成骨细胞,就没有特别限定,为例如0.01~100μM左右、优选0.1~50μM左右、更优选1~10μM左右。
作为培养基中的cAMP诱导剂的浓度,只要可以诱导成骨细胞,就没有特别限定,为例如0.01~100μM左右、优选0.1~50μM左右、更优选1~10μM左右。
作为培养基中的组蛋白甲基转移酶抑制剂的浓度,只要可以诱导成骨细胞,就没有特别限定,为例如100pM~50μM左右、优选1nM~10μM左右、更优选5nM~1μM左右、进一步优选10~100nM左右。
在上述培养基中共存的低分子化合物可以单独使用1种,也可以组合使用2种以上。组合使用2种以上时,其组合没有特别限定。从可以诱导成骨细胞的效果高的观点出发,作为优选的组合,可例示他汀化合物和酪蛋白激酶1抑制剂的组合。当然,也可以在他汀化合物和酪蛋白激酶1抑制剂的组合中进一步组合cAMP诱导剂和/或组蛋白甲基转移酶抑制剂。
组合使用2种以上的低分子化合物时,可以在培养期间中使2种以上同时共存,也可以在培养期间中的每阶段使用不同的低分子化合物(可多种)。另外,也可以将添加1种以上的低分子化合物并进行培养的细胞和添加另外的1种以上的低分子化合物并进行培养的细胞进行混合。
作为用于诱导成骨细胞的培养基,没有特别限定,优选诱导培养基。作为诱导培养基,可例示将抗坏血酸;β-甘油磷酸;选自由地塞米松及氢化可的松等糖皮质激素构成的组中的至少1种;血清成分(Fetal Bovine Serum(FBS)、Human serum(HS)等);链霉素等抗生素等添加于普通的液体培养基(DMEM(Dulbecco's Modified Eagle's Medium)、EMEM(Eagle's minimal essential medium)等。)而成的培养基。更具体而言,可举出例如在DMEM等普通培养基中加入50μg/ml抗坏血酸、10mMβ-甘油磷酸、100nM地塞米松(均为最终浓度)、10%FBS或5%HS、进一步根据需要的1%抗生素、1%NEAA(Non-Essential Amino Acid)而成的培养基。
培养温度为37℃左右,培养期间为1~6周左右、优选2~5周左右、更优选3~4周左右。
另外,可以在培养基中使用DMSO等溶剂。
本发明的试剂盒包含成骨细胞的培养基和他汀化合物,进一步根据需要包含酪蛋白激酶抑制剂、组蛋白甲基转移酶抑制剂等。
根据本发明,可以制备前成骨细胞、未成熟成骨细胞、成熟成骨细胞、骨细胞等。在本说明书中,为了简单起见,将它们全部称为成骨细胞。
作为成为使用通过本发明得到的成骨细胞(移植材料)进行治疗的对象的疾病,可举出:骨肿瘤、创伤或骨髄炎等所伴随的骨缺损、另外骨肿瘤等的刮除术之后的骨缺损、骨折、骨质疏松症、牙周病、牙槽骨吸收、类风湿性关节炎、突发性股骨头坏死、变形性关节病、腰椎变形性椎关节强硬、椎管狭窄症、椎间盘突出、脊椎滑脱、崩裂性脊柱滑脱、脊椎侧凸、脊髄型颈椎病、后纵韧带骨化症、脊髄损伤、变形性髋关节病、变形性膝关节病、股骨头滑脱症、骨软化症、下颌重塑术等因复杂骨折而被破坏的骨折部位的重塑术、手术后的骨的修复(心脏手术后的胸骨的修复等)、人工踝关节手术所伴随的缺损部位的修复、骨髄炎、骨坏死等。另外,如果移植成骨细胞,则有可能与骨移植、人工骨移植、人工关节或植入物并用而提高治疗效果。另外,通过使用三维支架等将成骨细胞进行培养而在体外制作各种形态的骨组织并移植该骨组织,也可以进行上述的疾病的治疗。除此之外,与成骨细胞的缺损、不足或功能降低有关的各种各样的疾病成为对象。
在本说明书中,只要没有特别明示,术语“治疗”指的是在患者患有特定的疾病或障碍期间进行的处置,意指由此缓解了疾病或障碍的严重性、或一种或多种症状减轻,或者延迟或减缓疾病或障碍的发展。在本说明书中,“治疗”包括“预防”。
本发明中得到的成骨细胞另外不限于疾病的治疗,也可以以美容目的使用。例如,通过将成骨细胞或由成骨细胞形成的骨组织移植到由事故或手术等导致的缺损的部位,细胞可以产生骨基质以修复缺损部位,使其丰满而变得不明显。此时,在本说明书中,为了方便起见,针对人的处置也称为治疗,可用术语“健康人”或“人”来替代术语“患者”,可用术语“美容”来替代术语“疾病”。
本发明不仅可用于人类疾病的治疗,也可用于包括犬、猫等宠物或牛、马、猪、羊、鸡等家畜的哺乳动物的疾病的治疗。该情况下,可用术语“患畜”或“哺乳动物”替代术语“患者”。
移植材料是指为了骨组织的修复、重塑而导入于活体内的、含有成骨细胞的材料。移植材料包括在体外部分或完全再生骨组织并被移植到同一或其它个体的材料。本发明中得到的成骨细胞可以用于移植材料的制作。成骨细胞自身也成为移植材料。因此,也可以将成骨细胞作为细胞制剂移植至患者,可以与由羟磷灰石或活体吸收性陶瓷等人工材料构成的基材(支架)一起移植,或者与支架同时培养后进行移植。在此类情况下,支架可以根据移植目的制作各种三维的形状。
体细胞只要来源于哺乳动物即可。在将成骨细胞移植至活体时,使用源自被移植的受试体的体细胞(自体细胞)降低感染或排斥反应等危险,因此优选。但是,对突发性骨折等移植等目的的情况下,可以将由其它人体或其它动物的体细胞预先准备的成骨细胞用于移植,来代替由自体细胞准备的成骨细胞。或者可以由预先准备的其它人体或其它动物的体细胞制作成骨细胞,并将其用于移植。即,可以预先制作成骨细胞库或成骨细胞前体细胞库,供于移植目的。这种情况下,为了降低排斥反应等危险,可以预先进行MHC分型。另外,可以预先确认成骨细胞的特性或致肿瘤性等。
在本说明书中,作为哺乳动物,可举出:小鼠、大鼠、仓鼠、人、犬、猫、猴子、兔子、牛、马、猪等,特别列举人。
本发明还可以用于使用成骨细胞的各种研究或技术开发等。例如对骨的生成和老化、形态形成、重塑的机制、针对这些因素的力学应力、营养、免疫、神经、激素的影响的分析等基楚研究是有用的。另外,对于锶90等放射性物质的内部照射对骨的影响的分析和从骨中除去锶90的技术的开发等也是有用的。
如果使用本发明,则可以由具有各种各样的疾病或遗传背景的人或动物简便、迅速且廉价地建立成骨细胞,因此,可以通过生物化学、分子生物学、免疫学等方法来分析与疾病或遗传的背景相关的成骨细胞的异常,由此可以有益于疾病的发病机制的阐明等研究或诊断法的开发。另外,如果使用这种成骨细胞进行药剂的开发、药剂的毒性试验等,则可以有益于对各种疾病的新型治疗法的开发。
可以通过ALP(碱性磷酸酶)、骨钙蛋白(Osteocalcin、OC)、骨桥蛋白(Osteopontin)、Runx2的mRNA的利用实时PCR的测定、利用茜素红S的染色(矿物化的骨基质的产生)等来确认成骨细胞的获得。
Runx2为骨形成中必须的转录因子。Runx2在活体内的从间充质干细胞向成骨细胞的分化中起到必不可少的作用。向间充质干细胞的Runx2的强制表达使OC(骨钙蛋白)、BSP(Bone sialo-protein,骨唾液酸蛋白)、ALP(碱性磷酸酶)、COL1A1等成骨细胞特异性基因增加。Runx2KO小鼠由于成熟成骨细胞的丧失,因此完全不显示膜性骨化以及软骨内骨化。但是,该源自小鼠的间充质干细胞具有向脂肪细胞和软骨细胞的诱导能力。
ALP(碱性磷酸酶)为成骨细胞的早期至中期的分化标记物。在成骨细胞的膜表面和从成骨细胞分泌的基质小泡中较多地含有,参与钙化基质产生的起始。
认为骨钙蛋白(Osteocalcin、OC)在成骨细胞中特异性地表达,有助于骨形成的促进。
利用茜素红S的染色或冯库萨染色可以检测作为骨形成的重要的要素之一的、矿物化的骨基质的产生、即钙的沉积。
实施例
下面,示出实施例,但本发明并不仅限于该实施例。
实施例1
1-1、茜素红S染色(图1)
将人正常皮肤成纤维细胞株HDFs以5×104细胞/孔的浓度在35mm培养盘中进行培养,在添加有100nM的辛伐他汀(SS)、或100nM的辛伐他汀(SS)和1μM的DZnep的诱导培养基中,在标准条件下进行培养。诱导培养基的组成为50μg/ml抗坏血酸、10mMβ-甘油磷酸、100nM地塞米松(均为最终浓度)、10%FBS、1%抗生素、1%NEAA、α-MEM。标准条件为37℃、5%CO2、95%增湿空气。约4天进行1次培养基更换,培养28天。从培养盘中吸引除去培养液,用蒸馏水进行2次清洗,用10%甲醛固定。用灭菌蒸馏水清洗之后,加入茜素红S染色液,在室温下静置。20分钟。用灭菌蒸馏水清洗之后,用肉眼及显微镜观察。将结果示于图1。红色的染色表示钙化骨基质。可知:通过添加SS或SS和DZnep,成纤维细胞转换为大量地产生钙化骨基质的成骨细胞。
1-2、茜素红S染色(图2-3)
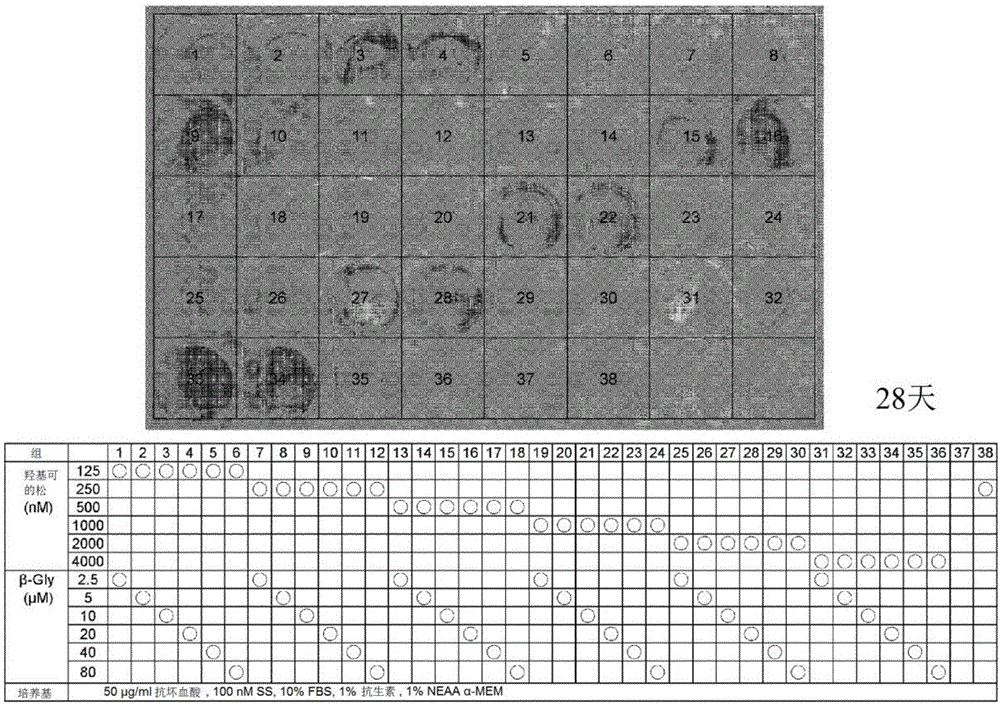
将人正常皮肤成纤维细胞株HDFs在24孔板中进行培养,在添加有100nM的辛伐他汀(SS)和各种浓度的羟基可的松及β-磷酸甘油的诱导培养基中,在标准条件下进行培养(表中,〇表示添加有各浓度的化合物)。约4天进行1次培养基更换,培养28天。从板中吸引除去培养液,用蒸馏水进行2次清洗,用10%甲醛固定。用灭菌蒸馏水清洗之后,加入茜素红S染色液,在室温下静置。20分钟后,回收染色反应液,其后用灭菌蒸馏水进行清洗,用肉眼及显微镜进行观察。将结果示于图2。另外,使用酶标仪测定从各孔中回收的染色反应液的吸光度(550nm)。将结果示于图3。可知:100nM的辛伐他汀(SS)在羟基可的松和β-甘油磷酸的存在下将成纤维细胞转换为成骨细胞,此时羟基可的松优选为125~4000nM的浓度,β-甘油磷酸优选为10~20μM的浓度。
1-3、茜素红S染色(图4-5)
将人正常皮肤成纤维细胞株HDFs在24孔板中进行培养,在添加有100nM的辛伐他汀(SS)和各种浓度的地塞米松(Dex)及β-磷酸甘油的诱导培养基中,在标准条件下进行培养(表中,〇表示添加有各浓度的化合物)。约4天进行1次培养基更换,培养28天。从板中吸引除去培养液,用蒸馏水进行2次清洗,用10%甲醛固定。用灭菌蒸馏水清洗之后,加入茜素红S染色液,在室温下静置。20分钟后,回收染色反应液,其后用灭菌蒸馏水进行清洗,用肉眼及显微镜进行观察。将结果示于图4。另外,使用酶标仪测定从各孔中回收的染色反应液的吸光度(550nm)。将结果示于图5。可知:100nM的辛伐他汀(SS)在地塞米松和β-甘油磷酸的存在下将成纤维细胞诱导为成骨细胞,此时地塞米松优选为25~800nM的浓度,β-甘油磷酸优选为10~20μM的浓度。
1-4、茜素红S染色(图6)
将人正常皮肤成纤维细胞株HDFs在24孔板中进行培养,在添加有各种浓度的辛伐他汀(SS)的诱导培养基中,在标准条件下进行培养。约4天进行1次培养基更换,培养28天。从培养板中吸引除去培养液,用蒸馏水进行2次清洗,用10%甲醛固定。用灭菌蒸馏水清洗之后,加入茜素红S染色液,在室温下静置。20分钟后,回收染色反应液,其后用灭菌蒸馏水进行清洗,用肉眼及显微镜进行观察。另外。使用酶标仪测定回收的染色反应液的吸光度(550nm)。将结果示于图6。可知:辛伐他汀诱导成骨细胞的优选的浓度为10~100nM。
1-5、茜素红S染色(图7)
将人正常皮肤成纤维细胞株HDFs在24孔板中进行培养,在添加有各种浓度的辛伐他汀(SS)和D4476(酪蛋白激酶抑制剂)的诱导培养基中,在标准条件下进行培养。约4天进行1次培养基更换,培养28天。其后从培养板中吸引除去培养液,用蒸馏水进行2次清洗,用10%甲醛固定。用灭菌蒸馏水清洗之后,加入茜素红S染色液,在室温下静置。20分钟后回收染色反应液,其后用灭菌蒸馏水进行清洗,用肉眼及显微镜进行观察。另外,使用酶标仪测定回收的染色反应液的吸光度(550nm)。将结果示于图7。可知:在100nM的辛伐他汀中共存2~5μM的D4476时,向成骨细胞的诱导效率进一步提高。
1-6、实时RT-PCR(图8)
将人正常皮肤成纤维细胞株HDFs在12-孔板中进行培养,在添加有100nM的辛伐他汀(SS)和各种浓度的D4476(酪蛋白激酶抑制剂)的诱导培养基中,在标准条件下进行培养(括弧内的数字为μM)。约4天进行1次培养基更换,培养21天。从细胞中用ISOGEN II回收总RNA,使用Rever Tra Ace qPCR RT Master Mix制作cDNA。将实时PCR Master Mix、Taqman探针、特异引物及cDNA进行混合,使用AB7300实时PCR系统进行实时RT-PCR,将Runx2、骨钙蛋白(OC)、碱性磷酸酶(ALP)基因的mRNA进行定量。作为对照,从进行了未添加辛伐他汀的培养的成纤维细胞中采取RNA,进行同样的分析。另外,从人成骨细胞中采取RNA,进行同样的分析。将结果示于图8。纵轴为将对照的细胞的mRNA水平设为1时的各基因的mRNA的相对值。可知:利用100nM的辛伐他汀由成纤维细胞诱导的成骨细胞表达Runx2、骨钙蛋白(OC)、碱性磷酸酶(ALP),另外,2~5μM的D4476共存时,这些的表达同等或进一步提高。
1-7、DNA微阵列(图9)
将人正常皮肤成纤维细胞株HDFs在60mm培养盘中进行培养,在添加有100nM的辛伐他汀(SS)或100nM的辛伐他汀和2μM的D4476(SS+D4)的诱导培养基中,在标准条件下进行培养。约4天进行1次培养基更换,培养21天。从细胞中用ISOGEN II回收总RNA。从人成纤维细胞(HDFs)和人成骨细胞(OBs)中也同样地回收总RNA。使用affymetrix公司的DNA芯片在全基因组中分析各细胞的mRNA表达谱。将结果示于图9。可知:与成纤维细胞相比,SS、SS+D4均显示与成骨细胞类似的网罗的基因表达谱,与SS相比,SS+D4显示更与成骨细胞类似的网罗的基因表达谱。
实施例2
2-1、茜素红S染色(图10)
将人正常皮肤成纤维细胞株HDFs以5×103细胞/孔的浓度播种于24孔板中(day 0)。第二天,扔掉各孔的培养液,更换成500μl/孔的新的培养基。诱导培养基为在达尔伯克改良伊格尔培养基(DMEM)、50μg/ml抗坏血酸、10mMβ-甘油磷酸、100nM地塞米松中添加有10%胎牛血清(FBS)的培养基。另外加入记载的小分子化合物。其中,AS表示阿伐他汀,LS表示洛伐他汀,RS表示罗苏伐他汀,PiS表示匹伐他汀,SS表示辛伐他汀,PrS表示普伐他汀,FSK表示毛喉素。AS从LKT Laboratories(St Pau,USA)购入,LS从Cayman chemical(Ann Arbor,USA)购入,RS从Cayman chemical(Ann Arbor,USA)购入,PiS从Cayman chemical(Ann Arbor,USA)购入,SS从Sigma(St Louis,USA)购入,PrS从(Cayman chemical(Ann Arbor,USA)购入,FSK从Sigma(St Louis,USA)购入。3~4天更换培养液1次并进行培养。
将本实施例中使用的化合物示于下述。
【化学式2】
【化学式3】
在培养28天后,吸引各孔的培养液,用PBS(-)清洗后,用10%甲醛固定。用灭菌蒸馏水清洗3次之后,加入茜素红S染色液,在室温下孵育15分钟。从各孔中回收液体,移至96孔板,用吸光度计测定吸光度(OD550nm-650nm)。
将结果示于图10。可知:通过添加有AS、LS、RS、SS、PrS、FSK、D4476的培养,对成纤维细胞诱导钙化基质产生能力。
另外,通过添加有10nM PiS的培养,也可以观察到与其它他汀化合物同样的结果。
2-2、茜素红S染色(图11)
将人正常皮肤成纤维细胞株HDFs以5×103细胞/孔的浓度播种于24孔板(day 0)。第二天,扔掉各孔的培养液,更换成500μl/孔的新的培养基。诱导培养基为在达尔伯克改良伊格尔培养基(DMEM)、50μg/ml抗坏血酸、10mMβ-甘油磷酸、100nM地塞米松中添加有10%FBS的培养基。另外加入记载的小分子化合物。3~4天更换培养液1次并进行培养。
在培养28天后,吸引各孔的培养液,用PBS(-)清洗后,用10%甲醛固定。用灭菌蒸馏水清洗3次之后,加入茜素红S染色液,在室温下孵育15分钟。从各孔中回收液体,移至96孔板,用吸光度计测定吸光度(OD550nm-650nm)。另外,用灭菌蒸馏水清洗染色后的孔之后,进行照片拍摄。
将结果示于图11。红色的染色表示钙化骨基质。可知:通过添加有D4476的培养,对成纤维细胞诱导钙化基质产生能力。
2-3、茜素红S染色(图12)
将人正常皮肤成纤维细胞株HDFs以5×103细胞/孔的浓度播种于24孔板(day 0)。第二天,扔掉各孔的培养液,更换成500μl/孔的新的培养基。诱导培养基为在达尔伯克改良伊格尔培养基(DMEM)、50μg/ml抗坏血酸、10mMβ-甘油磷酸、100nM地塞米松中添加有5%人血清的培养基。另外加入记载的小分子化合物。3~4天更换培养液1次并进行培养。
在培养28天后,吸引各孔的培养液,用PBS(-)清洗后,用10%甲醛固定。用灭菌蒸馏水清洗3次之后,加入茜素红S染色液,在室温下孵育15分钟。从各孔中回收液体,移至96孔板,用吸光度计测定吸光度(OD550nm-650nm)。另外,用灭菌蒸馏水清洗染色后的孔之后,进行照片拍摄。
将结果示于图12。红色的染色表示钙化骨基质。可知:通过添加有D4476的培养,对成纤维细胞诱导更高的钙化基质产生能力。
2-4、实时RT-PCR(图13)
添加记载的化合物而进行与上述“2-1、”同样的培养。
在培养28天后,从各孔中除去培养液,用PBS(-)进行清洗。从细胞中用ISOGEN II回收总RNA,使用Rever Tra Ace qPCR RT Master Mix合成cDNA。加入实时PCR Master Mix和人碱性磷酸酶(ALP)基因特异性Taqman探针和引物,使用AB7300实时PCR系统进行实时RT-PCR。另外,从源自正常人骨的成骨细胞中也提取总RNA,同样地进行分析。
将结果示于图13,用将正常人成纤维细胞的值设为1的相对值表示。可知:通过添加有AS、LS、RS、SS、PrS、D4476的培养,诱导ALP基因的mRNA表达。
2-5、实时RT-PCR(图14)
添加记载的化合物而进行与上述“2-1、”同样的培养。
在培养28天后,用与实施例3同样的方法通过实时RT-PCR分析各孔的细胞的ALP基因的mRNA表达。另外,从源自正常人骨的成骨细胞中也提取总RNA,同样地进行分析。
将结果示于图14,用将正常人成纤维细胞的值设为1的相对值表示。可知:将SS、PrS与D4476一起加入时,与D4476单独相比,更强地诱导ALP表达。
2-6、实时RT-PCR(图15)
将人正常皮肤成纤维细胞株HDFs以5×103细胞/孔的浓度播种于24孔板(day 0)。第二天,扔掉各孔的培养液,更换成500μl/孔的新的培养基。诱导培养基为在达尔伯克改良伊格尔培养基(DMEM)、50μg/ml抗坏血酸、10mMβ-甘油磷酸、100nM地塞米松中添加有5%人血清的培养基。另外加入记载的小分子化合物。3~4天更换培养液1次并进行培养。
在培养28天后,用与上述“2-3、”同样的方法通过实时RT-PCR分析各孔的细胞的ALP基因的mRNA表达。另外,从源自正常人骨的成骨细胞中也提取总RNA,同样地进行分析。
将结果示于图15,用将正常人成纤维细胞的值设为1的相对值表示。可知:将SS、PrS与D4476一起加入时,与单独加入D4476的情况相比,更强地诱导ALP表达。
2-7、实时RT-PCR(图16)
添加记载的化合物而进行与上述“2-6、”同样的培养。
在培养28天后,从各孔中除去培养液,用PBS(-)进行清洗。从细胞中用ISOGEN II回收总RNA,使用Rever Tra Ace qPCR RT Master Mix合成cDNA。加入实时PCR Master Mix和人骨钙蛋白(OC)基因特异性Taqman探针和引物,使用AB7300实时PCR系统进行实时RT-PCR。
将结果示于图16。可知:加入RS、PrS的任一种并进行培养时,诱导骨钙蛋白基因的mRNA表达。
2-8、实时RT-PCR(图17)
添加记载的化合物而进行与上述“1、”同样的培养。
在培养28天后,从各孔中除去培养液,用PBS(-)进行清洗。从细胞中用ISOGEN II回收总RNA,使用Rever Tra Ace qPCR RT Master Mix合成cDNA。加入实时PCR Master Mix和人Runx2基因特异性Taqman探针和引物,使用AB7300实时PCR系统进行实时RT-PCR。
将结果示于图17。可知:通过添加AS、LS、RS、SS、PrS或FSK并进行培养,诱导Runx2基因的mRNA表达。
2-9、实时RT-PCR(图18)
添加记载的化合物而进行与上述“2-1、”同样的培养。
在培养28天后,从各孔中除去培养液,用PBS(-)进行清洗。从细胞中用ISOGEN II回收总RNA,使用Rever Tra Ace qPCR RT Master Mix合成cDNA。加入实时PCR Master Mix以及人Osterix基因特异性Taqman探针和引物,使用AB7300实时PCR系统进行实时RT-PCR。
将结果示于图18。可知:通过添加FSK并进行培养,诱导Osterix基因的mRNA表达。
2-10、茜素红S染色(图19)
添加记载的化合物而进行与实施例1同样的培养。DZnep从Cayman chemical(Ann Arbor,USA)购入而使用,CX-4945从Biovision(Zurich,Switzerland)购入而使用。
在培养28天后,通过与实施例2同样的方法进行茜素红S染色,进行吸光度(OD 550nm-650nm)的测定和照片拍摄。
将结果示于图19。可知:通过添加有D4476、FSK、或DZnep的培养,对成纤维细胞诱导钙化基质产生能力。CX-4945不产生影响。
2-11、DNA微阵列(图20)
将人正常皮肤成纤维细胞株HDFs在60mm培养盘中进行培养,在添加有100nM的辛伐他汀(SS)、或100nM的辛伐他汀和2μM的D4476(SS+D4)的诱导培养基中、在标准条件下进行培养。3~4天进行1次培养基更换,培养21天。
从细胞中用ISOGEN II回收总RNA。从人成纤维细胞(HDFs)和人成骨细胞(OBs)中也同样地回收总RNA。使用affymetrix公司的DNA芯片在全基因组中分析各细胞的mRNA表达谱。
将结果示于图20。可知:与成纤维细胞相比,添加SS而培养的细胞和添加SS+D4而培养的细胞均显示与成骨细胞类似的网罗的基因表达谱,后者与前者相比显示与成骨细胞类似性更高的网罗的基因表达谱。
2-12、活体内骨形成(图21)
动物实验获得京都府立医科大学的认可而进行。在8周龄雄性的NOD/SCID小鼠(Charles River)的腹腔内注射戊巴比妥而进行麻醉。在注水下使用牙科钻头在左大腿骨骨骼上制作直径约4mm的部分骨缺损。通过与实施例11同样的方法使在辛伐他汀和D4476存在下将HDFs培养了21天的细胞悬浮于50μL的培养基和50μL的基质胶(BD Bioscience,San Jose,CA)的1:1混合液中,在骨缺损部和其周边的骨表面以5×105个/小鼠的浓度进行移植。另外,也准备同样地制作骨缺损之后移植成纤维细胞的小鼠。在21天后使小鼠安乐死,切除大腿,用中性甲醛固定后,使用X射线CT装置(Scan Xmate-L090,Com Scan Techno,Yokohama,Japan)进行微计算机断层拍摄(μCT)。
图21中示出进行了三维构建的μCT图像。黑箭头:在制作人工骨缺损并进行了移植的部位制作再生骨并修复缺损。白箭头:在骨周围进行了移植的部位制作再生骨。箭头:在制作人工骨缺损并进行了移植的部位残存骨缺损。显示添加辛伐他汀(SS)+D4476(D)并进行了培养的细胞在活体内具有骨形成能力。
2-13、活体内骨形成(图22)
动物实验获得京都府立医科大学的认可而进行。与上述“2-12、”同样地进行了移植实验。另外,也准备移植有成纤维细胞的小鼠。在21天后使小鼠安乐死,与实施例11同样地切除大腿,用中性甲醛固定后,用SCEM(Leica Microsysten)复合物包埋骨组织,迅速冻结。切成6μm的切片后,将连续切片用苏木素-伊红(H&E)(左)及茜素红S(右)染色。
将结果示于图22。显示添加SS+D4476而培养的细胞在活体内具有骨形成能力。
2-14、由人正常白色脂肪前体细胞的诱导(图23)
将人正常白色脂肪前体细胞(HWPs)以5×104细胞/盘的浓度播种于35mm盘(day 0)。第二天,扔掉各孔的培养液,更换成2mL/孔的新的培养基(普通培养基、或加入有记载的小分子化合物的诱导培养基)。普通培养基为在达尔伯克改良伊格尔培养基(DMEM)中添加有10%FBS的培养基,诱导培养基为在DMEM中添加有50μg/mL抗坏血酸、10mMβ-甘油磷酸、100nM地塞米松及10%FBS的培养基。3~4天更换培养液1次并进行培养。
在培养21天后,吸引各孔的培养液,用PBS(-)清洗后,用10%甲醛固定。用灭菌蒸馏水清洗3次之后,加入茜素红S染色液,在室温下孵育15分钟。在用灭菌蒸馏水清洗染色后的孔之后进行照片拍摄。
将结果示于图23。红色的染色表示钙化骨基质。可知:通过添加D4476的培养,较强地诱导HWPs的钙化基质产生能力。
- 还没有人留言评论。精彩留言会获得点赞!