通过合成探针的纳米孔隙探测的靶序列检测的制作方法
相关申请的交叉引用本申请要求2014年9月26日提交的美国临时专利申请no.62/056,378的权益,其公开内容通过引用并入本文。本公开涉及使用纳米孔隙装置的靶序列检测的方法和组合物。
背景技术:
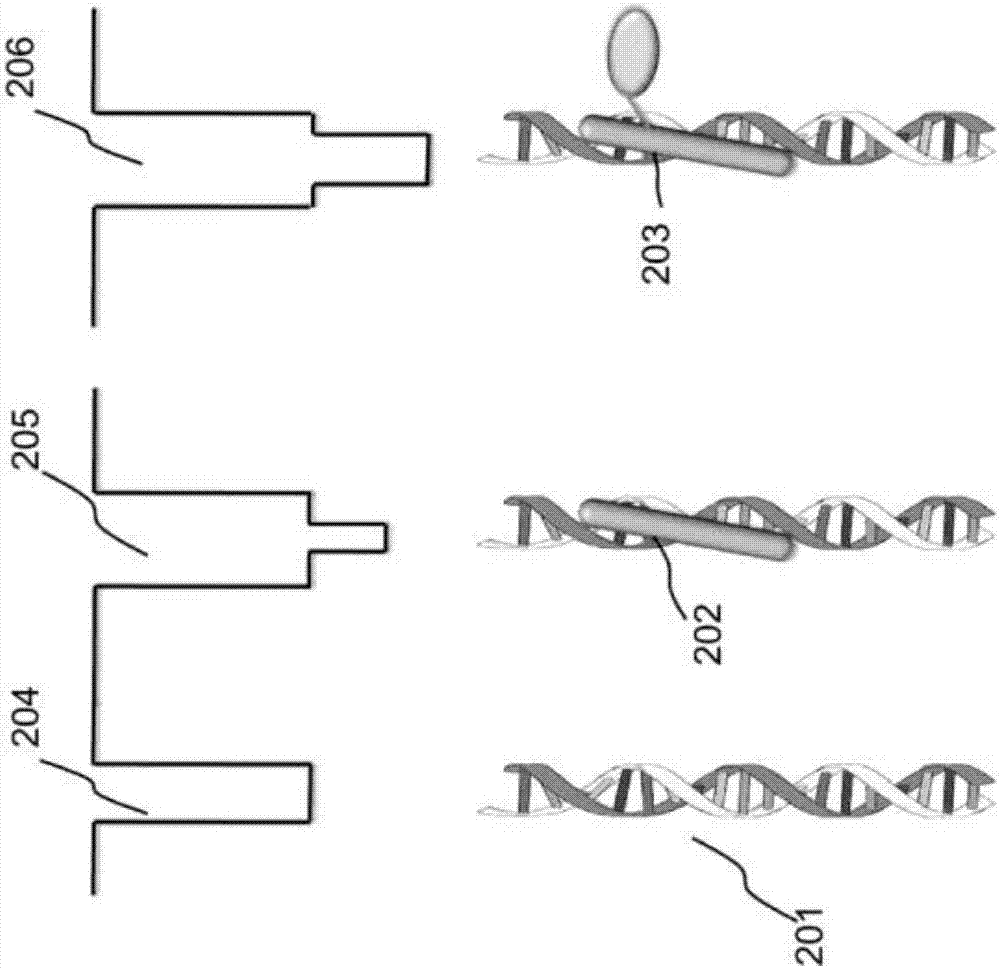
:核酸链内特定序列区域的检测、定位和拷贝数测定,本文中称为“靶序列检测”,具有生物医学科学和技术、医学、农业和法医学以及其它领域中的应用。基因及其修饰、序列、位置或数目的检测对于医学中分子诊断的发展是重要的。dna微阵列、pcr、southern印迹和fish(原位荧光杂交)是可用于进行或帮助靶序列检测的所有方法。这些方法是缓慢的和费力的,且具有有限的准确度和分辨率。较新的方法如实时pcr和下一代测序(ngs)技术具有提高的通量,但对于许多应用仍不具有足够的分辨率。固态纳米孔隙已证明通过施加跨孔隙的电压和测量在分子经过纳米孔隙时的电阻来检测分子。任何给定纳米孔隙装置的总体效力取决于其精确和可靠地测量电阻及区分经过的不同类型的分子的能力。文献中公开的实验证明了经过孔隙的dna和rna链及与其上的特定序列杂交的合成分子的检测。但是,还不能够使用它们来产生用于检测特定dna或rna序列上的探针的高通量和可靠的纳米孔隙装置。迄今已经开发的探针不足以用于可靠的序列检测。因此,所需要的是用于纳米孔隙中的检测的能够实现序列特异性的结合的探针组和探针复合体。技术实现要素:本文提供了检测样品中包含靶序列的多核苷酸的方法,该方法包括:在促进与包含所述靶序列的所述多核苷酸特异性结合的探针与所述靶序列结合以形成多核苷酸-探针复合体的条件下使所述样品与所述探针接触;将所述样品加载到纳米孔隙装置的第一腔室中,其中所述纳米孔隙装置包括至少一个纳米孔隙及至少所述第一腔室和第二腔室,其中所述第一和第二腔室通过所述至少一个纳米孔隙电连通和流体连通,且其中所述纳米孔隙装置还包括跨各个所述至少一个纳米孔隙的独立控制电压和与各个所述至少一个纳米孔隙关联的传感器,其中所述传感器配置为识别经过所述至少一个纳米孔隙的物体,且其中通过所述至少一个纳米孔隙移位的所述多核苷酸-探针复合体提供与所述多核苷酸-探针复合体相关的可检测信号;和通过观察所述可检测信号测定所述样品中所述多核苷酸-探针复合体的存在或不存在,从而检测包含所述靶序列的所述多核苷酸。在一个实施方式中,该方法还包括产生通过所述至少一个纳米孔隙的电压势,其中所述电压势在所述多核苷酸-探针复合体上产生力以将所述多核苷酸-探针复合体牵引通过所述至少一个纳米孔隙,导致所述多核苷酸-探针复合体移位通过所述至少一个纳米孔隙以产生所述可检测信号。在一些实施方式中,所述多核苷酸是dna或rna。在一个实施方式中,所述可检测信号是电信号。在一个实施方式中,所述可检测信号是光信号。在一个实施方式中,所述探针包括选自以下的分子:蛋白质、肽、核酸、talen、crispr、肽核酸或化学化合物。在一个实施方式中,所述探针包括选自以下的分子:脱氧核糖核酸(dna)、核糖核酸(rna)、肽核酸(pna)、dna/rna杂合体、多肽或任何化学衍生的聚合物。在一个实施方式中,所述探针包括与配置为利于在通过所述至少一个纳米孔隙移位的过程中检测结合于所述多核苷酸的探针的第二分子结合的pna分子。在进一步的实施方式中,所述第二分子是peg。在进一步的实施方式中,所述peg的分子量为至少1kda、2kda、3kda、4kda、5kda、6kda、7kda、8kda、9kda或10kda。在一个实施方式中,所述检测样品中包含靶序列的多核苷酸的方法还包括向所述样品施用疑似改变所述探针和所述靶序列之间的结合相互作用的条件。在进一步的实施方式中,所述条件选自:从所述样品移除所述探针、添加与所述探针竞争结合所述靶序列的试剂和改变初始ph、盐或温度条件。在一个实施方式中,所述多核苷酸包含配置为改变多核苷酸与探针的结合的化学修饰。在进一步的实施方式中,化学修饰选自生物素化、乙酰化、甲基化、小泛素样修饰蛋白化(summolation)、糖基化、磷酸化和氧化。在一个实施方式中,所述探针包含通过可切割键与所述探针偶联的化学修饰。在一个实施方式中,所述探针通过共价键、氢键、离子键、金属键、范德华力、疏水相互作用或平面堆叠相互作用与多核苷酸的靶序列相互作用。在一个实施方式中,所述检测样品中包含靶序列的多核苷酸的方法还包括使样品与能够结合探针或结合多核苷酸-探针复合体的一种或多种可检测标记接触。在一个实施方式中,所述多核苷酸包含至少两个靶序列。在一个实施方式中,所述纳米孔隙直径为约1nm-约100nm,长度为1nm-约100nm,且其中各腔室包括电极。在一个实施方式中,所述纳米孔隙装置包括配置为同时控制所述多核苷酸在两个纳米孔隙中的运动的至少两个纳米孔隙。在一个实施方式中,所述检测样品中包含靶序列的多核苷酸的方法还包括在通过所述可检测信号的多核苷酸-探针复合体初始检测后逆转所述独立控制电压,以使得所述多核苷酸通过纳米孔隙的移动在探针结合的部分经过纳米孔隙后被逆转,从而再次确定多核苷酸-探针复合体的存在或不存在。在一个实施方式中,所述纳米孔隙装置包括两个纳米孔隙,且其中所述多核苷酸同时位于所述两个纳米孔隙的两者内。在进一步的实施方式中,所述检测样品中包含靶序列的多核苷酸的方法包括调节所述两个纳米孔隙各自中的电压大小和/或方向以使得通过纳米孔隙产生相反的力来控制多核苷酸通过纳米孔隙移位的速率。本文还提供了检测样品中的多核苷酸或多核苷酸序列的方法,包括:使所述样品与第一探针和第二探针接触,其中所述第一探针在促进所述第一探针与所述多核苷酸的第一靶序列结合的条件下特异性地结合所述第一靶序列,其中所述第二探针在促进所述第二探针与所述多核苷酸的第二靶序列结合的条件下特异性地结合所述靶序列;在促进配置为在所述第一和第二探针彼此足够接近时与所述第一和第二探针同时结合的第三分子与所述第一探针和所述第二探针的结合的条件下使所述样品与所述第三分子接触,从而形成包含所述多核苷酸、所述第一探针、所述第二探针和所述第三分子的融合复合体;将所述样品加载到纳米孔隙装置的第一腔室中,其中所述纳米孔隙装置包括至少一个纳米孔隙及至少所述第一腔室和第二腔室,其中所述第一和第二腔室通过所述至少一个纳米孔隙电连通和流体连通,且其中所述纳米孔隙装置还包括跨各个所述至少一个纳米孔隙的受控电压势和与各个所述至少一个纳米孔隙关联的传感器,其中所述传感器配置为识别经过所述至少一个纳米孔隙的物体,且其中通过所述至少一个纳米孔隙移位的所述融合复合体提供与所述融合复合体相关的可检测信号;和通过观察所述可检测信号确定所述样品中所述融合复合体的存在或不存在。在一个实施方式中,所述多核苷酸是dna或rna。在一个实施方式中,所述可检测信号是电信号。在一个实施方式中,所述可检测信号是光信号。在一个实施方式中,所述足够接近是少于3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、60、70、80、90、100、150、200、300、400或500个核苷酸。在一个实施方式中,所述第三分子包括peg或抗体。在一个实施方式中,所述第三分子及所述第一和第二探针结合于ssdna,且其中与所述第三分子连接的所述ssdna包含与连接于所述第一探针的ssdna区域互补的区域并与连接于所述第二探针的ssdna的区域互补。在一个实施方式中,检测样品中的多核苷酸或多核苷酸序列的方法还包括使样品与能够结合所述第三分子或结合所述融合复合体的一种或多种可检测标记接触。本文还提供了包括第一探针、第二探针和第三分子的试剂盒,其中所述第一探针配置为与靶多核苷酸上的第一靶序列结合,其中所述第二探针配置为与所述靶多核苷酸上的第二靶序列结合,且其中所述第三分子配置为当所述第一和第二探针在所述第一和第二靶序列处与所述多核苷酸结合时与所述第一探针和所述第二探针结合,从而将所述第一和第二探针足够接近地定位以允许所述第三分子同时与所述第一和第二探针结合。在一个实施方式中,所述第一探针和所述第二探针选自:蛋白质、肽、核酸、talen、crispr、肽核酸或化学化合物。在一个实施方式中,所述第三分子包括peg或抗体。在一个实施方式中,所述第三分子包括改变对所述探针的结合亲和力的修饰。本文还提供了包括至少两个腔室和纳米孔隙的纳米孔隙装置,其中所述装置包括在所述纳米孔隙内与多核苷酸结合的修饰pna探针。本文还提供了用于检测通过两个孔隙的带电聚合物的双孔隙、双放大器装置,该装置包括上腔室、中腔室和下腔室,第一孔隙连接上腔室和中腔室,且第二孔隙连接中腔室和下腔室,其中所述装置包括在所述第一或第二孔隙内与多核苷酸结合的修饰pna探针。在一个实施方式中,所述装置配置为控制所述带电聚合物同时通过所述第一孔隙和所述第二孔隙两者的移动。在一个实施方式中,修饰pna探针与至少一个peg分子结合。在一个实施方式中,所述装置还包括配置为提供上腔室和中腔室之间的第一电压和提供中腔室和下腔室之间的第二电压的电源,各电压可独立地调节,其中中腔室相对于两个电压连接于共同地线,其中所述装置提供配置用于各孔隙的独立电压控制和电流测量的双放大器电子器件,其中所述两个电压可以大小不同,其中第一和第二孔隙配置为使得带电聚合物能够以任一方向和以受控的方式同时跨两个孔隙移动。附图说明作为本发明的实施方式提供了附图,其仅按照示例而非限制来图示。图1阐明了作为本公开的方法的一个实施方式在纳米孔隙对中与修饰的探针结合的目标分子的检测。图2显示了探针与目标分子结合对在复合体移位通过纳米孔隙时产生的电信号的影响。图3a和图3b各自显示在相应靶序列处与多核苷酸结合的两个探针及在两个探针结合于骨架时利于纳米孔隙中的探针检测的第三桥接分子(例如,抗体)的实施方式。图4显示了在相应靶序列处与多核苷酸结合的两个探针,其中第三桥接分子是peg且通过互补ssdna接头连接于探针以在两个探针足够接近地结合于骨架时能够实现探针检测。图5显示了在相应靶序列处足够接近地与多核苷酸结合的两个探针以允许检测由于其接近而产生的光信号,例如,通过共振能量转移(fret)。图6a是将纳米孔隙装置与落射荧光显微镜结合以使得能够检测荧光团修饰的结合剂的系统的示意图。图6b是随着荧光团经过平面内的两个纳米孔隙装置时通过检测器看到的东西的图示。图6c显示了在骨架经过纳米孔隙时电流大小和相应荧光信号的变化。图7显示了具有可切割的基团(例如,荧光团)以帮助检测的探针的结合。图8阐明了本技术通过包括不同尺寸的探针的多路复用能力,各探针结合于靶标携带分子中的独特靶序列。在该图示中,双链dna是具有靶序列和与希望检测的靶序列结合的多个不同dna结合探针的多核苷酸。图9a显示了已经修饰以增加配体电荷且因此利于通过纳米孔隙的检测的pna配体。图9b显示了其中双链dna用作靶标携带聚合物和与希望检测的靶序列结合的多个不同dna结合探针的实例。图10显示了在dna横跨纳米孔隙时与dna结合的多个不同的序列特异性探针以允许多重检测。图11a-c显示了纳米孔隙及来自分子通过纳米孔隙的移位的代表性电流特征和群体。在图11a中,显示了固态孔隙和电压通路。图11b显示了分子经过纳米孔隙的电流阻滞和驻留时间。图11c显示了基于驻留时间和平均电流大小的经过纳米孔隙的不同分子群体。图12a显示了与生物素结合的pna探针的用途的实例,生物素与较大的中性抗生物素蛋白复合以允许检测dna骨架上的序列。图12b显示了dna骨架上pna探针的结合位点。图13显示了未结合dna、游离中性抗生物素蛋白及与dna和与中性抗生物素蛋白结合的复合pna-生物素的移位。也显示了对于各复合体,分子在施加的电压下移位通过纳米孔隙时所得的电流特征(y-轴上的电流,x-轴上的时间)。dna/pna/中性抗生物素蛋白复合体导致高于其它背景事件类型(例如,单独的未结合dna和单独的中性抗生物素蛋白)的可检测的移位电流特征且因此可以作为与dna结合的可检测的pna探针(即,dna/pna/中性抗生物素蛋白复合体)事件标记。图14a显示了在三个群体,单独dna(x)、单独中性抗生物素蛋白(方块)和与连接于中性抗生物素蛋白的生物素探针复合的dna(圆圈),中通过持续时间和由于经纳米孔隙的移位导致的平均电导偏移表征的事件的散点图。图14b显示了与上述三个群体各自相关的驻留时间概率的直方图。图14c显示了仅dna(道2)、包含dna、具有结合中性抗生物素蛋白的3个生物素位点的pna和中性抗生物素蛋白的样品(道3)、包含dna、具有结合中性抗生物素蛋白的7个生物素位点的pna和中性抗生物素蛋白的样品(道3)、包含dna、具有结合中性抗生物素蛋白的16个生物素位点的pna和中性抗生物素蛋白的样品(道3)及包含dna、具有结合中性抗生物素蛋白的36个生物素位点的pna和中性抗生物素蛋白的样品(道3)的凝胶迁移分析(gelshiftassay)。图15显示了dna骨架上的探针结合位点的图解,其中探针是vspr蛋白。图16a显示了未结合dna分子经过纳米孔隙的图解及与单一分子的经过纳米孔隙相关的代表性电流特征。图16b显示了vspr-结合的dna分子经过纳米孔隙的图解及与其经过纳米孔隙相关的代表性电流特征。图17显示了与vspr-结合骨架经过孔隙一致的另外十个代表性的电流衰减事件。图18a显示了与dsdna分子上的靶序列结合的pna-peg探针。图18b显示了使用以下样品的凝胶迁移分析的结果:仅dna(道1)、dna/pna(道2)、dna/pna-peg(10kda)(道3)和dna/pna-peg(20kda)(道4)。图18c显示了使用以下样品的凝胶迁移分析的结果:dna标记(道1)、与pna探针孵育的随机dna序列(道2)、与相应pna探针孵育的具有靶序列处的单一错配的dna(道3)和与靶序列特异性的相应pna探针混合的具有靶序列的dna(道4)。图19a显示了在各电流特征下方描绘的分子在施加的电压下移位通过纳米孔隙时的代表性电流特征事件。图19b显示了在三个群体:dna/bispna(方块)、dna/bispna-peg5kda(圆圈)和dna/bispna-peg10kda(菱形)中,通过持续时间和由于经纳米孔隙的移位导致的平均电导偏移表征的事件的散点图。图19c显示了与上述三个群体各自相关的平均电导偏移概率的直方图。图19d显示了与上述三个群体各自相关的事件持续时间概率的直方图。图20a显示了与结合于dna分子的pna-peg探针的移位相关的代表性事件特征。图20b显示了来自包含细菌dna和pna-peg探针的样品的纳米孔隙中各记录事件的平均电导偏移相对持续时间的图表。图20c和图20d分别显示了通过各事件的平均电导偏移和持续时间表征这些检测的事件的相应直方图。图20e显示了凝胶迁移分析的结果,其显示:100bp梯状物(道1)、与pna-peg探针孵育的具有的野生型cftr序列的300bpdna(道2)和与pna-peg探针孵育的具有cftrδf508序列的300bpdna(道3)。图21a显示了凝胶迁移分析的结果,道1包含没有结合的bispna-peg的轻型链球菌(s.mitis)细菌dna且道2包含具有结合的位点特异性bispna-peg的轻型链球菌dna。图21b显示了在两个连续实验中对于所有记录的事件的纵轴上的平均电导偏移(dg)vs.横轴上的持续时间的散点图。第一样品包括具有peg-修饰的pna探针的细菌dna(dna/bispna-peg)。第二样品包括单独的细菌dna。一些或所有的附图是示例的示意图;因此,他们不一定描绘了展现的元件的实际相对大小或位置。附图是为了阐明一个或多个实施方式的目的而呈现的,应明确理解它们不限制以下权利要求的范围或含义。具体实施方式在整个本申请中,文字涉及本发明的营养物、组合物和方法的各种实施方式。所描述的各种实施方式旨在提供多种说明性例子,而不应该被解释为可选种类的描述。相反,应该注意的是,此处提供的各种实施方式的描述在范围上可能有重叠。此处讨论的实施方式仅仅是说明性的,并不是要限制本发明的范围。也在本公开的全文中,各种出版物、专利和公开的专利说明书均通过明确的引文被引用。这些出版物、专利和公开专利说明书的公开内容通过引用由此并入本公开中以更完全地描述本发明所属领域的状态。如说明书和权利要求中使用的,单数形式“一”、“一个”和“该”包括复数指代,除非上下文另外有明确规定。例如,术语“一电极”包括多个电极,包括其混合。如本文中使用的,术语“包含”意指所述装置和方法包含所列举的成分或步骤,但不排除其它的成分或步骤。“基本上由……组成”在用于定义装置和方法时意指排除对于组合有任何实质意义的其它成分或步骤。“由……组成”意指排除其它成分或步骤。通过这些过渡术语中各自限定的实施方式在本发明的范围内。所有数值表达,例如距离、大小、温度、时间、电压和浓度,包括范围,是近似值,其意图涵盖参数测量的普通实验变化且该变化意图在所描述的实施方式的范围内。需要明白的是,虽然并不总是明确表明所有数值表达前加有术语“大约”。也需要明白,尽管并不总是明确地表述,此处所描述的成分只是示例性的,并且此类成分的等价物是本领域中已知的。如本文中使用的,术语“纳米孔隙”(或仅"孔隙")是指分隔两个容积的膜中的单一纳米级开口。孔隙可以是例如插入脂质双层膜中的蛋白质通道,或者可以通过钻孔或刻蚀或者使用电压脉冲方法通过薄的固态基质(如氮化硅或二氧化硅或石墨烯或者这些或其他材料的组合)来工程化。几何上,孔隙具有直径不小于0.1nm和直径不大于1微米的尺度;孔隙的长度通过膜厚度控制,其可以是亚纳米厚度或最大1微米或更大的厚度。对于厚度大于几百纳米的膜,纳米孔隙可以称为“纳米通道”。如本文中使用的,术语“纳米孔隙仪”是指将一个或多个纳米孔隙(并联或串联的)与用于探测单一分子事件的电路结合的装置。具体地,纳米孔隙仪使用灵敏的电压钳放大器施加跨一个或多个孔隙的指定电压而同时测量通过孔隙的离子电流。当单一带电分子如双链dna(dsdna)被捕获和通过电泳驱动通过孔隙时,测量的电流变化,其指示捕获事件(即,分子通过纳米孔隙的移位或分子捕获在纳米孔隙中)及事件的变化量(电流大小)和持续时间,用于表征纳米孔隙中捕获的分子。在实验期间记录许多事件后,根据其变化量(即,其电流特征)分析事件的分布以表征相应的分子。以这种方式,纳米孔隙提供简单、无标记、纯电子的单分子生物分子探测方法。如本文中使用的,术语“事件”是指可检测的分子或分子复合体通过纳米孔隙的移位和其相关测量。这可以通过其电流、持续时间和/或纳米孔隙中分子的其它检测特征来定义。具有相似特征的多个事件指示相同的或具有相似特征(例如,体积、电荷)的分子或复合体的群体。分子检测本公开提供了用于分子检测和定量的方法和系统。另外,所述方法和系统也可以被配置来测量探针与目标分子结合的亲和力。此外,此类检测、定量和测量可以用多路复用方式进行,从而大大地提高其效率。图1提供了所公开的方法和系统的一个实施方式的图示。更具体地,该系统包括含有希望检测或定量的目标基序101的靶标携带分子(102)。探针(103)能够结合靶标携带分子102上的特定结合基序101。可以添加另外的分子以帮助检测靶标携带多核苷酸上的探针(107)(如果存在)。因此,如果全部存在于溶液中,探针103通过探针对目标基序101的特异性识别结合于目标基序。这种结合导致形成包括探针和靶序列的复合体。形成的复合体(101/103或101/103/107)可以通过包括两个孔隙(105和106)和配置为识别经过孔隙的物体的与孔隙邻近的传感器的装置(104)检测,该两个孔隙将装置的内部空间分隔成3个体积。这一实施方式是具有两个串联的纳米孔隙的双重纳米孔隙装置。在一些实施方式中,纳米孔隙装置包括投送跨纳米孔隙的受控电压(在一些实施方式中,该电压可以独立地控制和钳制)的电子部件以及用于测量跨纳米孔隙的电流的电路。电压可以调整以按照受控的方式跨孔隙从一个体积到另一体积移动多核苷酸。多核酸带电或经修饰以包含电荷,施加的跨孔隙电势或电压差通过在暴露于电场的带电分子上施加静电力帮助和控制带电骨架的移动。尽管图1显示了双重纳米孔隙装置,但上述原理也可以应用于使用单一纳米孔隙装置的本发明的其它实施方式。除非下文指明,所称的孔隙或纳米孔隙或纳米孔隙装置意图涵盖本发明的精神内的单孔隙、双孔隙或多孔隙装置。当包括形成的复合体的样品加载到纳米孔隙时,纳米孔隙可以配置为使靶标携带分子经过孔隙。当目标基序在孔隙内或邻近孔隙时,目标基序的结合状态可以通过传感器检测。如本文中使用的,目标基序的“结合状态”是指结合基序是否被探针占据。实质上,结合状态是结合的或未结合的。或者(i)目标基序是游离的和不与探针结合(参见图2中的201和204),或者(ii)目标基序结合于探针(参见图2中的202和205)。另外,不同大小或具有不同探针结合位点的探针可以用于给出另外的电流特征(参见,例如,图2中的203和206)以使得能够在一个靶标携带分子检测超过一个靶序列。目标基序的结合状态的检测可以通过各种方法完成。在一个方面,借助于在各状态(即,占据或未占据的)下目标基序的不同大小,当目标基序经过孔隙时,不同的大小导致跨孔隙的不同电流。在这一方面,不需要单独的传感器进行检测,因为电极(其连接于电源且可以检测电流)可以用于探测功能。因此,两个电极可用作“传感器”。在一些方面,向复合体添加试剂(例如,图1中的107)以增加检测。这一试剂能够与探针或多核苷酸/探针复合体结合。在一个方面,该试剂包括电荷(负的或正的)以利于检测。在另一个方面,该试剂增大尺寸以利于检测。在另一个方面,该试剂包括可检测标记如荧光团。在这一情况中,结合的状态(ii)的识别指示靶标携带分子中的靶序列与探针复合。换句话说,靶序列被检测。在另一实施方式中,结合的分子间隔开以通过阻抗变化单独地检测结合的分子,其中各结合的分子给出未被相邻的结合的分子掩蔽的阻抗值。在一个实施方式中,结合的探针分隔至少1nm的距离(即,对于核酸基多核苷酸来说大约3bp)。在另一实施方式中,结合的探针分隔至少10nm的距离(即,对于核酸基多核苷酸来说大约33bp)。在另一实施方式中,结合的探针分隔至少100nm的距离(即,对于核酸基多核苷酸来说大约333bp)。在另一实施方式中,结合的探针分隔至少500nm的距离(即,对于核酸基多核苷酸来说大约1666bp)。在一些方面,该方法进一步包括具有两个独立探针,其如果一旦结合于多核苷酸则彼此足够接近时,可以结合第三分子。这种第三分子的结合提供不同的移位电流特征,因此提供两个独立探针紧密靠近的证据。确定探针是否靠近地结合的机制允许我们使用可以区分单碱基对错配并因此检测具有单核苷酸多态性(或单核苷酸突变)的等位基因的短探针和起到标志物的作用以确定基因组中的独特位点的较长探针。在一个实施方式中,我们组合地使用两个探针以确定特定的序列是否与特定的靶基因相关。在另一实施方式中,这一方法用于通过使用探针作为基因组中区域的标志物确定结构重排。在另一实施方式中,我们组合地使用两个探针以确定特定的序列是否被化学地(从表观遗传学来说,例如,甲基化、羟甲基化)修饰和与特定的靶基因相关。在一个实施方式中,第三分子是仅结合探针(305和306)的抗体(301)(如果至少两个探针结合于多核苷酸(304)且显著地彼此接近(0.01nm–50nm))(图3a)。在另一实施方式中,抗体(301)的表位的一半连接于各探针分子(302和303)(通过共价连接、离子、h-键或其它方式),导致抗体结合取决于位置紧密靠近的两个表位,这表明探针彼此足够靠近(图3b)。在一个实施方式中,各探针是pna分子,且各pna分子包含或附接于抗体的结合表位的片段(共价连接、离子、h-键或其它方式)。在这一实施方式中,部分表位必须对于抗体结合以形成与多核苷酸的复合体是足够接近的。在另一实施方式中,peg分子(310)用作第三分子以结合很靠近且结合于多核苷酸(304)的两个探针(302和303)。在一些实施方式中,peg被修饰以提供(在存在时)允许独特特征的足够体积、电荷或其它特征(图4)。在一些实施方式中,peg被修饰以提高对紧密靠近的探针的结合亲和力。peg上的这种结合修饰可以是,例如,在peg的各末端处的单链dna(ssdna)分子,其与连接于各探针的游离ssdna是互补的。在一个实施方式中,peg结合于探针所需的能障仅在两个ssdna寡聚物与连接于探针的其互补序列结合时满足(图4)。因此,具有peg所跨越的距离的探针通过peg/探针/多核苷酸复合体的检测在纳米孔隙中检测到,而更大间隔的那些探针没有检测到。如本领域技术人员认识到的,ssdna可以被合成的核酸类似物如pna或被rna替换。在一些方面,两个独立探针被修饰以允许在其紧密靠近地结合于多核苷酸的情况下检测。在一个实施方式中,对探针的修饰包括改变探针的离子电荷以改变在探针紧密靠近地结合于多核苷酸并经过纳米孔隙时的电流特征,如与单一探针/多核苷酸复合体在不与第二探针紧密靠近的情况下经过纳米孔隙时的电流特征区分的。在一个实施方式中,向两个探针添加正电荷(例如,通过用2-羟乙基硫代磺酸酯(mtset)标记探针)在两个探针沿多核苷酸在空间上足够接近且电荷的效应是加性的时提供了不同的移位电流特征,如与它们以更远间隔结合于多核苷酸相反的。在一些方面,该方法进一步包括使用足够长以使得能够仅结合目标群体中的一个独特序列但也具有在仅存在单碱基对错配的情况下不与目标位点结合的能力的探针。这在使用pna探针时是可能的。如所示的(strand-invasionofextended,mixed-sequenceb-dnabyγpnas,g.he,d.ly等,jamchemsoc.2009september2;131(34):12088–12090.doi:10.1021/ja900228j),20bp的γ-pna探针能够高效地结合完全匹配的靶序列,但在靶序列和探针序列仅相差一个碱基时结合被消除。当考虑含有31亿碱基的人基因组时,20碱基对的序列很可能随机出现0.003次。因此,设计为与所研究的特定序列结合的20碱基对的探针很少可能与不希望的位置结合和提供假阳性。其内包含的实例(图19c和21)显示pna和pna-peg探针仅选择性地结合互补序列。在一些方面,该方法进一步包括具有两个独立探针,该探针包含在两个探针足够接近地连接于多核苷酸时发射可检测信号的元件。在一个实施方式中,各探针用荧光团标记(参见,例如,图5(315,316))。发射光谱在探针足够接近以产生可检测信号时通过检测器(317)检测。在一个实施方式中,两个探针不同的有色荧光团标记。当探针紧密接近时,颜色一起成像(或共混从而提供新颜色),其可以用外部传感器如相机或显微镜检测并证明两个探针在空间上接近。在相关的实施方式中,fret(或bret)型的检测用于确定两个探针的接近性,使得一个荧光标记的探针影响密切接近的另一探针的能量发射谱。在一些实施方式中,可检测标记是荧光团。为检测荧光团,用盖玻片在平面内制造的纳米孔隙装置可以与落射荧光显微镜结合以能够进行双重电流大小和荧光信号检测。图6a显示了这种装置可以如何用于检测添加的荧光团标记。纳米孔隙装置置于落射荧光显微镜的物镜下方。随着纳米孔隙测量进行,显微镜持续成像纳米孔隙区域。纳米孔隙区域通过经过滤以使得仅允许对应于荧光团的激发光谱的波长通过的宽带激发光源照明。二向色滤光器选择性地允许对应于荧光团的发射光谱的波长透射而同时发射所有其它波长。随着荧光团修饰的结合分子经过纳米孔隙,荧光团吸收激发光谱并再发射发射光谱。在检测器前方的发射滤光器确保仅对应于荧光团的发射光谱的波长被检测到。因此,检测器仅在荧光团经过纳米孔隙时具有信号。图6b显示了在荧光团发射过程中通过显微镜观看到的纳米孔隙装置的俯视图。图6c证明荧光团的检测可以如何与来自纳米孔隙的信号结合使用。使用两个信号增强生物分子检测的可信度。在一些方面,该方法进一步包括使用具有允许通过传感器检测的附接的特征的探针,但它们使用可切割的接头连接于探针。因此,可以在纳米孔隙中彼此区分的探针组与靶标携带多核苷酸结合。一旦该探针组在纳米孔隙中检测,该特征被切割掉并添加也具有可切割的检测特征的新探针组(图7)。添加/切割/洗涤循环可以继续直到所有序列信息从捕获的目标分子提取。帮助探针检测的分子的实例如上所述。可切割接头的实例是还原剂切割接头(通过tcep切割的二硫化物接头)、酸切割接头(腙/酰肼键)、通过蛋白酶切割的氨基酸序列、通过核酸内切酶(位点特异性限制性酶)切割的核酸接头、碱切割接头或光切割接头[leriche,geoffray,louisechisholm和alainwagner."cleavablelinkersinchemicalbiology."bioorganic&medicinalchemistry20,no.2(2012):571-582]。目标基序对于靶序列检测方法所应用的核酸和多肽,目标结合基序可以是被探针分子识别的核苷酸或肽序列。目标基序可以化学修饰(例如甲基化)或被其它分子(例如激活剂或阻遏剂)占据,且根据探针的特性,目标基序的状态可以阐明。在一些方面,靶序列包含用于将探针与多核苷酸结合的化学修饰。在一些方面,化学修饰选自乙酰化、甲基化、小泛素样修饰蛋白化、糖基化、磷酸化和氧化。探针分子在本技术中,探针分子通过其与携带靶标的多核苷酸的结合来检测或定量。如本文中使用的探针理解为能够特异性地结合多核苷酸上的位点,其中该位点通过序列或结构表征。探针分子的实例包括pna(蛋白质核酸)、bis-pna、γ-pna、增加pna的尺寸或电荷的pna-偶联物。探针分子的其它实例来自天然或重组蛋白质、融合蛋白质、蛋白质的dna结合域、肽、核酸、寡核苷酸、talen、crispr、pna(蛋白质核酸)、bis-pna、γ-pna、增加尺寸、电荷、荧光或功能性的pna-偶联物(例如,寡聚物标记的)或任何其它pna衍生的聚合物,及化学化合物的组。在一些方面,探针包括γ-pna。γ-pna具有肽样骨架中的简单修饰,特别是在n-(2-氨基乙基)甘氨酸骨架的γ-位,因此产生手性中心(rapireddys.等,2007.j.am.chem.soc.,129:15596-600;heg等,2009,j.am.chem.soc.,131:12088-90;chemav等,2008,chembiochem9:2388-91;dragulescu-andrasi,a.等,2006,j.am.chem.soc.,128:10258-10267)。与bis-pna不同,γ-pna可以结合dsdna而无序列限制,从而留下两个dna链之一可供进一步的杂交。在一些方面,探针的功能是通过互补碱基配对与具有靶序列的多核苷酸杂交以形成稳定的复合体。pna分子可以另外地与另外的分子结合以形成复合体,其具有足够大的横截面积以产生高于背景的信号大小的可检测变化或对比。该背景是对应于非探针结合的多核苷酸的截面的平均或均值信号大小。多核苷酸靶序列与pna分子的结合的稳定性对于通过纳米孔隙装置对其进行检测是重要的。结合稳定性必须在携带靶标的多核苷酸移位通过纳米孔隙的整个期间保持。如果稳定性弱或不稳定,探针可以与靶多核苷酸分离并且在携带靶标的多核苷酸穿过纳米孔隙时不会被检测到。在特定的实施方式中,探针的实例是其中pna部分特异性地识别核苷酸序列和结合部分增大不同pna-偶联物之间的尺寸/形状/电荷差异的pna-偶联物。如图8中显示的,配体a、b、c和d各自特异性地结合dna分子上的位点,且这些配体可以通过其宽度、长度、大小和/或电荷识别和彼此区分。如果其相应位点分别表示为a、b、c和d,则配体的识别导致在位点的组成和顺序方面揭示那些dna序列,a-b-c-d。不同的反应性部分可以并入配体中以提供标记可以与其偶联的化学处理(chemicalhandle)。反应性部分的实例包括,但不限于伯胺类、羧酸类、酮类、酰胺类、醛类、硼酸类、腙类、硫醇类、马来酰亚胺类、醇类和羟基,以及生物素。图9a显示了经修饰以增加配体电荷且因此利于通过纳米孔隙的检测的pna配体。具体地,通过pna分子上的碱基和靶dna中的碱基之间的互补碱基配对和hoogsteen碱基配对与靶dna结合的这一配体具有并入到骨架中的半胱氨酸残基,其提供用于标记的游离硫醇化学处理。此处,半胱氨酸通过马来酰亚胺接头被标记至肽2-氨基乙基甲烷硫代磺酸酯(mtsea),其提供检测配体是否结合其靶序列的手段,因为标记/肽导致配体电荷的增加。这一较大的电荷导致与未标记的pna相比通过孔隙的电流的较大变化。在一些方面,为增大配体结合多核苷酸和样品中存在的其它背景分子之间的变化的对比度,可以对假肽骨架进行修饰以改变配体(例如,pna)的总体大小而提高对比度。参见,例如,图9b,其显示具有并入的半胱氨酸残基(301)的pna,半胱氨酸残基用smcc接头(302)修饰以使得能够通过肽的n-末端酰胺与肽(303)偶联。除了通过标记配体而增加电荷(例如,如图9a中)外,选择带更多电荷的氨基酸而不是非极性氨基酸也可以用于增加pna的电荷。另外,小的颗粒、分子、蛋白质、肽或聚合物(例如peg)可以与假肽骨架偶联以增大配体和携带靶标的多核苷酸复合体的体积或截面积。增大的体积用于提高信号大小对比度以使得由增大的体积导致的任何差异信号可以容易地检测。可以与假肽骨架偶联的小的颗粒、分子、蛋白质或肽的实例包括,但不限于α-螺旋形成肽、纳米级金颗粒或棒(例如3nm)、量子点、聚乙二醇(peg)。分子偶联的方法是本领域技术人员中公知的,例如在美国专利no.5,180,816,6,423,685,6,706,252,6,884,780和7,022,673中,其通过引用全文并入本文中。以上实施方式描述了通过半胱氨酸残基的peg标记,但也可以使用其它残基。例如,赖氨酸残基容易与半胱氨酸残基互换以实现使用nhs-酯和游离胺的连接化学作用。而且,peg可以在双功能接头和pna之间容易地与其它体积增大的成分如dendrons、珠或棒互换,或者直接偶联dendron。本领域技术人员将认识到,这一系统的灵活性在于氨基酸可以改变和连接化学作用可以针对该特定氨基酸进行改变,例如丝氨酸反应性异氰酸酯。可以用于这一反应的连接化学作用的一些实例列于下表中。表1:连接化学作用反应性基团目标功能基团芳基叠氮化物非选择性或伯胺碳二亚胺胺/羧基酰肼碳水化合物羟甲基膦胺亚氨酸酯胺异氰酸酯羟基羰基肼马来酰亚胺巯基nhs-酯胺pfp-酯胺补骨脂素胸腺嘧啶吡啶二硫化物巯基乙烯基砜巯基胺,羟基图3a、3b、4、5、9a、9b和18a显示经修饰以增加探针尺寸、包含表位、包含ssdna寡聚物、包含荧光团、附加的电荷或附加的尺寸而利于检测或检测密切接近的两个探针的pna探针。不同的反应性部分可以并入探针中以提供标记可以与其偶联的化学处理。反应性部分的实例包括,但不限于伯胺类、羧酸类、酮类、酰胺类、醛类、硼酸类、腙类、硫醇类、马来酰亚胺类、醇类和羟基,以及生物素。用于并入化学处理的常用方法是将特定氨基酸包括到探针的骨架中。实例包括,但不限于半胱氨酸(提供硫醇盐)、赖氨酸(提供游离胺)、苏氨酸(提供羟基)、谷氨酸和天冬氨酸(提供羧酸)。可以使用反应性部分添加不同类型的标记。这些包括以下的标记:1.增大探针的尺寸,例如生物素/链霉亲和素、肽、核酸。2.改变探针的电荷,例如带电肽(6xhis)或蛋白质(例如,卡律蝎毒素),或者小分子或肽(例如,mtset)。3.改变或增加探针的荧光,例如常见荧光团、fitc、罗丹明、cy3、cy5。4.提供用于结合第三分子的表位或相互作用位点,例如用于结合抗体的肽。多路复用在一些实施方式中,与如上所述包括相同种类的探针不同,添加不同探针的集合,各探针结合独特的位点或目标基序。利用这种设置,多个不同探针可以用于检测相同的靶标携带多核苷酸内的多个不同目标位点。图10阐明了这种方法。这里,双链dna1002包含多个不同目标基序,两个拷贝的1003、两个拷贝的1004和一个拷贝的1005。通过使用各自提供独特电流特征(例如,通过尺寸不同)的探针1006、1007和1008,本技术可以检测相同分子内的不同目标基序,从而提供多路复用目标基序检测的手段。此外,通过计数各独特的探针的多少个被结合,各靶标的数目(或拷贝数)可以确定。通过调节影响结合的条件,该系统可以获得更详细的结合动态信息。类似地,多路复用可以通过采用具有属性不同的探针的集合和任意多种组合的混合-和-匹配来完成,唯一的要求是与不同序列结合的探针彼此可分辨。例如,实验可以使用可通过大小区分的探针和可通过大小区分的另外的探针(图9a、9b和19)。多路复用的另外的方法包括设计在彼此的固定位置处与已知序列处的多核苷酸结合的探针以查询包含来自不同物种的核酸的集合的样品。作为这一方法的实例,如果我们测试水源的具有已知序列的三种不同细菌,我们可以对于物种a定位间隔1000碱基对的两个探针,对于物种b定位间隔3000bp碱基对的两个探针和对于物种c定位间隔5000碱基对的两个探针。如果检测到间隔1000碱基对和3000碱基对的探针,则物种a和b存在,但物种c没有达到可检测的水平。设计的间隔的这种相同方法也可以用于在特定目标样品中已知或突变序列的检测的多路复用。纳米孔隙装置所提供的纳米孔隙装置包括在将装置的内部空间分为两个体积的结构中形成开口的孔隙,并配置为例如用传感器识别经过孔隙的物体(例如,通过检测指示物体的参数的变化)。用于本文描述的方法的纳米孔隙装置也公开于pct公开wo/2013/012881中,其通过引用全文并入。纳米孔隙装置中的孔隙是纳米级或微米级的。在一个方面,每个孔隙的大小允许小或大的分子或者微生物通过。在一个方面,每个孔隙直径至少约1纳米。可选地,每个孔隙直径至少约2纳米、3纳米、4纳米、5纳米、6纳米、7纳米、8纳米、9纳米、10纳米、12纳米、13纳米、14纳米、16纳米、17纳米、18纳米、19纳米、20纳米、25纳米、30纳米、35纳米、40纳米、45纳米、50纳米、60纳米、70纳米、80纳米、90纳米或100纳米。在一个方面,孔隙直径不超过约100纳米。可选地,孔隙直径不超过约95纳米、90纳米、85纳米、80纳米、75纳米、70纳米、65纳米、60纳米、55纳米、50纳米、45纳米、40纳米、35纳米、30纳米、25纳米、20纳米、15纳米或10纳米。在一些方面,每个孔隙的直径至少约100纳米、200纳米、500纳米、1000纳米、2000纳米、3000纳米、5000纳米、10000纳米、20000纳米或30000纳米。在一个方面,孔隙直径不超过约100000纳米。可选地,孔隙直径不超过约50000纳米、40000纳米、30000纳米、20000纳米、10000纳米、9000纳米、8000纳米、7000纳米、6000纳米、5000纳米、4000纳米、3000纳米、2000纳米或1000纳米。在一个方面,孔隙直径在约1纳米和约100纳米之间,或者可选地,在约2纳米和约80纳米,或在约3纳米和约70纳米,或在4约纳米和约60纳米,或在约5纳米和约50纳米,或在约10纳米和约40纳米,或在约15纳米和约30纳米之间。在一些方面,纳米孔隙装置中的孔隙是较大尺度的以用于大的微生物或细胞的检测。在一个方面,每个孔隙的大小允许大的细胞或微生物通过。在一个方面,每个孔隙直径至少约100纳米。可选地,每个孔隙直径为至少约200纳米、300纳米、400纳米、500纳米、600纳米、700纳米、800纳米、900纳米、1000纳米、1100纳米、1200纳米、1300纳米、1400纳米、1500纳米、1600纳米、1700纳米、1800纳米、1900纳米、2000纳米、2500纳米、3000纳米、3500纳米、4000纳米、4500纳米或5000纳米。在一个方面,孔隙直径不超过约100000纳米。可选地,孔隙直径不超过约90000纳米、80000纳米、70000纳米、60000纳米、50000纳米、40000纳米、30000纳米、20000纳米、10000纳米、9000纳米、8000纳米、7000纳米、6000纳米、5000纳米、4000纳米、3000纳米、2000纳米或1000纳米。在一个方面,孔隙的直径在约100纳米和约10000纳米之间,或者可选地在约200纳米和约9000纳米之间,或在约300纳米和约8000纳米之间,或在约400纳米和约7000纳米之间,或在约500纳米和约6000纳米之间,或在约1000纳米和约5000纳米之间,或在约1500纳米和约3000纳米之间。在一些方面,纳米孔隙装置进一步包括用于将聚合物支架移动跨过孔隙的手段和/或用来识别通过孔隙的物体的手段。进一步的细节在下面提供,其以双孔隙装置为背景描述。与单孔隙纳米孔隙装置相比,双孔隙装置可以更容易配置以提供聚合物支架跨孔隙运动的速度和方向的良好控制。在某些实施方式中,纳米孔隙装置包括多个腔室,各腔室通过至少一个孔隙与相邻的腔室连通。在这些孔隙中,两个孔隙(即第一孔隙和第二孔隙)被设置为使得允许至少一部分聚合物支架移出第一孔隙和进入第二孔隙。此外,装置包括能够在运动过程中识别聚合物支架的传感器。在一个方面,识别需要确定单个聚合物支架成分。在另一个方面,识别需要识别与聚合物支架结合的融合分子和/或目标分析物。当采用单一传感器时,该单一传感器可包含两个放置在孔隙两端以测量跨孔隙的离子电流的电极。在另一个实施方式中,单一传感器包含电极以外的部件。在一个方面,所述装置包括通过两个孔隙连接的三个腔室。具有三个以上腔室的装置可以容易地设计以在三腔室装置的任一侧或在三个腔室中任何两个腔室之间包括一个或多个额外的腔室。同样地,装置中可以包括连接腔室的多于两个的孔隙。在一个方面,两个相邻腔室之间可以有两个或更多个孔隙以允许多个聚合物支架同时从一个腔室移动到下一个腔室。这样的多孔隙设计可以提高装置中聚合物支架分析的通量。在一些方面,装置进一步包括用于将聚合物支架从一个腔室移动到另一个腔室的手段。在一个方面,该移动导致同时跨第一孔隙和第二孔隙两者加载聚合物支架。在另一个方面,所述手段进一步使聚合物骨支能够在同一方向上通过两个孔隙移动。例如,在三腔室两孔隙装置(“两孔隙”装置)中,每个腔室可以包含用于连接到电源的电极,从而可以跨在腔室之间的各个孔隙施加单独的电压。根据本发明的一个实施方式,提供了包括上腔室、中腔室和下腔室的装置,其中上腔室通过第一孔隙与中腔室连通,且中腔室通过第二孔隙与下腔室连通。这种装置可以具有此前在名称为双重孔隙装置的美国公开no.2013-0233709中披露的任何尺寸或其他特征,该文献在此通过引用整体并入本文。在如图7a所示的一些实施方式中,所述装置包括上腔室705(腔室a)、中腔室704(腔室b)和下腔室703(腔室c)。腔室通过两个分离层或膜(702和701)分隔开,每个分离层或膜具有单独的孔隙(711或712)。此外,每个腔室包含用于连接到电源的电极(721、722或723)。上、中和下腔室的标注是相对表述,且并不表示,例如,上腔室相对于地面被放置在中腔室或下腔室之上,反之亦然。各孔隙711和712独立地具有允许小或大的分子或微生物通过的尺寸。在一个方面,每个孔隙直径为至少约1纳米。可选地,每个孔隙直径为至少约2纳米、3纳米、4纳米、5纳米、6纳米、5纳米、7纳米、8纳米、9纳米、10纳米、11纳米、12纳米、13纳米、14纳米、15纳米、16纳米、17纳米、18纳米、19纳米、20纳米、25纳米、30纳米、35纳米、40纳米、45纳米、50纳米、60纳米、70纳米、80纳米、90纳米或100纳米。在一个方面,孔隙直径不超过约100纳米。可选地,孔隙直径不超过约95纳米、90纳米、85纳米、80纳米、75纳米、70纳米、65纳米、60纳米、55纳米、50纳米、45纳米、40纳米、35纳米、30纳米、25纳米、20纳米、15纳米或10纳米。在一个方面,孔隙直径在约1纳米和约100纳米之间,或者可选地在约2纳米和约80纳米之间,或在约3纳米和约70纳米之间,或在约4纳米和约60纳米之间,或在约5纳米和约50纳米之间,或在约10纳米和约40纳米之间,或在约15纳米和约30纳米之间。在其他方面,每个孔隙直径为至少约100纳米、200纳米、500纳米、1000纳米、2000纳米、3000纳米、5000纳米、10000纳米、20000纳米或30000纳米。在一个方面,每个孔隙直径为50000纳米至100000纳米。在一个方面,孔隙直径不超过约100000纳米。可选地,孔隙直径不超过约50000纳米、40000纳米、30000纳米、20000纳米、10000纳米、9000纳米、8000纳米、7000纳米、6000纳米、4000纳米、3000纳米、2000纳米或1000纳米。在一些方面,孔隙基本上呈圆形。本文所用的“基本上圆形”是指至少约80或90%为圆柱体形式的形状。在一些实施方式中,孔隙形状为方形、矩形、三角形、椭圆形或六角形。孔隙711和712独立地具有各自的深度(即孔隙在两个相邻容积之间延伸的长度)。在一个方面,每个孔隙深度至少约0.3纳米。可选地,每个孔隙深度是至少约0.6纳米、1纳米、2纳米、3纳米、4纳米、5纳米、6纳米、7纳米、8纳米、9纳米、10纳米、11纳米、12纳米、13纳米、14纳米、15纳米、16纳米、17纳米、18纳米、19纳米、20纳米、25纳米、30纳米、35纳米、40纳米、45纳米、50纳米、60纳米、70纳米、80纳米或90纳米。在一个方面,每个孔隙深度不超过约100纳米。可选地,深度不超过约95纳米、90纳米、85纳米、80纳米、75纳米、70纳米、65纳米、60纳米、55纳米、50纳米、45纳米、40纳米、35纳米、30纳米、25纳米、20纳米、15纳米或10纳米。在一个方面,孔隙的深度在约1纳米和约100纳米之间,或者可选地在约2纳米和约80纳米之间,或在约3纳米和约70纳米之间,或在约4纳米和约60纳米之间,或在约5纳米和约50纳米之间,或在约10纳米和约40纳米之间,或在约15纳米和约30纳米之间。在一些方面,纳米孔隙穿过膜延伸。例如,孔隙可以是插入脂质双层膜中的蛋白质通道,或者其也可以是通过钻孔、刻蚀或以其他方式形成通过固态基质(如二氧化硅、氮化硅、石墨烯或由这些或其他材料的组合形成的层)的孔隙来工程化。在一些方面,纳米孔隙的长度或深度足够大,从而形成连接两个在其它方面分隔的容积的通道。在一些此类方面,每个孔隙的深度大于100纳米、200纳米、300纳米、400纳米、500纳米、600纳米、700纳米、800纳米或900纳米。在一些方面,每个孔隙的深度不超过2000纳米或1000纳米。在一个方面,孔隙以约10纳米和约1000纳米之间的距离间隔开。在一些方面,孔隙之间的距离大于1000纳米、2000纳米、3000纳米、4000纳米、5000纳米、6000纳米、7000纳米、8000纳米或9000纳米。在一些方面,孔隙间距不超过30000纳米、20000纳米或10000纳米。在一个方面,距离为至少约10纳米,或者可选地为至少约20纳米、30纳米、40纳米、50纳米、60纳米、70纳米、80纳米、90纳米、100纳米、150纳米、200纳米、250纳米或300纳米。在另一个方面,距离不超过约1000纳米、900纳米、800纳米、700纳米、600纳米、500纳米、400纳米、300纳米、250纳米、200纳米、150纳米或100纳米。在又一个方面,孔隙之间的距离在约20纳米和约800纳米之间,在约30纳米和约700纳米之间,在约40纳米和约500纳米之间,或在约50纳米和约300纳米之间。两个孔隙可以以任何位置排列,只要它们允许腔室之间的流体连通并具有规定的大小和间距。在一个方面,孔隙的布置使得它们之间没有直接堵塞。仍然在一个方面,孔隙基本上是同轴的,如图7a中所示。在一个方面,如图7a中所示,装置通过分别在腔室703、704和705中的电极721、722和723连接到一个或多个电源。在一些方面,电源包含电压钳或膜片钳,其可以提供跨各孔隙的电压并独立地测量通过各孔隙的电流。在这个方面,电源和电极配置可以将中腔室设置成两个电源的共同地线。在一个方面,一个或多个电源配置为在上腔室705(腔室a)和中腔室704(腔室b)之间施加第一电压v1,和在中腔室704和下腔室703(腔室c)之间施加第二电压v2。在一些方面,第一电压v1和第二电压v2是独立可调的。在一个方面,中腔室被调节为相对于两个电压的地电压。在一个方面,中腔室包含用于在各个孔隙和中腔室中的电极之间提供电导的媒介。在一个方面,中腔室包含用于在各个孔隙和中腔室中的电极之间提供电阻的媒介。保持这种电阻相对于纳米孔隙电阻足够小有利于跨孔隙的两个电压和电流解耦,这有助于电压的独立调节。电压的调节可用于控制腔室内带电颗粒的运动。例如,当两个电压设置为极性相同时,适当带电的颗粒可以从上腔室顺序地移动到中腔室和到下腔室,或者反过来。在一些方面,当两个电压被设置成相反极性时,带电颗粒可以从上腔室或下腔室移动到中腔室并停留在那里。装置中电压的调节可以特别地用于大的分子如带电聚合物支架的运动的控制,该大分子足够长以同时跨两个孔隙。在这个方面,如下所述,分子移动的方向和速度可以通过电压的相对大小和极性来控制。所述装置可以包含适合容纳液体样品(特别是生物样品)的材料和/或适合于纳米加工的材料。在一个方面,此类材料包括介电材料,例如但不限于硅、氮化硅、二氧化硅、石墨烯、碳纳米管、tio2、hfo2、al2o3或其它金属层,或这些材料的任何组合。在一些方面,例如,约0.3纳米厚的单片石墨烯膜可用作孔隙承载膜。作为微流体装置且容纳双孔隙微流体芯片设施的装置可以通过多种手段和方法来制造。对于由两个平行的膜构成的微流体芯片,两个膜可以同时通过单波束钻孔以形成两个同心孔隙,尽管与任何适合的校准技术协同在膜的各侧使用不同的波束也是可能的。概括地说,外壳确保腔室a-c的密封分离。在图7b显示的一个方面,外壳在电压电极721、722和723及纳米孔隙711和712之间提供最小接入电阻,以确保每个电压主要跨各孔隙施加。在一个方面,所述装置包括微流体芯片(标记为“双核心芯片”),其由通过间隔体连接的两个平行的膜构成。每个膜包含通过膜中心用单波束钻孔形成的孔隙。进一步,所述装置优选具有用于芯片的外壳。外壳确保腔室a-c的密封分离,并为电极提供最小接入电阻以确保每个电压主要跨各孔隙施加。更具体地说,孔隙-承载膜可以用具有5-100纳米厚的硅、氮化硅或二氧化硅窗口的透射电子显微(tem)格栅制造。间隔体可采用绝缘体(如su-8、光刻胶、pecvd氧化物、ald氧化物、ald氧化铝)或蒸发的金属材料(如银、金或铂),且占据在膜之间的腔室b的否则为水性的部分中的小空间而用于分隔所述膜。支持器置于由腔室b的最大体积部分构成的水性浴中。腔室a和c可以通过较大直径的通道(用于低接入电阻)达到,这导致膜密封。聚焦的电子或离子束可以用来钻出通过膜的孔隙,并使其自然对准。孔隙也可以通过对每层施加适当束聚焦来雕刻(收缩)至较小尺寸。任何单一纳米孔隙钻孔方法也可以用来在两个膜中钻出孔隙对,考虑到对于给定方法可能的钻孔深度和膜的厚度。预钻出微孔隙到规定的深度和然后通过膜的剩余部分钻出纳米孔隙对于进一步优化膜的厚度也是可能的。在另一个方面,生物纳米孔隙插入到固态纳米孔隙中以形成杂化孔隙可用于双孔隙方法中的任一或两个孔隙。生物孔隙可以增加离子电流测量的灵敏度,且在仅单链多核苷酸在双孔隙装置中捕获和控制(例如,用于测序)时是有用的。通过在装置的孔隙处存在的电压,带电分子可以通过腔室之间的孔隙移动。移动的速度和方向可以通过电压的大小和极性控制。此外,由于两个电压可以各自独立地调节,所以带电分子的运动方向和速度可以在各腔室中精细地控制。一个例子涉及带电聚合物支架,例如dna,其长度大于包括两个孔隙的深度加两个孔隙之间的距离的综合距离。例如1000bp的dsdna长度约为340纳米,且显著大于间隔20纳米的两个10纳米深孔隙跨越的40纳米距离。第一步中,将多核苷酸加载到上腔室或下腔室中。由于其在ph约7.4的生理条件下带负电荷,多核苷酸可以跨施加电压的孔隙移动。因此,第二步中,相同极性且大小相同或相近的两个电压施加于孔隙以顺序地跨两个孔隙移动多核苷酸。大致在多核苷酸到达第二孔隙的时候,可以改变一个或两个电压。由于两个孔隙之间的距离选择为比多核苷酸的长度短,当多聚核苷酸到达第二孔隙时,它也在第一孔隙中。因此,在第一孔隙处的电压极性的突然改变产生将多核苷酸拉离第二孔隙的力,如图7c所示。假设两个孔隙具有相同的电压-力影响,且|v1|=|v2|+δv,值δv>0(或<0)可以为了在v1|(或v2)方向上获得可调的运动而进行调节。在实践中,虽然各个孔隙处电压诱导的力不会由于v1=v2而相同,但校准实验可以确定对于给定的双孔隙芯片产生相等的拉力的适当偏置电压;且围绕该偏置电压的变化然后可以用于定向控制。如果,在此时,第一孔隙处电压诱导力的大小小于第二孔隙处电压诱导力的大小,则多核苷酸继续穿越两个孔隙移向第二孔隙,但速度较低。在这个方面,很容易理解,多核苷酸运动的速度和方向可以通过两个电压的极性和大小来控制。正如下面将进一步描述的,运动的这种精细控制有着广泛的应用。因此,在一个方面,提供了用于控制带电聚合物支架通过纳米孔隙装置的运动的方法。所述方法需要(a)将包含带电聚合物支架的样品加载到上述任一实施方式的装置的上腔室、中腔室或下腔室之一中,其中该装置被连接到用于在上腔室与中腔室之间提供第一电压和在中腔室与下腔室之间提供第二电压的一个或多个电源;(b)设置初始第一电压和初始第二电压以使聚合物支架在腔室之间移动,从而使聚合物支架跨第一和第二孔隙两者定位;和(c)调节第一和第二电压以使两个电压都产生将带电聚合物支架拉离中腔室的力(电压竞争模式),其中在受控条件下,两个电压大小不同,以使得带电聚合物支架沿任一方向且以受控的方式跨两个孔隙移动。为了在步骤(c)中建立电压竞争模式,各个孔隙处的电压各自施加的相对作用力针对所用的各双孔隙装置来确定,并且这可以利用校准实验通过观察不同电压值对多核苷酸运动的影响来进行,所述影响可以通过探测已知位置和多核苷酸中的可检测特征(这些特征的例子之后在本公开中详细阐述)来测量。例如,如果力在各个公用电压下是等同的,则在各孔隙处使用相同的电压值(上腔室和下腔室中相对于接地的中腔室具有共同的极性)在不存在热扰动的情况下(布朗运动的存在和影响在下面讨论)产生零值净运动。如果力在各个公用电压下并不相等,则实现相等的力包括在公用电压下产生较弱力的孔隙处确定和使用较大的电压。电压竞争模式的校准可对于每个双孔隙装置和对于特定带电聚合物或分子(其特征影响特定带电聚合物或分子通过各个孔隙时的力)进行。在一个方面,含带电聚合物支架的样品加载到上腔室中,且初始第一电压设置为将带电聚合物支架从上腔室牵引到中腔室和初始第二电压设置为将聚合物支架从中腔室牵引到下腔室。同样地,样品可以初始加载到下腔室中,且带电聚合物支架可以被牵引到中腔室和上腔室。在另一方面,含带电聚合物支架的样品加载到中腔室中;初始第一电压设置成将带电聚合物支架从中腔室牵引到上腔室;和初始第二电压设置成将带电聚合物支架从中腔室牵引到下腔室。在一个方面,步骤(c)中调节的第一电压和第二电压在大小上高达两个电压之间的差异/差额的约10倍至约10000倍。例如,两个电压可以分别为90毫伏和100毫伏。两个电压的大小(约100毫伏)为它们之间的差异/差额(10毫伏)的约10倍。在一些方面,电压的大小高达两个电压之间的差异/差额的至少约15倍、20倍、25倍、30倍、35倍、40倍、50倍、100倍、150倍、200倍、250倍、300倍、400倍、500倍、1000倍、2000倍、3000倍、4000倍、5000倍、6000倍、7000倍、8000倍或9000倍。在一些方面,电压大小不超过两个电压之间的差异/差额的约10000倍、9000倍、8000倍、7000倍、6000倍、5000倍、4000倍、3000倍、2000倍、1000倍、500倍、400倍、300倍、200倍或100倍。在一个方面,在步骤(c)中第一电压和第二电压的实时或在线调节是采用专用的硬件和软件以高达数百兆赫的时钟频率通过主动控制或反馈控制进行的。第一电压或第二电压或两者的自动控制是基于第一或第二或两个离子电流测量的反馈。传感器在某些实施方式中,本发明的纳米孔隙装置包括一个或多个传感器以完成目标基序的结合状态的识别。装置中使用的传感器可以是任何适合于识别分子或颗粒(如带电聚合物)的传感器。例如,传感器可以配置为通过测量与带电聚合物或带电聚合物的一个或多个单独组分相关的电流、电压、ph、光学特征或停留时间来识别带电聚合物。在一些实施方式中,传感器包括放置在孔隙相对侧的一对电极以测量在分子或颗粒,特别是带电聚合物(例如,多核苷酸),移动通过孔隙时的跨孔隙离子电流。在某些实施方式中,传感器测量聚合物或聚合物的组分(或单元)的光学特征。此类测量的一个例子包括通过红外(或紫外)光谱识别特定单元独特的吸收带。当使用停留时间测量时,基于特定单元通过传感装置花费的时间长度,将单元的大小与特定的单元相关联。在一些实施方式中,传感器用与各个探针形成不同的非共价键的试剂功能化。在这一方面,间隙可以较大且仍允许有效测量。例如,5nm的间隙可以用于检测大致测定为5nm的探针/靶标复合体。用功能化传感器的通道传感称为“识别隧道效应(recognitiontunneling)”。使用带有识别隧道效应的扫描隧道显微镜(stm),容易识别与目标基序结合的探针。因此,本技术的方法可以为一个或多个识别隧道位点提供带电多核苷酸(例如,dna)传递率控制,各识别隧道位点位于一个或两个纳米孔隙通道中或孔隙之间,且电压控制可确保每个探针/靶标复合体停留于各个位点用于稳定识别的充分时间段。本公开的装置和方法中的传感器可以包含金、铂、石墨烯或碳,或者其他合适的材料。在特定的方面,传感器包括由石墨烯制成的部件。石墨烯可以起到导体和绝缘体的作用,因此通过石墨烯和跨纳米孔隙的隧道电流可以测序移位dna。在一些实施方式中,隧道间隙的宽度为约1纳米至约20纳米。在一个方面,间隙的宽度为至少约1纳米,或者可选地至少约1.5、2、2.5、3、3.5、4、4.5、5、6、7、8、9、10、12或15纳米。在另一个方面,间隙的宽度不大于约20纳米,或者可选地不大于约19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3或2纳米。在一些方面,此宽度在约1纳米与约15纳米之间,在约1纳米和约10之间纳米,在约2纳米和约10纳米之间,在约2.5纳米和约10纳米之间,或在约2.5纳米和约5纳米之间。在一些实施方式中,传感器是电传感器。在一些实施方式中,在探针具有产生独特的荧光特征的标记时,传感器检测荧光检测手段。出口处的辐射源可以用来检测该特征。应理解,尽管本发明已经结合上述实施方式描述,但前述说明和以下实施例意图阐明而不是限制本发明的范围。本发明范围内的其它方面、优势和改进对于本发明所属领域的技术人员是明显的。实施例实施例1–固态纳米孔隙实验中单独的dna纳米孔隙仪器使用灵敏的电压-钳放大器来施加跨孔隙的电压v而同时测量通过开放孔隙的离子电流i0。当单一带电分子如双链dna(dsdna)被捕获并通过电泳驱动经过孔隙时,测定的从i0至ib的电流偏移及偏移量δi=i0-ib和持续时间td用于表征事件。在记录实验过程中的许多事件后,分析在δivs.td曲线上的事件分布以在曲线上表征群体中的相应分子。以这种方式,纳米孔隙提供用于生物分子探测的简单、无标记、纯电子的单分子方法。在氮化硅(sin)基底中制造的单一纳米孔隙是100nm厚sin膜中的40nm直径孔隙(图11a),其显示为固态纳米孔隙的实例。在图11b中,代表性的电流迹线显示了在含1mkcl的缓冲液中200mv下由5.6kbdsdna以单行方式(未折叠的)经过10nm厚sin中的11nm直径纳米孔隙引起的阻塞事件。电流在dna于或高于0.3m的kcl浓度下经过孔隙时减弱,而电流在dna于低于0.3m的kcl浓度下经过孔隙时增强。平均开放通道电流是i0=9.6na,而平均事件幅度为ib=9.1na,且平均事件持续时间td=0.064ms。dsdna分子经过纳米孔隙移位的幅度偏移是δi=i0-ib=0.5na。在图11c中,散点图显示了在16分钟内记录的所有1301个事件的|δi|vs.td。实施例2–捕获包含pna和生物素的分子用于靶序列检测我们已经证明了通过工程化聚合物支架允许溶液中化合物的结合检测的途径。我们提供了已经进行修饰以包含结合中性抗生物素蛋白的生物素部分的pna探针。中性抗生物素蛋白增大体积并因此使得pna在大(例如,15-30nm直径)的纳米孔隙中可检测。特别地,我们对5.6kbdsdna支架工程化以结合12-mer肽-核酸(pna)探针分子,其中各pna探针具有3个生物素化位点,各位点用于结合中性抗生物素蛋白(图12a)。我们对dsdna支架工程化以具有25个与我们的pna探针结合的不同位点(结合基序)(图12b)。我们提供了包含仅聚合物支架、游离中性抗生物素蛋白或探针/dna复合体的溶液(图13)。来自各群体的所得电流事件印记(图13)显示,dna/pna/中性抗生物素蛋白复合体导致高于其它背景事件类型(例如,单独的未结合dna、单独的中性抗生物素蛋白、单独的pna/中性抗生物素蛋白)的可检测移位电流印记且因此可以在纳米孔隙装置中识别。在这一实施例的其余部分中,我们证明dna/pna/中性抗生物素蛋白复合体可以以高可信度用纳米孔隙检测。结合特定dna序列的探针是与独特序列(gaaagtgaaagt,useq1)结合的蛋白质核酸分子(pna),该序列在整个支架中重复25次。用于实验中的pna具有序列gaa*agt*gaa*agt,其中*表示生物素通过与赖氨酸氨基酸偶联在γ位并入pna骨架中,且因此,各pna具有三个生物素分子并潜在地结合3个中性抗生物素蛋白分子(pnabio)。为结合pna,60nm支架加热到95℃2分钟,冷却到60℃并在15mmnacl中与对于骨架上的可能pna-结合位点10x过量的pna孵育1hr和然后冷却到4℃。过量pna针对10mmtrisph8.0透析(20kmwco,thermoscientific)2hr。这一dna/pna复合体然后用与支架结合的对于可能的生物素位点10-倍过量的中性抗生物素蛋白蛋白质(pierce/thermoscientific)标记(假定在透析过程中60%的pna降低)。反应如上所述电泳以评估纯度、浓度和潜在聚集。图14a-b显示了比较来自三个独立实验的δivs.td分布的数据:单独dna(d)、单独中性抗生物素蛋白(n)和d/p/n试剂(dpn)。d/p/n实验中的最大|δi|事件归因于d/p/n复合体(图13),从而提供基于其结合状态(即,未结合的、具有pna的支架及具有pna和结合的中性抗生物素蛋白的支架)来对事件加标签的简单标准。具体地,我们可以将事件标记为对应于d/p/n复合体,如果对于该事件,|δi|>4na。对于图14a中的数据集,d/p/n实验中9.3%(390)的事件具有|δi|>4na,且对照中仅0.46%的d和0.16%的n事件超过4na。在1mkcl和施加的200mv下使用7nm直径孔隙的单独实验(数据未显示)中,在仅具有pna和0.4nm浓度的中性抗生物素蛋白的对照中,没有事件(0%)超过4na。应用我们的数学判据,随机变量q={标记事件的分数}具有二项分布,并且使用这一和其它统计建模工具,我们对于该数据集可以计算99%置信区间为q=9.29±1.15%。因为9.29%>0.46%(最大假阳性%)良好地符合q的99%置信区间,我们具有阳性测试结果,且在数据收集的8分钟内。事实上对于仅具有前60秒的数据的这一数据集获得了相同的99%置信区间。凝胶迁移(图14c)显示支架dna迁移以中性抗生物素蛋白依赖性的方式迟滞;这指导我们在这一初步实验中使用10x浓度,因为看起来所有dna被标记且产生近乎均质的群体。实施例3–vspr蛋白与dna支架结合和纳米孔隙检测vspr蛋白是来自霍乱弧菌(v.cholerae)的90kda蛋白质,其以序列特异性的方式以高的微摩尔亲和力与dsdna直接结合(参见参考文献:yildiz,fitnath.,nadiaa.dolganov和garyk.schoolnik."vpsr,amemberoftheresponseregulatorsofthetwo-componentregulatorysystems,isrequiredforexpressionofbiosynthesisgenesandepsetr-associatedphenotypesinvibriocholeraeo1eltor."journalofbacteriology183,no.5(2001):1716-1726)。在使用纳米孔隙技术的这一靶序列检测实施例中,vspr起到具有位点特异性的dna结合域的探针分子的作用。在这一实验中,我们显示dna支架上vspr的检测作为使用蛋白质检测dna中存在的特定序列的模型。dna支架含有10个vspr特异性结合位点(图15)。为保持vspr对dsdna结合的亲和力,我们使用0.1mkcl,这是其中vspr-结合的支架移位通过纳米孔隙增强通过纳米孔隙的电流的盐浓度(图16)。我们提供了在记录缓冲液(recordingbuffer)中含有18nm浓度的vspr蛋白质的溶液,且在标记过程(结合步骤)中180nm。这导致vspr蛋白对于dna上的结合位点18x过量。实验在ph8.0(vspr蛋白质的pi是5.8)下运行。考虑到kd和dna浓度,仅0.1-1%的dna应当被vspr完全占据,较大的百分比被部分占据,且一些未知的剩余百分比的dna完全未结合。在纳米孔隙实验过程中溶液中也存在游离vspr蛋白质。两个代表性的事件显示于图16a和图16b中。在使用vspr的实验中,vspr浓度是18nm(1.6mg/l),10nm结合位点。支架浓度是1nm,导致每6.6秒捕获。孔隙尺寸是15nm直径和长度。电压是-100mv,并注意负电压产生负电流,因此向上偏移对应于衰减事件,如对于vspr-结合的dna事件所显示的(图16b),而向下偏移产生如对于未结合的dna支架事件所显示的正向偏移(图16a)。这与图2中理想的信号模式和条件一致,其中dna事件(图16a)与融合分子-结合dna事件(图16b)相比具有更短的持续时间和相反的极性。因此,从该图得到的关键观察是vspr-结合的事件与未结合的dna事件相比具有相反的信号极性且因此是特定dna序列存在的容易检测的指标。图17显示了另外10个与vspr-结合的支架通过孔隙一致的代表性电流衰减事件。在记录的10分钟内具有90个这样的事件,对应于每6.6秒1个vspr-结合事件。事件是幅度上50-150pa和持续时间上0.2-2毫秒的衰减。如所述的,在图16-17中向下的事件对应于电流增强事件和向上事件对应于电流衰减事件,且这种偏移方向甚至在基线为显示目的归零时保持。实施例4–序列特异性探针合成和靶序列结合在本实施例中,我们显示用于与目标靶序列结合的pna探针的产生,其中特征添加到pna探针以允许纳米孔隙中更高的检测灵敏度。我们产生了包含3个半胱氨酸残基的bispna探针。bispna探针包含能够在靶dna分子的该靶序列位置处与含有ctttccc的靶序列的dna序列结合的pna的序列。bispna探针也用马来酰亚胺基-peg-me在bispna探针上的3个半胱氨酸残基处标记以增强在纳米孔隙中与目标dna分子连接的探针的检测。pna-peg探针通过在还原条件下将100倍过量的接头(甲基-peg(10kda)-马来酰亚胺)与bispna(lys-lys-cys-peg3-jtttjjj-peg-cys-peg-ccctttc-peg-cys-lys-lys)一起孵育而产生。接头的马来酰亚胺部分在ph7.4下与pna中的游离巯基反应,因此产生peg化的pna。赖氨酸的添加提高了试剂对于其特异性同源dna序列的亲和力,从而允许其在高盐条件(1mlicl)下保持结合。与dsdna分子上的其靶序列结合的所得的pna-peg探针显示于图18a中。为确认dna-peg探针与dna分子上的其靶序列的结合,我们将不同形式的peg探针与dna孵育并使用所得的溶液进行凝胶迁移分析。对于这一分析,我们运行4个样品,如图18b中所示。道1是仅dna,道2是dna+pna,道3是dna+pna-peg(10kda)和道4是dna+pna-peg(20kda)。道2-4中的向上偏移与bispna种类与dna结合一致。带圆圈的种类是dna/pna-peg,在标记实验中作为残留pna(无peg)存在的道3和4中加框的种类是dna/pna。凝胶迁移分析的结果显示包含靶序列的dna和pna探针与互补于靶序列的同源dna序列的复合体形成而与peg和pna的连接无关。因此,我们在此证明能够在纳米孔隙中检测的序列特异性探针的成功复合体形成。我们然后进行分析以证明pna探针对其靶dna序列的特异性。在此,我们将pna探针(无peg)与包含无靶序列的dna(道2)、具有包含与pna探针的单碱基错配的靶序列的dna(道3)和具有完整靶序列的dna(道4)的样品一起孵育,并使用凝胶迁移分析来分析各样品,其结果显示于图18c中。道1是dna标志物。如通过我们的结果显示的,具有精确靶序列匹配的dna(道4)结合pna,而具有包含单碱基错配序列的靶序列的dna(道3)和不具有靶序列的dna(取代靶序列的随机序列)(道2)未显示pna结合。因此,凝胶迁移分析显示pna特异性地结合包含其靶序列的dna,而没有与具有甚至靶序列中的单一错配的dna的结合。实施例5–纳米孔隙中使用修饰的序列特异性探针的靶序列检测在本实施例中,我们显示包含与我们的peg修饰的序列特异性pna探针结合的靶序列的dna分子的检测。此处,我们提供了三个不同的pna探针以基于peg连接和peg长度具有不同的体积。使用三种类型的探针:1)没有peg的pna,2)与5kdapeg结合的pna和3)与10kdapeg结合的pna。各探针与包含靶序列的dna混合并在纳米孔隙中运行以观察与pna探针结合的dna的检测。样品中各复合体的浓度在1mlicl缓冲液中是2nm。样品在100mv的施加电压下在纳米孔隙装置中运行。结果显示在图19a-19e中。所观察的代表性单个事件在图19a中对于与各类型的探针结合的dna显示。来自dna/bispna事件的事件特征显示在左侧。来自具有最多3个与各pna结合的peg且peg大小为5kda的dna/bispna-peg复合体的事件特征显示在中间。来自具有最多3个与各pna结合的peg且peg大小为10kda的dna/bispna-peg复合体的事件特征显示在右侧。各自的事件特征通过在识别的复合体的移位过程中经由纳米孔隙的电流阻塞测量。在图19a中,分子图示显示了用于目视比较的按比例调整大小的线性peg和dna。随着探针尺寸(体积)增大,事件特征改变。我们分析了事件群体并生成各数据集中所有事件的平均电导偏移(dg)vs.持续时间的散点图。我们生成来自我们的实验的事件平均电导(平均电流偏移除以电压)相对事件持续时间(宽度)的散点图,如图19b中所示。该图显示dna/pna、dna/pna-peg(5kda)和dna/pna-peg(10kda)给出了基于其事件持续时间和平均电导而不同的重叠群体。我们生成直方图以显示不同复合体之间对于各事件观察的平均电导偏移(dg)的差异(图19c)。我们也生成直方图以显示不同复合体之间观察的事件持续时间的差异(图19d)。实施例6–突变的cftr基因靶序列在纳米孔隙中的检测以检测人囊性纤维化我们已经证明我们的修饰pna探针与靶序列结合的特异性和在纳米孔隙装置中使用探针检测靶序列的能力。在此,我们观察修饰的pna探针在纳米孔隙装置中检测来自患者的样品中引起疾病(具体地囊性纤维化)的突变的用途。我们产生(按照实施例4中描述的方法)修饰的pna探针(pna-peg探针),其包含与靶dna序列特异性结合的pna分子,该靶dna序列包含其中带有引起囊性纤维化的突变(δf508)的cftr基因。与pna探针结合的peg为5kda。包含囊性纤维化疾病突变的dna与对该突变特异性的peg化pna一起孵育。样品然后置于具有26nm孔隙的纳米孔隙装置中且通过纳米孔隙的移位事件被记录和分析。与结合于dna分子的pna-peg探针的移位相关的移位事件特征在具有包含引起囊性纤维化的突变(δf508)的dna的样品中观察到。代表性的事件特征显示于图20a中。使用具有仅dna或仅dna/pna(即,没有peg-pna)的样品的实验没有给出高于背景的明确的移位事件,证明孔隙精确地识别与dna结合的pna-peg探针的能力,且检测的增强通过本文提供的修饰探针来获得。对于来自具有靶突变基因和pna-peg探针的样品的记录事件集,事件通过平均电导偏移和持续时间来表征并进行分析。图20b显示对于各记录的事件的平均电导偏移v.持续时间图。图20c和图20d显示相应的直方图以分别表征通过各事件的平均电导偏移和持续时间检测的事件。分析的数据匹配对于dna/pna-peg(5kda)复合体移位通过纳米孔隙的预期数据,表明纳米孔隙装置中cftr突变靶序列的成功的结合和识别。我们也对包含我们的对δf508cftr基因突变特异性的pna-peg(5kda)探针的样品与包含具有野生型cftr序列的300bpdna的样品(道2)和与包含具有δf508cftr基因突变的300bpdna的样品(道3)运行凝胶迁移分析(图20e)。这一数据显示我们的pna-peg探针仅特异性地结合δf508靶序列,但不结合野生型序列。因此,我们已经成功地检测包含单碱基cftr基因突变(δf508)的dna,并在此证明我们的系统检测样品中的多核酸的特定序列的用途,包括用于诊断或治疗人类患者的适应症。实施例7–在纳米孔隙中使用pna-peg探针的传染性细菌检测在本实施例中,我们观察我们的修饰的探针使用纳米孔隙装置检测样品中细菌dna的存在的用途。我们合成了具有能够特异性地结合轻型链球菌(s.mitis)细菌dna的pna分子的探针。bispna包含与对于轻型链球菌细菌物种特异性的序列互补的序列。在本分析中,pna探针结合于10kdapeg以允许在与细菌dna结合时在纳米孔隙中进行检测。我们将pna探针与细菌dna混合并对样品进行凝胶迁移分析以观察结合。图21a显示了凝胶迁移分析的结果,道1包含细菌dna而没有pna探针,和道2包含细菌dna及pna探针。我们的观察结果显示,我们的pna/peg(10kda)探针结合于轻型链球菌细菌dna。我们接着制备两个样品用于在纳米孔隙中检测。第一个样品包括细菌dna与peg-修饰的pna探针(dna/bispna-peg)。第二个样品仅包括细菌dna。我们在两个连续实验中通过纳米孔隙装置运行这些样品,并分析所得的事件。图21b显示对于在两个连续实验中所有记录事件的纵轴上的平均电导偏移(dg)vs.横轴上的持续时间的散点图。显示了通过带标签的样品1(方块)和不带标签的样品2(圆圈)表征的事件。带标签的分子始终高于背景阈值(断线),而不带标签的分子低于该线并与背景群体一致。来自多个背景实验(dna/pna而没有peg、过滤的血清等)的分子群体用于建立用于标记带标签事件的阈值(线)。背景事件在此未显示。为精确检测样品中的细菌dna,dna必须使用高度位点特异性的探针加标签。我们的结果显示,轻型链球菌细菌dna的pna/peg结合群体可从背景事件分辨,而仅dna和仅dna/pna不能分辨。因此,我们的修饰的pna-peg序列特异性探针允许可信地检测样品中轻型链球菌dna的存在或不存在。其它实施方式应理解,所使用的文字是说明的而非限制的文字,且可以在所附权利要求的范围内进行改变而不脱离本发明在其更宽泛的方面的真实范围和精神。尽管本发明关于几种描述的实施方式相当详细地和具体地进行了说明,但其不是意图将本发明限制于任何这种特例或实施方式或者任何特定实施方式,而是应参照所附权利要求来解释以基于现有技术提供对这些权利要求的最宽的可能解释并因此有效地涵盖本发明的预期范围。本文中提及的所有公开、专利申请、专利和其它参考文献通过引用全文并入。在冲突的情况下,以本说明书(包括定义)为准。另外,段落标题、材料、方法和实施例仅为说明性的而不旨在是限制性的。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1