一种荧光纳米探针及其制备方法和其在生物传感中的应用与流程
本发明属于分析化学领域,具体涉及一种基于二维镧金属有机骨架的荧光纳米探针及其制备方法和其在生物传感中的应用。
背景技术:
二维纳米材料因其特异的大比表面积已受到科研领域的热切关注。在生物传感领域,已被广泛应用到生物分子的检测,尤其是核酸分子的检测。其中,应用最多的二维纳米材料为石墨烯及其衍生物氧化石墨烯(Graphene Oxide, GO)。GO继承了石墨烯优良的光学性质,不但具有较好的亲水性,而且具有大的共轭结构,可通过荧光能量共振转移和非福射偶极-偶极相互作用,有效猝灭荧光物质(染料分子、量子点和上转换纳米材料等)发出的荧光。因此,纳米级的GO作为荧光猝灭元件,可实现对DNA等生物分子的灵敏检测。
近年来,新型的二维纳米材料(如MoS2、WS2和MnO2等),成功实现了对生物分子(如DNA等)的灵敏检测。例如,文献报道的MoS2二维纳米材料(Changfeng Zhu,J. Am. Chem. Soc. 2013, 135, 5998−6001),可吸附荧光标记的单链DNA,并使其荧光信号猝灭,当加入与该单链DNA完全匹配的目标DNA后,两者通过碱基配对原则进行杂交,形成结构稳定的双螺旋DNA结构,并从二维纳米材料脱离,体系的荧光信号恢复。根据体系荧光强度的变化,可实现对目标DNA的定量检测。而上述二维纳米材料在应用于细胞内或体内分析时,会遇到难以代谢的问题,进而产生一定的毒性,对细胞或组织造成损伤。
纳米级金属有机骨架(Metal-Organic Frameworks,MOFs)作为一种新型的传感材料,己成为材料化学研究的热点之一。荧光MOFs材料不仅具有优秀的气体储存、选择和分析能力,而且也可用来检测阴阳离子、溶剂分子和生物分子等一系列的客体分子。此外,相比于其他纳米材料(如GO、MoS2、WS2和MnO2等),纳米级MOFs在细胞内或体内完成生物传感之后,更容易被缓慢水解、代谢,产生较低的生物毒性。因此,MOFs在生物分子传感领域具有一定潜力。
技术实现要素:
针对上述问题,本发明提供了一种基于二维镧金属有机骨架(MOF-La)的荧光纳米探针,该荧光探针毒性较低,适用于检测细胞内部腺苷分子。
本发明另一目的是提供一种基于二维镧金属有机骨架(MOF-La)的荧光纳米探针的制备方法。该方法采用2,2′-硫代二乙酸和镧离子制得MOF-La晶体后,通过剥离步骤得到MOF-La的荧光纳米探针。
一种基于二维镧金属有机骨架(MOF-La)的荧光纳米探针的制备方法,包括如下步骤:
(1)在含有OH-的碱性溶液中,加入2,2′-硫代二乙酸或2,2′-硫代二乙酸盐,然后加入La3+镧离子无机盐,溶解后于120~180℃反应10~30h,反应后,降温至室温即得到MOF-La晶体;
(2)将步骤(1)得到的MOF-La晶体加入到有机溶剂中,超声处理25~35min,离心得到初步被剥离的MOF-La;
(3)将初步被剥离的MOF-La分散于正丁基锂的有机溶液中,在惰性气体保护下,于20~30℃反应15~25h,即得到二维MOF-La纳米材料。
(4)将二维MOF-La纳米材料分散于无机缓冲溶液或者有机缓冲溶液中,加入荧光标记的核苷酸链,室温下反应后离心得到基于二维镧金属有机骨架的荧光纳米探针。
上述方法,步骤(1)中所述的碱性溶液,为氢氧化钠水溶液或氢氧化钾水溶液。
上述方法,步骤(1)中所述的碱性溶液,其中OH-的浓度为70mM~120mM;优选浓度为90~110mM。
上述方法,步骤(1)中所述的镧离子无机盐,为La(NO3)3或La2(SO4)3。
上述方法,步骤(1)中所述的镧离子无机盐,其浓度为15mM~35mM;优选的浓度为20~30mM。
上述方法,步骤(1)中所述的2,2′-硫代二乙酸或2,2′-硫代二乙酸盐,浓度为30mM~60mM; 优选的浓度为50~55mM。
上述方法,步骤(2)中所述的有机溶剂,为乙醇或正己烷。
上述方法,步骤(3)中所述的正丁基锂的有机溶液,为正丁基锂的己烷溶液或正丁基锂的环己烷溶液。
上述方法,步骤(3)中所述的惰性气体,为氮气、氩气或氦气。
上述方法,步骤(4)中所述的缓冲溶液,为PBS缓冲溶液或三羟甲基氨基甲烷-盐酸(Tris-HCl)缓冲液。
上述方法,步骤(4)中所述的缓冲溶液,其PH为6.0~9.0;优选的pH为7.4。
上述方法,步骤(4)中所述的荧光标记的核苷酸链,为罗丹明标记的腺苷适体或荧光素标记的腺苷适体或二者的混合。
一种由上述方法制备的基于二维镧金属有机骨架的荧光纳米探针,其特征在于,该探针为片状,厚度为10nm以下,优选的厚度为2~6nm。
本发明还提供了由上述方法制备的荧光纳米探针在生物传感中的应用。
所述的应用包括细胞内或体外的荧光检测。
本发明提出的二维MOF-La探针对目标分子(腺苷)的识别是通过吸附在其表面的核酸适体对腺苷的选择性响应。当没有腺苷时,吸附有罗丹明标记的腺苷适体(TAMRA-P)和荧光素标记的腺苷适体(FAM-P)的二维MOF-La主要发出绿色荧光;当处在含腺苷的环境中时,TAMRA荧光强度恢复而FAM被进一步猝灭,是该荧光探针主要发出红色荧光。该探针可通过TAMRA和FAM两种荧光分子的荧光强度变化,检测体外或细胞内的腺苷。
本发明的有益效果在于:
(1)本发明所述的二维MOF-La探针制备方法简单,不需要严格的合成条件,且细胞毒性低。
(2)本发明所述的二维MOF-La探针可通过颜色的变化检测目标分子,避免了假阳性结果,定性定量更为准确。
(3)本发明所述的二维MOF-La探针对目标分子有良好的选择性,细胞中存在的其他生物分子对其荧光信号无明显影响。
附图说明:
图1为MOF-La晶体图。
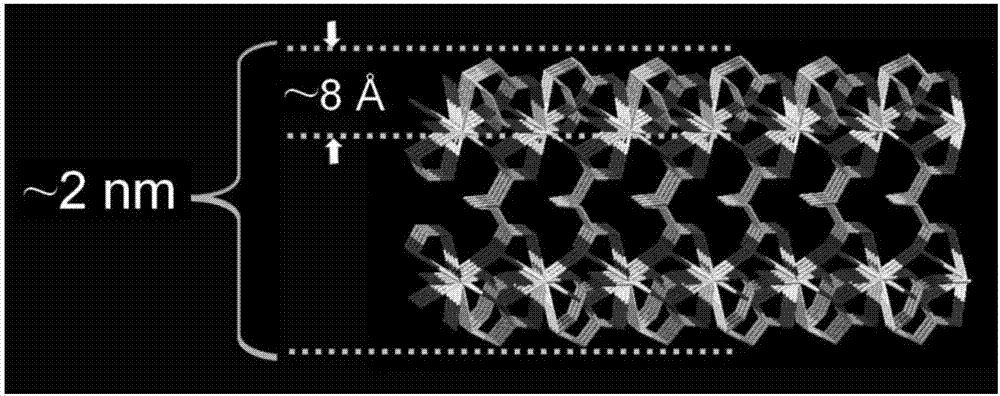
图2为单层MOF-La结构图
图3为剥离后的二维MOF-La的透射电镜图。
图4为剥离后的二维MOF-La的原子力显微镜图。
图5为二维MOF-La荧光探针对腺苷的选择性。其中,FI为荧光强度,浅色柱状图为FAM荧光强度,深色柱状图为TAMRA荧光强度。
图6为FAM-P+MOF-La探针对核苷响应荧光光谱图。
图7为TAMRA-P+MOF-La探针对核苷响应荧光光谱图。
图8为荧光探针检测MCF-7细胞中腺苷的激光共聚焦显微成像灰度图。标尺为30 µm。
具体实施方式
下面结合实施例对本发明的技术方案做进一步的说明,但不应理解为对本发明的限制:
实施例1:
一:MOF-La晶体的制备
(1) 在15 mL NaOH溶液(100 mM)中,加入120 mg (0.8 mmol)2,2′-硫代二乙酸,超声溶解。然后加入173 mg(0.4 mmol)La(NO3)3·6H2O,震荡使其溶解。将所得溶液转移至反应釜的聚四氟乙烯内胆中,封装反应釜,放入烘箱中,以150℃加热,反应15 h。反应后,反应釜降温至室温即得到MOF-La晶体,其形貌如图1所示。结构如图2所示。
(2)取上述反应得到的MOF-La (5 mg) 加入到2 mL乙醇中,利用细胞粉碎仪超声30 min,在8000 rpm 下离心,得到初步被剥离的MOF-La。然后将该MOF-La分散于10 mL正丁基锂的己烷溶液(0.16 M)中,通氮气保护,在25℃条件下,搅拌反应20 h,即得到被剥离的二维MOF-La,其形貌如图3。从原子力显微镜图(图4)可以看出,大部分二维MOF-La厚度在2-6 nm 之间。
二:探针对腺苷的荧光响应
① 向10 mL含有FAM-P(20 nM)的磷酸缓冲液(PBS,0.01 M,pH 7.4)中加入2 mg二维MOF-La,振荡反应5 min,然后分别加入30 nM的单磷酸腺苷(AMP)、二磷酸腺苷(ADP)、三磷酸腺苷(ATP)、三磷酸尿苷(UTP)、三磷酸鸟苷 (GTP)、三磷酸胞苷(CTP)、谷胱甘肽(GSH)、人血清白蛋白(HSA)、抗坏血酸(Vc)和组胺(histamine),观察荧光强度的变化。图5为二维MOF-La荧光探针对腺苷的选择性。图6为FAM-P+MOF-La探针加入核苷后的荧光光谱图。
②向10 mL含有TAMRA-P(15 nM)的磷酸缓冲液(PBS,0.01 M,pH 7.4)中加入2 mg二维MOF-La,振荡反应5 min,然后分别加入25 nM的AMP、ADP、ATP、UTP、GTP、CTP、GSH、HSA、Vc和histamine,观察荧光强度的变化,如图5。图7为TAMRA-P+MOF-La探针加入核苷后的荧光光谱图。
三:核酸适体修饰二维MOF-La
将0.2 mg二维MOF-La分散于1 mL PBS(0.01 M,pH 7.4)中,依次加入2 µL FAM-P(25 µM)和2 µL TAMRA-P(25 µM),室温下搅拌反应2 h,然后在14000 rpm下离心,得到核酸适体修饰的二维MOF-La(Dye-P+MOF-La),将其分散于2 mL PBS(0.01 M,pH 7.4)中,备用。
四:利用Dye-P+MOF-La对细胞内腺苷进行荧光检测
以人乳腺癌细胞MCF-7细胞为基本模型,将MCF-7细胞在培养皿中培养24 h。然后将50 μL Dye-P+MOF-La探针加入到培养皿中,温育1到6 h,利用激光共聚焦荧光显微镜进行观察。图6分别是Dye-P+MOF-La探针与MCF-7细胞温育1、2、4、6 h后的荧光成像图。从图6中可以看出,随着温育时间的增加FAM的荧光强度减弱,而TAMRA的荧光强度增强。
实施例2:
(1) 在15 mL KOH溶液(70 mM)中,加入77 mg (0.45 mmol)2,2′-硫代二乙酸钠,溶解后加入130 mg(0.225mmol)La2(SO4)3溶解。之后于120℃加热,反应10 h。反应后降温至室温即得到MOF-La晶体。
(2)取上述反应得到的MOF-La (5 mg) 加入到2 mL正己烷中,利用细胞粉碎仪超声35 min后离心,得到初步被剥离的MOF-La。
(3)将初步被剥离的MOF-La分散于10 mL正丁基锂的环己烷溶液(0.16 M)中,通氦气保护,在30℃条件下,搅拌反应25 h,即得到被剥离的二维MOF-La。
(4)将0.2 mg二维MOF-La分散于1 mL PBS(0.01 M,pH 8.0)中,加入2 µL FAM-P(25 µM)室温下搅拌反应,然后在14000 rpm下离心,得到核酸适体修饰的二维MOF-La。
实施例3:
(1) 在15 mL KOH溶液(90 mM)中,加入154 mg (0.9 mmol)2,2′-硫代二乙酸钠,溶解后加入227 mg(0.525mmol)La(NO3)3·6H2O溶解。之后于180℃加热,反应30 h。反应后降温至室温即得到MOF-La晶体。
(2)取上述反应得到的MOF-La (5 mg) 加入到2 mL乙醇中,利用细胞粉碎仪超声25 min后离心,得到初步被剥离的MOF-La。
(3)将初步被剥离的MOF-La分散于10 mL正丁基锂的环己烷溶液(0.16 M)中,通氩气保护,在20℃条件下,搅拌反应15 h,即得到被剥离的二维MOF-La。
(4)将0.2 mg二维MOF-La分散于1 mL Tris-HCl缓冲液(0.01 M,pH 6.0)中,加入2 µL TAMRA-P(25 µM)室温下搅拌反应,然后在14000 rpm下离心,得到核酸适体修饰的二维MOF-La。
实施例4:
(1) 在15 mL NaOH溶液(120 mM)中,加入113 mg (0.75 mmol)2,2′-硫代二乙酸,溶解后加入195 mg(0.45 mmol)La(NO3)3·6H2O溶解。之后于180℃加热,反应20 h。反应后降温至室温即得到MOF-La晶体。
(2)取上述反应得到的MOF-La (5 mg) 加入到2 mL乙醇中,利用细胞粉碎仪超声30 min后离心,得到初步被剥离的MOF-La。
(3)将初步被剥离的MOF-La分散于10 mL正丁基锂的己烷溶液(0.16 M)中,通氩气保护,在20℃条件下,搅拌反应15 h,即得到被剥离的二维MOF-La。
(4)将0.2 mg二维MOF-La分散于1 mL Tris-HCl缓冲液(0.01 M,pH 9.0)中,加入2 µL TAMRA-P(25 µM)室温下搅拌反应,然后在14000 rpm下离心,得到核酸适体修饰的二维MOF-La。
实施例5:
(1) 在15 mL NaOH溶液(110 mM)中,加入124 mg (0.83 mmol)2,2′-硫代二乙酸,溶解后加入130 mg(0.3 mmol)La(NO3)3·6H2O溶解。之后于150℃加热,反应15 h。反应后降温至室温即得到MOF-La晶体。
(2)取上述反应得到的MOF-La (5 mg) 加入到2 mL乙醇中,利用细胞粉碎仪超声30 min后离心,得到初步被剥离的MOF-La。
(3)将初步被剥离的MOF-La分散于10 mL正丁基锂的己烷溶液(0.16 M)中,通氦气保护,在25℃条件下,搅拌反应20 h,即得到被剥离的二维MOF-La。
(4)将0.2 mg二维MOF-La分散于1 mL Tris-HCl缓冲液(0.01 M,pH 7.4)中,依次加入2 µL FAM-P(25 µM)和2 µL TAMRA-P(25 µM),室温下搅拌反应,然后在14000 rpm下离心,得到核酸适体修饰的二维MOF-La。
- 还没有人留言评论。精彩留言会获得点赞!