用于治疗癌症的大分子过渡金属络合物及其制备方法与流程
本发明涉及大分子过渡金属络合物,含有它们的药物组合物,其在药剂中的用途,特别是作为抗肿瘤剂和抗转移剂,以及其制备方法。
背景技术:
金属络合物目前被公认为一种新兴类型的潜在非常有效的治疗癌症的药剂。
a.valente,m.h.garcia,f.murques,y.miao,c.rousseau,p.zinck,”firstpolymer'ruthenium-cydopentadienyl'complexaspotentialanticanceragent”(第一聚合物‘钌-环戊二烯基’络合物作为潜在的抗癌剂),journalofinorganicbiochemistry2013,127,79-81描述了如下合成的一类钌化合物:使用甲基2,3,4-三-o-苄基-α-d-吡喃葡萄糖苷(一种生物学关注的分子)作为引发剂用于由二甲基氨基吡啶催化的丙交酯的聚合反应,导致在链末端以取代的d-葡萄糖官能化的聚丙交酯;此后,该聚合物与2,2’-联吡啶-4,4’-二羰基二氯化物反应,导致含有连接到联吡啶的每个环上的酯的大配位体,其纯度约为75%。最终的化合物是在二氯甲烷中三氟甲基磺酸银的存在下在该大配位体与[ru(η5-c5h5)(pph3)2cl]之间的合成而得。
wo2007/128158a1(dyson,paul,joseph等人)公开了用于在癌症和转移瘤的治疗中抑制耐药性的过渡金属络合物。该专利申请涵盖几个过渡金属络合物族;但是,它并没有公开在其构成中具有大配位体的络合物。
用于治疗癌症的有机金属化合物公开在ep专利申请07101258.7中;然而,其中没有给出或公开含有大分子配位体的化合物的适应症。
在综述文章“polymer-metalcomplexes(pmc)forcancertherapy(用于癌症治疗的聚合物-金属络合物(pmc))”(a.vayee,p.zinck,recentresearchdevelopmentsinpolymerscience,11(2012);99-128,由transworldresearchnetwork,trivandmm,india(isbn:978-81-7895-538-4)出版)中,涉及在其构成中包含聚合物的化合物的主要族。已经报道它们中的大多数使用铂作为中心金属,而不使用环戊二烯基配位体。这些方法绝大多数是多核的,即化合物的每个分子在其构成中呈现几个金属中心。
关于钌的大分子化合物的综述文章“synthesesofmacromolecularrutheniumcompounds:anewapproachtothesearchofanticancerdrugs(大分子钌化合物合成:一种新型搜寻抗癌药物的方法)”(a.valente,m.h.garcia,inorganics2014,2,96-114)提到使用钌大分子化合物进行癌症治疗的方法。文献中所见的所有策略都是多核方法,而考虑到环戊二烯基配位体的唯一公开内容是上述文献(a.valente,m.h.garcia,f.marques,y.miao,c.rousseau,p.zinck,“firstpolymer'ruthenium-cyclopentadieny'complexaspotentialanticanceragent(第一聚合物‘钌-环戊二烯基’络合物作为潜在的抗癌剂)”,journalofinorganicbiochemistry2013,127,79-81)。有利地,本发明的络合物是单核的(即每分子仅含有一个金属原子),这允许精确控制待施用的药物的量。
施用药物和将药物递送至靶标的有效的方法的开发在抗击癌症方面与药物本身的效力同等重要。
此外,存在对于治疗上更有效并且还能够克服由目前可获得的药物引起的化疗副作用的化合物的需要。
用多核大分子金属化合物治疗的几种方法存在对于一定量的药物以金属近似百分比施用的问题,因此感觉非常需要对于施用金属的量的更高的准确性和更好的掌控。
另一个感觉到的需要是新化合物在水性介质中的稳定性。
本发明提供新的金属络合物和新的药物,以及含有它们的药物组合物,其能够以高效率和精确性递送至癌细胞,这是由于在所使用的金属的配位球中包含生物学感兴趣的大配位体和/或分子。
本发明的新络合物包括聚合物配位体,并因此它们表现出高分子量。该特征允许从肿瘤组织中增强的渗透和保留中获益,这导致与在健康组织中可能发生的相比,络合物在这些组织中的优先积累(“enhancedpermeationandretentioneffect(增强的渗透和保留效应)”,epreffect-j.kopecek,p.kopeckova,t.minko,z.r.lu,“hpmacopolymer-anticancerdrugconjugates:design,activity,andmechanismofaction(hpma共聚物-抗癌药物缀合物:设计、活性及作用机制)”,2000,eur.j.pharm.biopharm;y.matsumura,h.maeda,“anewconceptformacromoleculartherapeuticsincancerchemotherapy;mechanismoftumoritropicaccumulationofproteinsandtheantitumoragentsmancs(癌症化疗中大分子治疗新概念:蛋白质和抗肿瘤剂smancs的肿瘤向性积累机制)”,1986年,cancerres)。这是可能的,因为具有非常快速和异常细胞生长的肿瘤具有缺陷的血管形成,允许具有高分子量的分子在细胞内穿透,但是离开困难,所以随着时间的推移,肿瘤组织中积累更多。因此,与可以自由地进出肿瘤组织的低分子量分子相比,可以获得副作用的急剧减少(s.parveen,r.mrisra,s.k.sahoo,“nanoparticles:aboontodrugdelivery,therapeutics,diagnosticsandimaging(纳米粒子:药物递送、治疗、诊断和成像的福利)”,2012,nanomedicine:nanotechnology,biologyandmedicine)。
本发明还提供了包括大分子和金属药物的大分子过渡金属络合物的新合成。此外,本发明的合成提供了具有可控精确量的金属的本发明化合物的分子,其纯度为80-95%,因此这些化合物适合于受控制的施用。
收集的结果表明被施用时的本发明的大分子化合物及其源自在肿瘤中发现的特定条件下的片段两者均维持所需的细胞毒活性。
在足以使其用作药剂的时段中本发明化合物在空气和水性介质中是稳定的,并且与临床使用的药物顺铂相比,它们呈现增强的细胞毒性。这些是追求开发新药物时重要和有利的特征。
本发明的新一类化合物的目的在于应用于治疗原发性肿瘤及其起源的转移瘤的癌症。
由于本发明的化合物吸收可见光,所以它们也可以产生在激发状态(单线态)的反应性氧物种,并且可在用于治疗表面癌(如皮肤和咽部的癌症等)的光动力学疗法中使用。
药物组合物是本发明的目的。根据本发明的络合物和组合物可用作例如在原发性肿瘤及其起源的转移瘤的肿瘤的治疗中的药剂,包括在用于治疗如皮肤和咽部癌症等的表面癌症的光动力学疗法中。
这样的络合物和组合物旨在通过局部、静脉内、皮下和腹膜内施用来使用。
从以下描述、权利要求和附图中,本发明的这些和其它优点将变得更加明显明显,并且将更好地被理解。
通过对本发明的描述或实践的分析,另外的目标、优点和特征将变得对于本领域普通技术人员明显。
在整个说明书和权利要求书中,词语“包含”和“包括”及其变体不应被理解为排除其他技术特征或组分。
技术实现要素:
本发明是为了克服现有技术中提到的缺点而完成的,并且本发明的目的是提供特征在于具有由分子式[m(cpr)xyz]表示的(i)的大分子过渡金属络合物:
其中:
m是钌、铁、铑、铱或锇;
cpr是环戊二烯基或取代的环戊二烯基,在所述环戊二烯基中r是h,在所述取代的环戊二烯基中r选自:生物分子、杂芳族配位体、生物活性化合物或基团-r1、-r1-nh2、-r1-ccoh、-r1-coo-、-r1-oh、-r1-coonch3,其中r1是烷基或芳基,所述生物分子优选选自氨基酸、肽、寡肽、蛋白质、蛋白质片段、雌二醇及其衍生物、维生素、碳水化合物、水、核酸;r基团可以在任何环碳处键合到环戊二烯基环上。r可以占据多于一个碳原子,这可以导致在1、2、3、4和/或5位被取代的环戊二烯基环;
x、y或z配位体之一是大配位体,其本身可以是杂芳族配位体,x、y和z可以选自杂芳族配位体、大配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子,所述生物学感兴趣的分子优选选自糖、雌激素、含有共轭π体系的分子,x、y和z符合以下条件:
x、y或z中的至少一个是杂芳族配位体、co或二甲基亚砜;和
-x、y或z配位体中的至少一个包含或者是生物分子或生物学感兴趣的分子;
并且符合以下条件之一:
x、y和z是任何合适的单齿配位体,优选选自膦;杂芳族分子,其中杂原子可以是任何合适的杂原子,并且优选选自o,s,p,n或se;co;二甲基亚砜;乙腈;腈;异腈;二甲基甲酰胺;生物分子或生物学感兴趣的分子,并且x,y或z中至少一个包括大配位体;或
-x和y一起表示任何合适的二齿大配位体,优选选自大分子二膦)、在一个或多个杂芳环上具有至少一个亚甲氧基或氨基氧基官能的大分子杂芳族分子、大分子草酸盐或大分子甘氨酸盐,并且z是优选选自膦(磷化氢,phosphane)、杂芳族分子(其中杂原子可以是任何合适的杂原子,并且优选选自o、s、p、n或se)、co、二甲基亚砜、乙腈、腈、异腈或二甲基甲酰胺的任何合适的单齿配位体;
-x和y一起表示任何合适的二齿配位体,优选选自二膦、杂芳族分子、草酸盐、甘氨酸盐、三甲基乙二胺、乙二胺、生物分子或生物学感兴趣的分子,并且z是任何合适的单齿配位体,优选选自大分子膦、大分子杂芳族分子(其中杂原子可以是任何合适的杂原子,并且优选选自o、s、p、n或se)、大分子腈或大分子异腈。
及其药学上可接受的盐。
大配位体、大分子单齿配位体和大分子二齿配位体是这样的分子:具有>1000g/mol的分子量、天然或合成的、具有包含重复单元的直链或支链并且至少在其链末端之一具有允许它们与金属中心配位的一个或多个官能团且可选地在其链末端之一具有生物分子或生物学感兴趣的分子,所述生物分子优选选自氨基酸、肽、寡肽、蛋白质、蛋白质片段、雌二醇及其衍生物、维生素、碳水化合物、水、核酸。在一个实施方案中,大配位体是含有一个或更多个重复单元的具有直链或支链的天然或合成的聚合物,所述聚合物优选选自聚丙交酯、聚己内酯,聚-n-(2-羟丙基)甲基丙烯酰胺、聚(γ,l-谷氨酸)、聚(柠檬酸)、聚(乙二醇)、聚(天冬氨酸);共聚物,优选选自聚(γ,l-谷氨酸)-柠檬酸、聚(乙二醇)-嵌段-聚(谷氨酸)、聚(乙二醇)-嵌段-聚(天冬氨酸)、聚(乙二醇)-嵌段-聚(乳酸)、聚(乙二醇)-聚(己内酯);或天然或合成的生物聚合物,优选选自纤维素、淀粉、几丁质、蛋白质、肽、dna和rna。
金属盐是卤化物、亚硝酸盐、磷酸盐、高氯酸盐或碳酸盐。
一方面,本发明的目的是提供通式(xiv)的二齿大配位体:
通式(xv)的单齿大配位体:
如所附权利要求中所限定的。
另一方面,本发明络合物(包括大配位体的络合物)的合成程序是如所附权利要求中所限定的本发明的一个目的。
本发明的其他目的是包含药学上有效量的至少一种式(i)、式(ii)、式(iii)或式(iv)的过渡金属的大分子有机金属络合物的药物组合物和药剂,以及其作为药剂的用途,所述药剂可选地具有所附权利要求中所限定的其它活性成分和/或药学上可接受的载体和/或赋形剂。
如所附权利要求中所限定的,根据本发明的过渡金属的大分子有机金属络合物和含有它们的药物组合物可用作抗肿瘤剂和/或作为放射增敏剂用于癌症治疗和/或癌症预防,特别是用于治疗实体瘤、液体肿瘤和/或转移瘤。施用途径可以是局部的、静脉内的、皮下的或腹膜内的。
从以下描述和附图和权利要求书中,本发明的这些和其他优点将是明显的,并且将得到更好的理解。然而,提供了以下实施例和附图以说明发明概念,并不意图限制本发明的范围。
附图简述
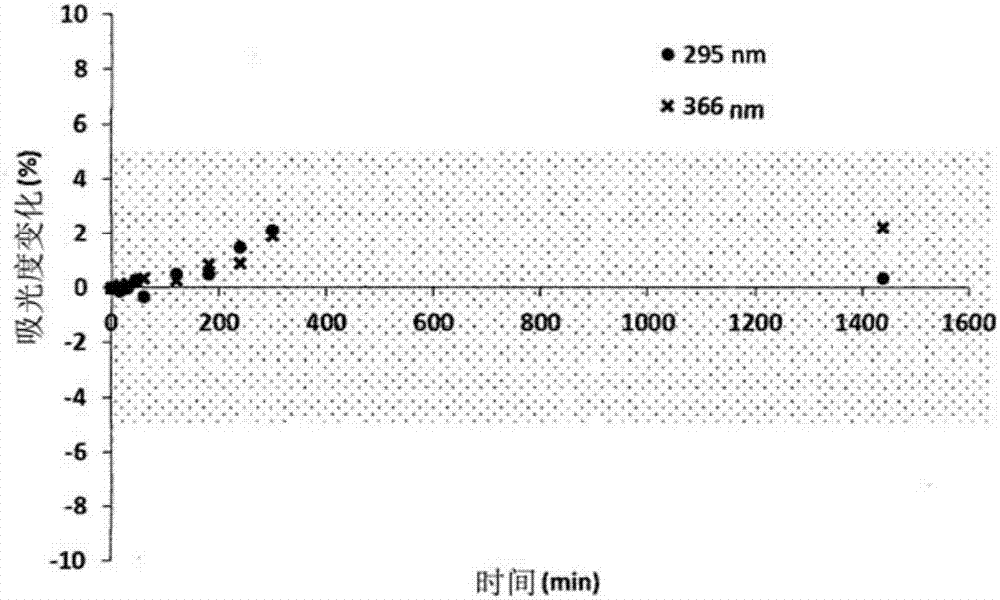
图1a)至1f)是分别示出化合物1、2、3、4、5和6在水性介质中的化学稳定性的图。
图2a)至2f)是分别示出化合物1、2、3、4、5和6的凝胶渗透色谱的结果的图。
图3a)和3b)是表示化合物5和6分别在孵育24小时和72小时后对mcf-7乳腺癌的人肿瘤细胞的细胞毒活性的图。
图4a)和4b)是表示化合物5和6在孵育72小时后分别对人卵巢癌细胞a2780和对人乳腺癌细胞mda-mb-231的细胞毒活性的剂量响应图。
图5a)至5d)是表示化合物1、2、3、4在孵育48小时后对人肿瘤细胞,分别对a2780卵巢、mcr-7乳腺、u87神经胶质瘤和a345黑素瘤人肿瘤系的细胞毒活性的图。
图6是表示化合物5和6在孵育24小时后对人mcf-7乳腺肿瘤细胞的细胞分布的图。
图7是表示未处理的人mcf-7乳腺肿瘤细胞和用化合物5和6处理的人mcf-7乳腺肿瘤细胞凋亡过程结果的图。
图8是表示在48小时孵育后确定化合物5e6mcf-7对肿瘤细胞诱导的细胞死亡机制类型的测定结果的图。
图9是表示在mcf-7人乳腺癌细胞中确定化合物5和6对细胞骨架的影响的免疫荧光测定的结果的图。
发明详述
术语“大配位体”、“大分子单齿配位体”和“大分子二齿配位体”是指这样的分子:具有相对高的分子量(>1000g/mol),天然或合成的,具有含重复单元的直链或支链并且至少在其链末端之一具有一个或多个允许其与金属中心配位的一个或多个官能团且其还可以在其链末端之一具有如下文定义的生物分子或生物学感兴趣的分子。被理解为也包括天然或合成的共聚物或生物聚合物、被理解为是大配位体的组成部分的聚合物被定义如下。
所谓“感兴趣的单体”是指可以与形成称为(共)聚合物的更大分子的其它单体结合的任何小分子。
也包括共聚的术语“聚合”应被理解为产生(共)聚合物的化学反应。
“聚合物”是指在其结构中具有直链或支链的天然或合成的分子,所述直链或支链含有一个或多个称为单体的重复单元。聚合物的优选实例是但不限于聚丙交酯、聚己内酯、聚-n-(2-羟丙基)甲基丙烯酰胺、聚(γ,l-谷氨酸)、聚(柠檬酸)、聚乙二醇、聚天冬氨酸等。在根据本发明的合成和式(i)至(iv)的描述中,术语“聚合物”还不作区分地包括天然或合成的共聚物或生物聚合物。
“共聚物”是指由不同单体形成的聚合物。共聚物的优选实例包括但不限于聚(γ,l-谷氨酸)-柠檬酸、聚(乙二醇)-嵌段-聚(谷氨酸)、聚(乙二醇)-嵌段-聚天冬氨酸、聚(乙二醇)-聚(乳酸)、聚(乙二醇)-聚(己内酯)。
在聚合的背景下,“催化剂”是加速化学反应但不自身消耗的分子。催化剂是反应的一部分,但在每个反应循环结束时再生。因此,一个催化剂单元导致几个反应物单元的转化。催化剂必须与“引发剂”区分。引发剂启动反应链,但在反应中被消耗。它不是催化剂(iupac-manualofsymbolsandterminologyforphysicochemicalquantitiesandunits(物理化学数量和单位的符号和术语手册).准备由robertl.burwell,jr.pergamonpress出版)。
天然的或合成的“生物聚合物”,表示由生物生产的聚合物或通过化学过程获得的模拟生物聚合物的聚合物;生物聚合物的优选实例是但不限于纤维素、淀粉、几丁质、蛋白质、肽、dna和rna。
“生物分子”是指存在于生物中的任何化学化合物或通过化学过程合成的模拟生物分子的分子;优选的生物分子是但不限于氨基酸、肽、寡肽、蛋白质、蛋白质片段、雌二醇及其衍生物、维生素、碳水化合物、水、核酸等。一些生物分子由于其包含杂芳族原子(heteroaromaticatom)的化学结构,本身可以被理解为“杂芳族配位体”。
“生物学感兴趣的分子”是指具有潜在生物活性的任何天然或合成的分子。如果化合物对任何细胞活组织具有相互作用或作用,则被认为是“生物活性的”。
“杂芳族配位体”是指具有单环或多环体系的任何分子,其中至少一个环具有至少一个杂原子,诸如n、o、s、se、p等。
“单齿配位体”是指具有一个带有电子可用性与过渡金属形成配位键的原子的任何分子;优选的单齿配位体是但不限于膦、杂芳族分子(其杂原子可以是o、s、p、n、se等)、co、二甲基亚砜、乙腈、腈、异腈、二甲基甲酰胺等。
“二齿配位体”是指具有两个带有电子可用性与同一金属中心形成配位键的原子的任何分子;优选的二齿配位体是但不限于二膦、杂芳族分子、草酸盐、甘氨酸盐、三甲基乙二胺、乙二胺等。
金属盐(mx3)是指任何合适的过渡金属(由m表示),特别是钌,铁,铑,铱或锇,的卤化物、亚硝酸盐、磷酸盐、高氯酸盐或碳酸盐(由x表示)。
发现使用具有通用结构式(i)的本发明化合物作为抗肿瘤剂获得最佳结果:
其由分子式[m(cpr)xyz]表示,
其中:
m是钌,铁,铑,铱或锇;
cpr是环戊二烯基(其中r是h)或取代的环戊二烯基(r选自:生物分子、杂芳族配位体、生物活性化合物或基团-r1、-r1-nh2、-r1-ccoh、-r1-coo-、-r1-oh、-r1-coonch3,其中r1是烷基或芳基);r基团可以在任何环碳处键合到环戊二烯基环上。r可以占据多于一个碳原子,可以产生在1、2、3、4和/或5位取代的环戊二烯基环;
x,y或z配位体之一是大配位体,其本身可以是杂芳族配位体,x,y和z可以选自杂芳族配位体、大配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子,x、y和z符合以下条件:
-x,y或z中的至少一个是杂芳族配位体、co或二甲基亚砜;和
-x,y或z配位体中的至少一个包含或者是生物分子或生物学感兴趣的分子;
并且符合以下条件之一:
x,y和z是任何合适的单齿配位体,优选选自膦;杂芳族分子,其中杂原子可以是任何合适的杂原子,并且优选选自o、s、p、n或se;co;二甲基亚砜;乙腈;腈;异腈;二甲基甲酰胺;生物分子或生物学感兴趣的分子并且x,y或z中的至少一个包括大配位体;或
-x和y一起表示任何合适的二齿大配位体,优选选自大分子二膦、在一个或多个杂芳环上具有至少一个亚甲氧基或氨基氧基官能的大分子杂芳族分子、大分子草酸盐或大分子甘氨酸盐,并且z是任何合适的单齿配位体,优选选自膦、杂芳族分子(其中杂原子可以是任何合适的杂原子,且优选选自o,s,p,n或se)、co、二甲基亚砜、乙腈、腈、异腈或二甲基甲酰胺;
-x和y一起表示任何合适的二齿配位体,优选选自二膦、杂芳族分子、草酸盐、甘氨酸盐、三甲基乙二胺、乙二胺、生物分子或生物学感兴趣的分子,并且z是任何合适的单齿配位体,优选选自大分子膦、大分子杂芳族分子(其中杂原子可以是任何合适的杂原子且优选选自o、s、p、n或se)、大分子腈或大分子异腈。
因此,在本发明的一个方面,一组特别优选的式(i)化合物是由通式(ii)表示的化合物:
其中
r是h;
m表示钌或铁;
x和y一起表示在一个或多个杂芳环上具有至少一个亚甲氧基或氨基氧基官能的二齿大配位体,其可以优选在其链末端含有一个或多个生物学感兴趣的分子或生物分子;
z表示膦、co、二甲基亚砜、杂芳族单齿配位体、生物学感兴趣的分子或包含生物学感兴趣的分子或生物分子的配位体;
a表示聚合物;和
b表示生物学感兴趣的分子。
另一组特别优选的式(i)化合物是由通式(iii)表示的化合物:
其中
r是h;
m表示钌或铁;
x和y一起表示二齿杂芳族配位体或生物学感兴趣的分子或生物分子;
z表示大分子单齿膦配位体,其可在其链末端含有生物学感兴趣的分子或生物分子;
a表示聚合物;和
b表示生物学感兴趣的分子。
另一组特别优选的式(i)化合物是由通式(iv)表示的化合物:
其中
r是h;
m表示钌或铁;
z表示单齿大配位体,其中聚合物优选与膦或杂芳族配位体键合,其可以在其链末端含有生物学感兴趣的分子;
y优选表示co;
x表示卤化物、生物学兴趣的配位体或生物分子;
a表示聚合物;和
b表示生物学感兴趣的分子或生物分子。
式(i)化合物可以是阳离子或中性的,并且可以是盐形式,所述盐的阴离子可以是例如卤化物(卤离子,halide)、磷酸盐(磷酸根)、三氟甲基磺酸盐(三氟甲基磺酸根)、苯基硼酸盐(苯基硼酸根)、六氟磷酸盐(六氟磷酸根)等。
根据本发明的特别优选的化合物为以下化合物:
式(v)的(2,2'-联吡啶-4,4'-二基双{亚甲基}双(2-{2-(2-羟基丙酰氧基)
聚(乳酸)-基}丙酸酯)-k2n,n’)(羰基)(η5-环戊二烯基)六氟磷酸钌(ii)(化合物1):
式(vi)的[(1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二蒽-9-羧酸酯)-k2n,n'](羰基)(η5-环戊二烯基)六氟磷酸钌(ii)-(化合物2):
式(vii)的[(1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二蒽-9-羧酸酯)-k2n,n'](三苯基膦)(η5-环戊二烯基)三氟磷酸钌(ii))-(化合物3):
式(viii)的[(1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二萘-2-羧酸酯)-k2n,n'](三苯基膦)(η5-环戊二烯基)三氟甲基磺酸钌(ii)(化合物4):
式(ix)的(2,2'-联吡啶-4,4'-二基双{亚甲基}双(2-{2-(2-羟基丙酰氧基)聚(乳酸)-基}丙酸酯)-k2n,n')(三苯基膦)(η5-环戊二烯基)三氟甲基磺酸钌(ii)(化合物5):
式(x)的[(1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基)双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二(2s,3s,4s,5r,6r)-3,4,5,6-四羟基噁烷-2-羧酸酯)-k2n,n'](三苯基膦)(η5-环戊二烯基)-三氟甲基磺酸钌(ii)(化合物6):
式(xi)的[1-({1-({1-(苄氧基)-1-氧代丙烷-2-基}氧基)-1-(聚(乳酸))}-1-氧代丙烷-2-基-4-(二苯基膦基)苯甲酸酯-k1p](羰基)(碘基)(η5-环戊二烯基)铁(ii)(化合物7):
式(xii)的[三(1-{1-(1-羟基丙酰氧基)聚(乳酸)-基}丙酸酯)膦-k1p](羰基)-(碘基)(η5-环戊二烯基)铁(ii)(化合物8):
式(xiii)的[(1-({1-({1-(苄氧基)-1-氧代丙烷-2-基}氧基)-1-(聚-(乳酸))}-1-氧代丙烷-2-基)-4-(二苯基膦基)苯甲酸酯-k1p]((2-苯甲酰基吡啶)-k2n,o)(η5-环戊二烯基)三氟甲基磺酸钌(ii)(化合物9):
本发明涉及通式(xiv)的二齿大配位体:
其中
x和y一起表示大分子二齿膦配位体或在一个或多个杂芳环上具有至少一个亚甲氧基或氨基氧基官能的大分子二齿杂芳族配位体,并且其优选可在其链末端含有一个或多个生物学感兴趣的分子或生物分子;
a表示聚合物;
b表示生物学感兴趣的分子或生物分子。
本发明还涉及通式(xv)的单齿大配位体:
其中
z表示大分子杂芳族单齿配位体或大分子单齿膦,并且其可在其链末端含有一个或多个生物学感兴趣的分子或生物分子。
a表示聚合物;
b表示生物学感兴趣的分子或生物分子。
本发明的优选的大分子二齿杂芳族配位体如下:
a)式(xvi)的1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二-基双(亚甲基)}-双(氧基)双(1-氧代丙烷-2,1-二-基))-双(聚乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二-基)-二蒽-9-羧酸酯:
b)式(xvii)的1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二-基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二-基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二-基)二萘-2-羧酸酯:
c)式(xviii)的1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二-基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二-基)双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二-基)二(2s,3s,4s,5r,6r)-3,4,5,6-四-羟基噁烷-2-羧酸酯:
本发明的优选的大分子单齿膦配位体如下:
d)式(xix)的1-({1-({1-(苄氧基)-1-氧代丙烷-2-基}氧基)-1-(聚-(乳酸))}-1-氧代丙烷-2-基4-(二苯基膦基)苯甲酸酯:
e)式(xx)的三(1-{1-(1-羟基丙酰氧基)聚(乳酸)-基}丙酸)膦:
另一方面,本发明的目的是本发明提供了用于新的有机金属化合物的合成程序。
步骤1)大配位体的合成
a)杂芳族大配位体的合成
杂芳族大配位体的合成可以如下进行:
i)选自吡啶类、联吡啶类、咪唑类等含有例如伯胺或醇官能的杂芳族配位体充当一种或多种感兴趣的单体的聚合反应的引发剂和/或催化剂,以提供杂芳族大配位体。如果需要,可以通过通常的纯化技术纯化所获得的杂芳族大配位体,并通过缩合、取代、加成、消除、氧化还原、重排或周环反应反应键合到生物学感兴趣的分子(例如糖、雌激素、含有共轭π体系的分子等)。
ii)预先制备或市售的聚合物通过缩合、取代、加成、消除、氧化还原、重排或周环反应与杂芳族配位体(例如吡啶、联吡啶和咪唑等)反应。如果需要,可以通过常规纯化技术纯化所获得的杂芳族大配位体,并通过缩合、取代、加成、消除、氧化还原、重排或周环反应的反应将其键合到生物学感兴趣的分子(例如糖、雌激素、含有共轭π体系的分子、n-(3-{[5-(4-氯苯基)-1h-吡咯并[2,3-b]吡啶-3-基]羰基}-2,4-二氟苯基)丙烷-1-磺酰胺、溴隐亭、4-甲基-5-氧代-2,3,4,6,8-五氮杂双环[4.3.0]壬-2,7,9-三烯-9-甲酰胺等)。
iii)含有例如伯胺或醇官能的生物学感兴趣的分子(例如氨基酸、dna碱基等)用作一种或多种感兴趣的单体的聚合反应的引发剂和/或催化剂。如果需要,可以通过通常的纯化技术纯化获得的大分子,并通过缩合、取代、加成、消除、氧化还原、重排或周环反应的反应将其与杂芳族配位体(例如吡啶、联吡啶、咪唑等)键合,以提供杂芳族大配位体。
iv)预先制备或市售的聚合物通过缩合、取代、加成、消除、氧化还原、重排或周环反应与生物学感兴趣的分子(例如糖、雌激素、含有共轭π体系的分子、n-(3-{[5-(4-氯苯基)-1h-吡咯并[2,3-b]吡啶-3-基]羰基}-2,4-二氟苯基)丙烷-1-磺酰胺、溴隐亭、4-甲基-5-氧代-2,3,4,6,8-五氮杂双环[4.3.0]壬-2,7,9-三烯-9-甲酰胺等)反应。如果需要,可以通过常规纯化技术纯化该大分子,并通过缩合、取代、加成、消除、氧化还原、重排或周环反应的反应将其与杂芳族(例如吡啶、联吡啶和咪唑等)配位体键合,以提供杂芳族大配位体。
b)大分子膦的合成
大分子膦的合成可以如下进行:
i)含有例如伯胺或醇官能的膦用作引发剂和/或催化剂,用于一种或多种感兴趣的单体的聚合反应,以提供大分子膦。如果需要,可以通过常规纯化技术纯化获得的大分子膦,并通过缩合、取代、加成、消除、氧化还原、重排或周环反应的反应将其与生物学感兴趣的分子(例如糖、雌激素、含有共轭π体系的分子、n-(3-{[5-(4-氯苯基)-1h-吡咯并[2,3-b]吡啶-3-基]羰基}-2,4-二氟苯基)丙烷-1-磺酰胺、溴隐亭、4-甲基-5-氧代-2,3,4,6,8-五氮杂双环[4.3.0]壬-2,7,9-三烯-9-甲酰胺等)键合。
ii)通过缩合、取代、加成、消除、氧化还原、重排或周环反应的反应将膦与预先制备的或市售的聚合物反应以提供大分子膦。通过通常的纯化技术纯化后(如果需要),大分子膦可通过缩合、取代、加成、消除、氧化还原、重排或周环反应的反应与生物学感兴趣的分子(例如糖、雌激素、含有共轭π体系的分子等)键合。
iii)含有例如伯胺或醇官能的生物学感兴趣的分子(例如糖、雌激素、含有共轭π体系的分子等)用作一种或多种感兴趣的单体的聚合反应的引发剂和/或催化剂,以提供大配位体。如果需要,可以通过常规纯化技术纯化该大分子,并通过缩合、取代、加成、消除、氧化还原、重排或周环反应的反应将其与膦键合,从而提供大分子膦。
iv)通过缩合、取代、加成、消除、氧化还原、重排或周环反应的反应将预先制备或市售的聚合物与生物学感兴趣的分子(例如糖、雌激素、含有共轭π体系的分子、n-(3-{[5-(4-氯苯基)-1h-吡咯并[2,3-b]吡啶-3-基]羰基}-2,4-二氟苯基)丙烷-1-磺酰胺、溴隐亭、4-甲基-5-氧代-2,3,4,6,8-五氮杂双[4.3.0]壬-2,7,9-三烯-9-甲酰胺等)反应。如果需要,可以通过通常的纯化技术纯化该大分子,并通过缩合、取代、加成、消除、氧化还原、重排或周环反应的反应将其与膦键合,以提供大分子膦。
步骤2)合成过渡金属的大分子有机金属络合物:
i)为了合成通式(i)的本发明的络合物,在通式(i)中
x和y表示两个大分子单齿膦配位体,并且z是杂芳族单齿配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子;或
x和y一起表示大分子二齿膦配位体;z是杂芳族单齿配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子;或
x是大分子单齿膦配位体,并且y和z一起表示二齿杂芳族配位体、生物分子或生物学感兴趣的分子,
使式[m(cpr)(pp)l]的化合物(其中pp表示两个大分子单齿膦配位体或大分子二齿膦配位体,l是卤基,诸如例如氯基或碘基)与杂芳族单齿或二齿配位体l1、co、二甲基亚砜、生物分子或生物学感兴趣的分子之间发生反应。
ii)为了合成通式(i)的本发明的络合物,在通式(i)中
x和y表示两个单齿膦配位体,z是大分子单齿杂芳族配位体;或
x和y一起表示二齿膦配位体,z是大分子单齿杂芳族配位体;或
x是单齿膦配位体;y和z一起表示在一个或多个杂芳环上具有至少一个亚甲氧基或氨基氧基官能的大分子二齿杂芳族配位体,
使大分子杂芳族配位体与络合物[m(cpr)(pp)l]之间发生反应,络合物[m(cpr)(pp)l]中pp表示两个单齿膦配位体或二齿膦配位体;l是卤基,诸如例如氯基或碘基。
iii)为了合成通式(i)的本发明的络合物,在通式(i)中
x和y表示两个大分子单齿膦配位体,z是杂芳族单齿配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子;或
x和y一起表示大分子二齿膦配位体,z是杂芳族单齿配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子;或
x是大分子单齿膦配位体;y和z一起表示二齿杂芳族配位体、生物分子或生物学感兴趣的分子,
使水合或非水合的金属盐(mx3)与环戊二烯基衍生物(cpr)和过量的大分子膦之间直接发生反应。将得到的通式[m(cpr)(pp)l](其中pp表示两个大分子单齿膦配位体或大分子二齿膦配位体;l是卤基,诸如例如氯基或碘基)的化合物进行纯化,其后是由杂芳族单齿或二齿配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子取代卤基(并最终取代一个大分子膦)的反应,以提供式[m(cpr)xyz]的最终化合物。
iv)为了合成通式(i)的本发明的络合物,在通式(i)中
x和y表示两个大分子单齿膦配位体,z是杂芳族单齿配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子;或
x和y一起表示大分子二齿膦配位体,z是杂芳族单齿配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子;或
x是大分子单齿膦配位体;y和z一起表示二齿杂芳族配位体、生物分子或生物学感兴趣的分子,
使水合或非水合的金属盐(mx3)与环戊二烯基衍生物(cpr)和过量的含有允许进一步的官能化的官能团(诸如例如羧基)的膦之间直接发生反应。将所获得的通式[m(cpr)(pp)l](其中pp表示含有官能团的两个单齿膦配位体或含有官能团的二齿膦配位体;l是卤基,诸如例如氯基或碘基)的化合物进行纯化,然后进行由杂芳族单齿或二齿配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子取代卤基(最终取代一个含有官能团的膦)的反应。然后,通过缩合、取代、加成、消除、氧化还原、重排或周环反应的反应,将所得化合物与预先制备的或市售聚合物反应,以提供式[m(cpr)xyz]的最终化合物。
v)为了合成通式(i)的本发明的络合物,在通式(i)中
x和y表示两个大分子单齿膦配位体,z是杂芳族单齿配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子;或
x和y一起表示一个大分子二齿膦配位体,z是杂芳族单齿配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子;或
x是大分子单齿膦配位体;y和z一起表示二齿杂芳族配位体、生物分子或生物学感兴趣的分子;或
x和y表示两个单齿膦配位体,z是大分子单齿杂芳族配位体;或
x和y一起表示二齿膦配位体,z是大分子单齿杂芳族配位体;或
x是单齿膦配位体;y和z一起表示在一个或多个杂芳环上具有至少一个亚甲氧基或氨基氧基官能的大分子二齿杂芳族配位体,
使大分子配位体与络合物[m(cpr)(ncme)3]+[w]-之间发生反应,伴以1个或2个乙腈被取代(根据以上给出的多种选择)。然后,在不分离该化合物的情况下,将其与其他一个或多个感兴趣的配位体(杂芳族单齿或二齿配位体、单齿或二齿膦、生物分子或生物学感兴趣的分子)反应,以提供所需的式[m(cpr)xyz]+[w]-(其中w是优选选自pf6、cf3so3、cl、i、bph4等的阴离子)的化合物。
vi)为了合成本发明的通式(i)的络合物,在通式(i)中
x和y表示两个大分子单齿膦配位体,z是杂芳族单齿配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子;或
x是大分子单齿膦配位体,y和z表示单齿杂芳族配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子
使水合或非水合的金属盐(mx3)(x是卤基,诸如例如氯基或碘基)与过量大分子膦之间的反应,以提供化合物[ru(大分子膦)3ln](n为2或3)。此后,该化合物与(cpr)na反应或在kobut存在下与(cpr)反应,以提供化合物[m(cpr)(pp)l](pp表示两个大分子单齿膦配位体)。分离后,由一个或多个单齿或二齿杂芳族配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子取代l(并最终取代一个大分子膦),以提供式[m(cpr)xyz]的最终化合物。
vii)为了合成通式(i)的本发明的络合物,在通式(i)中
x和y一起表示大分子二齿膦配位体,z是杂芳族单齿配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子
使[ru(pph3)3cln](其中n为2或3)与大分子二齿膦之间发生反应,以提供化合物[ru(大分子二齿膦)2cln](n为2或3)。此后,该化合物与(cpr)na反应或在kobut存在下与(cpr)反应,以提供化合物[m(cpr)(pp)l](pp为大分子二齿膦;l为卤基)。分离后,l被杂芳族单齿配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子取代,以提供式[m(cpr)xyz]的最终化合物。
viii)为了合成通式(i)的本发明的络合物,在通式(i)中
x和y表示两个大分子单齿膦配位体,z是杂芳族单齿配位体、co、卤基、二甲基亚砜、生物分子或生物学感兴趣的分子;或
x是大分子单齿膦配位体,y和z表示单齿杂芳族配位体、co、卤基、二甲基亚砜、生物分子或生物学感兴趣的分子
使[m(cpr)(co)2l](其中l是卤基,诸如例如氯基或碘基)与大分子膦之间发生反应,以提供[m(cpr)x(co)l]型的络合物,其中x是大分子单齿膦,l是卤基。co和l中的一个或两个可以被杂芳族单齿配位体、co、卤基、二甲基亚砜、生物分子或生物学感兴趣的分子取代,以提供式[m(cpr)xyz]的最终化合物。
ix)为了合成通式(i)的本发明的络合物,在通式(i)中
x和y一起表示大分子二齿膦配位体,z是杂芳族单齿配位体、co、卤基、二甲基亚砜、生物分子或生物学感兴趣的分子,
使[m(cpr)(co)2l](其中l是卤基)与大分子二齿膦之间发生反应,以提供式[m(cpr)xyl]的化合物,其中x和y一起表示大分子二齿膦配位体,且l是卤基)。然后,l被杂芳族单齿配位体、co、二甲基亚砜、生物分子或生物学感兴趣的分子取代。
具有相同一般结构和相同'm(cpr)'片段的这些化合物允许非常针对预期目的聚合物和生物学感兴趣的分子的非常标准的合成,因为所进行的合成具有高产率(70-90%),并且在大多数情况下不需要额外的纯化。如通过凝胶渗透色谱法获得的色谱图的单峰特性(图2a至2f)和1.1-1.4的分散度值(也可以从相同的色谱图计算)可以看出,获得了适合用作药物的纯度为80-95%的产品。核磁共振允许计算已经提到的80-95%之间的官能化百分比。
用于所有上述无机/有机金属合成的反应介质包括选自水、乙醇、甲醇、乙酸乙酯、异丙醇、叔丁醇、乙二醇、二甲基乙二肟、乙醚、氯仿、二氯甲烷、苯、甲苯、丙酮、四氢呋喃、二甲基亚砜、二噁烷、二甲基甲酰胺或乙腈的一种溶剂或多种溶剂的混合物。
上述步骤可以发生在-80℃至300℃之间的温度和在10-3至100atm的压力下,伴以搅拌或不搅拌,如果需要则伴以uv光照射,并且在必要时加入盐。
本发明的络合物是空气稳定的并且在适合于药用目的的一段时期内其在水性介质中是稳定的,并且具有非常相关的抗肿瘤和抗转移性质。
因此,在另一方面,本发明的目的是提供包含药学有效量的至少一种本发明的过渡金属的大分子络合物或其盐的药物组合物和药剂,其可选地与其它活性成分和/或药学上可接受的载体和/或赋形剂组合。
如上定义的式(i)、(ii)、(iii)或(iv)的过渡金属的大分子有机金属络合物和根据本发明的组合物和药物可用作例如肿瘤(原发性肿瘤及其起源的转移瘤)治疗中的药剂。肿瘤的例子包括乳腺癌、卵巢癌、前列腺癌、胰腺癌、神经胶质瘤、白血病和黑素瘤等。它们也可以用于针对治疗浅表性癌症(如皮肤癌和咽癌等)的光动力学疗法中。
在再另一方面,本发明的目的是式(i)化合物在药剂中的应用,即在癌症治疗和/或预防中,包括治疗实体瘤,液体肿瘤和/或转移瘤。此外,本发明的化合物可以用在作为抗肿瘤剂和/或作为癌症治疗的放射增敏剂的药物组合物或药剂中。
下面给出的具体实施例仅意在说明本发明的发明,并且不应被解释为限制本发明。
具体实施方式
实施例
i-合成
实施例1
杂芳族大配位体:2,2'-双吡啶-4,4'-二基双{亚甲基}双(2-{2-(2-羟基丙酰氧基)聚(乳酸)-基}丙酸酯)的合成
该合成使用schlenk技术在氮气惰性气氛下进行,并且将溶剂预先干燥并在氮气气氛下蒸馏。将1g的3,6-二甲基-1,4-二噁烷-2,5-二酮、56.5mg的二甲基氨基吡啶和37.5mg的2,2'-联吡啶-4,4'-二甲醇的混合物在油浴中在135℃下搅拌下加热。3,6-二甲基-1,4-二噁烷-2,5-二酮熔化后,保持该状态5分钟,并且这段时间之后加入过量的甲醇/水混合物淬灭反应。然后,将产物在约50ml甲醇/水混合物中沉淀。真空蒸发溶剂,并将得到的产物用乙醚洗涤,并真空干燥,以提供约750mg标题化合物,为白色产物。
1hnmr[cdcl3,me4si,δ/ppm(多重,分配)]:8.67[d,h间位联吡啶],8.30[s,h邻位联吡啶],7.27h对位联吡啶],5.26[s,-ch2o联吡啶],5.16[m,-ch-聚丙交酯主链],4.36[q,-ch-聚丙交酯端基],1.55[m,-ch3聚丙交酯主链],1.49[m,-ch3聚丙交酯端基]。
实施例2
用生物学感兴趣的分子官能化的杂芳族大配位体:1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二蒽-9-羧酸酯的合成
在氮气惰性气氛下使用schlenk技术进行合成,并且将溶剂预先干燥并在氮气气氛下蒸馏。将300mg的在实施例1中获得的2,2'-联吡啶-4,4'-二基双{亚甲基}双(2-{2-(2-羟基丙酰氧基)聚(乳酸)-基}丙酸酯)溶于无水四氢呋喃(thf)中,并加入25μl三乙胺。反应持续1小时。然后向溶液中加入36.5mg的蒽-9-羧酸,并在thf回流温度下继续反应,直到使用dean-stark装置完全除去反应期间形成的水。最后,将得到的化合物在真空下干燥,以提供约300mg标题化合物1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二蒽-9-羧酸酯,为白色产物。
1hnmr[cdcl3,me4si,δ/ppm(多重,分配)]:8.67[d,h间位联吡啶],8.38[d,h对位蒽+h邻位联吡啶],8.16[d,h-芳族蒽],7.95[d,h-芳族蒽],7.43[t,h-芳族蒽],7.27[d,h对位联吡啶],5.26[s,-ch2o联吡啶],5.16[m,-ch-聚丙交酯主链],4.36[q,-ch-聚丙交酯端基],1.57[m,-ch3聚丙交酯主链],1.50[m,-ch3聚丙交酯端基]。
实施例3
包含杂芳族配位体的钌的有机金属络合物:(2,2'-联吡啶-4,4'-二基双{亚甲基}双(2-{2-(2-羟基丙酰氧基)聚(乳酸)-基}丙酸酯)-k2n,n’)(羰基)(η5-环戊二烯基)六氟磷酸钌(ii)-化合物1的替代合成
在氮气惰性气氛下使用schlenk技术进行合成,并将溶剂预先干燥并在氮气气氛下蒸馏。将15mg的[ru(cp)(ncme)3][pf6]溶解在无水二氯甲烷中。将所得溶液用冰冷却至0℃。一旦达到0℃的温度,加入170mg的在实施例1中获得的2,2'-联吡啶-4,4'-二基双{亚甲基}双(2-{2-(2-羟基丙酰氧基)聚(乳酸)-基}丙酸酯)。5分钟后,将溶液从冰中取出并使之在室温下反应约30分钟。此后,使co流通过约15分钟。然后,用硅藻土(celite)过滤溶液,并将滤液蒸发至化合物沉淀极限。加入约15ml无水己烷以促进沉淀。将溶液倾析,并将沉淀物在真空下干燥。将产物从无水二氯甲烷/己烷中重结晶,得到150mg标题化合物(2,2'-联吡啶-4,4'-二基双{亚甲基}双(2-{2-(2-羟基丙酰氧基)聚(乳酸)-基}丙酸酯)-k2n,n’)(羰基)(η5-环戊二烯基)六氟磷酸钌(ii),为带褐色的盐。
1hnmr[丙酮-d6,me4si,δ/ppm(多重,分配)]:9.28[d,h间位联吡啶],8.49[s,h邻位联吡啶],7.69[h对位联吡啶],5.51[s,η5-环戊二烯基],5.30[m,-ch-聚丙交酯主链+-ch2o联吡啶],[q,-ch-聚丙交酯端基],1.55[m,-ch3聚丙交酯主链],1.39[m,-ch3聚丙交酯端基]。
实施例4
含有杂芳族大配位体的钌的有机金属络合物:[(1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二蒽-9-羧酸酯)-k2n,n'](羰基)(η5-环戊二烯基)六氟磷酸钌(ii)-化合物2的替代合成
在氮气惰性气氛下使用schlenk技术进行合成,并将溶剂预先干燥并在氮气气氛下蒸馏。将15mg的[ru(cp)(ncme)3][pf6]溶解在无水二氯甲烷中。所得溶液用冰冷却至0℃。一旦达到0℃的温度,加入170mg的在实施例2中获得的1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基))二蒽-9-羧酸酯。5分钟后,将溶液从冰中取出并使之在室温下反应约30分钟。此后,使co流通过约15分钟。然后,用硅藻土过滤溶液,并将滤液蒸发至化合物沉淀极限。加入约15ml无水己烷以促进沉淀。将溶液倾析,并将沉淀物在真空下干燥。将产物从无水二氯甲烷/己烷中重结晶,得到约150mg化合物[(1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二蒽-9-羧酸酯)-k2n,n'](羰基)(η5-环戊二烯基)六氟磷酸钌(ii),为带褐色的盐。
1hnmr[丙酮-d6,me4si,δ/ppm(多重,分配)]:8.71[d,h间位联吡啶],8.62[s,h对位蒽],8.49[s,h邻位联吡啶],8.22[d,h-芳族蒽],8.11[d,h-芳族蒽],7.55[m,h-芳族蒽],7.45[d,h对位联吡啶],5.38[s,η5-环戊二烯基],5.21[m,-ch-聚丙交酯主链+-ch2o联吡啶],4.31[q,-ch-聚丙交酯端基],1.55[m,-ch3聚丙交酯主链],1.39[m,-ch3聚丙交酯端基]。
实施例5
包含杂芳族大配体的钌的有机金属络合物:[(1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二蒽-9-羧酸酯)-k2n,n'](三苯基膦)(η5-环戊二烯基)三氟磷酸钌(ii))-化合物3的替代合成
在氮气惰性气氛下使用schlenk技术进行合成,并将溶剂预先干燥并在氮气气氛下蒸馏。将70mg的[rucp(pph3)2cl]溶解在无水二氯甲烷中。然后,加入450mg的在实施例2中获得的1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二蒽-9-羧酸酯和24.6mg的agcf3so3。将得到的混合物在搅拌下回流3小时。使其静置,并将溶液过滤以除去沉淀的agcl。然后,将产物在真空下干燥,用己烷洗涤并从无水二氯甲烷/己烷中重结晶,得到约430mg标题化合物[(1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二蒽-9-羧酸酯)-k2n,n'](三苯基膦)(η5-环戊二烯基)三氟磷酸钌(ii),为橙色盐。
1hnmr[丙酮-d6,me4si,δ/ppm(多重性,分配)]:9.51[d,h间位联吡啶],8.49[m,h-芳族蒽+h邻位联吡啶],7.70[m,h-芳族蒽],7.57[m,h-芳族膦],7.57[d,h对位联吡啶],7.43[m,h-芳族膦],7.13[m,h-芳族膦],5.35[s,-ch2o-联吡啶],5.21[m,-ch-聚丙交酯主链],4.94[s,η5-环戊二烯基],4.31[m,-ch-聚丙交酯端基],1.55[m,-ch3聚丙交酯主链],1.39[m,-ch3聚丙交酯端基]。
实施例6
含有杂芳族大配位体的钌的有机金属络合物:[(1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二萘-2-羧酸酯)-k2n,n'](三苯基膦)(η5-环戊二烯基)三氟甲基磺酸钌(ii)-化合物4的替代合成
使用schlenk技术在氮气惰性气氛下进行合成,并将溶剂预先干燥并在氮气气氛下蒸馏。将70mg[rucp(pph3)2cl]溶解在无水二氯甲烷中。然后,加入450mg的1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二萘-2-羧酸酯和24.6mg的agcf3so3。将得到的混合物在搅拌下回流3小时。使其静置,并将溶液过滤以除去沉淀的agcl。然后,将产物在真空下干燥,用己烷洗涤并从无水二氯甲烷/己烷中重结晶,得到约420mg标题[(1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二萘-2-羧酸酯)-k2n,n'](三苯基膦)(η5-环戊二烯基)三氟甲基磺酸钌(ii),为橙色盐。
1hnmr[丙酮-d6,me4si,δ/ppm(多重,分配)]:9.51[d,h间位联吡啶],8.66[m,h-芳族萘+h邻位联吡啶],8.09[m,h对位联吡啶],7.97[d,h-芳族萘],7.77[d,h-芳族萘],7.57[m,h-芳族萘],7.45[t,h-芳族膦],7.34,[t,h-芳族膦],7.16[m,h-芳族萘],5.22[m,-ch2o-联吡啶+-ch-聚丙交酯主链],4.95[s,η5-环戊二烯基],4.30[m,-ch-聚丙交酯端基],1.55[m,-ch3聚丙交酯主链+-ch3聚丙交酯端基]。
实施例7
含有杂芳族大配位体的钌的有机金属络合物:(2,2'-联吡啶-4,4'-二基双{亚甲基}双(2-{2-(2-羟基丙酰氧基)聚(乳酸)-基}丙酸酯)-k2n,n')(三苯基膦)(η5-环戊二烯基)三氟甲基磺酸钌(ii)化合物5的替代合成
使用schlenk技术在氮气惰性气氛下进行合成,并将溶剂预先干燥并在氮气气氛下蒸馏。将70mg[rucp(pph3)2cl]溶解在无水二氯甲烷中。然后,加入450mg实施例1中获得的2,2'-联吡啶-4,4'-二基双{亚甲基}双(2-{2-(2-羟基丙酰氧基)聚(乳酸)-基}丙酸酯)和24.6mg的agcf3so3。将得到的混合物在搅拌下回流3小时。使其静置,并过滤溶液以除去沉淀的agcl。然后,将产物在真空下干燥,用己烷洗涤,并从无水二氯甲烷/己烷中重结晶,得到约430mg(2,2'-联吡啶-4,4'-二基双{亚甲基}双(2-{2-(2-羟基丙酰氧基)聚(乳酸)-基}丙酸酯)-k2n,n')(三苯基膦)(η5-环戊二烯基)三氟甲基磺酸钌(ii),为橙色盐。
1hnmr[丙酮-d6,me4si,δ/ppm(多重,分配)]:9.53[d,h间位联吡啶],8.11[s,h邻位联吡啶],7.69[d,h对位联吡啶],7.60-7.10[m,h-芳族膦],5.48[s,-ch2o-联吡啶],5.20[m,-ch-聚丙交酯主链],4.97[s,η5-环戊二烯基],4.32[m,-ch-聚丙交酯端基],1.57[m,-ch3聚丙交酯主链],1.40[m,-ch3聚丙交酯端基]。
实施例8
包含杂芳族大配位体的钌的有机金属络合物:[(1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基)双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二(2s,3s,4s,5r,6r)-3,4,5,6-四羟基噁烷-2-羧酸酯)-k2n,n'](三苯基膦)(η5-环戊二烯基)-三氟甲基磺酸钌(ii)-化合物6的替代合成
使用schlenk技术在氮气惰性气氛下进行合成,并将溶剂预先干燥并在氮气气氛下蒸馏。将70mg[rucp(pph3)2cl]溶解在无水二氯甲烷中。然后,加入450mg1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基))双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二(2s,3s,4s,5r,6r)-3,4,5,6-四羟基噁烷-2-羧酸酯和24.6mg的agcf3so3。将得到的混合物在搅拌下回流3小时。使其静置,并将溶液过滤以除去沉淀的agcl。然后,将产物在真空下干燥,用己烷洗涤并用无水二氯甲烷/己烷重结晶,得到400mg标题[(1,1'-{1,1'-(1,1'-{2,2'-联吡啶-4,4'-二基双(亚甲基)}双(氧基)双(1-氧代丙烷-2,1-二基)双(聚(乳酸)-基))}双(氧基)双(1-氧代丙烷-2,1-二基)二(2s,3s,4s,5r,6r)-3,4,5,6-四羟基噁烷-2-羧酸酯)-k2n,n'](三苯基膦)(η5-环戊二烯基)-三氟甲基磺酸钌(ii),为橙色盐。
1hnmr[丙酮-d6,me4si,δ/ppm(多重,分配)]:9.53[d,h间位联吡啶],8.10[s,h邻位联吡啶],7.67-7.11[m,h-芳族膦+h对位联吡啶],5.49-5.31[m,h葡萄糖醛酸酯],5.20[m,-ch2o-联吡啶+-ch-聚丙交酯主链],4.96[s,η5-环戊二烯基],4.30[m,-ch-聚丙交酯端基+h葡萄糖醛酸酯],3.47-3.29[m,h葡萄糖醛酸酯],1.55[m,-ch3聚丙交酯主链],1.39[m,-ch3聚丙交酯端基]。
实施例9
大分子1-({1-({1-(苄氧基)-1-氧代丙烷-2-基}氧基)-1-(聚-(乳酸))}-1-氧代丙烷-2-基4-(二苯基膦基)苯甲酸酯的合成
使用schlenk技术在氮气惰性气氛下进行合成,将溶剂预先干燥并在氮气气氛下蒸馏。将1g3,6-二甲基-1,4-二噁烷-2,5-二酮、28.25mg二甲基氨基吡啶和11.98μl苯基甲醇的混合物在油浴中并在搅拌下在135℃下加热。一旦3,6-二甲基-1,4-二噁烷-2,5-二酮熔化,就使其保持该状态5分钟。此后,加入过量的甲醇/水混合物淬灭反应。然后,将产物在约50ml甲醇/水混合物中沉淀。真空蒸发溶剂,并且产物用乙醚洗涤,并且在真空下干燥。然后,将270mg该聚合物溶于无水thf中,并且加入10μl三乙胺。反应持续1小时。此后,加入23mg4-(二苯基膦)苯甲酸,并且反应在thf回流温度下继续进行,直到使用dean-stark装置完全除去反应中形成的水。最后,将产物在真空下干燥,得到700mg标题化合物,为白色产物。
1hnmr[cdcl3,me4si,δ/ppm(多重性,分配)]:7.41-7.20[m,h-芳族苄基和膦],5.19[m,-ch-聚丙交酯主链],4.39[q,-ch-聚丙交酯端基],1.52[m,-ch3聚丙交酯主链],1.41[m,-ch3聚丙交酯端基]。
实施例10
含有大分子膦的铁的有机金属络合物:[1-({1-({1-(苄氧基)-1-氧代丙烷-2-基}氧基)-1-(聚(乳酸))}-1-氧代丙烷-2-基-4-(二苯基膦基)苯甲酸酯-k1p](羰基)(碘基)(η5-环戊二烯基)铁(ii)-化合物7的合成
使用schlenk技术在氮气惰性气氛下进行合成,并将溶剂预先干燥并在氮气气氛下蒸馏。将810mg[fecp(co)2i]溶于无水丙酮。然后加入900mg4-(二苯基膦)苯甲酸(bza)。混合物在搅拌下用uv(230v,300w灯)照射3小时。使其静置,并过滤溶液;然后将滤液的溶剂蒸发。所得化合物用己烷洗涤,并从无水二氯甲烷/己烷重结晶,得到所需化合物[fecp(p(ph2)(bza))(co)i]。将95mg该化合物溶于约50ml无水thf中,并加入50μl三甲胺。反应持续1小时,此后,加入420mg所需的聚合物,并且反应在thf回流温度下继续进行,直到使用dean-stark装置完全除去反应中形成的水。最后将产物在真空下干燥,得到390mg标题化合物[1-({1-({1-(苄氧基)-1-氧代丙烷-2-基}氧基)-1-(聚(乳酸))}-1-氧代丙烷-2-基-4-(二苯基膦基)苯甲酸酯-k1p](羰基)(碘基)(η5-环戊二烯基)铁(ii),为褐绿色中性固体化合物。
1hnmr[dmso-d6,me4si,δ/ppm(多重,分配)]:7.90-7.30[m,h芳烃膦+h芳烃苄基],5.1[m,η5-环戊二烯基+-ch-聚丙交酯主链+-ch2o苄基],4.63[q,-ch-聚丙交酯端基],1.24[m,-ch3聚丙交酯主链],1.24[m,-ch3聚丙交酯端基]。
实施例11
大分子膦:三(1-{1-(1-羟基丙酰氧基)聚(乳酸)-基}丙酸酯)膦的合成
在氮气惰性气氛下使用schlenk技术进行合成,并将溶剂预先干燥并在氮气气氛下蒸馏。将1g(3s)-顺-3,6-二甲基-1,4-二噁烷-2,5-二酮、56.5mg二甲基氨基吡啶和30mg三(羟甲基)膦的混合物在油浴中在搅拌下在120℃下加温。在(3s)-顺-3,6-二甲基-1,4-二噁烷-2,5-二酮熔化后,使其保持该状态5分钟,此后,加入过量的甲醇/水混合物猝灭反应。然后,将产物在约50ml甲醇/水混合物中沉淀。在真空下蒸发溶剂,并用乙醚洗涤获得的产物,并在真空下干燥,得到约900mg标题化合物,为白色产物。
1hnmr[cdcl3,me4si,δ/ppm(多重性,分配)]:5.16[m,-ch-聚丙交酯主链],4.58[s,-ch2o膦],4.36[q,-ch-聚丙交酯端基],1.58[m,-ch3聚丙交酯主链],1.50[m,-ch3聚丙交酯端基]。
实施例12
含有大分子膦的铁有机金属络合物:[三(1-{1-(1-羟基丙酰氧基)聚(乳酸)-基}丙酸酯)膦-k1p](羰基)(碘基)(η5-环戊二烯基)铁(ii)-化合物8的合成
使用schlenk技术在氮气惰性气氛下进行合成,预先将溶剂干燥并在氮气气氛下蒸馏。将40mg[fecp(co)2i]溶于无水丙酮中。然后,加入445mg上述实施例中制备的三(1-{1-(1-羟基丙酰氧基)聚(乳酸)-基}丙酸酯)膦。将得到的混合物在搅拌和氮气气氛下用uv(230v灯,300w)照射8小时。使溶液静置并过滤;然后蒸发滤液溶剂。所得化合物用己烷洗涤,并用无水丙酮/正己烷重结晶,从而得到约450mg标题化合物,为棕绿色中性固体化合物。
1hnmr(cdcl3,me4si,δ/ppm(多重性,分配)):5.16[m,-ch2o-膦,-ch-聚丙交酯主链],4.63[s,η5-环戊二烯基],4.31[m,-ch-聚丙交酯端基],1.57[m,-ch3聚丙交酯主链],1.50[m,-ch3聚丙交酯端基]
实施例13
含有大分子膦的钌有机金属络合物:[(1-({1-({1-(苄氧基)-1-氧代丙烷-2-基)-1-(聚-(乳酸))}-1-氧代丙烷-2-基)-4-(二苯基膦基)苯甲酸酯-k1p]((2-苯甲酰基吡啶)-k2n,o)(η5-环戊二烯基)三氟甲基磺酸钌(ii)-化合物9的替代合成
将137mg({1-({1-(苄氧基)-1-氧代丙烷-2-基}氧基)-1-(聚(乳酸))}-1-氧代丙烷-2-基)溶解在约50ml无水thf中并加入50μl三乙胺。反应持续1小时。此后,加入68mg[(2-苯甲酰基吡啶)-k2n,o][(4-(二苯基膦基苯甲酸酯))-k1p](η5-环戊二烯基)三氟甲基磺酸钌(ii),并且反应在thf回流温度下继续进行直到使用dean-stark装置完全去除在整个反应中形成的水分。产物在真空下干燥,得到93mg标题化合物,为紫色固体产物。
1hnmr[丙酮-d6,me4si,δ/ppm(多重,分配)]:9.89[d,h邻位联吡啶],8.30[d,h间位联吡啶],8.05[t,h对位联吡啶],7.95[d,h-芳族膦],7.68[m,h间位吡啶+],7.60-7.20[m,h-芳族膦+h-芳族苄基],5.20[m,-ch2-苄基聚丙交酯端基,-ch-聚丙交酯主链],4.88[s,η5-环戊二烯基],4.32[m,-ch-聚丙交酯端基],1.55[m,-ch3聚丙交酯主链],1.47[m,-ch3聚丙交酯端基]。
如图2a至2f中所呈现的大分子分布的单峰特征显示了化合物6的分散度为1.1,化合物2、3和5的分散度为1.2,化合物4的分散度为1.3,以及化合物1的分散度为1.4,突出了具有非常相似的分子质量值(约1的分散度)的单一群体/化合物种类(单峰特征)的存在。
ii-生物活性
实施例14
体外细胞活力抑制测定
通过实例的方式,通过测定细胞活力的50%抑制(ic50)所需的浓度,研究了化合物1、2、3、4、5和6的细胞毒活性,ic50是用来评价本发明的一些化合物在人肿瘤系中的体外活性抑制的参数。
a)在人mcf-7乳腺腺癌肿瘤细胞中评价化合物5和6的细胞毒活性,对每种测试化合物如下进行:
在含有glutamaxi的dmem(gibco)培养基中进行人乳腺癌(mcf-7;atcc)细胞系的培养,并补充10%fbs和1%青霉素-链霉素,并保持在37℃,含有5%co2的加湿气氛中。
细胞培养在含有适合于细胞增殖并允许细胞粘附的培养基的烧瓶中进行。
达到所需的汇合后,通过加入0.05%胰蛋白酶-edta溶液
将细胞粘附24小时,然后加入测试化合物在介质(200μl)中的各稀释度。首先将测试化合物溶解在dmso中,然后溶解在细胞培养基中,并以1-100μm的浓度加入到细胞中。培养基中dmso的最终浓度低于0.5%。在37℃/5%co2孵育24小时和72小时后,培养基用200μlmtt溶液(0.5mg/ml于磷酸盐缓冲液-pbs中)代替。孵育3-4h后,除去mtt溶液,将由活细胞形成的甲簪晶体溶解于dmso(200μl)中。使用平板分光光度计测定570nm处的吸光度来评价细胞活力。通过计算抑制50%细胞生长的药物浓度(ic50)(graphpadprism软件),对测试化合物的细胞毒性进行定量。评价是用至少两个独立实验进行的,每个实验对于每个浓度包含6个重复。在孵育24小时和72小时后细胞活力的剂量-响应曲线分别在图3a和3b的图中表示。获得的结果清楚地表明,化合物5和6在微摩尔范围内对于mcf-7细胞系是细胞毒性的。另外,存在明确的剂量响应关系。
b)在人a2780卵巢癌细胞中和在mda-mb-231人乳腺癌细胞中评价化合物5和6的细胞毒活性,对每种测试化合物如下进行:
在含有glutamaxi(mda-mb-231)或rpmi(a2780)的dmem(gibco)培养基中进行人乳腺癌细胞系(mda-mb-231;atcc)和卵巢癌细胞系(a2780,atcc)的培养,并用10%fbs和1%青霉素-链霉素完成,并保持在37℃在含有5%co2的潮湿气氛中。
细胞培养在含有适于细胞增殖的培养基并允许细胞粘附的烧瓶中进行。
达到所需的汇合后,通过加入0.05%胰蛋白酶-edta溶液
将细胞粘附24小时,然后加入测试化合物在介质(200μl)中的各稀释度。首先将测试化合物溶解在dmso中,然后溶解在细胞培养基中,并以浓度1-100μm加入细胞。培养基中dmso的最终浓度低于0.5%。在37℃/5%co2下孵育24小时和72小时后,将培养基用200μlmtt溶液(0.5mg/ml于磷酸盐缓冲液-pbs)代替。孵育3-4h后,除去mtt溶液,并将活细胞形成的甲簪晶体溶于dmso(200μl)中。使用平板分光光度计测量570nm处吸光度来评价细胞活力。
通过计算抑制50%细胞生长的药物浓度(ic50)(graphpadprism软件),对测试化合物的细胞毒性进行定量。评价是用至少两个独立实验进行的,每个实验对于每个浓度包含6个重复。72小时孵育后细胞活力的剂量-响应曲线在图4a和4b的图中表示。获得的结果清楚地表明,化合物5和6在摩尔范围内对于mda-mb-231和a2780细胞系都是细胞毒性的。另外,存在明确的剂量-响应关系。
c)在人卵巢a2780、乳腺mcf-7、胶质瘤u87和黑素瘤a345肿瘤细胞系的肿瘤细胞中评价化合物1、2、3和4的细胞毒活性,对于每种测试化合物如下进行:
在含有glutamaxi(mcf-7;u87;a345)或rpmi(a2780)的dmem
如图1a至图1f中所示,在5%dmso混合物中化合物1、2、3、4、5和6分别在固定波长处的吸光度随时间(>24h)的相对变化(%):95%的细胞培养基显示化合物在水性介质中适当的化学稳定性。
结果在较低的“钢琴凳(piano-stool)”型化合物的细胞毒性值之中(例如,p.c.a.bruijnincx,p.j.sadler,in:inr.vaneldik,c.d.hubbard(编),advancesininorganicchemistry(无机化学进展),61,academicpress,london,2009,pp.1-61),并且化合物在微摩尔浓度范围内显示活性,并且在大多数情况下优于参考化合物顺铂,如表1在以下所示。表1示出了两种新化合物,化合物5和6的ic50值(在mcf-7、a2780和mda-mb-231细胞中50%细胞活力抑制所需的浓度),其细胞活力的剂量响应曲线在图3b)、4a)和4b)中表示。
表1
以下表2示出了对应于化合物5和6的mcf-7细胞中的ic50值,化合物5和6的细胞活力的剂量响应曲线在图3a)中表示。
一旦达到肿瘤组织,并且由于增加的渗透性和保留(epr)作用,化合物可以积聚在那里,从而提高了药物的效力以及从而容许减少治疗剂量数量和时间间隔,这体现了化疗中的及其重要的优势。
这些化合物在肿瘤细胞中的细胞分布研究表明,它们主要位于这些细胞的细胞骨架、细胞核和/或胞浆上,表明它们在细胞内积累,这带来了对其用在靶向治疗即针对细胞内靶标有很大的期望。图6的图显示了化合物5和6在24小时孵育后在mcf-7人乳腺肿瘤细胞中的细胞分布,观察到的差异与每种不同化合物中使用的生物学感兴趣的分子相关(化合物5中的-oh与化合物6中的糖)。
从证据可以得出结论,包括被肿瘤靶标识别的分子的根据本发明的药物能够以高精度达到肿瘤细胞。由于包含有机金属单元的聚合物生物降解的剩余产物,这些药物的效力也增加,也显示出对肿瘤细胞的细胞毒性。本发明化合物的这一特征也可以是克服由目前使用的药物引起的可怕的化疗副作用的关键。
由于绝大多数由癌症引起的死亡是由于转移瘤而不是原发性肿瘤,所以在转移水平上起作用的能力是至关重要的。考虑到:第一,在高转移细胞系如mda-mb-231中体外获得的优异结果,第二,来自使用我们已经合成的低分子量化合物(即其结构上不包括聚合物)的裸小鼠中体内研究的结果,预期根据本发明的化合物除了在原发性肿瘤水平上表现外,还显示出对抗转移瘤的有利性质。在裸小鼠:n:nih(s)ii-nu/nu中(在乳腺中对其诱导肿瘤(mda-mb-231))获得的结果显示,相对于对照小鼠而言,每天注射2.5mg/kg的测试药物,持续10天,诱导约50%的肿瘤抑制。最重要的结果是治疗后主要器官(肺,肾,肝和心脏)内没有转移瘤,而所有对照小鼠均显示转移。这些结果表明,该药物不仅可以作用于原发性肿瘤,而且可以通过抑制转移行为,可能干扰肿瘤血管生成。
此外,本发明化合物通过凋亡引起细胞死亡,凋亡是受控的细胞死亡机制,似乎通过线粒体途径阻止受影响细胞向周围环境裂解,如下所述的凋亡测定所证明。
实施例15
凋亡测定法
为了测定与未处理的细胞相比,化合物5和6在mcf-7乳腺癌的人细胞中诱导的凋亡,使用了用于检测凋亡过程的试剂盒,humanapoptosisarray(人细胞凋亡系列),其提供了快速和灵敏的方法来同时检测35种凋亡过程相关蛋白的相对表达水平(对照细胞表示100%表达水平),根据制造商说明进行。
与化合物5和6孵育24小时后观察到测试过氧化氢酶和smac暗黑蛋白(diabloproteins)的表达降低,表明通过内源性线粒体途径诱导凋亡过程。内在途径由细胞内或细胞外应激引发。响应于这些刺激而转导的信号主要汇聚于线粒体。该细胞器整合了细胞死亡刺激物,诱导线粒体透化,从而释放存在于其中的促凋亡分子。这些结果还表明络合物在肿瘤细胞中诱导高水平的氧化应激。获得的结果表示在图7的图中。
实施例16
化合物5和6诱导的细胞死亡机制的确定
由化合物5和6在mcf-7癌细胞系中以10μm浓度孵育48小时后诱导的细胞死亡类型通过膜联蛋白v/碘化丙啶(pi)细胞计数测定法来确定。该测定广泛用于通过细胞膜完整性和通透性差异来确定细胞是否存活、凋亡或坏死。总之,膜联蛋白v/pi是研究细胞死亡的常用方法(rieger等,2011)。
结果表明,与对照相比,化合物5和6的孵育导致anexinv染色细胞的百分比增加(图8)。膜联蛋白v是早期凋亡的标志物。表明在这种情况下,由这些化合物引起的细胞死亡类型是凋亡。对于两种标志物的双重染色,其表明晚期凋亡。顺铂被用作阳性对照,因为已知其诱导凋亡。
实施例17
化合物5和6对细胞骨架的影响
考虑到表明化合物5和6都与细胞骨架相互作用的前述结果(图9),在mcf-7癌细胞系中进行了免疫荧光技术。
在该免疫荧光测定中,使用与绿色荧光alexa
- 还没有人留言评论。精彩留言会获得点赞!