咪唑酮类化合物的晶型、其制备方法、药物组合物和用途与流程
本发明涉及具有pi3k/mtor双重抑制活性的咪唑酮类化合物的晶型、其制备方法、药物组合物和用途,属于药物化合物晶体领域。
背景技术:
:
哺乳动物雷帕霉素靶蛋白(mtor)是一种非典型丝氨酸/苏氨酸蛋白激酶,属于磷脂酰肌醇-3激酶(phosphoinositide3-kinase,pi3k)相关激酶家族成员,是细胞内合成和分解代谢等细胞功能的主要信号传递分子。mtor信号通路与营养、能量状态和生长因子有着密切的关系。它调节包括自体吞噬、蛋白、脂类、溶酶体合成和能量代谢、细胞骨架组建、细胞存活等多个细胞过程。在哺乳动物细胞外周营养条件不断变化下,mtor调控着合成和降解代谢的转换,从而使得细胞在不同的营养条件下能够生长和存活。由于mtor在细胞中的重要作用,异常或失调的mtor信号传递能导致人类疾病的发生(例如癌症等疾病)。因此mtor信号通路逐渐成为设计抗癌药物的一个重要靶点。
pi3k/akt/mtor信号通路活化与多种肿瘤发生密切相关,在脑胶质瘤、乳腺癌、卵巢癌中mtor能够加速细胞周期,减少细胞凋亡,并促进肿瘤细胞的迁移。mtor的活化起始于一些被配体激活的细胞表面上的生长因子受体,例如表皮生长因子受体和类胰岛素生长因子-1和-2(igf-1和-2)。受体的激活导致pi3k激酶的激活,从而导致下游效应akt蛋白的激活。akt是一个能在多层次上调控细胞存活的调控因子。akt磷酸化后抑制下游tsc1/2复合物,从而导致mtor被rheb所激活。在pi3k/akt及pen/akt和ras/erk1/2的信号通路的下游,tsc1/2复合物为调节mtor的激活起着关键性的作用。
现已发现细胞内存在两种不同的mtor蛋白质复合体,mtorc1和mtorc2。这两种蛋白质复合体包含独特的与mtor相互作用的蛋白质,而且各自受不同的机制调控。mtor抑制剂药物的研发已取得重大进展。雷帕霉素是第一个被发现的mtor抑制剂,在多种癌症模型中表现出较好的抑癌效果。虽然具有更好药理学特性的雷帕霉素类似物已被开发出来,然而,临床上能应用的雷帕霉素类似物却仅局限在少数几种癌症上。akt是癌细胞存活的一个重要激酶,而mtorc2可直接磷酸化akt,这一重要发现为mtorc2在抗癌方面的研究提供了新的思路,同时也促进了同时作用于mtorc1和mtorc2两个靶点的第二代抗癌药物的研发。在癌细胞中同时抑制两个mtor复合体(mtorc1和mtorc2)的活性有更广泛和更有效的抗癌作用。
化合物1,化学名为1-((1s,4s)-4-羟基环己基)-3-甲基-8-(6-(1-甲基-1h-吡唑-4-基)吡啶-3-基)-1h-咪唑并[4,5-c]喹啉-2(3h)-酮,为蛋白激酶pi3k/mtor双重抑制剂,具有下式所示的结构:
化合物1
化合物1及其药学上可接受的盐已公开于wo2015074516a1,据报道,其在细胞和动物模型中显示出了良好的药物活性。为此,开发更稳定、更适于制剂以及吸收代谢较好的化合物1的晶型对其临床应用具有重要意义。
技术实现要素:
本发明提供下式所示化合物1的可药用盐(如盐酸盐)或其水合物的晶体:
化合物1。
化合物1的命名为1-((1s,4s)-4-羟基环己基)-3-甲基-8-(6-(1-甲基-1h-吡唑-4-基)吡啶-3-基)-1h-咪唑并[4,5-c]喹啉-2(3h)-酮。所述化合物1及其盐酸盐的制备方法记载于例如wo2015074516a1实施例18。所述wo2015074516a1公开文本的全部内容以引用的方式并入本文。
本发明提供化合物1盐酸盐一水合物的晶型i,其特征在于,使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰可以包括:9.028±0.2、11.196±0.2、17.393±0.2、22.504±0.2。
根据本发明,所述晶型i使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰可以包括:9.028±0.2、11.196±0.2、15.406±0.2、16.380±0.2、17.393±0.2、18.066±0.2、18.739±0.2、20.894±0.2、22.504±0.2、22.955±0.2。
优选地,所述晶型i使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰包括:9.028±0.2、11.196±0.2、15.406±0.2、16.380±0.2、17.393±0.2、18.066±0.2、18.739±0.2、20.894±0.2、22.504±0.2、22.955±0.2、26.312±0.2、26.918±0.2、27.556±0.2、35.168±0.2。
更优选地,所述晶型i使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰包括:9.028±0.2、11.196±0.2、12.200±0.2、15.406±0.2、16.380±0.2、16.828±0.2、17.393±0.2、18.066±0.2、18.739±0.2、20.036±0.2、20.894±0.2、22.504±0.2、22.955±0.2、24.973±0.2、25.505±0.2、26.312±0.2、26.918±0.2、27.556±0.2、28.403±0.2、29.176±0.2、31.586±0.2、 35.168±0.2。
优选地,晶型i具有基本上如图1所示的cu-kα辐射x-射线粉末衍射图。
本发明还提供化合物1盐酸盐一水合物的晶型i的制备方法a,包括:
1)将化合物1盐酸盐溶于水中;
2)向步骤1)的溶液中加入氯化钠;
3)降温,析晶,过滤,干燥,得到晶型i。
根据本发明,优选地,
步骤1)中,可以在加入化合物1盐酸盐之前或之后将水加热,以使化合物1盐酸盐溶解;其中,水的用量可以为化合物1盐酸盐重量的2~80倍,例如4~70倍、6~60倍、8~50倍或10~25倍;可将水加热至例如70-100℃,如75℃、80℃、85℃、90℃或95℃;
步骤2)中,可以在保持步骤1)溶液的温度下,加入氯化钠;作为实例,可以控制所述氯化钠的用量以使其占溶液总重量的0.1~26%,例如0.5~20%、0.8~15%或1~10%,例如3~5%;
所述氯化钠可以为其合适的形式,例如可以使用氯化钠溶液或氯化钠固体。优选地,加入氯化钠后搅拌使其溶解;所述氯化钠溶液优选为氯化钠水溶液,其中氯化钠的重量百分含量可以为10%至饱和浓度,例如12%、15%、16%、17%、18%、20%、22%、24%、25%、26%;
步骤3)中,可以在搅拌下缓慢降温至60℃以下(如20~50℃)析晶,抽滤,淋洗,15~35℃(例如20℃、25℃、30℃)真空干燥,得到化合物1盐酸盐一水合物的晶型i。
本发明还提供化合物1盐酸盐一水合物的晶型i的制备方法b,包括:
1)将化合物1盐酸盐溶于乙醇水溶液中;
2)降温,析晶,过滤,干燥,得到晶型i。
根据本发明,优选地,
步骤1)中,可以在加入化合物1盐酸盐之前或之后将乙醇水溶液加热,以使化合物1盐酸盐溶解;其中,乙醇水溶液的用量可以为化合物1盐酸盐重量的5~80倍,例如10~70倍、20~60倍或30~50倍;可将乙醇水溶液加热至例如50-100℃,如55℃、60℃、65℃、70℃、75℃、80℃、85℃、90℃或95℃;
乙醇水溶液中乙醇的质量百分比可以为例如30~99%,如40~98%、45~95%、46~85%、48~80%、50~75%或60~70%;
步骤2)中,可以在搅拌下缓慢降温至40℃以下(如20~30℃)析晶,抽滤,15~35℃(例如室温25℃)真空干燥,得到化合物1盐酸盐一水合物的晶型i。
本发明还提供化合物1盐酸盐一水合物的晶型ii,其特征在于,使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰可以包括:8.934±0.2、11.126±0.2、15.367±0.2、22.437±0.2。
根据本发明,所述晶型ii使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰包括:8.934±0.2、11.126±0.2、12.161±0.2、15.367±0.2、16.289±0.2、17.369±0.2、18.037±0.2、18.667±0.2、20.896±0.2、22.437±0.2、22.928±0.2、24.995±0.2、26.269±0.2、26.890±0.2、27.574±0.2。
优选地,所述晶型ii使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰包括:8.486±0.2、8.934±0.2、11.126±0.2、12.161±0.2、13.317±0.2、15.367±0.2、16.289±0.2、16.742±0.2、17.369±0.2、18.037±0.2、18.667±0.2、19.966±0.2、20.896±0.2、22.437±0.2、22.928±0.2、24.995±0.2、25.467±0.2、26.269±0.2、26.890±0.2、27.213±0.2、27.574±0.2、28.366±0.2、29.075±0.2、35.001±0.2。
优选地,晶型ii具有基本上如图8所示的cu-kα辐射x-射线粉末衍射图。
本发明还提供化合物1盐酸盐一水合物的晶型ii的制备方法,包括:
1)将化合物1盐酸盐在两种不同溶剂中的饱和溶液混合;
2)使步骤1)的混合物挥发溶剂,得到晶型ii。
根据本发明的制备方法,优选地,
步骤1)中,可以在10~35℃,优选20~25℃的温度下,将两种饱和溶液混合;所述溶剂选自有机溶剂,例如选自下列中的一种或多种:酯类溶剂(如乙酸乙酯、乙酸甲酯、甲酸乙酯、甲酸甲酯)、酮类溶剂(如丙酮、2-丁酮)、醚类溶剂(如四氢呋喃、1,4-二氧六环、甲基叔丁基醚、甲基异丙基醚、甲基乙基醚、乙醚)、腈类溶剂(如乙腈、丙腈);优选地,所述两种饱和溶液各自的总体积之比为2:1~1:2,例如1:1;例如,可将两种饱和溶液在96孔板内混合;
步骤2)中,可以将步骤1)的混合物置于大气环境下缓慢挥发溶剂;作为实例,可通过用扎过洞的封口膜覆盖96孔板,置于通风橱中,大气环境下自然挥干,得到晶型ii。
本发明还提供化合物1盐酸盐的晶型iii,其特征在于,使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰可以包括:6.396±0.2、7.115±0.2、8.972±0.2、10.803±0.2、11.870±0.2、18.542±0.2、23.071±0.2。
根据本发明,所述晶型iii以2θ角度(°)表示的x-射线粉末衍射特征峰可以包括:6.396±0.2、7.115±0.2、8.972±0.2、10.803±0.2、11.147±0.2、11.870±0.2、12.139±0.2、15.417±0.2、16.297±0.2、16.559±0.2、17.374±0.2、18.074±0.2、18.542±0.2、19.310±0.2、22.464±0.2、23.071±0.2、24.550±0.2、25.843±0.2、26.903±0.2、28.737±0.2、29.664±0.2、35.016±0.2。
优选地,晶型iii具有基本上如图10所示的cu-kα辐射x-射线粉末衍射图。
本发明还提供化合物1盐酸盐晶型iii的制备方法,包括:
1)将化合物1盐酸盐在两种不同溶剂中的饱和溶液混合;
2)使步骤1)的混合物挥发溶剂,得到晶型iii。
根据本发明的制备方法,优选地,
步骤1)中,可以在35℃以下,优选20~25℃下,将两种饱和溶液混合;所述溶剂选自有机溶剂,例如选自下列中的一种或多种:醇类溶剂(如甲醇、乙醇、正丙醇、异丙醇、正丁醇)、醚类溶剂(如四氢呋喃、1,4-二氧六环、甲基叔丁基醚、甲基异丙基醚、甲基乙基醚、乙醚);优选地,所述两种饱和溶液各自的总体积之比为2:1~1:2,例如1:1;例如,可将两种饱和溶液在96孔板内混合;
步骤2)中,可以将步骤1)的混合物置于大气环境下缓慢挥发溶剂;作为实例,可通过用扎过洞的封口膜覆盖96孔板,置于通风橱中,大气环境下自然挥干,得到晶型iii。
本发明还提供化合物1盐酸盐的晶型iv,其特征在于,使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰可以包括:6.178±0.2、8.996±0.2、11.170±0.2、15.393±0.2、16.343±0.2、17.349±0.2、18.064±0.2、18.708±0.2、19.479±0.2、19.994±0.2、20.901±0.2、22.470±0.2、22.935±0.2、24.964±0.2、25.504±0.2、26.287±0.2、26.920±0.2、27.545±0.2。
根据本发明,所述晶型iv使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰可以包括:6.178±0.2、6.614±0.2、7.181±0.2、7.470±0.2、8.996±0.2、11.170±0.2、11.723±0.2、12.183±0.2、13.323±0.2、14.412±0.2、15.393±0.2、16.343±0.2、16.777±0.2、17.349±0.2、18.064±0.2、18.708±0.2、19.479±0.2、19.994±0.2、20.901±0.2、22.470±0.2、22.935±0.2、24.964±0.2、25.504±0.2、26.287±0.2、26.920±0.2、27.545±0.2、28.363±0.2、28.841±0.2、29.152±0.2、31.487±0.2、33.970±0.2、35.136±0.2。
优选地,晶型iv具有基本上如图11所示的cu-kα辐射x-射线粉末衍射图。
本发明还提供化合物1盐酸盐的晶型iv的制备方法,包括:
1)将化合物1盐酸盐在两种不同溶剂中的饱和溶液混合;
2)使步骤1)的混合物挥发溶剂,得到晶型iv。
根据本发明的制备方法,优选地,
步骤1)中,可以在35℃以下,优选20~25℃下,将两种饱和溶液混合;所述溶剂选自有机溶剂,例如选自下列中的一种或多种:芳烃类溶剂(如苯、甲苯、二甲苯、氯苯)、酯类溶剂(如乙酸乙酯、乙酸甲酯、甲酸乙酯、甲酸甲酯);优选地,所述两种饱和溶液各自的总体积之比为2:1~1:2,例如1:1;例如,可将两种饱和溶液在96孔板内混合;
步骤2)中,可以将步骤1)的混合物置于大气环境下缓慢挥发溶剂;作为实例,可通过用扎过洞的封口膜覆盖96孔板,置于通风橱中,大气环境下自然挥干,得到晶型iv。
本发明还提供化合物1盐酸盐二水合物的晶型v,其特征在于,使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰可以包括:6.181±0.2、8.318±0.2、18.223±0.2、31.778±0.2。
根据本发明,所述晶型v使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特 征峰可以包括:6.181±0.2、7.226±0.2、8.318±0.2、9.524±0.2、10.496±0.2、12.037±0.2、18.223±0.2、27.421±0.2、31.778±0.2。
优选地,晶型v具有基本上如图13所示的cu-kα辐射x-射线粉末衍射图。
本发明还提供化合物1盐酸盐二水合物的晶型v的制备方法,包括:
1)制备化合物1盐酸盐的盐水饱和溶液;
2)将步骤1)的溶液放置,析晶,抽滤,得到晶型v。
根据本发明的制备方法,优选地,
步骤1)中,所述化合物1盐酸盐的盐水饱和溶液为化合物1盐酸盐的氯化钠水饱和溶液;所述饱和溶液中氯化钠的重量百分含量可以为1%至饱和浓度,例如1%、5%、10%、12%、15%、16%、17%、18%、20%、22%、24%、25%、26%;
优选地,步骤1)的饱和溶液来自于上述晶型i制备方法a步骤3)过滤后的母液;
步骤2)中,所述溶液可以在40℃以下,例如30℃以下,如20~25℃放置8h以上,例如放置过夜,或者放置24h以上,例如36h以上、48h以上或七天以上。
本发明还提供化合物1盐酸盐二水合物的晶型vi,其特征在于,使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰可以包括:7.489±0.2、8.897±0.2、11.140±0.2、11.638±0.2、13.348±0.2、13.755±0.2、16.110±0.2、17.152±0.2、18.782±0.2、19.865±0.2、20.891±0.2、21.477±0.2、25.245±0.2、26.184±0.2、26.431±0.2、27.242±0.2、28.489±0.2。
根据本发明,所述晶型vi使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰可以包括:7.489±0.2、8.153±0.2、8.897±0.2、11.140±0.2、11.638±0.2、13.348±0.2、13.755±0.2、14.985±0.2、15.467±0.2、16.110±0.2、17.152±0.2、18.240±0.2、18.782±0.2、19.865±0.2、20.891±0.2、21.477±0.2、22.333±0.2、22.888±0.2、25.245±0.2、26.184±0.2、26.431±0.2、27.242±0.2、28.489±0.2、29.710±0.2。
优选地,晶型vi具有基本上如图15所示的cu-kα辐射x-射线粉末衍射图。
本发明还提供化合物1盐酸盐二水合物的晶型vi的制备方法,包括:
1)将化合物1盐酸盐溶于水和乙腈的混合液中;
2)搅拌,析出晶体,过滤,干燥,得晶型vi。
根据本发明,优选地,
步骤1)中,可以在40℃以下,例如30℃以下,如20~25℃,将化合物1盐酸盐溶于水和乙腈的混合液中;水和乙腈的混合液中乙腈的体积百分比可以为例如5~99%,如10~95%、15~75%、20~60%或25~50%;
步骤2)中,可以在40℃以下,例如30℃以下,如20~25℃,搅拌20小时,析出大量白色晶体,抽滤,所得固体在25℃真空干燥,得到晶型vi。
本发明还提供化合物1盐酸盐二水合物的晶型vii,其特征在于,使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰可以包括:6.264±0.2、6.760±0.2、7.556±0.2、14.455±0.2、20.123±0.2、26.373±0.2。
根据本发明,所述晶型vii使用cu-kα辐射,以2θ角度(°)表示的x-射线粉末衍射特征峰可以包括:6.264±0.2、6.760±0.2、7.556±0.2、11.414±0.2、11.743±0.2、12.488±0.2、13.419±0.2、14.455±0.2、17.246±0.2、18.099±0.2、20.123±0.2、21.082±0.2、25.370±0.2、26.373±0.2、27.294±0.2。
优选地,晶型vii具有基本上如图17所示的cu-kα辐射x-射线粉末衍射图。
本发明还提供化合物1盐酸盐二水合物的晶型vii的制备方法a,包括:
1)将化合物1盐酸盐溶于水中;
2a)将步骤1)的水溶液冷却析晶;或2b)向步骤1)的水溶液中加入氯化钠,搅拌析晶;
3)过滤,干燥,得晶型vii。
根据本发明的方法,优选地,
步骤1)中,水的用量为化合物1盐酸盐重量的10~500倍,例如20~200倍,如60或180倍;优选地,在加入化合物1盐酸盐之前或之后将水加热;优选地,还包括热过滤除去不溶物的步骤;可将水加热至例如70-100℃,如75℃、80℃、85℃、90℃或95℃;
步骤2a)中,将步骤1)的水溶液冷却到40℃以下,例如30℃以下,如20~25℃析晶;
步骤2b)中,在40℃以下,例如30℃以下,如20~25℃搅拌析晶;氯化钠可以为其合适的形式,例如可以使用氯化钠溶液或氯化钠固体。优选地,加入氯化钠后搅拌使其溶解;例如,氯化钠的用量可以为化合物1盐酸盐的1~15倍,例如4~8倍;
其中步骤2a)和2b)为择一进行;
步骤3)中,所述过滤可以为抽滤,所述干燥可以为真空干燥。
本发明还提供化合物1盐酸盐二水合物的晶型vii的制备方法b,包括:
将上述晶型i-vi中的一种或多种,使用水进行混旋打浆3天,得到晶型vii。
优选地,所述方法中混旋打浆在40℃以下,例如30℃以下,如20~25℃下进行;混旋打浆中水的用量为晶型i-vi总重量的20~200倍,例如100倍。
本发明还提供一种药物组合物,包含上述晶体或晶型中的一种或多种。
根据本发明,所述药物组合物还可包含药学上可接受的载体。
药学上可接受的载体优选是这样的载体,其在与活性成分的有效活性一致的浓度下对患者相对无毒且无害,以致于由所述载体引起的任何副作用不会破坏所述活性成分的有益作用。化合物或其药学上可接受的盐的药学有效量优选是对正在治疗的具体病况产生结果或者产生 影响的量。可使用包括速释、缓释和定时释放制剂在内的任意有效的常规剂量单位形式,将本发明的化合物与本领域公知的药学上可接受的载体一起以如下方式给药:口服、肠胃外、局部、鼻腔、眼部、舌下、直肠、阴道给药等。
对于口服给药,可将所述化合物或其药学上可接受的盐配制成固体或液体制剂,例如胶囊剂、丸剂、片剂、含锭剂(troche)、锭剂(lozenge)、熔胶剂(melt)、散剂、溶液剂、混悬剂或乳剂,并且可根据本领域已知的用于制备药物组合物的方法来制备。固体单位剂型可为胶囊剂,其可为普通的硬胶囊型或软胶囊型,包含例如表面活性剂、润滑剂和惰性填充剂(例如乳糖、蔗糖、磷酸钙和玉米淀粉)。
在另一实施方案中,可将本发明的化合物或其药学上可接受的盐和常规片剂基质(例如乳糖、蔗糖和玉米淀粉)一起并与如下物质组合压制成片剂:粘合剂(例如阿拉伯胶、玉米淀粉或明胶)、用于辅助给药后片剂的分解和溶出的崩解剂(例如土豆淀粉、藻酸、玉米淀粉和瓜尔胶、黄蓍树胶、阿拉伯胶)、用于提高片剂制粒的流动性并且防止片剂材料与片剂模具和冲头的表面粘附的润滑剂(例如滑石、硬脂酸或硬脂酸镁、硬脂酸钙或硬脂酸锌)、染料、着色剂,以及用于改善片剂的感官性质并使它们更容易被患者接受的调味剂(例如薄荷油、冬青油或樱桃香精)。用于口服液体剂型的适合的赋形剂包括磷酸二钙和稀释剂,例如水和醇(例如乙醇、苯甲醇和聚乙烯醇),所述稀释剂添加或不添加有药学上可接受的表面活性剂、助悬剂或乳化剂。可以存在各种其它物质作为包衣或者用于改变剂量单位的物理形式。例如可用虫胶、糖或二者将片剂、丸剂或胶囊剂包衣。
还可将本发明的化合物以所述化合物的注射剂进行肠胃外给药,即皮下、静脉内、眼内、滑膜内、肌内或腹膜内给药,所述注射剂优选在含有药物载体的生理学可接受的稀释剂中,所述药物载体可为无菌液体或液体的混合物,所述液体为例如水,盐水,葡萄糖水溶液和相关的糖溶液,醇例如乙醇、异丙醇或十六醇,二醇例如丙二醇或聚乙二醇,甘油缩酮例如2,2-二甲基-1,1-二氧戊环-4-甲醇,醚例如聚乙二醇400(peg400),油,脂肪酸,脂肪酸酯或脂肪酸甘油酯或乙酰化脂肪酸甘油酯,所述稀释剂添加或不添加有药学上可接受的表面活性剂,例如肥皂或洗涤剂,助悬剂例如果胶、卡波姆、甲基纤维素、羟丙甲纤维素或羧甲基纤维素,或乳化剂和其它药学辅剂。
用于肠胃外制剂的示例性表面活性剂是聚乙烯脱水山梨糖醇脂肪酸酯类,例如脱水山梨糖醇单油酸酯,以及环氧乙烷与疏水性基质的高分子量加合物,所述疏水性基质由环氧丙烷和丙二醇缩合形成。
还可将本发明的组合物以用于药物的直肠给药的栓剂的形式给药。可通过将药物与在常温下为固体但是在直肠温度下为液体并且因此可在直肠中溶化而释放所述药物的适合的无刺激性的赋形剂混合来制备这些组合物。此类物质是例如可可脂和聚乙二醇。
用于肠胃外给药的控释制剂包括本领域已知的脂质体微球、聚合物微球和聚合物凝胶制剂。
可能需要或必须通过机械递送装置将所述药物组合物递送至患者。用于递送药剂的机械递送装置的构造和用途是本领域公知的。例如将药物直接给药至脑的直接技术通常涉及将药物递送导管置入患者的脑室系统以绕过血脑屏障。
可将本发明的化合物作为单一药剂给药或者与一种或多种其它药剂组合给药,其中所述组合不会引起不可接受的不良反应。本发明还涉及此类组合。例如,可将本发明的化合物与已知的化疗剂或抗癌剂(例如抗过度增殖性疾病或其它适应症的药剂等)以及与它们的混合物和组合进行组合。其它适应症药剂包括但不限于抗血管生成剂、有丝分裂抑制剂、烷化剂、抗代谢剂、dna-嵌入抗生素、生长因子抑制剂、细胞周期抑制剂、酶抑制剂、拓扑异构酶抑制剂、生物应答调节剂或抗激素。
本发明还提供所述晶型中的一种或多种,其用于治疗或预防与蛋白激酶活性相关的疾病。
本发明还提供调节(如下调)蛋白激酶活性的方法,其中包括将所述蛋白激酶与有效量的上述晶型中的一种或多种接触。该方法可以用于体内,也可以用于体外。优选地,所述蛋白激酶选自mtor和pi3k中至少之一。
根据本申请的另一个方面,本申请提供了一种治疗与蛋白激酶活性相关的疾病的方法,所述方法包括将有效量的上述晶型中的一种或多种施用于有此需求的个体。所述个体可以为哺乳动物,如人类。
本说明书所述的与蛋白激酶活性相关的疾病(例如通过抑制mtor和pi3k中一种或两种激酶来治疗或预防的疾病)可以为肿瘤,例如白血病、恶性淋巴瘤、多发性骨髓瘤、胃肠道间质瘤、结肠癌、直肠癌、乳腺癌、肝癌、胃癌、卵巢癌、子宫癌、宫颈癌、阴道癌、绒毛膜癌、肺癌、肾癌、前列腺癌、膀胱癌、胰腺癌、神经胶母细胞瘤、肥大细胞肿瘤、脑瘤、生殖细胞肿瘤、黑色素瘤、肉瘤,包括隆突性皮肤纤维肉瘤、骨肉瘤。本申请中所述的与蛋白激酶活性相关的疾病还可以为代谢性疾病(例如糖尿病、肥胖症)和心血管疾病(例如动脉粥样硬化)。
本发明还提供所述晶型中的一种或多种用于制备治疗或预防疾病或病症的药物的用途,所述疾病或病症可以是与蛋白激酶活性相关的疾病或病症,例如包括可通过抑制mtor和pi3k中一种或两种激酶来治疗或预防的疾病。
本发明还提供所述晶型中的一种或多种用于制备抑制mtor和pi3k激酶中一种或两种的药物中的用途。
所述疾病包括由不受控制的细胞生长、增殖和/或存活、不适当的细胞免疫应答或不适当的细胞炎症应答引起的疾病,或者伴有不受控制的细胞生长、增殖和/或存活、不适当的细胞免疫应答或不适当的细胞炎症应答的疾病,特别地,所述疾病为例如血液肿瘤、实体瘤和/ 或它们的转移,如白血病和骨髓增生异常综合征、恶性淋巴瘤、包括脑瘤和脑转移在内的头部和颈部肿瘤、包括非小细胞肺肿瘤和小细胞肺肿瘤在内的胸部肿瘤、胃肠道肿瘤、内分泌肿瘤、乳腺肿瘤和其它妇科肿瘤、包括肾肿瘤、膀胱瘤和前列腺瘤在内的泌尿系统肿瘤、皮肤肿瘤和肉瘤、和/或它们的转移。
本发明还提供本发明的化合物及其组合物在制备治疗哺乳动物的过度增殖性病症的药物中的用途。可利用化合物来抑制、阻断、降低、减少等细胞增殖和/或细胞分裂和/或引起凋亡。过度增殖性病症包括但不限于银屑病、瘢痕疙瘩和其它影响皮肤的增生、良性前列腺增生(bph)、实体瘤例如乳腺癌、呼吸道癌、肺癌、脑癌、生殖器官癌、消化道癌、泌尿道癌、眼癌、肝癌、皮肤癌、头颈癌、甲状腺癌、甲状旁腺癌以及它们的远端转移。所述病症还包括淋巴瘤、肉瘤和白血病。
本文所用的“代谢性疾病”是指因代谢问题引起的疾病,包括代谢障碍和代谢旺盛等原因,主要包括以下这些疾病:糖尿病、糖尿病酮症酸中毒、高血糖高渗综合征、低血糖症、痛风、蛋白质-能量营养不良症、维生素a缺乏病、坏血病、维生素d缺乏病、骨质疏松症等。
本文所用的“心血管疾病”又称为循环系统疾病,是一系列涉及循环系统的疾病,循环系统指人体内运送血液的器官和组织,主要包括心脏、血管(动脉、静脉、微血管),可以细分为急性和慢性,一般都是与动脉硬化有关。心血管疾病包括:心脏病、低血压、高血压、高血糖症、中风、心肌梗塞、血栓、动脉硬化等。
这些病症已在人类中得到良好的表征,但是还以相似的病因学存在于其它哺乳动物中,并且可通过给药本发明的药物组合物进行治疗。
在一些实施方式中,所述药物组合物可以是口服的片剂、胶囊、丸剂、粉剂、缓释制剂、溶液和悬浮液,用于胃肠外注射的无菌溶液、悬浮液或乳液,用于外用的软膏或乳膏,或者用于直肠给药的栓剂。在其它实施方式中,所述药物组合物为适合单次施予精确剂量的单位剂型。在其它实施方式中,所述化合物的量在约0.001mg/kg体重/天-约1000mg/kg体重/天的范围内。在其它实施方式中,所述化合物的量的范围为约0.5mg/kg体重/天-约50mg/kg体重/天。在一些实施方式中,所述化合物的量为约0.001g/天-约7g/天。在其它实施方式中,所述化合物的量为约0.002g/天-约6g/天。在其它实施方式中,所述化合物的量为约0.005g/天-约5g/天。在其它实施方式中,所述化合物的量为约0.01g/天-约5g/天。在其它实施方式中,所述化合物的量为约0.02g/天-约5g/天。在其它实施方式中,所述化合物的量为约0.05g/天-约2.5g/天。在其它实施方式中,所述化合物的量为约0.1g/天-约1g/天。在其它实施方式中,低于上述范围下限的剂量水平可能已经是足够的。在其它实施方式中,可能需要高于上述范围上限的剂量水平。在一些实施方式中,以单剂量施用所述化合物,每天一次。在其它实施方式中,以多剂量施用所述化合物,每天不只一次。在一些实施方式中,每天施用两次所述化合物。在其它实施方式中,每天施用三次所述化合物。在其它实施方式中,每天施用四次所述化合物。在其它实施方式中,每天施用四次以上的所述化合物。在一些实施方式中,所述药物组合物施用于的个体为哺乳动物。在其它实施方式中,所述哺乳动物是人。在其它实施 方式中,所述药物组合物还包含至少一种治疗剂(即制成一种剂型)。在一些实施方式中,所述药物组合物和至少一种治疗剂分别以独立的剂型组合成组合产品,如套装药品(kitofpart)。
本发明提供的晶型具有良好的稳定性,包括在高温、高湿和强光照等三种极端条件下具有良好的稳定性,并且在压片过程中也保持良好的稳定性。本发明提供的晶型具有良好的体内吸收代谢性质,包括血药浓度、药时曲线auc、半衰期等。而且,本发明的晶型溶解速度得到改善,有利于制剂上的应用。
药学术语
某些药学术语本文所用的有关术语“受试者”、“患者”或“个体”是指患有疾病、病症或病况等的个体,包括哺乳动物和非哺乳动物。哺乳动物的实施例包括但不限于哺乳动物纲的任何成员:人,非人的灵长类动物(例如黑猩猩和其它猿类和猴);家畜,例如牛、马、绵羊、山羊、猪;家养动物,例如兔、狗和猫;实验室动物,包括啮齿类动物,例如大鼠、小鼠和豚鼠等。非人哺乳动物的实施例包括但不限于鸟类和鱼类等。在本文提供的一个有关方法和组合物的实施方式中,所述哺乳动物为人。
本文所用的术语“治疗”和其它类似的同义词包括缓解、减轻或改善疾病或病症症状,预防其它症状,改善或预防导致症状的潜在代谢原因,抑制疾病或病症,例如阻止疾病或病症的发展,缓解疾病或病症,使疾病或病症好转,缓解由疾病或病症导致的症状,或者中止疾病或病症的症状,此外,该术语包含预防的目的。该术语还包括获得治疗效果和/或预防效果。所述治疗效果是指治愈或改善所治疗的潜在疾病。此外,对与潜在疾病相关的一种或多种生理症状的治愈或改善也是治疗效果,例如尽管患者可能仍然受到潜在疾病的影响,但观察到患者情况改善。就预防效果而言,可向具有患特定疾病风险的患者施用所述组合物,或者即便尚未做出疾病诊断,但向出现该疾病的一个或多个生理症状的患者施用所述组合物。
本文所使用术语“有效量”、“治疗有效量”或“药学有效量”是指服用后足以在某种程度上缓解所治疗的疾病或病症的一个或多个症状的至少一种药剂或化合物的量。其结果可以为迹象、症状或病因的消减和/或缓解,或生物系统的任何其它所需变化。例如,用于治疗的“有效量”是在临床上提供显著的病症缓解效果所需的包含本文公开化合物的组合物的量。可使用诸如剂量递增试验的技术测定适合于任意个体病例中的有效量。
本文所用术语“服用”、“施用”、“给药”等是指能够将化合物或组合物递送到进行生物作用的所需位点的方法。这些方法包括但不限于口服途径、经十二指肠途径、胃肠外注射(包括静脉内、皮下、腹膜内、肌内、动脉内注射或输注)、外用和经直肠给药。本领域技术人员熟知可用于本文所述化合物和方法的施用技术,例如在goodmanandgilman,thepharmacologicalbasisoftherapeutics,currented.;pergamonandremington's,pharmaceuticalsciences(currentedition),mackpublishingco.,easton,pa中讨论的那些。在优选的实施方式中,本文讨论的化合物和组合物通过口服施用。
本文针对制剂、组合物或成分所用术语“可接受的”是指对接受治疗的受试者的一般健康情况没有长期的有害影响。
附图说明
图1为实施例i-1中晶型i使用cu-kα辐射的x-射线粉末衍射(xrpd)谱图。
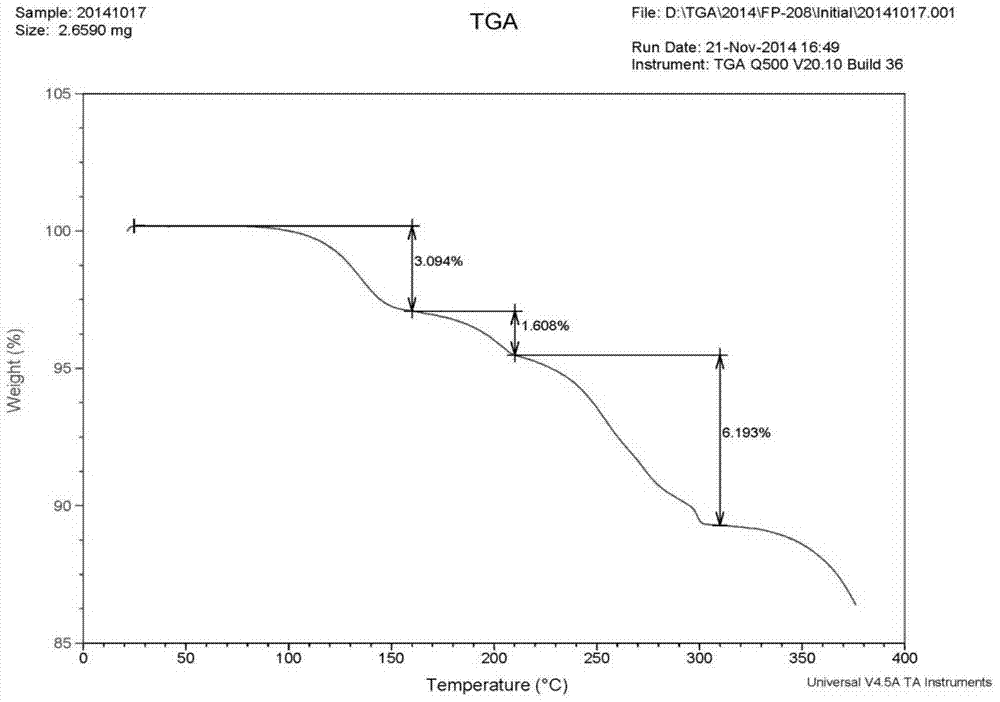
图2为实施例i-1中晶型i的热失重分析(tga)谱图。
图3为实施例i-1中晶型i的差示扫描量热(dsc)谱图。
图4为实施例i-4中晶型i在60℃条件下固体的xrpd谱图。
图5为实施例i-4中晶型i在25℃/90%rh条件下固体的xrpd谱图。
图6为实施例i-4中晶型i在光照条件下固体的xrpd谱图。
图7为实施例i-5中晶型i压片前后的xrpd对比图。
图8为实施例ii-1中晶型ii的xrpd谱图。
图9为实施例ii-1中晶型ii的tga谱图。
图10为实施例iii-1中晶型iii的xrpd谱图。
图11为实施例iv-1中晶型iv的xrpd谱图。
图12为实施例iv-1中晶型iv的tga谱图。
图13为实施例v-1中晶型v的xrpd谱图。
图14为实施例v-1中晶型v的tga谱图。
图15为实施例vi-1中晶型vi的xrpd谱图。
图16为实施例vi-1中晶型vi的tga谱图。
图17为实施例vii-1中晶型vii的xrpd谱图。
图18为实施例vii-1中晶型vii的tga谱图。
图19为实施例vii-1中晶型vii的差示扫描量热(dsc)谱图。
具体实施方式
以下通过实施例对本发明的技术方案进行详细说明,以便更好的理解本发明的技术方案和实质。所述实施例仅为示例性的描述,不应当理解为对本发明保护范围的限制。本领域技术人员根据发明内容及以下实施例所作出的变型或改变均涵盖在本发明要求保护的范围内。
以下实施例中x-射线粉末衍射是由brukerd8advance型x-射线粉末衍射仪测定的,该仪器配备了lynxeye检测器。样品的2θ扫描角度是从3°到40°,扫描步长是0.02°,管电压和管电流分别为40kv和40ma。样品测量采用的样品盘为零背景样品盘。
以下实施例中的差示扫描量热(dsc)分析使用tadscq200进行,其校正使用的标准样品是铟。2-3mg样品精确称重后置于tadsc样品盘中,并记录下样品的准确质量。样品在50ml/min的氮气流中以10℃/min的升温速率加热至200-250℃。以下实施例中的热重分析使用tatgaq500进行。2-3mg样品置于已平衡的铝制样品盘中,样品质量在tga加热炉内自动称量。样品以10℃/min的速率加热至200-300℃。测试过程中,氮气对天平室和样品室的氮气流量分别是40ml/min和60ml/min。
除非另有说明,如下实施例中的原料、底物或试剂均为市售可得的商品(例如所用无水 乙醇为市售的分析纯无水乙醇),其也可通过本领域已知的方法制备获得。
实施例i-1晶型i制备
将化合物1盐酸盐96g溶于浴温100℃的860ml水中,趁热加入43g氯化钠固体,搅拌下使其溶解,缓慢降温至30℃析晶,抽滤并用100ml水淋洗,所得固体在25℃真空干燥,得到86g黄绿色结晶,经测试为化合物1盐酸盐一水合物的晶型i。
实施例i-2晶型i制备
将化合物1的盐酸盐110g溶于浴温100℃的2l水中,趁热加入100g氯化钠在500ml水中的溶液,搅拌下缓慢降温至20℃析晶,抽滤并用100ml水淋洗,所的固体在30℃真空干燥,得到97g黄绿色结晶,经测试为化合物1盐酸盐一水合物的晶型i。
实施例i-3晶型i制备
将化合物1的盐酸盐0.5g溶于浴温85℃的10ml乙醇和5.5ml水的混合液中,搅拌下自然冷却至25℃析晶,抽滤,所的固体在25℃真空干燥,得到0.36g黄绿色结晶,经测试为化合物1盐酸盐一水合物的晶型i。
实施例i-4晶型i稳定性实验
取少量实施例i-1中化合物1盐酸盐一水合物的晶型i,分别放入药品稳定性实验箱中,控制表1所列的条件进行稳定性实验,纯度和含量所得结果列于表i-1中,晶型测试结果如图4到6所示。
如表i-1所示,在高温、高湿和强光照等三种极端条件下,晶型i的化合物纯度和含量均无明显变化(纯度浮动在0.2%以内,含量浮动在1%以内),证明了晶型i的稳定性较好。
如图4至图6所示,在高温、高湿和强光照等三种极端条件下,晶型i均保持晶型未变,证明了晶型i的稳定性较好。
表i-1晶型i固体稳定性实验结果
实施例i-5晶型i压片稳定性实验
取少量实施例1中化合物1盐酸盐一水合物的晶型i,手动压成直径为8mm的药片,然后将药片轻轻碾碎,粉末进行xrpd分析,并将结果与压片前的xrpd结果进行对比,如果图7所示,用以考察压片过程否对晶型产生影响。对晶型i压片前后粉末的xrpd图谱进行了对比,结果表明,压片过程对晶型i无改变,压片前后粉末的xrpd图谱相同。
实施例i-6晶型i的sd大鼠口服给药代谢实验
将11.392mg晶型i的化合物1盐酸盐的悬浮于5.274ml0.5%的羧甲基纤维素钠中,涡旋,形成均一混悬液,之后超声2min最终制成浓度为2mg/ml的均一混悬溶液(给药当天现用现配,存放不超过4小时)。对三只sd大鼠按10mg/kg体重剂量灌胃给药,按设定的时间点取血分析,所得结果列于下表i-2:
表i-2:晶型i大鼠灌胃药物代谢实验数据
从表i-2可以得知,晶型i的药物给药后,最高血药浓度(cmax)可达14600ng/ml,auclast可达190696h*ng/ml,这在药物代谢中是非常高的数值,同时5.5h的半衰期也是药物代谢中比较理想的数值,这些都证明了晶型i的药物在动物体内的吸收代谢性质良好。
实施例ii-1晶型ii制备
室温下,将化合物1盐酸盐的乙酸乙酯饱和溶液和2-丁酮饱和溶液各100微升,于96孔板内混合,用扎过洞的封口膜覆盖,置于通风橱中,大气环境下自然挥干,得到晶体,经 测试为化合物1盐酸盐一水合物的晶型ii。
实施例ii-2晶型ii制备
室温下,将化合物1盐酸盐的四氢呋喃饱和溶液和乙腈饱和溶液各100微升,于96孔板内混合,用扎过洞的封口膜覆盖,置于通风橱中,大气环境下自然挥干,得到晶体,经测试为化合物1盐酸盐一水合物的晶型ii。
实施例ii-3晶型ii制备
室温下,将化合物1盐酸盐的四氢呋喃饱和溶液和丙酮饱和溶液各100微升,于96孔板内混合,用扎过洞的封口膜覆盖,置于通风橱中,大气环境下自然挥干,得到晶体,经测试为化合物1盐酸盐一水合物的晶型ii。
实施例iii-1晶型iii制备
室温下,将化合物1盐酸盐的乙醇饱和溶液和异丙醇饱和溶液各100微升,于96孔板内混合,用扎过洞的封口膜覆盖,置于通风橱中,大气环境下自然挥干,得到晶体,经测试为化合物1盐酸盐的晶型iii。
实施例iii-2晶型iii制备
室温下,将化合物1盐酸盐的异丙醇饱和溶液和甲基叔丁基醚饱和溶液各100微升,于96孔板内混合,用扎过洞的封口膜覆盖,置于通风橱中,大气环境下自然挥干,得到晶体,经测试为化合物1盐酸盐的晶型iii。
实施例iv-1晶型iv制备
室温下,将化合物1盐酸盐的甲苯饱和溶液和乙酸异丁酯饱和溶液各100微升,于96孔板内混合,用扎过洞的封口膜覆盖,置于通风橱中,大气环境下自然挥干,得到晶体,经测试为化合物1盐酸盐的晶型iv。
实施例v-1晶型v制备
将实例i-1的母液在20~25℃长时间放置48小时以上,析出白色结晶,抽滤,得到晶体,经测试为化合物1盐酸盐二水合物的晶型v。
实施例v-2晶型v制备
将实例i-2的母液在20~25℃长时间放置,析出白色结晶,抽滤,得到晶体,经测试为化合物1盐酸盐二水合物的晶型v。
实施例vi-1晶型vi制备
将化合物1的盐酸盐0.5g于20~25℃溶于50ml水和20ml乙腈的混合液中,室温搅拌20小时,析出大量白色晶体,抽滤,所得固体在25℃真空干燥,得到0.27g白色结晶,经测试为化合物1盐酸盐二水合物的晶型vi。
实施例vii-1晶型vii制备
将化合物1的盐酸盐0.5g溶于加热至90℃的90ml水,冷却到室温(20~25℃),搅拌下加入3g氯化钠,室温搅拌20小时,析出大量黄白色固体,抽滤,所得固体在25℃真空干燥,得到0.46g白色结晶,经测试为化合物1盐酸盐二水合物的晶型vii。
实施例vii-2晶型vii制备
将化合物1的盐酸盐0.5g大部分溶于加热至100℃的12ml水,热过滤除掉少量不溶物,母液搅拌下自然冷却到室温(20~25℃),抽滤,所得固体在25℃真空干燥,得到0.21g白色结晶,经测试为化合物1盐酸盐二水合物的晶型vii。
实施例vii-3晶型vii制备
将上述晶型i,取10mg,加入1ml水,20~25℃混旋打浆3天,得到白色结晶,经测试为化合物1盐酸盐二水合物的晶型vii。
实施例vii-4晶型vii制备
按照实施例vii-3,但将晶型i替换为上述晶型ii、iii、iv、v、vi中的一种,均获得晶型vii。
实施例vii-5晶型vii的溶解速度测试
分别称取取化晶型vii、晶型i、晶型vi各3mg,分别放入3个1ml的塑料离心管中,每管加1ml蒸馏水,于20~25℃晃动5秒钟后放置,观察溶解现象:
晶型vii在10秒内全部溶清;
晶型i在2小时内基本溶清,5小时内全部溶清;
晶型vi在5小时后未溶清。
由此可见,晶型vii是速溶晶型,在制作速溶剂型方面有很好的应用价值。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种制备5-乙酰乙酰氨基苯并咪唑酮过程中物料分离粉碎装置的制造方法
- 制备5,6-二氨基苯并咪唑酮的即热式蒸汽热水发生器的制造方法
- Artalbic acid的O?(苯并咪唑基)乙基与O?(二羟乙胺基)乙基衍生物的组合物在抗病毒 ...的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗骨质疏松药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备防治胰腺纤维化药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗缺氧药物的制作方法
- 二氮芴基芳香型二酸单体及其聚苯并咪唑聚合物的合成的制作方法
- 一种咪唑酮类化合物的合成方法
- 一种多苯并咪唑类配合物及其制备方法和用图
- 苯并咪唑酸性盐类化合物及其在催化合成混合二元酸二甲酯中的应用
- 一种制备5-乙酰乙酰氨基苯并咪唑酮过程中物料分离粉碎装置的制造方法
- 制备5,6-二氨基苯并咪唑酮的即热式蒸汽热水发生器的制造方法
- Artalbic acid的O?(苯并咪唑基)乙基与O?(二羟乙胺基)乙基衍生物的组合物在抗病毒 ...的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗骨质疏松药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备防治胰腺纤维化药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗缺氧药物的制作方法
- 二氮芴基芳香型二酸单体及其聚苯并咪唑聚合物的合成的制作方法
- 一种咪唑酮类化合物的合成方法
- 一种多苯并咪唑类配合物及其制备方法和用图
- 苯并咪唑酸性盐类化合物及其在催化合成混合二元酸二甲酯中的应用