高效耐受和利用甲醇的酵母菌株及应用的制作方法
本发明涉及生物技术领域,具体涉及一种能高效耐受和利用甲醇的酵母菌株及应用。
背景技术:
甲醇作为一种古老的有机原料,是仅次于乙烯、丙烯和苯的基本有机原料,其需求与国民经济的增长密切相关,近年来随着中国经济的持续增长,甲醇的需求也出现大幅增长,年均增长率保持在10%~15%,与此同时,甲醇的生产能力也在稳步提升,据权威统计,2012年中国甲醇行业共有企业近300家,产能达到5149.1万t,产量为3129万t。由于中国是缺油少气、煤炭资源相对丰富的国家,随着国家产业政策调整和技术进步,目前中国甲醇产能中以煤为原料约占66%,以天然气为原料约占23%,以焦炉气为原料约占11%。甲醇作为重要的基础化工原料,在传统下游应用,包括塑料、合成纤维、合成橡胶、胶粘剂、染料、涂料、香料、医药和农药等方面有着重要的作用,近年来随着煤化工国产化工艺技术及装备大型化取得突破,醇醚燃料、甲醇制烯烃/芳烃等新兴煤化工产业发展前景乐观。另外,基于国际石油价格上涨和中国汽油消费量大幅增加的发展趋势,甲醇汽油、甲醇燃料和二甲醚等新型燃料也将随着标准的完善和销售网络的建设,成为甲醇新的消费增长点。随着生产工艺的改进与社会需求的变大,甲醇的生产成本也在初步降低,2006年,中国国内均价甲醇是2936元/吨,而到2012年,已经变成了2650元/吨,目前的生产成本已经低于传统的工业原料葡萄糖和甘油,可以预知,未来若干年,甲醇将成为十分重要的原料。
1969年,kiochiogata首次报道,发现一种特别的能够以甲醇作为唯一的碳源和能源的酵母菌,这种嗜甲醇酵母立刻引起人们极大关注。由于甲醇的经济性,这种生物体可作为一种单细胞蛋白(singlecellprotein,scp)推向市场,成为高蛋白的动物饲料。70年代,philipspetroleum公司发展了该菌株适应在甲醇中高密度连续培养的培养基和方法,使细胞产量高达130g干细胞/升。不幸的是,随之而来的石油危机导致甲醇价格急剧上升,使得人们不再重视利用甲醇生产单细胞蛋白。这种酵母即为巴斯德毕赤酵母(pichiapastoris),由于其细胞内含有甲醇代谢途径所必需的酶,如乙醇氧化酶(alcoholoxidase,aox)、二羟丙酮合成酶(dihydroxyacetonesynzyme,dhas)和过氧化氢酶(catalase,cts)等,其中aox是甲醇代谢途径中的十分重要的酶,也是催化甲醇代谢第一步反应的酶,它能使甲醇被氧化成甲醛和过氧化氢,过氧化氢酶又降解过氧化氢为氧气和水,过氧化氢又进一步氧化甲醛为甲酸和co2,这样通过两种脱氢酶的作用使细胞以甲醇为唯一碳源。由于aox与氧的亲合力低,所以p.pastoris在以甲醇为唯一碳源时,会代偿性产生大量的aox,约占全部可溶性蛋白质的30%,而在以葡萄糖、甘油或乙醇作为碳源的培养细胞中则检测不到aox,这说明aox基因启动子具有明显的调控功能,可用于调控外源基因的表达。此调控作用是由一般碳源抑制/解抑制及碳源特殊诱导双重机制控制的:外源基因在甲醇以外的碳源中处于非表达状态,而在培养液中加入甲醇后,外源基因即被诱导表达。一般来说,毕赤酵母在表达外源蛋白的大规模高密度发酵过程中,主要分为两个阶段,即菌体生长增殖阶段和诱导外源蛋白表达阶段。在菌体增殖阶段,细胞通常以甘油或葡萄糖为碳源进行扩大培养,在获得所需要的菌体密度后,再进入外源蛋白诱导表达阶段。外源蛋白表达阶段是以甲醇作为唯一碳源并且诱导目的蛋白表达。在这个过程中,甲醇的精确流加是确定外源蛋白表达的关键,流加速率过高超过了毕赤酵母对于甲醇的利用速率,就会在过程中积累高浓度的甲醇。过量的甲醇会严重抑制细胞活力和产物的表达,甚至可导致菌体死亡。因此,在应用上往往通过溶氧控制、甲醇离线/在线控制或甘油/甲醇混合补料等工艺来避免甲醇可能对于酵母宿主带来的毒害。但上述工艺调控,操作复杂并会增加生产成本。因此提高菌株对甲醇的耐受性,增加甲醇的利用速率,将是解决毕赤酵母甲醇毒性的有效策略,同时也会显著缩短酵母培养的周期,提高生产强度,降低生产成本。
技术实现要素:
本发明提供了一种高效耐受和利用甲醇的酵母菌株,通过将出发菌株巴斯德毕赤酵母在含甲醇的培养基中经过驯化得到,获得的驯化后的菌株可高效耐受和利用甲醇。
以上所述的酵母菌株,其中,所述驯化所用培养基是以甲醇为唯一碳源的培养基。
以上所述的酵母菌株,其中,所述驯化是通过菌株连续传代培养的方式进行。
以上所述的酵母菌株,其中,所述驯化包括以下步骤:
1)活化:在ypd固体培养基平板上挑取单克隆接种至ypd液体培养基中培养48h;
2)驯化:取1ml活化后的菌液,离心收集菌体沉淀,并用无菌生理盐水洗涤一次,离心,将沉淀重悬于25ml含0.5%(v/v)甲醇的bmmy液体培养基中进行培养,待菌株进入稳定期后,再取1ml培养液接种至另一新鲜的25ml的bmmy液体培养基中进行传代培养,如此重复进行多次传代,将最后一次传代培养的菌株进行稀释涂布含0.5%(v/v)甲醇的bmmy平板,选择长势最快、个体最大的1个优良菌落进行保存,用同样的方法依次在含1.0%(v/v)、1.5%(v/v)、2.0%(v/v)、2.5%(v/v)甲醇的bmmy培养基中进行驯化,优选地,所述传代培养次数为10代或10代以上;
3)筛选:选择长势较好、个体较大的菌落接种至含有较高浓度的甲醇的发酵培养基中进行摇瓶/平板发酵验证,筛选出能高效利用甲醇的优良菌株。
以上所述的酵母菌株,其中,所述ypd固体培养基成分包括20g/l葡萄糖、20g/l蛋白胨、10g/l酵母粉、15g/l琼脂,ph自然;所述ypd液体培养基包括20g/l葡萄糖、20g/l蛋白胨、10g/l酵母粉,ph自然;所述bmmy培养基成分包括10g/l酵母精提物、20g/l蛋白胨、13.4g/lynb和4×10-4g/l生物素,所述ynb和生物素在其他成分灭菌后温度降至室温时再加入。
以上所述的酵母菌株,其中,所述步骤1)及步骤2)的培养条件为30℃,摇床转速200r/m。
以上所述的酵母菌株,其中,所述出发菌株为巴斯德毕赤酵母gs115。
以上任一项所述的酵母菌株,获得的驯化后的菌株命名为pichiapastorisgsm5-01,保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno.12174,保藏日期为2016年3月3日,地址为:北京市朝阳区北辰西路1号院3号,邮编:100101。
本发明的另一个方面,提供了以上所述的酵母菌株在耐受高浓度甲醇或高效利用甲醇方面的应用。
本发明的再一个方面,提供了以上所述的酵母菌株在表达外源蛋白和高值化学品方面的应用。
本发明获得的巴斯德毕赤酵母菌在固体培养基中可耐受50g/l以上的甲醇,而出发菌株仅能耐受至多20g/l的甲醇。本发明获得的巴斯德毕赤酵母菌在甲醇为唯一碳源时比生长速率比出发菌株显著提升。在复合培养基bmmy中的生长速率比出发菌株提高1.38倍,在盐培养基bsm中的生长速率比出发菌提高1.95倍。本发明驯化获得的巴斯德毕赤酵母可以应用于表达外源蛋白和高值化学品,经试验证明经过甲醇驯化获得的菌株作为宿主表达乳糖酶基因获得的乳糖酶的酶活显著高于未经过甲醇驯化的菌株作为宿主菌表达乳糖酶基因获得的乳糖酶的酶活。
附图说明
图1各菌株在含不同浓度甲醇的固体培养基上的生长情况对比;
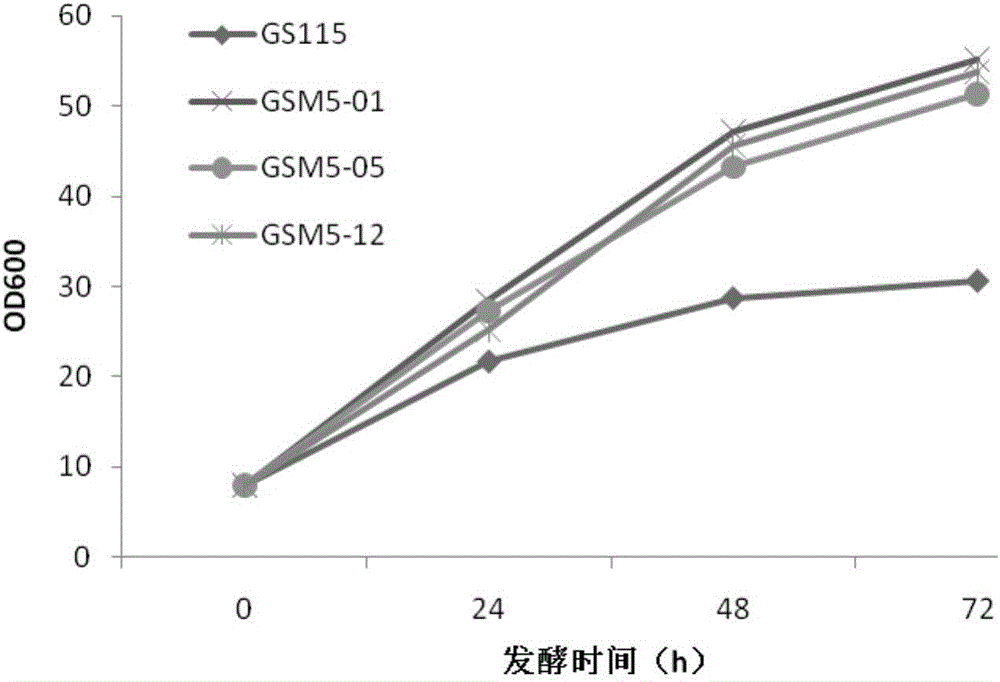
图2各菌株在液体复合培养基bmmy中的生长情况(od600随时间变化)对比;
图3各菌株在液体盐培养基bsm中的生长情况(od600随时间变化)对比。
具体实施方式
以下结合具体实施例,对本发明的具体实施方式进行更加详细的说明,以便能够更好地理解本发明的方案以及其各个方面的优点。然而,以下描述的具体实施方式和实施例仅是说明的目的,而不是对本发明的限制。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明中所述“驯化”指传代培养,即在相同的培养基中,通过多次转接培养液而实施。
所述“工程菌”为用基因工程的方法,使外源基因得到高效表达的菌类细胞株系。
实施例1、巴斯德毕赤酵母菌的驯化
一、原始菌株的活化
将-80℃保存的巴斯德毕赤酵母(pichiapastoris)gs115(购自invitrogen公司,ca.18100)菌液采用ypd固体平板(20g/l葡萄糖、20g/l蛋白胨、10g/l酵母粉,ph自然,15g/l琼脂)进行培养,分离获得单菌落,然后挑取一个单克隆接种至5mlypd培养基中,30℃,200r/m震荡培养48h。
二、驯化流程
取1ml步骤一活化后的菌液,离心(5000r/min,5min)收集菌体沉淀,并用无菌生理盐水洗涤一次,离心(5000r/min,5min),将沉淀重悬于25ml含0.5%(v/v)甲醇的bmmy培养基(10g/l酵母精提物、20g/l蛋白胨,121℃灭菌20min后,温度降至室温时加入13.4g/lynb,4×10-4g/l生物素,0.5%(v/v)甲醇)中进行培养(30℃,200r/m),待菌株进入稳定期(大约需要4~6d)后,再取1ml培养液接种至另一新鲜的25ml的bmmy培养基中进行传代培养,如此重复进行多次传代,将最后一次传代培养的菌株进行稀释涂布0.5%(v/v)甲醇的bmmy固体平板,选择长势最快、个体最大的1个优良菌落进行保存,命名为gsm1-01。
用同样的方法在含1.0%(v/v)、1.5%(v/v)以及2.0%(v/v)甲醇的bmmy培养基中进行驯化,每个浓度的甲醇驯化均重复操作多次,将最后一次传代培养经过平板分离的最优良的一个菌株进行保存,相应的菌株分别命名为gsm2-01,gsm3-01,gsm4-01。将gsm4-01活化后接入含2.5%(v/v)甲醇的bmmy培养基中进行再次驯化,将驯化多次后的菌株进行稀释涂布含2.5%(v/v)甲醇的bmmy平板,选择相比于其他菌落长势较好、个体较大的20个菌落进行保存分析,分别命名为gsm5-01~20。
三、筛选
选择长势较好、个体较大的菌落(gsm5-01~20)接种至含有较高浓度的甲醇的发酵培养基中进行摇瓶/平板发酵验证,筛选出能高效利用和耐受甲醇的优良菌株。
实施例2、巴斯德毕赤酵母菌利用甲醇的能力评价
一、菌株的发酵培养
将实施例1驯化得到的能高效利用和耐受甲醇的优良菌株分别接种于25mlbmgy液体培养基中(10g/l酵母粉、20g/l蛋白胨,121℃灭菌20min后,温度降至室温时加入13.4g/lynb、4×10-4g/l生物素、20g/l甘油),于30℃,200r/min摇床培养,5000r/min离心5min收集菌体,弃上清,用无菌生理盐水洗涤菌体1~2次。调整菌株的od600=8,接入复合培养基bmmy或者盐培养基bsm(硫酸铵5g/l,硫酸钙0.46g/l,硫酸钾9.1g/l,七水硫酸镁14.9g/l,磷酸二氢钾6.8g/l,甘油40g/l,蛋白胨20g/l,酵母粉10g/l,ptm(五水硫酸铜6g/l,碘化钾0.08g/l,硫酸锰2.68g/l,硼酸0.02g/l,二水钼酸钠0.2g/l,七水硫酸锌20g/l,七水硫酸亚铁65g/l,六水氯化钴0.916g/l,硫酸5ml/l,生物素0.2g/l)14ml/l)中进行培养,每隔12h加入终浓度为1.2%甲醇,30℃,200r/min摇床培养,以巴斯德毕赤酵母gs115为对照。
二、检测指标
1、od600
在菌株培养的过程中,每隔一段时间取样检测菌株的生长情况即od600。采用比色法进行,取1ml发酵液于1.5ml离心管中,离心(5000r/min,5min),去上清液,用生理盐水洗涤后,重悬酵母细胞,稀释适当的倍数后,采用紫外分光光度计在600nm下用0.5cm光径的比色皿测定吸光度,再乘以相应的稀释倍数即为酵母的od600。
2、菌株耐受甲醇能力的平板检测
取培养后的各菌株发酵液,调整各菌株的od600为同一值,经梯度稀释不同的倍数后,各取10μl分别点样于含有不同甲醇浓度(10g/l,20g/l,30g/l以及50g/l)的bmmy固体培养基,30℃培养72h后,比较各菌株的生长情况,以巴斯德毕赤酵母gs115作为对照。
3、甲醇含量的测定
每隔一段时间取样检测发酵液中的甲醇含量,检测的方法为气相色谱法,色谱柱为hp-624(30m×0.3m×21.8m)石英毛细管柱,柱温为50℃保持5min,进样口压力为44.28kpa,进样口温度为200℃,检测器温度为220℃,采用高纯氮气为载气,柱流量为1.3ml/min,进样量为60μl,分流比为10:1。将待测样品置于40℃恒温平衡15min后,取60μl气液平衡液进行色谱分析,以标准系列含量对峰面积绘制标准曲线,以保留时间定性,峰面积定量。
三、菌株评价结果
驯化后菌株耐受甲醇的能力评价结果如图1所示。随着甲醇浓度的提高(依次为10g/l,20g/l,30g/l以及50g/l),对照菌株gs115的生长越来越缓慢,在含50g/l甲醇浓度的bmmy平板上几乎看不到菌落生长。其他经过甲醇驯化的gsm5-01,gsm5-05以及gsm5-12均长势良好,说明这些菌株均获得了在较高甲醇浓度下生长的能力。
驯化后菌株在复合培养基bmmy中发酵的实验结果如图2所示。菌株在bmmy培养基中开始诱导,所有菌株起始od600均为8,每12h加入相当终浓度1.2%(v/v)的100%甲醇。结果显示经过甲醇驯化的gsm5-01,gsm5-05以及gsm5-12的生长比出发菌株gs115显著提高,特别是gsm5-01的最终菌浓度比gs115提高了1.38倍。驯化后菌株随后在以甲醇为唯一碳源的盐培养基bsm中进行生长评价(见图3)。结果显示经甲醇驯化的菌株在盐培养基中的生长优势更加明显,对照菌株gs115在高强度的甲醇流加条件下,生长受到了抑制,在整个发酵过程中生长十分缓慢,而经过驯化的菌株仍然可以照常生长,gsm5-01菌株在生长速率方面优势特别显著,其最终菌浓度比gs115提高了1.95倍,这些结果说明了,经过较高浓度甲醇的驯化之后,这些菌株获得了对甲醇高效耐受性,并且利用甲醇的能力也得到了大幅度的提升。
实施例3、巴斯德毕赤酵母在表达外源蛋白方面的应用
一、重组菌株的获得
将来源于米曲霉(aspergillusoryzae,保藏编号为cgmcc3.05232,购自中国微生物菌种保藏管理委员会普通微生物中心)的乳糖酶(β-galactosidase)基因(序列如序列表中seqidno.2所示)通过插入表达载体paoαmh(序列如序列表中seqidno.1所示)的xhoi和noti位点,再分别转入gs115以及gsm5-01,获得重组菌株gs-aor以及gsm-aor。
二、重组菌株的培养
将菌株gs-aor以及gsm-aor接种于25mlbmgy液体培养基(具体成分即含量同实施例2中所述)中,于30℃、200r/min培养,5000r/min离心5min收集菌体,弃上清,用无菌纯净水洗涤菌体1-2次。调整菌株的od600=8,接入复合培养基bmmy(具体成分即含量同实施例2中所述)中进行培养,每12h加入相当终浓度1.2%(v/v)的100%甲醇,以菌株gs115作为空白对照进行同样的操作。
三、胞外乳糖酶酶活的测定
标准曲线的绘制:
分别移取邻硝基苯酚储备液(onp,称取139.0mg的onp,用10ml96%的乙醇溶解后,转移至1000ml的容量瓶中,用水定容并摇匀)2、4、6、8、10、12ml和14ml到100ml的容量瓶中,分别加入25ml的1mol/l的碳酸钠溶液(称取10.6gna2co3,用水定容至100ml),再用醋酸缓冲液(称取0.82g的醋酸钠,溶解在100ml的水中,用醋酸调节溶液的ph为5.2)定容至刻度,摇匀,使邻硝基苯酚的浓度分别是0.02、0.04、0.06、0.08、0.10、0.12mmol/l和0.14mmol/l。采用酶标仪,在420nm处测定每个稀释液的吸光度。
样品的测定:
取25μl经过适当稀释的发酵液(需采用0.1mol/lph5.2的醋酸缓冲液进行稀释),加入100μl0.25%的邻硝基苯-β-d-半乳糖苷(onpg)底物(称取250.0mgonpg,用0.1mol/lph5.2的醋酸缓冲液定容至100ml),在60℃水浴中精确反应10min后,迅速加入125μl1mol/l碳酸钠溶液终止反应。
空白的制备:
将添加onpg底物和碳酸钠溶液的顺序颠倒,其余步骤与样品处理方式相同。
酶活的定义:
在ph5.2、60℃下,每分钟分解onpg生成1μmolonp所需的酶量为一个酶活力单位(u)。
发酵72h后,各菌株摇瓶发酵液酶活见表1。
表1不同菌株的酶活
由表可知,空白菌株在诱导发酵72h后,没有检测到乳糖酶酶活,而重组菌株均能检测到明显的酶活,说明乳糖酶基因在毕赤酵母中成功实现了表达,且以经过甲醇驯化获得的菌株作为宿主表达乳糖酶的重组菌株gsm-aor(113u/ml),其酶活显著高于对照菌株gs-aor(42u/ml)。
显然,上述实施例仅仅是为清楚地说明本发明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!
- 用甲醇酵母(Pichia Pastoris)生产神经营养素-3(NT-3)的方法及应用的制作方法
- Brca1诱导剂吲哚-3-甲醇在制备放射损伤防护药物中的应用的制作方法
- 高效表达d-氨基酸氧化酶的甲醇酵母
- 一种重组Mut<sup>s</sup>型甲醇营养型毕赤酵母生产脂肪酶的方法
- 杂色云芝漆酶在甲醇毕赤酵母中异源表达发酵工艺的制作方法
- 抗内毒素短肽在毕氏酵母中的诱导表达方法、表达的抗内毒素短肽及应用的制作方法
- 诱导提高生防酵母对果实病害防治效力方法及所用培养基的制作方法
- 可利用非甲醇碳源诱导aox1启动子表达外源蛋白的毕赤酵母菌株的制作方法
- 用甲醇酵母(Pichia pastoris)生产人脑源性神经营养因子BDNF的方法及应用的制作方法
- 一种用甲醇酵母制备抑肽酶衍生物的新方法