接枝聚合物及基于表面接枝的抗菌软镜的制备方法与流程
本发明属于软镜技术领域,具体涉及接枝聚合物及基于表面接枝的抗菌软镜的制备方法。
背景技术:
软镜,即隐形眼镜,也叫角膜接触镜,是根据人眼角膜形态以透明或染色材料制成的镜片,直接附着在角膜的泪液层表面,并能与人眼生理相容,最终达到矫正视力、美容或治疗的目的。但是,隐形眼镜在佩戴过程中,因其表面吸附泪液中的蛋白质、脂质、胶原等,从而容易滋生病菌,进而发生角膜水肿、角膜新生血管反应和过敏反应等副作用。医学证明,隐形眼镜中的金黄色葡萄球菌、曲霉菌可引起角膜炎、结膜炎等眼病。空气中其他病菌如大肠杆菌、革兰氏阳性菌等以及各种微生物代谢产物也会对眼镜造成伤害。因此,如何在佩戴软镜中避免上述问题将对软镜的进一步推广有着重要意义。为了解决上述现象,常见的护理手段就是佩戴结束后将软镜浸泡在镜片护理液中,利用后者中含有的少量抗菌剂如季铵盐类表面活性剂等,对镜片表面进行消毒、清洗。由此可以看出,如能制备出具有抗菌功能的镜片,直接抑制细菌在其表面生长,将可以从根本上克服软镜表面易繁殖细菌或其他微生物现象。
目前,抗菌隐形眼镜的制备方法主要是有两种,其中美国专利5,213,801提到的是在里面掺杂银的陶瓷材料,其过程繁琐,且影响眼镜的色泽,不具有发展前景。而另一种是以季铵盐为主体的抗菌隐形眼镜,如EP2067797A1、JP11502949、JP06337378与JP6330820等专利。在该方案中,需要事先将抗菌单体添加到软镜单体中,然后聚合而成,因此就需要改变角膜接触镜现有的工艺路线。在本发明中,克服了以上的缺点,提出了一种表面接枝路线,通过将抗菌聚合物和软镜表面的羟基进行化学键合,从而将抗菌材料直接修饰到软镜表面。其中,未键合的聚合物通过水化等过程除去;与现有的抗菌软镜制备工艺相比,该技术不改变现有的软镜生产路线,简单便捷,适合大批量的生产。
技术实现要素:
发明目的:本发明的目的在于提供接枝聚合物,本发明的另一目的在于提供基于表面接枝的抗菌软镜的制备方法,针对目前制备抗菌软镜制备路线中的缺点,该方法路线简单,不需对现有的软镜制备工艺进行修改,只需将成型后的软镜浸入含有接枝聚合物的水溶液中,随后,取出软镜于100℃烘干,即可将抗菌成分修饰到镜片表面。
技术方案:为实现上述发明目的,本发明采用如下技术方案:
接枝聚合物,其结构通式如下:
其中:m,n,p为1~1000;
其中,A为以下基团中的一种:R1是其中w为1~17;B为以下基团中的一种:其中q为1~250;C为以下基团中的一种:其中D是Cl、Br或I。
其中,A提供季铵盐基团,季铵盐基团起到抗菌作用,C提供硅烷偶联基团,硅烷偶联基团便于与软镜表面羟基基团连接,而B中包含聚乙二醇官能团,聚乙二醇基团则可以改善软镜表面亲水性及防止蛋白分子在镜片表面吸附。
所述的接枝聚合物聚合物的分子量为300~10万道尔顿;其中,季铵盐基团A的含量占比不超过70%,硅烷偶联C的含量占比不超过40%,聚乙二醇基团B的含量占比不超过在40%。
采用接枝聚合物的基于表面接枝的抗菌软镜的制备方法,包括如下步骤:超声震荡接枝聚合物后,将接枝聚合物溶于水中得到反应液,然后将成型后的软镜,浸泡于上述反应液中,然后取出晾干、烘干。
烘干后,将所得软镜浸渍在生理盐水中,洗去软镜中残余未反应的接枝聚合物。
所述的超声震荡时间为5~10min min。
所述的反应液中,接枝聚合物的质量浓度为0.01%~15%。
所述的烘干温度为120℃,烘干时间为5~15分钟。
所述的浸渍温度为60-100℃,浸渍过程中,浸渍液更换2~-3次。
发明原理:基于表面接枝的抗菌软镜的制备方法,是将抗菌聚合物溶于水中,然后,将成型后的软镜浸入其中,接着,取出软镜于80~120℃烘干。在烘干过程中,通过硅烷偶联基团水解后产生的新鲜硅羟基(Si-OH)与软镜表面的羟基(-OH)进行化学键合,从而将抗菌成分修饰到镜片表面,未键合的聚合物通过水化等过程除去。其中,接枝聚合物在水溶液中的质量浓度为0.01~15%,其值可以随透镜组成的不同而变化,最高值是不损害所得软镜的物理性能,如镜片透光率、透氧系数、焦度清晰度、吸脂性和生物相容性等,最低浓度是指所得镜片基本达到抑菌性能,整个聚合物的分子量在300~10万道尔顿之间。其中,季铵盐基团的含量在0~70%间,硅烷偶联基团的含量在0~40%间、聚乙二醇基团的含量在0~40%间。
有益效果:与现有技术相比,本发明的接枝聚合物,既含有硅烷偶联基团又含有季铵盐基团,其中季铵盐官能团,能有效地抑制镜片表面的细菌的生长:而硅烷偶联基团水解后产生的新鲜硅羟基(Si-OH)与软镜表面的羟基(-OH)进行化学键合,从而将抗菌成分修饰到镜片表面,未键合的聚合物通过水化等过程除去,无需改变现有的软镜的制备工艺路线,而目前的专利都是将抗菌单体,添加到硅烷化单体中聚合而成,需改变角膜接触镜现有的工艺路线;本发明的基于表面接枝的抗菌软镜的制备方法,整个过程不涉及对现有的软镜制备工艺进行改动,只需在以成型的软镜表面接枝一层高分子膜,即可达到抗菌效果。
附图说明
图1是抗菌眼镜的合成示意图;
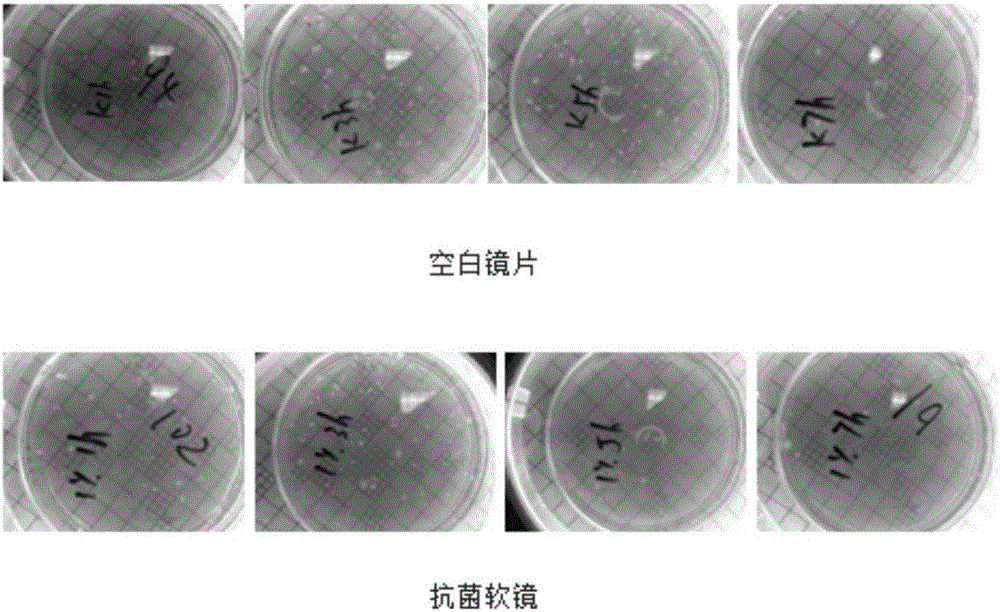
图2是金黄色葡萄球菌分别在抗菌软镜表面与空白软镜表面上孵育不同小时图。
具体实施方式
本发明中的接枝聚合物结构如下:
其中:m,n,p为1~1000。
A为以下基团中的一种:D是Cl、Br或I,R1是其中w为1~17.
B为以下基团中的一种:其中q为1~250.
C为以下基团中的一种:其中D是Cl、Br或I。
其中,A提供季铵盐基团,季铵盐基团起到抗菌作用,C提供硅烷偶联基团,硅烷偶联基团便于与软镜表面羟基基团连接,而B中包含聚乙二醇官能团,聚乙二醇基团则可以改善软镜表面亲水性及防止蛋白分子在镜片表面吸附。整个制备过程如下:使用超声震荡5min,然后将上述结构的接枝聚合物溶于100mL的水中,使其浓度为0.2mol/L;接着,将聚合成型后的软镜,浸泡于上述溶液中,然后取出晾干,并在120℃烘干5~15分钟。最后,将所得软镜放在生理盐水中洗去软镜中残余未反应的接枝聚合物。
术语“抗菌”是指软镜表现出一种或多种以下性能:抑制细菌或其它微生物在透镜上生长,杀死在透镜表面上或在透镜半径延伸处的细菌或其它微生物(细菌或其它微生物在透镜上生长以及细菌或其它微生物在透镜表面上存在统称为“微生物的产生”)。本发明的透镜抑制10%至99%的细菌或真菌产生。这种细菌或其它微生物包括但是不局限于在眼睛中存在的那些生物:特别是铜绿假单胞菌、金黄色葡萄球菌、大肠杆菌、白色念珠菌。
实施例1-3是A的合成路线
实施例1
取3.98g(0.03mol)反应物a,150ml无水乙腈,置于250ml三口瓶中常温下混合均匀后,缓慢向混合物中滴加2.025g(0.02mol)反应物b,混合均匀后,70℃,回流反应15h,静置直到溶液分层,取下层液旋蒸,直到产生少量白色固体,然后用无水乙醚冲洗,得到白色固体,反复冲洗4-6次,过滤得白色固体产物。
实施例2
取7.631g(0.03mol)反应物a,150ml无水乙腈,置于250ml三口瓶中常温下混合均匀后,缓慢向混合物中滴加2.585g(0.02mol)反应物b,混合均匀后,70℃,回流反应15h,静置直到溶液分层,取下层液旋蒸,直到产生少量白色固体,然后用无水乙醚冲洗,得到白色固体,反复冲洗4~6次,过滤得白色固体产物。
实施例3
取3.66g(0.015mol)反应物a,150ml无水乙腈,置于250ml三口瓶中常温下混合均匀后,缓慢向混合物中滴加2.14g(0.01mol)反应物b,混合均匀后,70℃,回流反应15h,静置直到溶液分层,取下层液旋蒸,直到产生少量白色固体,然后用无水乙醚冲洗,得到白色固体,反复冲洗4~6次,过滤得白色固体产物。
实施例4-6是B的合成路线
实施例4
反应物b,其中一端用甲基封端的聚乙二醇(PEG),分子量选取3000。取7.631g(0.05mol)反应物a,溶于150ml无水四氢呋喃溶液中,混合均匀后,向溶液中加入20g反应物b,搅拌均匀,加入0.3g氢化钠,室温,回流反应6h。过滤除去氢化钠,旋转蒸发,得液态产物。
实施例5
反应物b,其中一端用甲基封端的聚乙二醇(PEG),分子量选取6000。取4.3045g(0.05mol)反应物a,溶于150ml无水四氢呋喃溶液中,混合均匀后,向溶液中加入22g反应物b,搅拌均匀,加入2ml浓硫酸,50℃,回流反应6h。加入200ml去离子水,置于分液漏斗中,去下层液,旋转蒸发,得液体产物。
实施例6
反应物b,其中一端用甲基封端的聚乙二醇(PEG),分子量选取8000。取3.606g(0.05mol)反应物a,溶于150ml无水四氢呋喃溶液中,混合均匀后,向溶液中加入22g反应物b,搅拌均匀,加入2ml浓硫酸,50℃,回流反应6h。加入200ml去离子水,置于分液漏斗中,去下层液,旋转蒸发,得液体产物。
实施例7-15是C的合成路线
实施例7
取3.0524g(0.02mol)反应物a,溶于150ml无水四氢呋喃溶液中,置于三口烧瓶中,混合均匀,向混合物中缓慢滴加3.8664g(0.02mol)反应物b,混合均匀后,氮气保护,50℃,回流反应6h。旋蒸直到产生少许固体后,使用无水乙醚冲洗5-6次,得固体产物。
实施例8
取3.9416g(0.02mol)反应物a,溶于150ml无水四氢呋喃溶液中,置于三口烧瓶中,混合均匀,向混合物中缓慢滴加4.708g(0.02mol)反应物b,混合均匀后,氮气保护,50℃,回流反应6h。旋蒸直到产生少许固体后,使用无水乙醚冲洗5-6次,得固体产物。
实施例9
取2.025g(0.015mol)反应物a,150ml无水乙腈,置于250ml三口瓶中常温下混合均匀后,缓慢向混合物中滴加1.9332g(0.01mol)反应物b,混合均匀后,氮气保护,70℃,回流反应15h,静置直到溶液分层,取下层液旋蒸,直到产生少量白色固体,然后用无水乙醚冲洗,得到白色固体,反复冲洗4~6次,过滤得白色固体产物。
实施例10
取1.358g(0.015mol)反应物a,150ml无水乙腈,置于250ml三口瓶中常温下混合均匀后,缓慢向混合物中滴加2.354g(0.01mol)反应物b,混合均匀后,氮气保护,70℃,回流反应15h,静置直到溶液分层,取下层液旋蒸,直到产生少量白色固体,然后用无水乙醚冲洗,得到白色固体,反复冲洗4~6次,过滤得白色固体产物。
实施例11
取2.5197g(0.015mol)反应物a,150ml无水乙腈,置于250ml三口瓶中常温下混合均匀后,缓慢向混合物中滴加1.9332g(0.01mol)反应物b,混合均匀后,氮气保护,70℃,回流反应15h,静置直到溶液分层,取下层液旋蒸,直到产生少量白色固体,然后用无水乙醚冲洗,得到白色固体,反复冲洗4~6次,过滤得白色固体产物。
实施例12
取1.1478g(0.015mol)反应物a,150ml无水乙腈,置于250ml三口瓶中常温下混合均匀后,缓慢向混合物中滴加2.354g(0.01mol)反应物b,混合均匀后,氮气保护,70℃,回流反应15h,静置直到溶液分层,取下层液旋蒸,直到产生少量白色固体,然后用无水乙醚冲洗,得到白色固体,反复冲洗4~6次,过滤得白色固体产物。
实施例13
20g(0.13mol)对氯甲基苯乙烯溶于150ml无水乙醚中得溶液A,8g(0.2mol)镁屑置于50ml无水乙醚中搅拌均匀得混合物B,在氮气保护下将A缓慢滴加到B中,滴加时间控制在1h,继续反应1h后得格式试剂C,ClSi(OEt)3(52g,0.26mol)溶于50ml无水乙醚中得溶液D。在-5~0℃,氮气保护下,将C缓慢滴加到D中,回流反应14h后,将100ml正己烷加入到反应液中,将沉淀出的镁盐过滤除去,将滤液旋转蒸发得产物无色液体。
实施例14
20g(0.13mol)对氯甲基苯乙烯溶于150ml无水乙醚中得溶液A,8g(0.2mol)镁屑置于50ml无水乙醚中搅拌均匀得混合物B,在氮气保护下将A缓慢滴加到B中,滴加时间控制在1h,继续反应1h后得格式试剂C,ClSi(OMe)3(41.08g,0.26mol)溶于50ml无水乙醚中得溶液D。在-5~0℃,氮气保护下,将C缓慢滴加到D中,回流反应14h后,将100ml正己烷加入到反应液中,将沉淀出的镁盐过滤除去,将滤液旋转蒸发得产物无色液体。
实施例15-23接枝聚合物(15-23)
实施例15
取实施例1合成的产物A1,2.3513g(0.01ml),实施例4合成的产物B2,3.6682g(0.001mol),实施例7合成的产物C1,3.4594g(0.01mol),150ml无水乙腈,置于250ml三口烧瓶中,搅拌均匀,加入0.2g偶氮异丁腈(AINB),在氮气保护下,80℃,回流反应15h后,溶液呈乳白色,离心得白色粉末固体产品。
实施例16
取实施例1合成的产物A1,2.3513g(0.01ml),实施例5合成的产物B2,6.682g(0.001mol),实施例7合成的产物C2,4.3594g(0.01mol),150ml无水乙腈,置于250ml三口烧瓶中,搅拌均匀,加入0.2g偶氮异丁腈(AINB),在氮气保护下,80℃,回流反应15h后,溶液呈乳白色,离心得白色粉末固体产品。
实施例17
取实施例2合成的产物A2,2.6513g(0.01ml),实施例4合成的产物B1,7.282g(0.002mol),实施例8合成的产物C2,4.3594g(0.01mol),置于250ml三口烧瓶中,搅拌均匀,加入0.2g偶氮异丁腈(AINB),本体聚合,在氮气保护下,80℃回流反应15h后,得固体产物,可溶于无水四氢呋喃,二氯甲烷,DMF,DMSO。
实施例18
取实施例2合成的产物A2,2.6513g(0.01ml),实施例4合成的产物B1,7.282g(0.002mol),实施例9合成的产物C3,3.2594g(0.01mol),置于250ml三口烧瓶中,搅拌均匀,加入0.2g偶氮异丁腈(AINB),本体聚合,在氮气保护下,80℃,回流反应15h后,得固体产物,可溶于无水四氢呋喃,二氯甲烷,DMF,DMSO。
实施例19
取实施例3合成的产物A3,3。1513g(0.01ml),实施例6合成的产物B3,8.6682g(0.001mol),实施例7合成的产物C4,3.2832g(0.01mol),150ml无水乙腈,置于250ml三口烧瓶中,搅拌均匀,加入0.2g偶氮异丁腈(AINB),在氮气保护下,80℃,回流反应20h后,溶液呈乳白色,离心得白色粉末固体产品。
实施例20
取实施例2合成的产物A2,2.6513g(0.01ml),实施例4合成的产物B1,7.282g(0.002mol),实施例11合成的产物C3,3.6594g(0.01mol),置于250ml三口烧瓶中,搅拌均匀,加入0.2g偶氮异丁腈(AINB),本体聚合,在氮气保护下,70℃,回流反应15h后,得固体产物,可溶于无水四氢呋喃,二氯甲烷。
实施例21
取实施例3合成的产物A3,3.1513g(0.01ml),实施例4合成的产物B1,7.282g(0.002mol),实施例12合成的产物C6,3.1154g(0.01mol),置于250ml三口烧瓶中,搅拌均匀,加入0.2g偶氮异丁腈(AINB),本体聚合,在氮气保护下,70℃,回流反应15h后,得固体产物,可溶于无水四氢呋喃,二氯甲烷。
取实施例1合成的产物A1,2.3513g(0.01ml),实施例5合成的产物B2,6.682g(0.001mol),实施例13合成的产物C7,2.8044g(0.01mol),150ml无水乙腈,置于250ml三口烧瓶中,搅拌均匀,加入0.2g偶氮异丁腈(AINB),在氮气保护下,80℃,回流反应15h后,溶液呈乳白色,离心得白色粉末固体产品。
实施例23
取实施例2合成的产物A2,2.6719g(0.01ml),实施例4合成的产物B1,7.282g(0.002mol),实施例14合成的产物C8,2.3854g(0.01mol),置于250ml三口烧瓶中,搅拌均匀,加入0.2g偶氮异丁腈(AINB),本体聚合,在氮气保护下,70℃,回流反应15h后,得固体产物,可溶于无水四氢呋喃,二氯甲烷。
实施例24
在加热与超声震荡的条件下,将实施例15-23中合成的抗菌剂溶于二氯甲烷,接着,将聚合后的干软镜,短时间浸泡于溶液中(9-10秒),然后取出晾干得到抗菌镜片。
实施例25
在加热与超声震荡的条件下,将实施例15-23中合成的抗菌剂溶于四氢呋喃中,接着,将聚合后的干软镜,短时间浸泡于溶液中(9-10秒),然后取出晾干得到抗菌镜片。
实施例26
在加热与超声震荡的条件下,将实施例15-23中合成的抗菌剂溶于氯仿中,接着,将聚合后的干软镜,短时间浸泡于氯仿溶液中(9-10秒),然后取出晾干得到抗菌镜片。
实施例27
在加热与超声震荡的条件下,将实施例15-23中合成的抗菌剂溶于二甲基亚砜中,接着,将聚合后的干软镜,短时间浸泡于二甲基亚砜溶液中(9-10秒),然后取出晾干得到抗菌镜片。
表1是添加了不同含量的实施例15-23的产物到软镜中相对应的抗菌效果。
表1部分抗菌高分子、添加量及对应抗菌效果
实施例28-30软镜的抗菌性能评价
实施例28金黄色葡萄球菌
对以上实施例1-9中所得软镜进行抗菌性能评价,基本过程参照《QB/T2591-2003抗菌塑料的抗菌性能试验方法试验》进行。通过定量接种细菌于待测软镜上,用贴膜的方法使细菌均匀接触样品,经过一定时间的培养后,测定样品中的或菌数,并计算出样品的抗细菌率。
具体过程如下:(1)材料准备,覆盖膜为聚乙烯薄膜,尺寸为(40±2)mm X(40±2)mm、厚度为(0.05∽0.1)mm。使用前用70%乙醇溶液浸泡1分钟,再用无菌水冲洗,自然干燥。样品分为空白对照软镜A与抗菌软镜B,前者指未添加抗菌成分的软镜,测试尺寸为(50±2)mmX(50±2)mm。所有样品在试验前经高温灭菌,然后用无菌水冲洗,自然干燥。测试过程中所用洗脱液指含0.8%NaCl的生理盐水(含少量的吐温80),培养液指营养肉汤/生理盐水溶液(1:500);(2)金黄色葡萄球菌ATCC 6538,利用接种环从金黄色葡萄球菌的培养基上取少量(刮1∽2环)新鲜菌,加入到培养液中,并依次做10倍递增稀释液,选择菌液浓度为(5.0-10.0)*105cfu/mL的稀释液作为试验用菌液。(3)样品试验,分别取0.2mL试验用菌液滴加在空白对照软镜和抗菌软镜上,然后用灭菌镊子夹起灭菌覆盖膜分别覆盖在其表面,使菌均匀接触样品,置于灭菌平皿中,在37℃、相对湿度RH≥90%条件下培养24小时。结束后,取出样品,分别加入20mL洗脱液,反复洗样品与覆盖膜,充分摇匀后,取一定量接种于营养琼脂培养基中,在37℃培养24后活菌计数。(4)检验结果计算,抗菌率(%)=(A-B)/A*100。
实施例29大肠杆菌
对于大肠杆菌的抗菌测试,过程如实施例10,将大肠杆菌取代金黄色葡萄球菌。此外,培养液指营养肉汤/生理盐水溶液(1:100)。
实施例30软镜的细胞毒性的评价
对以上实施例1-9所得的软镜进行体外细胞毒性实验,基本过程参照《GB/T16886.5-2003医疗器械生物学评价》进行。通过定量接种细胞于待测软镜及其浸提液中,经过一定时间的培养,对细胞的形态进行观察。
具体过程如下:(1)材料准备:24孔板,镊子,空白对照软镜A、抗菌软镜B(实施例1)和抗菌软镜C(添加实施例1-9的样品),实验前将所有材料在121℃下高压灭菌25min,灭菌水反复清洗,自然干燥。实验过程中的完全培养基指的是89%DMEM、10%胎牛血清和1%的青霉素和链霉素。将软镜A、B和C用镊子取出放入24孔板中,加入1mL完全培养基,37℃±2℃浸提24h,将浸提液取出新的孔中,将L929细胞用胰蛋白酶消化下来,并用完全培养基调整细胞悬液浓度为5×105个/mL,在含浸提液和镜片的孔中加入细胞悬液和完全培养基,置于37℃培养箱下培养24h,观察细胞形态并拍摄照片。从图2可以看出,随着时间的增加,抗菌软镜表面的金黄色葡萄球菌基本凋亡,而空白镜片表面一直含有大量葡萄球菌。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种接枝视黄醇聚合物及采用其作为载体的喜树碱化合物的制作方法与工艺
- 星形聚合物接枝多肽和聚乙烯亚胺的基因载体及制备方法与流程
- 一种木质纤维接枝丙烯酰胺聚合物及其制备方法与流程
- 棉织物用聚合物/Ag掺杂纳米ZnO长效抗菌防霉整理剂及其制备方法与流程
- 含橡胶接枝聚合物粉体、以及含有其的太阳能电池用密封材料和夹层玻璃用中间膜的制作方法与工艺
- 一种抗菌纳米碳溶胶、纳米石墨辐照接枝改性锦纶单丝滤布及其制备方法与流程
- 附接到可降解的聚合物区的支撑件的制作方法与工艺
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 角蛋白接枝水性聚氨酯聚合物皮革复鞣填充材料的制备方法与流程
- 一种HDPE多单体接枝聚合物及其制备方法与制造工艺
- 接枝用的夹具的制作方法
- 一种两嵌段低分子聚合物接枝纳米二氧化硅粒子、制备方法和聚酯的制作方法
- 基于聚醚接枝改性的热增黏聚合物及其制备方法
- 以马铃薯淀粉为原料一锅法接枝聚合合成含钾高吸水树脂的方法
- 以马铃薯淀粉为原料氧化、碱糊化及接枝聚合一锅法制备吸附Ni<sup>2+</sup>离子树脂的方法
- 以马铃薯淀粉为原料氧化、碱糊化及接枝聚合一锅法制备吸附Co<sup>2+</sup>离子树脂的方法
- 以马铃薯淀粉为原料氧化、碱糊化及接枝聚合一锅法制备吸附Ag<sup>+</sup>离子树脂的方法
- 一种合成温敏含糖聚合物接枝的纳米金胶束的方法
- 一种基于点击化学的超支化聚合物接枝碳纳米管的制备方法
- 星形聚合物接枝多肽和聚乙烯亚胺的基因载体及制备方法与流程
- 一种木质纤维接枝丙烯酰胺聚合物及其制备方法与流程
- 使用新颖的阳离子性接枝聚合物的目标物分离浓缩方法与流程
- 含橡胶接枝聚合物粉体、以及含有其的太阳能电池用密封材料和夹层玻璃用中间膜的制作方法与工艺
- 一种原位制备黑磷混杂聚合物的制备方法与流程
- 附接到可降解的聚合物区的支撑件的制作方法与工艺
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 角蛋白接枝水性聚氨酯聚合物皮革复鞣填充材料的制备方法与流程
- 一种高接枝率聚烯烃接枝物的制备方法及该高接枝率聚烯烃接枝物的应用与流程
- 星形聚合物接枝多肽和聚乙烯亚胺的基因载体及制备方法与流程
- 一种木质纤维接枝丙烯酰胺聚合物及其制备方法与流程
- 含橡胶接枝聚合物粉体、以及含有其的太阳能电池用密封材料和夹层玻璃用中间膜的制作方法与工艺
- 附接到可降解的聚合物区的支撑件的制作方法与工艺
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 角蛋白接枝水性聚氨酯聚合物皮革复鞣填充材料的制备方法与流程
- 一种高接枝率聚烯烃接枝物的制备方法及该高接枝率聚烯烃接枝物的应用与流程
- 一种高抗冲聚丙烯接枝聚合物及其制备方法与流程
- 非硫化硅烷改性聚合物锌粉膏及其用于悬索桥主缆的复合防护结构的制作方法与工艺