一种抗大肠杆菌k88ac的单链抗体及其编码基因与应用的制作方法
本发明涉及基因工程,具体地说,涉及一种抗大肠杆菌k88ac的单链抗体及其编码基因。
背景技术:
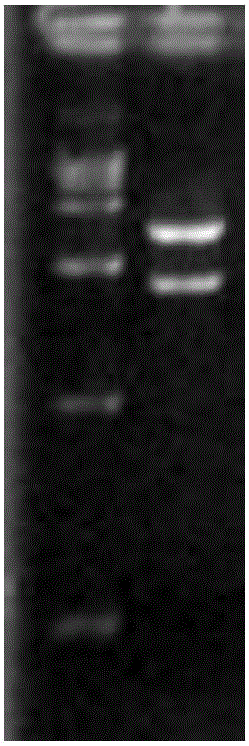
:仔猪腹泻在养猪业危害中居首位,严重威胁着养猪业的健康发展,是集约化养猪生产条件下的一种典型的多因素性疾病。而哺乳仔猪以传染性腹泻较为常见,尤其以携带k88ac菌毛蛋白的大肠杆菌引起的仔猪腹泻最为常见。大肠杆菌k88ac菌毛蛋白属于大肠杆菌纤毛抗原的一种,是蛋白质,不耐热,位于菌体表面,与菌株的肠病原性有着密切的关系。大肠杆菌k88ac是引起仔猪腹泻的主要病原,大肠杆菌k88ac菌毛蛋白则作为一种粘着因素在猪体内发挥作用,使大肠杆菌固着于前部肠道的粘膜绒毛上,产生肠毒素,引起常见的仔猪腹泻病。然而,目前对于k88ac大肠杆菌并没有很好的单克隆抗体用以抵御k88ac大肠杆菌对仔猪危害,导致仔猪腹泻病仍然是威胁养猪业的一大原因。迄今为止,国内尚未见有特异性结合大肠杆菌k88ac、并可有效发挥免疫抗性的单链抗体的报道。因此,亟需一种抗k88ac大肠杆菌的单链抗体,来达到制备抗腹泻转基因猪、降低抗腹泻发病率的目的。技术实现要素:为了解决现有技术中存在的问题,本发明的目的是提供一种抗大肠杆菌k88ac的单链抗体及其编码基因与应用。为了实现本发明目的,本发明的技术方案如下:第一方面,本发明提供了一种抗大肠杆菌k88ac的猪源单链抗体,其特征在于,其氨基酸序列如下(a)或(b):(a)seqidno.1所示的氨基酸序列;(b)将seqidno.1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有抗大肠杆菌k88ac活性的由seqidno.1衍生的序列。进一步地,本发明提供编码前述单链抗体的基因。进一步地,所述基因的核苷酸序列如seqidno.2所示。进一步地,本发明提供了含有所述基因的载体。作为优选,所述载体为真核表达载体,更优选为pcmv5,使抗体基因在cmv启动子作用下得以高效表达,表达产物含myc标签便于检测抗体表达。更进一步地,本发明提供了含有所述基因或所述载体的工程菌或转基因细胞。第二方面,本发明提供了所述单链抗体在检测k88ac抗原方面的应用。并提供了所述基因在制备抗大肠杆菌k88ac转基因细胞或转基因动物中的应用。以及所述载体在制备抗大肠杆菌k88ac药物方面的应用。本发明的有益效果在于:本发明提供了一种可对大肠杆菌k88ac抗原产生抗性的猪源单链抗体,并提供了其氨基酸序列和其编码基因的核苷酸序列。利用所述编码基因构建cmv启动子调控scfv-fc基因表达的重组载体k88-pcmv5,可使其在细胞水平高效表达。通过western和elisa检测抗体可正常表达;具有与k88ac抗原的结合能力。本发明成功获得了针对k88ac大肠杆菌的抗体基因,为得到抗腹泻转基因猪群提供了新方法,对于农业发展具有很大的经济效益。附图说明图1是本发明实施例2中重组质粒k88ac-pcmv5图谱。图2是本发明实施例2中构建好的k88ac-pcmv5进行酶切鉴定的电泳图,其中,左泳道为dl5000marker。图3是本发明实施例2中构建好的k88ac-pcmv5测序比对结果。图4是本发明实施例2中进行转染实验时,gfp质粒对照组作为转染效率的参考。图5是本发明实施例2中western检测细胞上清及细胞裂解液中k88ac抗体表达的结果(约38kd);两者均有k88ac抗体的表达。具体实施方式下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例1本实施例用于说明一种特异性识别并结合大肠杆菌k88ac抗原的单链抗体及其编码基因。本实施例提供了一种包括重链可变区(vh)、轻链可变区(vl)、猪源恒定区(ch)的抗大肠杆菌k88ac的单链抗体,其氨基酸序列如seqidno.1所示,分子量约为38kda,其中vh具有seqidno.3所示的氨基酸序列,vl具有seqidno.4所示的氨基酸序列,ch具有seqidno.5所示的氨基酸序列。本实施例还提供了前述单链抗体的编码基因,其核苷酸序列如seqidno.2所示。实施例2本实施例用于说明本发明所述单链抗体的制备与产物验证和功能验证。由生物公司合成vh-linker-vl-ch片段,将此片段重组到含myc标签的pcmv5真核表达载体上的ecori和xmai之间,构建得到k88-pcmv5载体(图谱如图1所示),便于进行抗体功能验证。采用econi和scai对重组后的载体进行酶切鉴定,酶切电泳图如图2所示,其中左泳道为dl5000marker进行,目的条带2172bp和3563bp,并进行测序,测序比对结果如图3所示,上面一行核苷酸序列为抗k88ac抗体基因;下面一行核苷酸序列为测序结果。参见qiagen公司的endofreeplasmidmaxikit说明书。将提取好的质粒测浓度后分装、冻存,用于后续的细胞转染。取无内毒素pcmv5-k88ac质粒2μg,与100ul电击液混匀,采用lonza核转仪的t-013程序转染到crl-3063小鼠乳腺上皮细胞中。以gfp为对照,观察t013程序转染crl-3063的效率。转染结果如图4所示,左图为gfp对照的暗场图,右图为gfp对照的明场图。收集转染后的细胞上清液及细胞裂解液,10kd蛋白超滤管浓缩后,-20度冷冻保存。westernblot检测k88ac抗体的表达水平。westernblot实验中,sds-page分离胶浓度为10%。60v电泳30min,90v电泳1h。电泳结束后,使用bio-rad转膜仪进行转膜,300ma恒流,1h。5%的脱脂奶粉封闭2h,myc标签一抗(1:1000稀释)过夜室温孵育。tbst洗膜6×5min。山羊抗兔二抗(1:5000稀释)室温孵育2h。tbst洗膜6×5min。进行显影。由图5可知,细胞上清液及裂解液均检测到k88ac抗体的高效表达。采用k88acantibodyelisa检测试剂盒检测浓缩后的细胞上清液及细胞裂解液中k88ac抗体以及与抗原的结合能力。浓缩方法为10kd蛋白超滤管。重组k88ac抗体能和k88ac菌毛抗原特异性结合。如表1所示,此发明中的抗k88ac抗体可在真核细胞中高效表达,且具有与k88ac菌毛抗原特异性结合的能力,细胞中表达量可达到41.2ng/ml,上清中表达量可达到137.7ng/ml。表1elisa试剂盒检测细胞上清及细胞裂解液中k88ac抗体与抗原结合能力od45012345a0.11740.10140.08940.08880.0845b0.10980.09520.15190.11840.1696注:a1-a5为标准曲线,b1-b2为细胞裂解液样品,b3-b5为细胞上清液样品。虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1