工程化CD20靶向性的NKT细胞及其制备方法和应用与流程
技术领域
本发明属于肿瘤生物制品领域,涉及过继免疫治疗中的一种工程化CD20靶向性的NKT细胞(CAR20-NKT细胞)、其制备及应用。
背景技术:
临床将TCR-、mIg-、CD56+、CD16+、CD3+淋巴样细胞鉴定为NKT细胞。NKT细胞既表达T细胞表面标志,又表达NK细胞的表面标志,NKT细胞能够识别和杀伤突变的肿瘤细胞和病毒感染细胞,而对正常自身组织细胞无细胞毒作用。NKT细胞通过自身表面的CD16与特异性抗体的Fc段结合,发挥ADCC(antibody-dependent cell-mediated cytotoxicity)作用。但是,在抗体介导的ADCC作用过程中,抗体能与靶细胞上的相应抗原表位特异性结合,可杀伤任何已与抗体结合的靶细胞,抗体与靶细胞上的抗原结合是特异性的,NKT细胞等对靶细胞的杀伤作用是非特异性的。通常情况下,输注的NKT细胞在患者体内半衰期一般为2周左右,有效期短暂,需要反复多次输注。另外,NKT细胞本身缺少非特异性抗体,不足以在肿瘤周围或者瘤巢中富集,制约了NKT细胞对进展期恶性肿瘤的靶向治疗。
嵌合抗原受体(chimeric antigen receptor,CAR)是由抗原识别结构域(配体或单链抗体)和胞内的一系列信号结构域依次连接而成,具体包括抗原特异性的受体(如单链抗体ScFv),间隔序列(spacer),跨膜序列(TM Domain)和胞内共刺激信号分子。在体内CAR修饰的淋巴细胞能够通过其单链抗体特异的识别相关肿瘤表面抗原,然后通过胞内共刺激信号分子将识别的信号传递到细胞内,激活细胞的杀伤性,靶向杀伤肿瘤细胞。
CD20单克隆抗体疗法在治疗B细胞淋巴瘤中已取得了令人满意的效果,但是很多患者最终会产生耐药性。CD20分子是一种B细胞分化抗原,仅表达于前B细胞和成熟B细胞表面,表达于95%以上的B细胞性淋巴瘤,而在造血干细胞、浆细胞和其他正常组织细胞中不表达。重要的是,CD20分子在膜上比较暴露,容易接近,与单克隆抗体结合后无显著内化及脱落,也不会因为与抗体的结合而发生抗原调变,故成为治疗B细胞淋巴瘤的理想靶点。
技术实现要素:
本发明的目的是提供一种的工程化CD20靶向性的NKT细胞及其制备方法,本发明的另一个目的是提供工程化CD20靶向性的NKT细胞在制备用于治疗肿瘤制剂中的应用。
为实现上述目的,本发明采用以下技术方案:
一种工程化CD20靶向性的NKT细胞,该细胞是嵌合抗原受体CD20ScFv-CD8-CD137-CD3ζ修饰的NKT细胞,该嵌合抗原受体由CD20ScFv、CD8的hinge区和跨膜区、CD137的胞内信号结构域和CD3ζ的胞内信号结构域串联构成。
如上所述的工程化CD20靶向性的NKT细胞,优选地,所述嵌合抗原受体CD20ScFv-CD8-CD137-CD3ζ的核苷酸序列如序列表中SEQID NO.2所示。
一种如上所述NKT细胞的制备方法,该方法包括以下步骤:通过RT-PCR从NKT细胞cDNA中分别扩增CD8的hinge区和跨膜区,以及CD137和CD3ζ的胞内信号结构域,酶切、胶回收后通过T4DNA连接酶连接到载体pWPT-GFP,构建得到pWPT-CD8-CD137-CD3ζ;再通过全基因合成技术合成编码大鼠生长激素信号肽和CD20ScFv的核苷酸序列,酶切、胶回收后克隆到pWPT-CD8-CD137-CD3ζ,测序验证序列正确性,得到pWPT-CD20ScFv-CD8-CD137-CD3ζ;然后包装成携带pWPT-CD20ScFv-CD8-CD137-CD3ζ编码基因的慢病毒;利用该慢病毒感染NKT细胞,使NKT细胞表达该嵌合抗原受体。
一种如上所述NKT细胞的制备方法,优选地,该方法包括以下步骤:
1)NKT细胞的制备:分离静脉血中的单个核细胞,进行培养获得NKT细胞;
2)重组质粒pWPT-CD8-CD137-CD3ζ的构建:以提取步骤1培养后NKT细胞cDNA为模板,利用引物P1、P2进行PCR扩增获得CD8基因的hinge区和跨膜区,核苷酸序列如序列表中SEQID NO.3所示,两端分别含有MluI和BglⅡ酶切位点和保护碱基;利用引物P3、P4进行PCR扩增获得基因CD137胞内信号结构域,核苷酸序列如序列表中SEQID NO.4所示,两端分别含有BglⅡ和EcoRI酶切位点及保护碱基;利用引物P5、P6进行PCR扩增基因CD3ζ的胞内信号结构域,核苷酸序列如序列表中SEQID NO.5所示,两端分别含有EcoRI和SalI酶切位点及保护碱基,将获得的PCR产物电泳分离纯化后分别进行双酶切,酶切产物纯化后与MluI/SalI双酶切后的慢病毒表达载体pWPT-GFP通过T4DNA连接酶连接,连接产物转入Trans1-T1Phage Resistant化学感受态细胞,感受态细胞大量培养后提取质粒,将鉴定正确的重组质粒命名为pWPT-CD8-CD137-CD3ζ;
3)嵌合抗原受体pWPT-CD20ScFv-CD8-CD137-CD3ζ的构建:将含有大鼠生长激素信号肽和CD20ScFv的质粒pGSI-CD20ScFv进行BglⅡ/MluI双酶切,回收DNA片段;其中,该大鼠生长激素信号肽核苷酸序列如序列表中SEQID NO.6,5’端含有BglⅡ、kozak序列,该CD20ScFv核苷酸序列如序列表中SEQID NO.7,其3’端含有MluI酶切位点;将步骤2回收的重组质粒pWPT-CD8-CD137-CD3ζ进行BamHI/MluI双酶切,回收载体片段;将酶切后的DNA片段和质粒载体片段连接后转入Trans1-T1Phage Resistant化学感受态细胞,感受态细胞大量扩增培养后提取质粒,经鉴定正确的重组质粒即为嵌合抗原受体pWPT-CD20ScFv-CD8-CD137-CD3ζ;
4)嵌合抗原受体pWPT-CD20ScFv-CD8-CD137-CD3ζ修饰NKT细胞:慢病毒表达质粒pWPT-CD20ScFv-CD8-CD137-CD3ζ与辅助质粒psPAX2、pMD2.G按4:2:1的质量比共转染293T包装细胞,转染48h、72h时收集病毒上清,离心并用4.5μm滤器过滤,在滤液中添加1/4体积的5×PEG6000-NaCl进行混匀,离心后弃上清,沉淀用4℃预冷的无菌PBS溶解,获得病毒浓缩液;
5)嵌合抗原受体pWPT-CD20ScFv-CD8-CD137-CD3ζ修饰NKT细胞:取1×107-5×107NKT细胞,弃掉旧的培养液,加入2-4mL新鲜GT-T551培养液,加入200-400μL步骤4)得到的病毒浓缩液、2-4μL 1×10-6单位鱼精蛋白、终浓度为1000U/mL IL-2,置于37℃,5%CO2孵箱中感染12-16小时后,弃培养液,将细胞转至未包被的培养瓶中,加入20-50mL的GT-T551培养基,于37℃,5%CO2孵箱继续进行扩增培养8-15天后,感染获得嵌合抗原受体CD20ScFv-CD8-CD137-CD3ζ修饰的NKT细胞,该嵌合抗原受体的成熟蛋白氨基酸序列如序列表中SEQID NO.1所示。
如上所述工程化CD20靶向性的制备方法,优选地,所述步骤5)转染后的NKT细胞用终浓度为1000U IL-2的GT-T551培养液进行体外诱导,待细胞量占培养瓶80-90%时将细胞转入细胞培养袋中,隔2天加入终浓度为1000U/mL IL-2的新鲜GT-T551培养液进行扩增培养,待细胞扩增到1×109左右后,采用流式细胞仪对感染的细胞群体进行鉴定。
一种工程化CD20靶向性的NKT细胞,优选地,该细胞是采用如上所述的方法制备的。
如上所述的工程化CD20靶向性的NKT细胞在制备用于治疗肿瘤制剂中的应用。
如上所述的应用,优选地,所述肿瘤是指进展期CD20阳性恶性肿瘤。
本发明的研究者发现,在进展期CD20阳性恶性肿瘤免疫治疗中,工程化CD20靶向性的NKT细胞比NKT细胞具有更突出的优势,包括特异的靶向性,CD20嵌合抗原受体依赖的肿瘤杀伤活性以及输注后的长效性。工程化CD20靶向性的NKT细胞所拥有的这些特性,源于嵌合抗原受体的功能结构,主要包含抗体识别区域以及细胞激活区域,抗体识别区域使工程化CD20靶向性的NKT细胞靶向于进展期CD20阳性恶性肿瘤,另外,细胞内激活区能延长细胞在患者体内的存活时间。可见,工程化CD20靶向性的NKT细胞为治疗进展期CD20阳性恶性肿瘤提供一个新的选择。
本发明的有益效果在于:本发明的工程化CD20靶向性的NKT细胞可特异性结合CD20,在进展期CD20阳性恶性肿瘤治疗中采用工程化CD20靶向性的NKT细胞明显的延长免疫细胞在患者体内的存活时间,增强免疫细胞靶向识别肿瘤抗原的能力,加强对肿瘤细胞的杀伤活性。此外,本发明通过优化制备工艺,提供一种高效制备CD20靶向性NKT细胞的方法,该方法制备的NKT细胞具有较高的转染率,并可规模化生产,具有良好的产业应用前景。
附图说明
图1为流式细胞术对分离培养的NKT细胞表型分析结果。
图2为本发明所述慢病毒表达载体pWPT-CD8-CD137-CD3ζ的限制性内切酶MluI/SalI双酶切片段电泳鉴定图。
图3为本发明所述嵌合抗原受体的慢病毒表达载体pWPT-CD20ScFv-CD8-CD 137-CD3ζ的限制性内切酶BamHI/SalI双酶切片段电泳鉴定图。
图4为本发明所述的慢病毒表达质粒pWPT-CD20ScFv-CD8-CD137-CD3ζ的结构示意图,其中,逆时针序列为正向基因片度,顺时针为反向基因片段。
图5为流式细胞术检测对CAR20-NKT细胞表型鉴定结果。
图6为流式细胞术检测含有CD20ScFv-CD8-CD137-CD3ζ的病毒浓缩液对NKT细胞的感染效率。
图7为PT-PCR检测CD20ScFv-CD8-CD137-CD3ζ在NKT细胞中的表达效率。
图8为本发明所述的CAR20-NKT细胞对人肿瘤细胞的杀伤作用的细胞毒性分析图。
图9为本发明所述的CAR20-NKT细胞对CD20阳性的B细胞恶性肿瘤患者的治疗效果。
图10为本发明所述的CAR20-NKT细胞治疗前(上图)与治疗后1月CT的对比图。
图11为本发明所述的CAR20-NKT治疗前后患者病变淋巴结增速图。
具体实施方式
本发明提供一种工程化CD20靶向性的NKT细胞,它是在NKT细胞基础上构建而成的一种工程化细胞,是由嵌合抗原受体(chimeric antigen receptor,CAR)CD20ScFv-CD8-CD137-CD3ζ修饰的NKT细胞。嵌合抗原受体前体蛋白由信号肽、CD20ScFv、CD8的hinge区和跨膜区、CD137的胞内信号结构域和CD3ζ的胞内信号结构域串联构成,蛋白质翻译后在细胞内粗面型内质网切除信号肽后成为成熟嵌合抗原受体蛋白,分泌输出后并定位于NKT细胞的细胞膜上。该嵌合抗原受体的成熟蛋白氨基酸序列如序列表中SEQID NO.1所示,其对应的基因编码序列如序列表中SEQID NO.2所示。该嵌合抗原受体特异地识别CD20的胞外区LOOP环44个氨基酸的一段,其氨基酸序列如序列表中SEQID NO.8所示。该嵌合抗原受体以基因CD8的hinge区和跨膜区及CD137和CD3ζ的胞内信号结构域串联而成的结构为信号传导结构域,其氨基酸序列如序列表中SEQID NO.9所示,其对应的基因编码序列如序列表中SEQID NO.10所示。
利用该嵌合抗原受体修饰的NKT细胞,能够通过识别肿瘤细胞表面的CD20抗原,消除CD20抗原阳性的肿瘤细胞,进行肿瘤治疗。
本发明一个优选的实施方式是通过RT-PCR从人NKT细胞cDNA中分别扩增CD8的hinge区和跨膜区及CD137和CD3ζ的胞内信号结构域,酶切、胶回收后通过T4DNA连接酶连接到载体pWPT-GFP,构建得到pWPT-CD8-CD137-CD3ζ,再通过全基因合成技术合成编码大鼠生长激素信号肽和CD20ScFv的核苷酸序列,酶切、胶回收后克隆到pWPT-CD8-CD137-CD3ζ,测序验证序列正确性,得到pWPT-CD20ScFv-CD8-CD137-CD3ζ。然后包装成携带pWPT-CD20ScFv-CD8-CD137-CD3ζ编码基因的慢病毒。利用该慢病毒感染NKT细胞,使NKT细胞表达该嵌合抗原受体。通过细胞毒性分析实验证明该嵌合抗原受体修饰的NKT细胞对CD20阳性的肿瘤细胞具有特异杀伤作用。因此本发明所述的工程化CD20靶向性的NKT细胞可应用于CD20阳性的肿瘤治疗。
下面结合实施例对本发明作进一步说明,以下所举实施例是为便于更好地理解本发明,但并不用来限定本发明,本领域技术人员可以对本发明做各种修改或改动,这些等价形式同样落于本申请权利要求书所限定的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的实验材料,如无特殊说明,均为自常规生化试剂商店购买得到。
本发明的实施例中所用的试剂如下:
GT-T551细胞培养基,TaKaRa公司
淋巴细胞分离液,TBD公司
NK细胞培养基GT-T551、CD3单克隆抗体、retronectin,TAKORA公司
重组人蛋白干扰素-γ、重组人白介素2,protech公司
总RNA提取试剂盒RNAiso Reagent、高保真DNA聚合酶(HS DNA Polymerase)、T4DNA连接酶,TaKaRa公司
RevertAidTM First Strand cDNA Synthesis Kit,Fermentas公司
BglⅡ、EcoRI、MluI、BamHI,Fermentas公司
琼脂糖凝胶DNA回收试剂盒、普通DNA产物纯化试剂盒、质粒小提试剂盒,天根生化科技有限公司
pWPT-GFP,Addgene公司
Trans1-T1Phage Resistant化学感受态细胞,北京全式金生物技术有限公司
LipofectamineTM 2000Transfection Reagent转染试剂,Invitrogen公司
羧基荧光素琥珀酰亚胺酯,圣地亚哥,CA,USA
膜联蛋白V-RPE试剂盒,南方生物技术,AL,USA
实施例1NKT细胞的制备
(1)取人静脉血于含肝素的真空管中。采用淋巴细胞分离液,密度梯度离心方法分离获得单个核细胞(PBMCs)。
(2)PBMCs洗三次后,采用含有0.6%常规血清的NKT细胞培养基GT-T551调整细胞终浓度为2×106cell/mL;将细胞接种于预先经过终浓度为5μg/mLCD3单克隆抗体及终浓度为10μg/mL的retronectin(购自TAKORA公司)包被的75厘米细胞培养瓶。培养基里加入终浓度为1000U/mL的重组人蛋白干扰素-γ和1000U/mL的重组人白介素2,37℃,饱和湿度为5%CO2培养箱培养。
(3)第四天,向瓶中补加100mL含有0.6%常规血清的NKT细胞培养基,加入终浓度为1000U/mL的重组人白介素2。于37℃,5%CO2培养箱培养,得到NKT细胞,流式细胞术对NKT细胞表型进行分析。结果见图1,其中CD3:98.76%;CD3CD4:26.03%;CD3CD8:68.65%;CD3CD56:4.73%;CD8CD56:3.33%。
实施例2:嵌合抗原受体(pWPT-CD20ScFv-CD8-CD137-CD3ζ)慢病毒表达载体的构建
(1)NKT细胞cDNA的制备
离心沉淀实施例1培养的NKT细胞,用总RNA提取试剂盒RNAiso Reagent提取细胞的总RNA,-80℃保存备用。提取的总RNA用逆转录试剂盒RevertAidTM First Strand cDNA Synthesis Kit逆转录得NKT细胞cDNA,-20℃保存备用。
(2)慢病毒质粒pWPT-CD8-CD137-CD3ζ的制备
所用引物由北京天一辉远生物科技有限公司合成,引物序列如下(其中,下划线标记为保护碱基,方框为酶切位点):
以步骤(1)中NKT细胞cDNA为模板,用引物P1、P2进行PCR扩增,得到长287bp的CD8的hinge区和跨膜区,核苷酸序列如序列表中SEQID NO.3所示;两端分别含有MluI和BglⅡ酶切位点和保护碱基,用引物P3、P4进行PCR反应,扩增长146bp的CD137胞内信号结构域,核苷酸序列如序列表中SEQID NO.4所示,两端分别含有BglⅡ和EcoRI酶切位点及保护碱基;用引物P5、P6进行PCR反应,扩增CD3ζ的胞内信号结构域,核苷酸序列如序列表中SEQID NO.5所示,两端分别含有EcoRI和SalI酶切位点及保护碱基。各步PCR扩增反应体系相同,以扩增CD137胞内信号结构域为例,进行PCR扩增,PCR反应条件参照HS DNA Polymerase的说明书,反应体系(50μL)如下:
双蒸水:32.5μL
5×反应buffer:10μL
dNTP Mixture(2.5mM each):4μL
P3(10mM):1μL
P4(10mM):1μL
NKT细胞cDNA(200ng/ul):1μL
HS DNA Polymerase:0.5μL
将上述PCR产物用1%的琼脂糖凝胶进行分离,用琼脂糖凝胶DNA回收试剂盒进行DNA片段回收。得到片段分别进行双酶切反应,酶切产物普通DNA产物纯化试剂盒回收备用。
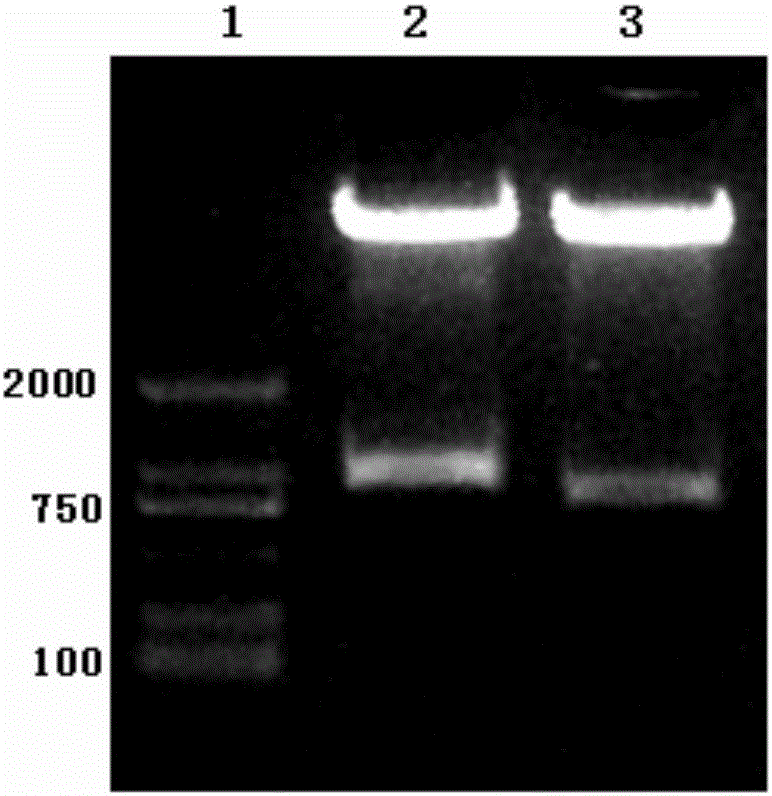
慢病毒表达载体pWPT-GFP用MluI/SalI双酶切,酶切产物经1%的琼脂糖凝胶进行分离,用琼脂糖凝胶DNA回收试剂盒回收大的载体片段,然后与之前回收的CD8、CD137、CD3ζ片段通过T4DNA连接酶连接,连接产物转化Trans1-T1Phage Resistant化学感受态细胞,37℃培养16h后挑取单克隆,37℃,250rpm培养12h后质粒小提试剂盒提取质粒。提取的质粒经限制性内切酶MluI和SalI双酶切鉴定,鉴定电泳图见图2,其中,1泳道:DNA分子量标记D2000;2泳道:质粒pWPT-GFP的酶切片段(835bp);3泳道:质粒pWPT-CD8-CD137-CD3ζ的酶切片段(756bp)。将鉴定正确的质粒送北京天一辉远科技有限公司对插入的融合基因片段进行测序。将测序结果正确的重组质粒命名为pWPT-CD8-CD137-CD3ζ。
(3)慢病毒质粒pWPT-CD20ScFv-CD8-CD137-CD3ζ的制备
全基因合成编码大鼠生长激素信号肽和CD20ScFv的核苷酸序列,序列如序列表中SEQID NO.6所示,由天一辉远科技有限公司合成,其5’端含有BglⅡ、kozak序列,3’端含有MluI酶切位点,克隆在质粒pGSI中,命名为pGSI-CD20ScFv。质粒经BglⅡ/MluI双酶切,酶切产物经1%琼脂糖凝胶进行分离,用琼脂糖凝胶DNA回收试剂盒回收目的片段备用。
pWPT-CD8-CD137-CD3ζ质粒经限制性内切酶BamHI/MluI进行酶切。酶切产物经1%琼脂糖凝胶进行分离,用琼脂糖凝胶DNA回收试剂盒回收载体片段备用。然后与回收的含有大鼠生长激素信号肽和CD20ScFv的DNA片段通过T4DNA连接酶进行连接,具体方法见说明书。将连接产物转化Trans1-T1Phage Resistant化学感受态细胞,37℃培养16h后挑取单克隆,37℃,250rpm培养12h后,用质粒小提试剂盒提取质粒。提取的质粒经限制性内切酶BamHI/MluI双酶切鉴定,鉴定结果如图3所示,其中,1泳道:DNA分子量标记D15000;2泳道:质粒pWPT-CD8-CD137-CD3ζ的酶切片段(756bp);3泳道:质粒pWPT-GFP的酶切片段(835bp);4泳道:质粒pWPT-CD20ScFv-CD8-CD137-CD3ζ的酶切片段(1305bp)。将鉴定正确的质粒送北京天一辉远生物科技有限公司对插入的融合基因片段进行测序。将测序结果正确的重组质粒命名为pWPT-CD20ScFv-CD8-CD137-CD3ζ,亦称为CAR-CD20,其结构示意图如图4所示,其中包括信号肽、抗CD20单链抗体、CD8的hinge区和跨膜区及CD137和CD3ζ的胞内信号结构域。
实施例3嵌合抗原受体pWPT-CD20ScFv-CD8-CD137-CD3ζ修饰的NKT细胞的制备
(1)慢病毒的包装和浓缩
用质粒小提试剂盒分别提取慢病毒表达质粒pWPT-CD20ScFv-CD8-CD137-CD3ζ和辅助质粒psPAX2、pMD2.G。分光光度计测定质粒浓度,三种质粒以4:2:1的质量比用LipofectamineTM 2000Transfection Reagent转染试剂共转染293T包装细胞。分别在转染48h、72h时收集病毒上清于EP管中,4℃,2000g离心10min,转移上清至新EP管中,用4.5μm滤器过滤病毒上清;过滤的病毒上清与5×PEG6000-NaCl按照4:1的体积比混匀,4℃静置2h,然后4℃,10000g离心20min,弃上清,沉淀用4℃预冷的无菌PBS溶解,即得病毒浓缩液,进行分装,-80℃保存备用。
(2)慢病毒感染NKT细胞及感染后细胞的扩增培养
取实施例1在25cm2培养瓶的培养的1×107NKT细胞,弃掉旧的培养液,加入2mL新鲜GT-T551培养液,200μL病毒液,2μL 1×10-6单位鱼精蛋白,终浓度为1000U/mL IL-2,置于37℃,5%CO2孵箱中感染12小时后,弃培养液,同时设置含GFP绿色荧光标记的嵌合抗原受体病毒浓缩液对对照组NKT细胞进行同步感染,用于计算该病毒的感染效率。将感染后的细胞转至未包被的75cm2培养瓶中,加入20mL的培养基,于37℃,5%CO2孵箱继续进行培养。该嵌合抗原受体病毒浓缩液对NKT细胞的感染效率,设置含GFP绿色荧光标记的嵌合抗原受体病毒浓缩液对对照组NKT细胞进行同步感染,用流式细胞术检测并计算该病毒的感染效率,结果如图6所示,感染效率为33.63%。
(3)体外诱导扩增成富含CD3CD56双阳性的CAR20-NKT细胞群
将感染后的NKT细胞应用含有终浓度为1000U/mL IL-2的GT-T551培养液对CART细胞进行体外诱导、待细胞量占培养瓶80-90%时将细胞转入细胞培养袋中,隔2天加入终浓度为1000U/mL IL-2的GT-T551培养液扩增培养,待细胞扩增到1×109左右后,采用流式细胞仪对感染的细胞群体进行鉴定,细胞表型一般达到:CD3阳性细胞比例>90%;CD3CD8阳性细胞比例>70%;CD3CD56双阳性细胞比例>5%,结果见图5,CD3:96.9%;CD3CD4:20.93%;CD3CD8:70.52%;CD3CD56:6.24%;CD8CD56:5.09%。
(4)流式细胞术检测嵌合抗原受体CD20ScFv-CD8-CD137-CD3ζ在NKT细胞内的表达
分别收集1×106感染pWPT-CD20ScFv-CD8-CD137-CD3ζNKT细胞(即CAR20-NKT细胞)及未感染病毒对照组细胞(NKT),用2%多聚甲醛固定,进行逆转录-PCR检测基因的表达,检测结果如图7,图中阳性参照物(阳参)指单独pWPT-CD20ScFv-CD8-CD137-CD3ζ重组质粒;NKT为未感染pWPT-CD20ScFv-CD8-CD137-CD3ζ重组质粒的NKT细胞;CAR20-NKT为感染pWPT-CD20ScFv-CD8-CD137-CD3ζ重组质粒的NKT细胞。结果表明,嵌合抗原受体在NKT细胞内表达,该嵌合抗原受体的氨基酸序列如序列表中SEQID NO.1所示。
实施例4 CAR20-NKT细胞对人肿瘤细胞杀伤作用的细胞毒性分析
分别取实施例3中制备的CAR20-NKT细胞和实施例1中培养的NKT细胞接种于96孔板,用羧基荧光素琥珀酰亚胺酯(CFSE)进行染色,与Molt-4,K562,K562-CD20+和Reji细胞以1:1,5:1,10:1,20:1比率进行共培养,经过24小时的共培养后,将细胞用膜联蛋白V-RPE试剂盒染色。流式细胞术对细胞凋亡进行检测,细胞死亡的量根据下面的公式计算:死亡率=(对照-样品)/对照×100%),对照为未加CAR20-NKT的肿瘤细胞;样本为加入效靶比(杀伤细胞:靶细胞)为20:1的CAR20-NKT的肿瘤细胞,见图8。嵌合抗原受体CD20ScFv-CD8-CD137-CD3ζ修饰的NKT细胞对高表达CD20的肿瘤细胞具有特异杀伤活性。
实施例5 CAR20-NKT细胞对CD20阳性的恶性肿瘤患者的治疗效果
取5×108个CD20ScFv-CD8-CD137-CD3ζ修饰的NKT淋巴细胞,连续三天静脉回输到CD20阳性的肿瘤患者体内,治疗一个月后进行分析。
如图9所示,免疫组化检测工程化CD20靶向性的NKT细胞回输到患者体内的归巢情况,结果显示,淋巴结活检显示靶向免疫细胞治疗后大量CD3,CD20阳性细胞出现在肿瘤组织,说明CD20靶向性的NKT细胞能够归巢到病灶部位发挥杀伤作用。
如图10所示,CT显示工程化CD20靶向性的NKT细胞对CD20恶性肿瘤患者的治疗效果,结果表明靶向免疫细胞治疗前(上图)与治疗后1月CT(下图)对比:肿大淋巴结缩小(具体见箭头所示)。
如图11所示,工程化CD20靶向性的NKT细胞治疗后患者病变淋巴结增速较前明显减慢,并于治疗3周后,肿大淋巴结开始自行消退(图中以肿大的锁骨上浅表淋巴结最长经为代表)。
- 还没有人留言评论。精彩留言会获得点赞!
- 具有肿瘤细胞靶向性的超细磁性核壳纳米材料及其制备和应用的制作方法与工艺
- 具有肿瘤细胞靶向性的超细磁性核壳纳米材料及其制备和应用的制作方法与工艺
- 一种利用细胞通透性差异治疗皮肤癌的靶向药物的制作方法与工艺
- 一种基于细胞源性微囊泡的肿瘤靶向递送载体及制备方法和应用与流程
- 靶向CLDN6的免疫效应细胞及其制备方法和应用与流程
- 一种检测靶向CD33的CART细胞中CAR表达的荧光定量试剂盒的制作方法与工艺
- 靶向HBV核心启动子的抗HBV药物筛选细胞模型及其构建和应用的制作方法与工艺
- 一种响应过氧化氢杀灭肿瘤细胞的光敏感靶向抗肿瘤前药及其制备方法与应用与流程
- 靶向循环肿瘤细胞的长循环纳米粒及其制备和应用的制作方法与工艺
- 使用CRISPR/Cas9技术靶向敲除水稻矮杆基因SD1的方法与流程
- 一种治疗非小细胞肺癌的中药胶囊的制作方法
- 基于p53抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于ca125抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于survivin抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于psma抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于psa抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于scc抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于sp17抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于mage-3抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于lmp-1抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图