靶向循环肿瘤细胞的长循环纳米粒及其制备和应用的制作方法
本发明涉及药物制剂
技术领域:
,尤其涉及一种靶向循环肿瘤细胞的长循环纳米粒及其制备和应用。
背景技术:
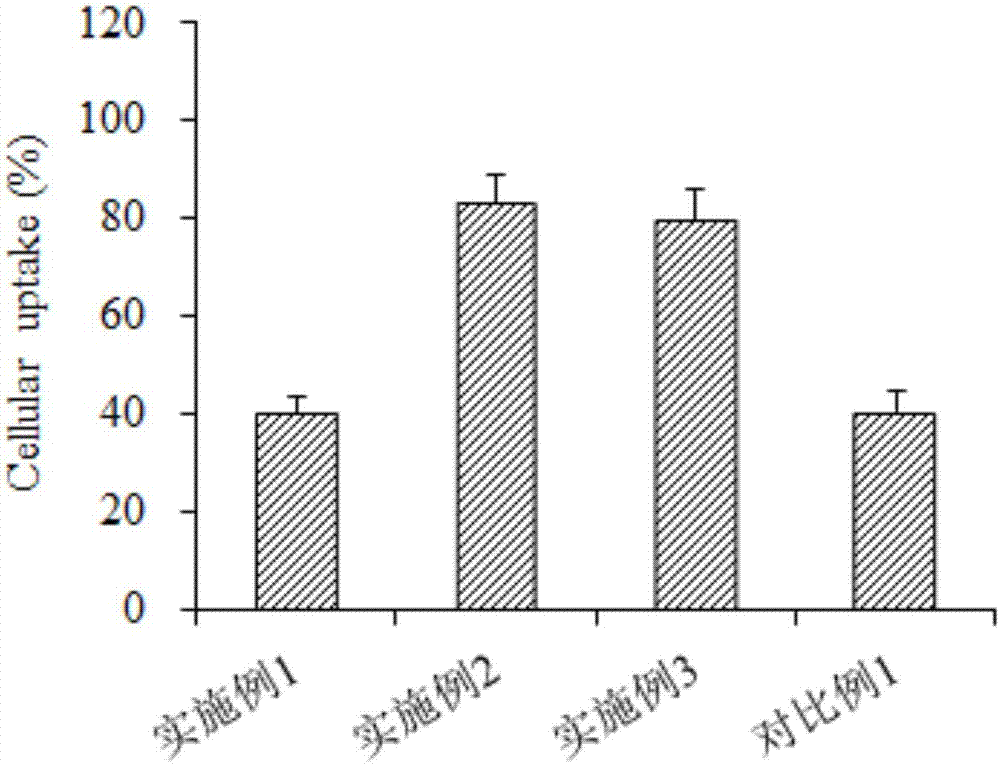
:研究发现,肿瘤在最初发生时多为器官局限性疾病,但最终几乎都会通过血流传播到远处器官形成转移,这种远处转移是导致肿瘤患者死亡的主要原因。而循环肿瘤细胞存在于患者外周血中,是造成肿瘤转移和复发的必要前提。循环肿瘤细胞主要是指自发或因诊疗操作由实体瘤或转移灶释放入外周血循环的肿瘤细胞,且主要通过以下步骤完成血行性转移:从原发性肿瘤上分离;内渗进入血管系统;在体循环中存活;外渗进入靶组织进而形成远处转移灶。因此,杀伤循环肿瘤细胞能阻断或延缓肿瘤转移的过程。癌症患者体内每天大约有数百万个肿瘤细胞从原发性的肿瘤部位脱落,进入血液循环系统,但是大部分因缺乏变形能力不能顺利通过血管、缺乏形成癌栓能力或受到机体的免疫系统攻击而在短期内死亡,只有很少一部分具有高活力及高转移潜能的癌细胞能够存活下来,进而在远处脏器中定植。研究表明,循环肿瘤细胞与血液中红细胞或白细胞的比例接近于1:109或1:106,相当于“稻草堆中的针”。另外,循环肿瘤细胞所处的生物环境明显不同于实体瘤。当循环肿瘤细胞循环在不同管路中(动脉、静脉或毛细血管)时,会受到一个较大范围的流体剪切力,而实体瘤内的癌细胞承受的是因僵硬的细胞外基质产生的组织液静压。中国发明专利cn106377772a公开了一种用于清除循环肿瘤细胞的免疫吸附剂,该吸附剂以天然高分子为载体,以循环肿瘤细胞特异性抗原的单克隆或多克隆抗体为培基,能特异性地清除血液中的肿瘤细胞。但是,该吸附剂不含抗肿瘤癌或凋亡配体,无法使循环肿瘤细胞凋亡,只能用于体外全血灌流,而目前该方法还不成熟,在临床使用方面仍面临较多挑战。中国发明专利cn105125510a公开了一种抗体偶联的介孔二氧化硅/米非司酮纳米制剂,该制剂包含二氧化硅纳米粒子、米非司酮和上皮细胞粘附分子抗体(anti-epcam),能靶向识别并遏制循环肿瘤细胞的活性。但是,单克隆稳定性差、价格昂贵而且难以大批量制备。中国发明专利cn104535772a公开了一种her2高表达的循环肿瘤细胞的多肽-磁性纳米颗粒及其制备方法和应用,该发明提出了一种利用多肽对细胞表面抗原进行特异性识别ctcs的方法。但是该制剂进入机体体循环后,易被机体的免疫系统,尤其是巨噬细胞所识别,而被快速清除出体外,难以与循环肿瘤细胞结接触,不能有效发挥多肽特异性识别的效果。因此目前亟需一种新型手段,提高药物载体在体内的循环时间,并主动靶向循环肿瘤细胞,以改善循环肿瘤细胞的治疗效果。技术实现要素:为解决上述技术问题,本发明的目的是提供一种靶向循环肿瘤细胞的长循环纳米粒及其制备和应用,本发明的靶向循环肿瘤细胞的长循环纳米粒(slns),能延长载体血液循环时间,提高载体对循环肿瘤细胞的靶向性,抑制巨噬细胞的吞噬,并通过化学药物引起循环肿瘤细胞的凋亡,从而干扰肿瘤转移进程,显著遏制肿瘤转移。在一方面,本发明提供了一种靶向循环肿瘤细胞的长循环纳米粒,纳米粒的内核包括化学药物、固体脂质材料和乳化剂,纳米粒的表面修饰有抗巨噬细胞吞噬多肽(pepcd47)和循环肿瘤细胞靶向多肽(pep10)。进一步地,化学药物为多西他赛、阿霉素和紫杉醇中的一种或几种。进一步地,固体脂质材料为单硬脂酸甘油酯、三硬脂酸甘油酯和甘油棕榈酸硬脂酸酯中的一种或几种。进一步地,乳化剂为泊洛沙姆、吐温-80、聚乙烯醇和十二烷基磺酸钠中的一种或几种。进一步地,抗巨噬细胞吞噬多肽(pepcd47)的氨基酸序列如seqidno.1所示。进一步地,循环肿瘤细胞靶向多肽(pep10)的氨基酸序列如seqidno.2所示。在另一方面,本发明还提供了一种上述靶向循环肿瘤细胞的长循环纳米粒的制备方法,包括以下步骤:(1)将抗巨噬细胞吞噬多肽和循环肿瘤细胞靶向多肽溶于第一有机溶剂,然后与溶有化学药物的第二有机溶剂混合,再与熔融的固体脂质材料混合,得到油相;(2)将乳化剂在水中分散均匀,得到水相;(3)将步骤(1)得到的油相与步骤(2)得到的水相中混匀后,将第一有机溶剂和第二有机溶剂除尽,得到靶向循环肿瘤细胞的长循环纳米粒。进一步地,在步骤(1)中,第一有机溶剂为二甲亚砜、乙腈和三氯甲烷的一种或几种,第二有机溶剂为甲醇、乙醇和二氯甲烷的一种或几种。进一步地,在步骤(1)中,第二有机溶剂中还溶有大豆磷脂。大豆磷脂起到表面活性剂的作用,能够使化学药物在第二有机溶剂中分散的更加均匀。进一步地,在步骤(1)中,抗巨噬细胞吞噬多肽和循环肿瘤细胞靶向多肽中均含有硬脂酸。硬脂酸的作用是增加多肽的亲脂性。进一步地,在步骤(1)中,固体脂质材料在60~80℃下的水浴条件下熔融。进一步地,在步骤(1)中,抗巨噬细胞吞噬多肽(pepcd47)的氨基酸序列如seqidno.1所示。进一步地,在步骤(1)中,循环肿瘤细胞靶向多肽(pep10)的氨基酸序列如seqidno.2所示。进一步地,在步骤(1)中,化学药物为多西他赛、阿霉素和紫杉醇中的一种或几种。进一步地,在步骤(1)中,固体脂质材料为单硬脂酸甘油酯、三硬脂酸甘油酯和甘油棕榈酸硬脂酸酯中的一种或几种。进一步地,在步骤(2)中,在60~80℃的水浴条件下分散。进一步地,在步骤(1)中,乳化剂为泊洛沙姆、吐温-80、聚乙烯醇和十二烷基磺酸钠中的一种或几种。在又一方面,本发明还提供了上述靶向循环肿瘤细胞的长循环纳米粒在制备治疗循环肿瘤细胞制剂中的应用。借由上述方案,本发明至少具有以下优点:(1)利用cd47-sirpɑ通路在逃避巨噬细胞吞噬中的作用,选取cd47中有效氨基酸序列通过化学合成得到功能性多肽pepcd47,并将其修饰于靶向循环肿瘤细胞的长循环纳米粒(slns)表面,克服传统纳米载体peg化后多次注射时易引起免疫排斥的难点,同时slns载体可延长体循环时间,提高药物疗效。(2)将pep10修饰于slns表面后,借助于pep10与循环肿瘤细胞表面的上皮细胞粘附分子(epcam)的特异性结合,将载体靶向集中于循环肿瘤细胞,实现主动靶向治疗,同时解决单克隆抗体稳定性和重现性差,价格昂贵,难以大量制备等缺点。(3)将抗癌药物即化学药物包裹于slns内核中,递送至循环肿瘤细胞内,发挥杀伤循环肿瘤细胞,防止癌症转移的效果。同时本发明的slns稳定性高、生理相容性好,可增加化学药物稳定性,可使药物稳定缓慢释放,且提高药物生物利用度,降低机体毒副作用。(4)制备工艺简单,包封率高,便于工业化生产;所制得的靶向循环肿瘤细胞的长循环纳米粒的物理性质等方面符合循环肿瘤细胞治疗的需要。上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。附图说明图1图示了流式定量分析巨噬细胞raw264.7对slns的摄取情况;图2图示了流式定量分析乳腺癌细胞mcf-7对slns的摄取情况;图3图示了slns在裸鼠血液中对循环肿瘤细胞的靶向性的荧光测试结果;图4为slns在裸鼠体内血药-浓度曲线测试结果。具体实施方式下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。除非另外指明,以下实施例中所涉及到的“dtx”均表示“多西他赛”;“dox”均表示“阿霉素”;“taxol”均代表“紫杉醇”;“sa”均表示“硬脂酸”(上海泰坦科技股份有限公司);“c6”均表示“香豆素6”;“peg”均表示“聚乙二醇”。实施例1dtx-slns-pepcd47的制备本实施例提供了作为对照实验的slns的制备方法,具体如下:称取3mgdtx及20mg大豆磷脂置于西林瓶中,加入2ml甲醇溶解。称取1mgsa-pepcd47溶于微量二甲亚砜中,随后与上述甲醇溶液混合,得到混合溶液。同时,称取60mg单硬脂酸甘油酯于70℃的水浴下熔融,得到熔融液,将上述混合溶液与熔融液混合得到均一的油相,随后将含有乳化剂的水相(提前预热至70℃)快速加至油相中,经分散后,置于超声细胞粉碎机中超声,搅拌5h挥尽有机溶剂,即得dtx-slns-pepcd47。其中,乳化剂为吐温-80。本实施例所制备的slns的粒径、电位、载药量和包封率如表1所示。实施例2dtx-slns-pep10的制备本实施例提供了作为对照实验的slns的制备方法,具体如下:称取3mgdtx及20mg大豆磷脂置于西林瓶中,加入2ml甲醇溶解。称取3mgsa-pep10溶于微量二甲亚砜中,随后与上述甲醇溶液混合,得到混合溶液。同时,称取60mg单硬脂酸甘油酯于70℃的水浴下熔融,得到熔融液,将上述混合溶液与熔融液混合得到均一的油相,随后将含有乳化剂的水相(提前预热至70℃)快速加至油相中,经分散后,置于超声细胞粉碎机中超声,搅拌5h挥尽有机溶剂,即得dtx-slns-pep10。其中,乳化剂为吐温-80。本实施例所制备的slns的粒径、电位、载药量和包封率如表1所示。实施例3dtx-slns-pepcd47-pep10的制备本发明的靶向循环肿瘤细胞的长循环纳米粒的制备方法,具体如下:称取3mgdtx及20mg大豆磷脂置于西林瓶中,加入2ml甲醇溶解。称取1mgsa-pepcd47与3mgsa-pep10溶于微量二甲亚砜中,随后与上述甲醇溶液混合,得到混合溶液。同时,称取60mg单硬脂酸甘油酯于70℃的水浴下熔融,得到熔融液。将上述混合溶液与熔融液混合,得到均一的油相。将乳化剂在水浴70℃条件下,分散于纯化水中,制成水相,其中,乳化剂为吐温-80。随后将含有水相(提前预热至70℃)快速加至油相中,经分散后,置于超声细胞粉碎机中超声,搅拌5h挥尽有机溶剂,即得dtx-slns-pepcd47-pep10。本实施例所制备的slns的粒径、电位、载药量和包封率如表1所示。实施例4dtx-slns-pepcd47-pep10的制备本发明的靶向循环肿瘤细胞的长循环纳米粒的制备方法,具体如下:称取3mgdtx及20mg大豆磷脂置于西林瓶中,加入2ml甲醇溶解。称取1mgsa-pepcd47与3mgsa-pep10溶于微量二甲亚砜中,随后与上述甲醇溶液混合,得到混合溶液。同时,称取60mg单硬脂酸甘油酯于70℃的水浴下熔融,得到熔融液。将上述混合溶液与熔融液混合,得到均一的油相。将乳化剂在水浴70℃条件下,分散于纯化水中,制成水相,其中,乳化剂为泊洛沙姆。随后将含有水相(提前预热至70℃)快速加至油相中,经分散后,置于超声细胞粉碎机中超声,搅拌5h挥尽有机溶剂,即得dtx-slns-pepcd47-pep10。实施例5dtx-slns-pepcd47-pep10的制备本发明的靶向循环肿瘤细胞的长循环纳米粒的制备方法,具体如下:称取3mgdtx及20mg大豆磷脂置于西林瓶中,加入2ml甲醇溶解。称取1mgsa-pepcd47与3mgsa-pep10溶于微量二甲亚砜中,随后与上述甲醇溶液混合,得到混合溶液。同时,称取60mg单硬脂酸甘油酯于70℃的水浴下熔融,得到熔融液。将上述混合溶液与熔融液混合,得到均一的油相。将乳化剂在水浴70℃条件下,分散于纯化水中,制成水相,其中,乳化剂为聚乙烯醇。随后将含有水相(提前预热至70℃)快速加至油相中,经分散后,置于超声细胞粉碎机中超声,搅拌5h挥尽有机溶剂,即得dtx-slns-pepcd47-pep10。实施例6dox-slns-pepcd47-pep10的制备本发明的靶向循环肿瘤细胞的长循环纳米粒的制备方法,具体如下:称取3mgdox及20mg大豆磷脂置于西林瓶中,加入2ml甲醇溶解。称取1mgsa-pepcd47与3mgsa-pep10溶于微量二甲亚砜中,随后与上述甲醇溶液混合,得到混合溶液。同时,称取60mg单硬脂酸甘油酯于70℃的水浴下熔融,得到熔融液。将上述混合溶液与熔融液混合,得到均一的油相。将乳化剂在水浴70℃条件下,分散于纯化水中,制成水相,其中,乳化剂为吐温-80。随后将含有水相(提前预热至70℃)快速加至油相中,经分散后,置于超声细胞粉碎机中超声,搅拌5h挥尽有机溶剂,即得dox-slns-pepcd47-pep10。。实施例7taxol-slns-pepcd47-pep10的制备本发明的靶向循环肿瘤细胞的长循环纳米粒的制备方法,具体如下:称取3mgtaxol及20mg大豆磷脂置于西林瓶中,加入2ml甲醇溶解。称取1mgsa-pepcd47与3mgsa-pep10溶于微量二甲亚砜中,随后与上述甲醇溶液混合,得到混合溶液。同时,称取60mg单硬脂酸甘油酯于70℃的水浴下熔融,得到熔融液。将上述混合溶液与熔融液混合,得到均一的油相。将乳化剂在水浴70℃条件下,分散于纯化水中,制成水相,其中,乳化剂为吐温-80。随后将含有水相(提前预热至70℃)快速加至油相中,经分散后,置于超声细胞粉碎机中超声,搅拌5h挥尽有机溶剂,即得taxol-slns-pepcd47-pep10。实施例8dtx-slns的制备本实施例提供了作为对照实验的对比例1的slns的制备方法,具体如下:称取3mgdtx及20mg大豆磷脂置于西林瓶中,加入2ml甲醇溶解。同时,称取60mg单硬脂酸甘油酯于70℃的水浴下熔融,将甲醇溶液与熔融液混合得到均一的油相,随后将含有乳化剂的水相(提前预热至70℃)快速加至油相中,经分散后,置于超声细胞粉碎机中超声,搅拌5h挥尽有机溶剂,即得dtx-slns。其中,乳化剂为吐温-80。本实施例所制备的slns的粒径、电位、载药量和包封率如表1所示。实施例9dtx-slns-peg2000的制备本实施例提供了作为对照实验的对比例2的slns的制备方法,具体如下:称取3mgdtx、1mgsa-peg2000及20mg大豆磷脂s-100置于西林瓶中,加入2ml甲醇溶解,同时,称取60mg单硬脂酸甘油酯于70℃的水浴下熔融,将甲醇溶液与熔融液混合得到均一的油相,随后将含有乳化剂的水相(提前预热至70℃)快速加至油相中,经分散后,置于超声细胞粉碎机中超声,超声条件为500w,超声时间为120s,最后,搅拌5h挥尽有机溶剂,即得dtx-slns-peg2000。其中,乳化剂为吐温-80。本实施例所制备的slns的粒径、电位、载药量和包封率如表1所示。实施例10dtx-slns-peg6000的制备本实施例提供了作为对照实验的对比例3的slns的制备方法,具体如下:称取3mgdtx、1mgsa-peg6000及20mg大豆磷脂s-100置于西林瓶中,加入2ml甲醇溶解,同时,称取60mg单硬脂酸甘油酯于70℃的水浴下熔融,将甲醇溶液与熔融液混合得到均一的油相,随后将含有乳化剂的水相(提前预热至70℃)快速加至油相中,经分散后,置于超声细胞粉碎机中超声,超声条件为500w,超声时间为120s,最后,搅拌5h挥尽有机溶剂,即得dtx-slns-peg6000。其中,乳化剂为吐温-80。本实施例所制备的slns的粒径、电位、载药量和包封率如表1所示。表1本发明涉及的slns的物理参数slns来源粒径(nm)电位(mv)包封率(%)载药量(%)实施例1163.9-12.8589.893.37实施例2176.6-11.9090.483.39实施例3198.4-10.2181.763.07对比例181.7-6.0086.293.24对比例2134.2-20.1789.353.29对比例3166.3-25.5487.853.25实施例11slns体外细胞实验(1)抗吞噬实验以下实验中所使用的slns分别为实施例1-3以及8-10中所制备的产物。将小鼠单核巨噬细胞株raw264.7细胞进行消化后,计数后按1×105个/ml浓度分别铺于6孔板,待细胞融合至80-90%后,弃去旧培养基,加入负载c6的slns。培养1h后,舍弃培养基,加入0.25%胰酶消化,1500rpm离心5min,倒去上清,加入pbs离心洗涤3次,最后细胞分散于适量的pbs中形成单细胞混悬液,用流式细胞仪评价细胞对slns的摄取情况。结果如图1所示,图1表明,实施例1和实施例3所制slns表面的pepcd47可与巨噬细胞的sirpɑ结合,传递抑制吞噬信号,因此两者摄取率均在20%左右;实施例2所制slns无pepcd47修饰,其摄取率接近85%;对比例1为空白slns,1h内巨噬细胞raw264.7对其的摄取率接近100%;对比例2为peg2000修饰的slns,peg2000能增加slns的亲水性,抑制巨噬细胞的吞噬,因此摄取率约为45%;peg6000亲水链长于peg2000,因此经peg6000修饰后,巨噬细胞raw264.7对对比例3的摄取率为14%左右。综上所述,pepcd47与sirpα结合后抑制巨噬细胞吞噬的效果强于peg2000,稍弱于peg6000。(2)靶向性实验以下实验中所使用的slns分别为实施例1-3以及实施例8中所制备的产物。将人乳腺癌细胞株mcf-7细胞进行消化后,计数后按1×105个/ml浓度分别铺于6孔板,待细胞融合至80-90%后,弃去旧培养基,加入负载c6的slns。培养2h后,舍弃培养基,加入0.25%胰酶消化,1500rpm离心5min,倒去上清,加入pbs离心洗涤3次,最后细胞分散于适量的pbs中形成单细胞混悬液,用流式细胞仪评价细胞对slns的摄取情况。结果如图2所示,从图2中可看出,mcf-7细胞对实施例2和实施例3所制slns摄取率均在85%左右,明显高于未经pep10修饰的实施例1(摄取率约40%)及对比例1(摄取率约42%),表明pep10可与mcf-7细胞表面的epcam特异性结合,促进细胞对slns的摄取。实施例12slns体内评价实验本实施例所使用的slns分别为实施例3和实施例8中所制备的产物。(1)动物模型建立实验动物为健康雌性balb/c裸鼠,收集对数生长期的mcf-7细胞,用生理盐水将细胞重悬,密度为5×105个/ml,用一次性无菌注射器给裸鼠尾静脉注射约200μl细胞悬液,使肿瘤细胞在裸鼠血液中循环10min后,即建立起循环肿瘤细胞动物模型。(2)体内靶向性实验选取成功构建动物模型的裸鼠9只,随机分为三组:生理盐水组、c6-slns组和c6-slns-pepcd47-pep10组。其中,c6-slns组使用的slns为实施例8中所制备的产物,c6-slns-pepcd47-pep10组使用的slns为实施例3中所制备的产物。按dtx给药量为8mg/kg进行尾静脉注射。在给药后2h后,将裸鼠从尾巴处侧切,收集血液;将10倍血液体积的红细胞裂解液加入血液样品中,室温裂解5min后,500g离心5min,离心弃去上清。加入5倍细胞沉淀体积的pbs,重悬沉淀,500g离心5min,弃去上清,重复两次该步骤。用pbs充分重悬后,置于6孔板内,用激光共聚焦显微镜观察slns在血液中对ctcs的靶向性。使用激光共聚焦显微镜观察slns在裸鼠血液中对循环肿瘤细胞的靶向性,结果如图3所示,图3a和3d中,经细胞膜染料did染色的mcf-7细胞发出红色荧光,图3b和3e中,c6发出绿色荧光,图3c和3f为merge结果,是对前两图的叠加结果,在叠加后,细胞发出黄色荧光。从结果看出,对比例1中c6的绿色荧光零星分布在mcf-7细胞周围,强度微弱,而实施例3的绿色荧光较为集中,且绿色荧光强度明显高于对比例1,表明slns经pep10修饰后,能在血液中特异性地靶向mcf-7细胞,促进细胞对slns的摄取。(3)体内长循环实验选取成功构建动物模型的裸鼠48只,平均分为两组:c6-slns组和c6-slns-pepcd47-pep10组。其中,c6-slns组使用的slns为实施例8中所制备的产物,c6-slns-pepcd47-pep10组使用的slns为实施例3中所制备的产物。按dtx的给药量为8mg/kg进行尾静脉注射。在给药后0.08、0.5、1、2、4、8、12、24h的时间点,眼眶取血0.5ml于肝素钠化的ep中,经一系列处理后,采用液质联用仪测定血液中dtx含量。使用液质联用仪分析slns在裸鼠体内血药-浓度曲线,结果如图4所示,从中可看出,在给药后的0.08~8h内,实施例3的血药浓度均高于对比例1。另外,从血药-浓度曲线计算得出的药动学参数可知,实施例3的血浆清除率约为1.70l/hr/kg,低于对比例1的3.22l/hr/kg,两者具有显著性差异。以上结果表明,slns经pep10修饰后能降低机体的清除速率,显著延长载体循环时间。以上所述仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。序列表<110>苏州大学<120>靶向循环肿瘤细胞的长循环纳米粒及其制备和应用<160>1<170>patentinversion3.3<210>1<211>23<212>prt<213>氨基酸序列<400>1valargargaspalaproargphesermetglnglyleuaspala51015cysglyglyasnasncysasnasn20<210>2<211>12<212>prt<213>氨基酸序列<400>2cysgluargvalileglythrglytrpvalargcys510当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 具有肿瘤细胞靶向性的超细磁性核壳纳米材料及其制备和应用的制作方法与工艺
- 具有肿瘤细胞靶向性的超细磁性核壳纳米材料及其制备和应用的制作方法与工艺
- 一种利用细胞通透性差异治疗皮肤癌的靶向药物的制作方法与工艺
- 一种基于细胞源性微囊泡的肿瘤靶向递送载体及制备方法和应用与流程
- 靶向CLDN6的免疫效应细胞及其制备方法和应用与流程
- 一种检测靶向CD33的CART细胞中CAR表达的荧光定量试剂盒的制作方法与工艺
- 靶向HBV核心启动子的抗HBV药物筛选细胞模型及其构建和应用的制作方法与工艺
- 一种响应过氧化氢杀灭肿瘤细胞的光敏感靶向抗肿瘤前药及其制备方法与应用与流程
- 靶向循环肿瘤细胞的长循环纳米粒及其制备和应用的制作方法与工艺
- 使用CRISPR/Cas9技术靶向敲除水稻矮杆基因SD1的方法与流程
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺