一种微生物角蛋白酶的分离纯化及应用方法与流程
本发明属于生物技术领域。具体涉及一种从发酵液中分离纯化副短短芽孢杆菌角蛋白酶的方法及该角蛋白酶的应用。
背景技术:
制革生产过程包含脱毛工序。传统的化学脱毛采用的脱毛剂是硫化物(Na2S)和石灰。使脱毛过程中排出的废液中含有大量高污染物质,这也是制革行业污染环境的主要环节。近年来采用蛋白酶进行脱毛已受到大量关注,但蛋白酶质量不稳定,专一性差,作用复杂,因此在生产中易出现脱毛不彻底或烂面、松面等问题,操作控制难度大,这也是过去酶法脱毛不能全面代替化学法的主要原因。而角蛋白酶由于具备特异性强、底物选择性专一等优势,在制革工业中具有重要应用。开发具有高活性、脱毛效果好、对胶原蛋白活性低的高选择性酶制剂是酶法脱毛行业的发展趋势。由于角蛋白酶底物选择性好,选择无胶原或者低胶原酶活性的角蛋白酶,能最大程度保留胶原组分,在不破坏皮革胶原、获得高品质皮革产品的情况下,又可以彻底消除或者降低硫化物对环境的污染,实现无硫脱毛,应用于制革脱毛具有广阔的发展前景。
此外,角蛋白酶的另一重要应用潜力是在制药方面可以改善甲板的对药物通透性。通常发现感染指甲和脚指甲的是真菌类致病菌。常规的治疗方案是口服抗真菌药物与按月注射激素类药物相结合。这种治疗方案具有诸多副作用,如患者必需承受疼痛、身体机能损伤以及药物相互作用等,且疗效较差。因此,对病灶部位指甲局部治疗是较好的替代治疗方案。然而,这种治疗方案的主要限制因素是甲床对药物的通透性差,从而导致治疗效果有限、易重复感染。为了提高药物通过甲床效率,一些化学试剂如N-乙酰半胱氨酸、N-β-巯基乙醇可用于治疗,但是由于这些化学试剂气味难闻和治疗高浓度需求,使其应用受到限制。由于指甲的主要组成成分是硬质角蛋白,所以角蛋白酶可以有效的解决这个问题。角蛋白酶可以对指甲的α-角蛋白有效作用从而使甲床表面的角蛋白排列松散以达到提高药物通过指甲基质的效率。因此,开发高角蛋白活性且无胶原或低胶原的高选择性角蛋白酶,能够适度重整指甲角蛋白的排列以提高甲床角蛋白的药物通透性,最大程度保留皮肤组织胶原组分且能够促进目标药物渗透甲床角蛋白到达目标作用位点,从而提高药物的治疗效果,在制药行业具有较 好的应用前景。
本发明目的在于提供一种副短短芽孢杆菌角蛋白酶及其分离纯化方法,并初步考察分离纯化获得的角蛋白酶的酶学性质及其应用。
技术实现要素:
本发明的首要目的提供一种副短短芽孢杆菌Brevibacillus parabrevis CGMCC 10798来源的角蛋白酶。
为实现本发明的目的所采用的技术方案是:
一种副短短芽孢杆菌角蛋白酶的分离纯化方法,用于从副短短芽孢杆菌Brevibacillus parabrevis CGMCC 10798的发酵液中分离纯化角蛋白酶,该菌于2015年5月11号保藏在位于北京市朝阳区北辰西路1号院3号的中国科学院微生物研究所中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.10798,分类命名为副短短芽孢杆菌Brevibacillus parabrevis,其操作过程包括以下步骤:
粗酶液制备:(1)菌种活化:先将菌种在LB固体培养基上活化;(2)种子培养:然后挑取单菌落转入LB液体培养基中,37℃,震荡培养12h;(3)发酵培养:将种子液按照体积百分比为2%接种到发酵培养基中,于摇床培养37℃培养20h。作为优选,发酵培养基由以下组分构成:角蛋白10g/L,可溶性淀粉10g/L,玉米粉10g/L,NaCl 1.5g/L,NH4Cl 0.5g/L,K2HPO40.3g/L,KH2PO4 0.4g/L,MgCl2·6H2O 0.1g/L,初始pH值为8.0,装液量为30mL/250mL;(4)将副短短芽孢杆菌发酵液在4℃,8000rpm离心20min去除菌体,取上清。
角蛋白酶的分离纯化:向上清液中缓慢加硫酸铵粉末并搅拌至其硫酸铵浓度达到40%饱和度,于4℃静置过夜;4℃,10000rpm离心30min收集上清;向上清中加入硫酸铵粉末,至硫酸铵浓度达到70%,于4℃静置过夜;10000rpm离心30min收集沉淀,继而用Tris-HCl缓冲液(10mM,pH 8.5)将沉淀复溶;然后用相同缓冲液进行透析;期间更换缓冲液数次直至透析完全;透析结束后,离心去除不溶性杂蛋白,收集上清液待纯化。(2)将得到的上清液上到DEAE阴离子交换柱中,用Tris-HCl缓冲液(10mM,pH 8.5)平衡柱之后,用0.6M NaCl Tris-HCl缓冲液(10mM,pH 8.5)对柱子进行系统,并通过检测UV280nm收集第二个洗脱峰。(3)将第二个峰用Tris-HCl缓冲液(10mM,pH 8.5)透析后浓缩,得到角蛋白酶。
本发明提供一种副短短芽孢杆菌角蛋白酶,其反应特征及酶学性质为:SDS-PAGE分析测得该酶分子量是28kDa;该角蛋白酶的最适反应pH和温度分别为8.0和60℃;在pH 6.0-9.0条件下处理1h,残余酶活还有90%以上,20-40℃下,保留1h后,残余酶活还有80%以上; 金属离子Na+、K+、Ca2+对该角蛋白酶具有促进作用,而Zn2+和Fe3+对该酶有抑制作用;PMSF和EDTA完全抑制该角蛋白酶活性,表明该角蛋白酶为丝氨酸金属角蛋白酶;Tween 80和Triton X-100对该酶的活性有促进作用;以角蛋白为底物的酶反应动力学参数Km和Vmax分别是0.734mg/mL和882.36U/mg;对该酶底物谱的研究结表明:该角蛋白酶对不同的蛋白底物催化效率由高到低的顺序是偶氮酪蛋白、羽毛粉、角蛋白和羊毛粉有较高的酶活,而对I型胶原蛋白无活性。
本发明的另一目的在于提供一种副短短芽孢杆菌角蛋白酶的脱毛应用。取酶活为180U/mL的角蛋白酶发酵上清进行适当稀释,在37℃与羊皮孵育5-10h,可以独立脱除羊毛。
与现有技术相比,本发明具有以下有益效果:
1.本发明提供了一种从副短短芽孢杆菌发酵液中纯化角蛋白酶的方法。该方法步骤简洁,操作条件温和,特异性高,纯化效果好,回收效率高,成本低,易于扩大化,为大规模制备角蛋白酶奠定了重要基础。
2.采用本方法纯化得到的角蛋白酶,其比酶活为6605.48U/mg,对表面活性剂有较好的耐受性,且对胶原蛋白无活性。相比传统蛋白酶脱毛具有独到优势,不会导致皮革烂面、松面等问题。
3.本发明获得的副短短芽孢杆菌角蛋白酶脱毛效率高,可在5-10h内独立完成对羊皮的脱毛,在制革脱毛中具有良好的应用前景。
附图说明
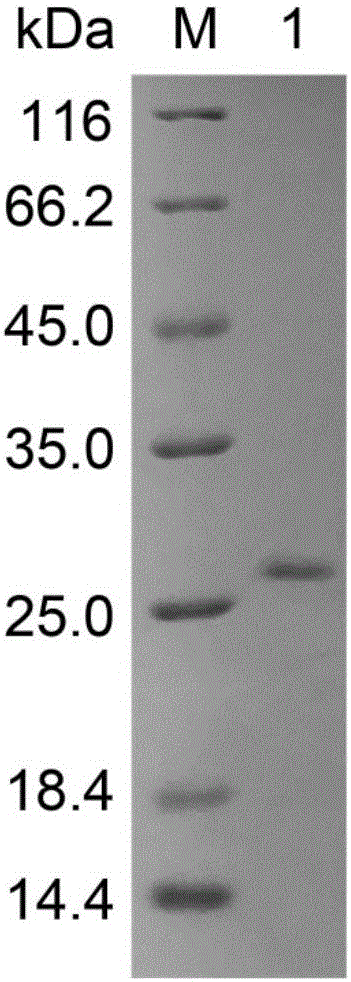
图1.副短短芽孢杆菌角蛋白酶的SDS-PAGE电泳分析图。M,蛋白marker;1,角蛋白酶纯酶。
图2.副短短芽孢杆菌角蛋白酶的最适pH。
图3.副短短芽孢杆菌角蛋白酶的最适温度。
图4.底物特异性。1,角蛋白;2,酪蛋白;3,明胶;4,BSA;5,Ⅰ型胶原蛋白;6,AAPF;7,偶氮酪蛋白;8,羽毛粉;9,羊毛粉;10,人发;11,天青角蛋白。
图5.脱毛效果评价。A,自来水处理7h;B,传统的化学脱毛法;C,副短短芽孢杆菌角蛋白酶的脱毛效果(7h)。
图6.体式显微镜(A、B)(×3)和电子显微镜SEM(C、D)(×80)观察副短短芽孢杆菌角蛋白酶的脱毛效果。A、C,化学法处理;B、D,酶法处理7h。
图7.天狼猩红染色观察脱毛的羊皮(A)化学法、(B)酶法(×40);Masson’s染色法观察脱 毛的羊皮(C)化学法、(D)酶法(×40)1,上皮;2,血管;3,腺体;4,毛囊;5,毛轴。
具体实施例
以下结合实施例对本发明做进一步详细说明,而不是对本发明的限制。
实施例1副短短芽孢杆菌角蛋白酶的纯化
一种副短短芽孢杆菌角蛋白酶的分离纯化方法,其特征在于包括如下步骤:
菌种活化:先将菌种在LB固体培养基上活化。种子培养:然后挑取单菌落转入LB液体培养基中,37℃,220rpm培养12h。发酵培养:将种子液按照体积百分比为2%接种到发酵培养基中,于摇床培养37℃培养20h。发酵培养基:角蛋白1%,可溶性淀粉1%,玉米粉1%,NaCl 0.15%,NH4Cl 0.05%,K2HPO4 0.03%,KH2PO4 0.04%,MgCl2·6H2O 0.01%,初始pH值为8.0,装液量为30mL/250mL。
角蛋白酶的分离纯化:(1)将副短短芽孢杆菌发酵液在4℃8000rpm离心20min去除菌体,取上清;(2)在上清中加入硫酸铵使其浓度达到90%的饱和度,于4℃静置过夜;4℃10000rpm离心30min收集沉淀,继而用Tris-HCl缓冲液(10mM,pH8.5)将沉淀复溶;然后用相同缓冲液进行透析;期间更换缓冲液数次直至透析完全;透析结束后,离心去除不溶性杂蛋白,收集上清液待纯化。(3)将得到的上清液上样到DEAE阴离子交换柱中,用Tris-HCl缓冲液(10mM,pH8.5)平衡柱之后,用0.6M NaCl Tris-HCl缓冲液(10mM,pH8.5)对柱子进行系统,收集第二个洗脱峰。(4)将第二个峰透析后浓缩,得到纯化的角蛋白酶。
角蛋白酶纯酶的SDS-PAGE分析显示为单带,表明纯化后的角蛋白酶为电泳纯的单一组分。如图1所示,纯酶和标准蛋白经SDS-PAGE测定,该酶的分子量约为28kDa。
实施例2副短短芽孢杆菌角蛋白酶的酶学性质研究
研究了所产角蛋白酶的酶学性质。分别研究了作用温度(30、40、50、60、70)和作用pH(6、7、8、9、10、11、12)对该酶活力的影响,发现该角蛋白酶的最适作用温度和pH分别是60℃和pH 9.0(图2和图3)。
抑制剂、表面活性剂和有机试剂对角蛋白酶活性的作用结果见表1。其中EDTA和PMSF对该酶的完全抑制,显示该酶属于丝氨酸金属蛋白酶类。还原剂β-ME和表面活性剂Tween 80、Triton X-100对该酶的活性都有促进作用。
副短短芽孢杆菌角蛋白酶的底物特异性从高至低依次是偶氮酪蛋白>羽毛粉>角蛋白>羊毛粉,以酪蛋白、明胶和BSA为底物显示为低活性;此外对I型胶原蛋白没有活性(图4)。 其高角蛋白酶活性和无胶原蛋白酶活性使B.parabrevis角蛋白酶在制革业脱毛应用方面和药物运输方面具有较高潜力。
表1.多种抑制剂、表面活性剂和有机溶剂对角蛋白酶活性的影响
ND代表未检测到酶活。
实施例3副短短芽孢杆菌角蛋白酶的脱毛能力
将副短短芽孢杆菌角蛋白酶稀释液与羊皮混合,在30℃条件下振荡反应7h,可完成彻底脱毛。采用感官评价、体式显微镜、电子显微镜相结合的观察分析手段,与传统的化学脱毛法相比较,研究该菌角蛋白酶的脱毛功能。天狼猩红染色和Masson染色结果显示B.parabrevis角蛋白酶脱毛对羊皮没有造成胶原损伤;且与化学脱毛法相比,触感检测显示酶法脱毛后的羊皮颜色较亮、质地软而光滑,且粒面清晰(图5、图6和图7)。
- 还没有人留言评论。精彩留言会获得点赞!