H3亚型流感病毒血凝素特异性保守表位、其抗体及其应用的制作方法
本发明涉及h3亚型流感病毒血凝素特异性保守表位,与所述表位特异性结合的抗体,以及所述表位用于诊断h3n2病毒感染的用途。
背景技术:
流感病毒是导致急性上呼吸道感染的主要病原,感染者具有较高的发病率和死亡率。据who统计,每年的流感疫情导致大约300-500万人致严重疾病,其中大约25-50万人死亡(参见:who.factsheetnumber211.influenza(seasonal).http://www.who.int/mediacentre/factsheets/fs211/en/,2014)。每年的流感疾病负担相当一部分是由两种共同流行的a型流感病毒-h1n1和h3n2-所致。据美国1979-2001的一项调查显示,h3n2是导致流感病毒发病和死亡的最主要流感病毒亚型,其次是h1n1和b型流感病毒(参见thompsonww,etal.influenza-associatedhospitalizationsintheunitedstates.jama,2004,292:1333-40)。
流感病毒快速进化、适应新的宿主和逃避宿主免疫的能力,使得其可以在人间持续流行(taubenbergerjk,etal.influenzavirusevolution,hostadaptation,andpandemicformation.cellhostmicrobe,2010,7:440-51)。流感病毒表面有两种糖蛋白,血凝素(ha)和神经氨酸酶(na),它们是宿主针对流感病毒免疫反应的主要靶标。宿主蛋白酶将ha切割成ha1和ha2两个亚单位,ha1与宿主受体结合,ha2负责病毒包膜与宿主内吞体膜的结合(krystalm,etal.evolutionofinfluenzaaandbviruses:conservationofstructuralfeaturesinthehemagglutiningenes.procnatlacadsciusa,1982,79:4800-4)。ha1亚单位氨基酸的改变将会干扰宿主抗体对病毒的识别,而ha2亚单位在ha亚组中则是相对保守的。
h3n2流感病毒是导致季节性流感的病毒之一,在高危人群中导致严重疾病和死亡。研究表明,机体感染流感病毒后会产生针对不同株和亚型流感病毒的交叉反应性抗体(noisumdaengp,etal.homosubtypicandheterosubtypicantibodiesagainsthighlypathogenicavianinfluenzah5n1recombinantproteinsinh5n1survivorsandnon-h5n1subjects.virology,2014,454-455254-62)。而且,h3n2和h7n9病毒之间也存在双向交叉反应(guol,etal.cross-reactivitybetweenavianinfluenzaa(h7n9)virusanddivergenth7subtypic-andheterosubtypicinfluenzaaviruses.scirep,2016,622045)。不同亚型的流感病毒,例如季节性流感和禽流感,可以导致患者产生不同临床后果。因此,对h3n2流感病毒感染的诊断应该考虑到不同亚型流感病毒之间的交叉反应,所以应发展h3n2流感病毒感染的特异性诊断方法。然而,h3n2流感病毒持续进化,这使得鉴定h3亚型特异性保守型表位以用于h3n2流感病毒的特异性诊断尤为重要。
在本研究中,我们成功鉴定了两个在h3n2中高度保守的特异性表位。在此基础上,我们建立了基于特异性表位的h3n2病毒免疫荧光检测方法和iggelisa检测方法,iggelisa检测方法与血凝抑制检测方法具有良好的相符性。
技术实现要素:
在本研究中,我们利用合成的肽库对h3ha蛋白的抗体进行筛选,获得两个反应性较强的抗原表位。抗原表位多肽与klh偶联后免疫小鼠,获得抗血清。通过酶联免疫吸附法和免疫印迹鉴定、序列比对等方法,确定这两个表位是在不同年份的h3亚型流感病毒株中高度保守的特异性表位。基于此表位,我们建立了基于所述特异性表位的h3n2病毒免疫荧光检测方法和iggelisa检测方法。
在第一方面中,本发明提供了一种h3亚型流感病毒血凝素的特异性抗原表位,其氨基酸序列为icdsphqildgknct。
在第二方面中,本发明提供了一种分离的抗体或抗原结合片段,其特异性结合第一方面所述的抗原表位,其中所述抗体优选为igg抗体。
在第三方面中,本发明提供了第二方面的抗体或抗原结合片段,其为单克隆抗体或其抗原结合片段。
在第四方面中,本发明提供了一种制备包含第二方面所述的抗体或抗原结合片段的免疫血清的方法,所述方法包括用合成的第一方面所述的抗原表位与载体(优选klh)的偶联物对动物进行免疫,以及免疫后采血和分离血清。
在第五方面中,本发明提供了第二或第三方面的抗体或抗原结合片段用于制备检测h3n2流感病毒抗原的试剂的用途。
在第六方面中,本发明提供了第二或第三方面的抗体或抗原结合片段用于制备预防或治疗h3n2流感病毒感染的药物的用途。
在第七方面中,本发明提供了一种h3亚型流感病毒血凝素的特异性抗原表位,其氨基酸序列为gknctlidallgdpq。
在第八方面中,本发明提供了一种分离的抗体或抗原结合片段,其特异性结合第七方面所述的抗原表位,其中所述抗体优选为igg抗体。
在第九方面中,本发明提供了第八方面的抗体或抗原结合片段,其为单克隆抗体或其抗原结合片段。
在第十方面中,本发明提供了一种制备包含第八方面所述的抗体或抗原结合片段的免疫血清的方法,所述方法包括用合成的第七方面所述的抗原表位与载体(优选klh)的偶联物对动物进行免疫,以及免疫后采血和分离血清。
在第十一方面中,本发明提供了第八或第九方面的抗体或抗原结合片段用于制备检测h3n2流感病毒抗原的试剂的用途。
在第十二方面中,本发明提供了第八或第九方面的抗体或抗原结合片段用于制备预防或治疗h3n2流感病毒感染的药物的用途。
在第十三方面中,本发明提供了一种多肽,其序列为icdsphqildgknctlidallgdpq。
在第十四方面中,本发明提供了第十三方面的多肽用于制备检测h3n2流感病毒血凝抑制抗体的试剂的用途。
在第十五方面中,本发明提供了第一或第七方面的抗原表位用于制备检测h3n2流感病毒血凝抑制抗体的试剂的用途。
附图说明
图1为流感毒株victoria/210/2009xpuertorico/8/1934(ncbi登录号cy121727)免疫优势表位的合成肽筛选图。
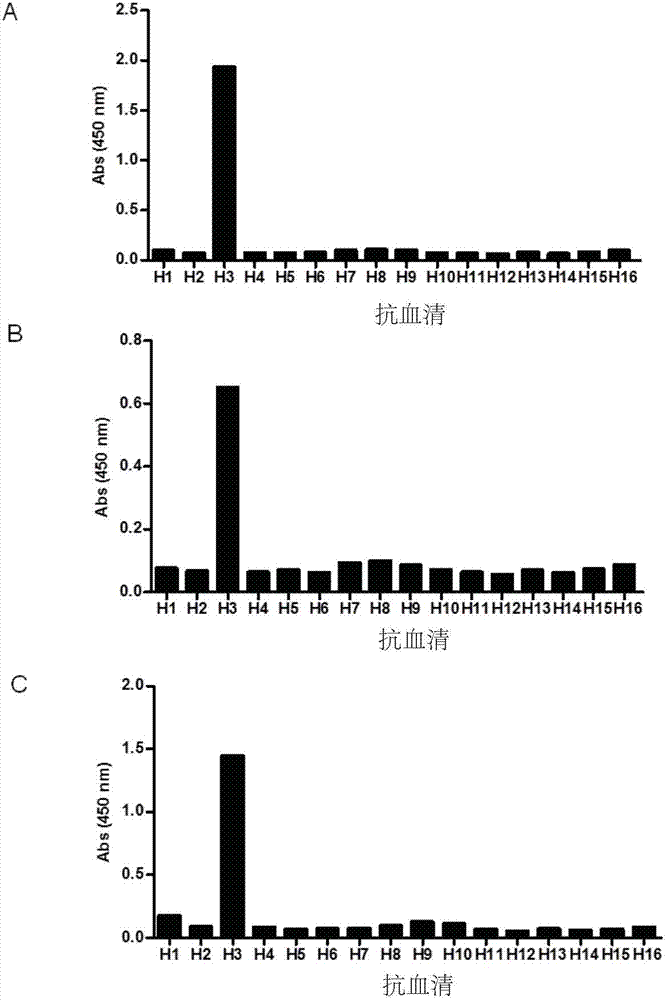
图2a-2c依次示出了合成肽p6,p7,p21与h1-h16亚型流感病毒ha抗血清的反应性。
图3中,a示出了合成肽抗血清的滴度;b示出了westernblot方法测定合成肽抗血清与纯化的h1-h16ha1蛋白的反应;c示出了westernblot方法测定合成肽抗血清与不同年份h3-ha(68ha、77ha、89ha、99ha和07ha)蛋白以及乙型流感病毒(ifvb)ha蛋白的反应;d示出了elisa方法测定合成肽抗血清与纯化的h1-h16ha1蛋白的反应。
图4示出了合成肽p6和p7的三维结构位置及保守性分析。
图5示出了利用p6和p7抗血清检测h3亚型流感病毒的免疫荧光分析。其中a示出了p6抗血清与h3n2感染的mdck细胞的反应性;b示出了p7抗血清与h3n2感染的mdck细胞的反应性;c示出了阴性小鼠血清与h3n2感染的mdck细胞的反应性(阴性对照);d示出了np抗血清与h3n2感染的mdck细胞的反应性(阳性对照)。
具体实施方式
下面结合优选实施例进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体的实验方法,通常按照常规条件和方法,如分子克隆实验室手册(sambrook,etal.newyork:coldspringharborlaboratorypress,1989)中所述方法或试剂制造商提供的方法。
实施例1.h3n2血凝素蛋白免疫优势表位的鉴定
1.1a/h3n2流感血凝素蛋白膜外区肽库的合成
委托上海生物工程技术有限公司合成51条重组h3n2流感病毒a/reassortant/nymcx-187(victoria/210/2009xpuertorico/8/1934,ncbi登录号cy121727)株血凝素蛋白膜外区肽库。每条肽的长度为15个氨基酸,每相邻的两条肽重叠5个氨基酸。所有合成肽通过高效液相色谱纯化,纯度>95%,并通过质谱鉴定。
所有合成肽的氨基酸位置及序列示于表1,因为h3n2ha蛋白1-16位氨基酸为信号肽,按照文献中h3n2氨基酸位置标记方法,表一中肽的氨基酸位置从第17位开始计算,并记为第1位氨基酸。
表1a/h3n2流感病毒血凝素蛋白膜外区肽库
1.2间接elisa筛选免疫优势表位
用包被液(ph9.6的碳酸盐缓冲液)对合成的51条多肽进行稀释,以1μg/孔包被于96孔酶标板(costar公司产品,货号:9018),置4℃过夜。次日加入封闭液(1%bsa/pbs)置37℃封闭2小时后,用pbst(含0.1%tween20的pbs)缓冲液洗涤1次,甩干洗涤液。每孔加入100μl1:1000稀释的抗h3ha小鼠免疫血清,置37℃孵育1小时,甩掉液体,用pbst缓冲液洗涤5次。然后每孔加入100μl1:40000稀释的辣根过氧化物酶山羊抗小鼠igg(sigma公司产品,货号:a0168),置37℃孵育1小时,甩掉液体,用pbst缓冲液洗涤5次。每孔加入100μl3,3’,5,5’-四甲基联苯胺(tmb)底物避光显色15分钟后,加入50μl2mh2so4终止反应,测定450nm处的吸光值。结果显示p6、p7、p21三条肽可以与抗h3ha小鼠免疫血清发生特异性结合(图1)。
1.3优势表位肽与不同亚型ha抗血清的反应性
用包被液对p6、p7、p21三条多肽分别进行稀释,以1μg/孔包被于96孔酶标板(costar公司产品,货号:9018),置4℃过夜。次日加入封闭液置37℃孵育2小时,用pbst缓冲液洗涤1次,甩干洗涤液。每孔加入100μl1:1000稀释的抗h1-h16ha小鼠免疫血清,置37℃孵育1小时,甩掉液体,用0.1%pbst缓冲液洗涤5次。然后每孔加入100μl1:40,000稀释的辣根过氧化物酶山羊抗小鼠igg(sigma公司产品,货号:a0168),置37℃孵育1小时后甩掉液体,用pbst缓冲液洗涤5次。每孔加入100μltmb底物避光显色15分钟,加入50μl2mh2so4终止反应,测定450nm处的吸光值。结果显示,p6、p7、p21三条肽只能被h3ha小鼠免疫血清特异性识别(图2),而与其它亚型ha抗血清无反应,提示这三条抗原表位为h3亚型特异性抗原表位。
实施例2.免疫优势肽的抗原性
2.1肽与klh的偶联
根据抗原表位筛选结果,合成多肽p6、p7、p21和p16(p16为阴性反应对照),在c端加一个半胱氨酸后分别与klh进行偶联,用于免疫小鼠。肽的合成及与klh的偶联委托上海生物工程技术有限公司完成。
表2用于免疫的肽-klh偶联物的氨基酸序列
2.2免疫方案
用上述klh偶联多肽对6-8周龄的雌性balb/c小鼠进行免疫。免疫方案如下:共进行3次免疫,每次间隔14天。首次免疫时,将等体积肽-klh偶联物与弗氏完全佐剂混合,每只小鼠皮下注射100μg肽-klh偶联物。加强免疫时,将等体积肽-klh偶联物与弗氏不完全佐剂混合,每只小鼠皮下注射50μg肽-klh偶联物。在最后一次免疫14天后眼球采血,分离血清置于-20℃保存备用。
2.3免疫血清滴度测定
分别将多肽p6、p7、p21和p16用包被液进行稀释(终浓度1μg/孔)后包被酶标板(costar公司产品,货号:9018),置4℃过夜,加入封闭液置37℃孵育2小时,用pbst缓冲液洗涤1次,甩干洗涤液。每孔加入100μl系列稀释(从1:5,000开始进行倍比稀释至1:320,000)的相应小鼠免疫血清,同时设立未免疫小鼠血清作为对照,置37℃孵育1小时,甩掉液体,用pbst缓冲液洗涤5次。然后每孔加入100μl1:40000稀释的辣根过氧化物酶山羊抗小鼠igg(sigma公司产品,货号:a0168),置37℃孵育1小时,甩掉液体,用pbst缓冲液洗涤5次。每孔加入100μltmb底物避光显色15分钟,加入50μl2mh2so4终止反应,测定450nm处的吸光值。结果见图3a,显示p6、p7和p16均诱导出较强的抗体,以免疫前小鼠血清od450nm的2.1倍作为cut-off值,抗体滴度分别为1:80,000,1:40,000和1:40,000,提示p6和p7具有较强的免疫原性。但是p21多肽没有诱导出明显的抗体滴度。
实施例3.抗原表位的特异性
3.1h1-h16亚型ha1蛋白和不同年份h3ha蛋白的表达
因为抗原表位p6和p7位于血凝素ha1亚单位,我们按照文献报道的方法(参见cuis,etal.secretoryexpressionofall16subtypesofthehemagglutinin1proteinofinfluenzaavirusininsectcells.jvirolmethods.2011,177:160-7)利用重组杆状病毒表达系统分别表达和纯化h1-h16亚型ha1蛋白。同时,对不同年份(1968、1977、1989、1999和2007)h3n2亚型流感病毒ha膜外区(分别简称为68ha、77ha、89ha、99ha和07ha)以及乙型流感病毒(ifvb)ha膜外区利用重组杆状病毒表达系统分别表达和纯化。
表3不同年份的h3亚型流感病毒、乙型流感病毒和不同亚型流感病毒血凝素基因信息
3.2表位免疫血清与h3ha蛋白反应的特异性
3.2.1免疫印迹检测表位的特异性
将100ng纯化的h1–h16ha1蛋白、不同年份的h3ha蛋白(68ha、77ha、89ha、99ha和07ha)以及ifvbha蛋白分别进行12%sds-page电泳,然后转至硝酸纤维素膜(nc膜,pall公司产品,货号:s80209)。nc膜用5%脱脂奶室温封闭2小时后,与1:500稀释的p6、p7和p16免疫小鼠血清孵育2h。nc膜经pbst洗涤5次,加入1:10,000稀释的
3.2.2elisa方法检测表位的特异性
分别将h1-h16ha1用包被液进行稀释(终浓度50ng/孔)后包被酶标板(costar公司产品,货号:9018),置4℃过夜,加入封闭液置37℃孵育2小时,用pbst缓冲液洗涤1次,甩干洗涤液。每孔加入100μl系列1:500稀释的p6、p7和p16小鼠免疫血清,置37℃孵育1小时,甩掉液体,用pbst缓冲液洗涤5次。然后每孔加入100μl1:40,000稀释的辣根过氧化物酶山羊抗小鼠igg(sigma公司产品,货号:a0168),置37℃孵育1小时,甩掉液体,用pbst缓冲液洗涤5次。每孔加入100μltmb底物避光显色15分钟,加入50μl2mh2so4终止反应,测定450nm处的吸光值。结果显示,p6和p7抗血清仅与h3ha1蛋白进行特异性反应,而与其它亚型流感病毒ha1蛋白没有反应(图3d)。
以上结果说明p6是跨越30年的h3亚型流感病毒共有的、特异性的抗原表位,而p7是跨越40年的h3亚型流感病毒共有的、特异性的抗原表位。
实施例4.同源建模分析和序列比对
将h3n2流感毒株a/reassortant/nymcx-187(victoria/210/2009xpuertorico/8/1934)株的ha氨基酸序列递交到swiss-model数据库中,寻找已知空间构象的同源蛋白。通过swiss-model自动同源建模程序,模拟出h3n2ha的三维结构。用rasmol软件标记出反应性强的合成肽对应的三维结构位置,确定p6和p7表位位于头部区域。结构见图4a。
根据h3亚型不同年份毒株和h1、h2、h4-h16亚型流感病毒血凝素基因信息,找出p6和p7肽所对应的氨基酸序列,用dnastar软件的megalign程序对p6和p7氨基酸序列进行比对。结果发现p6和p7肽在不同年份h3亚型ha序列中保守,而其氨基酸序列与其他亚型流感病毒ha相应序列同源性较低(图4b)。值得注意的是,与77ha、89ha、99ha、07ha相比,p6肽在68ha上表现出53、54、62和63位氨基酸的突变,而p7肽在不同年份的h3ha中则表现出更好的保守性。
实施例5.h3亚型流感病毒抗原及抗体诊断方法的构建
免疫荧光法检测病毒抗原
mdck细胞传于96孔培养板(costar公司产品,货号:3599),于37℃,5%co2培养箱进行培养。第二天将h3n2病毒株以moi=0.1感染mdck细胞,于33℃,5%co2培养箱进行培养48h后,h3n2感染的mdck细胞用4%多聚甲醛室温固定30min,加入鼠抗p6和鼠抗p7肽抗体,于37℃孵育1h,用pbst洗涤后,加入相应的荧光二抗,于37℃孵育1h,用pbst洗涤后,利用operetta高内涵筛选系统进行扫描分析。结果显示,鼠抗p6肽、鼠抗p7肽抗体及流感病毒np抗体(作为阳性对照)均可以特异性识别h3n2感染的mdck细胞,而阴性小鼠对照血清无法识别h3n2感染的mdck细胞(图5)。
因为p6和p7肽有5个氨基酸的重叠,我们合成了一条51-75位氨基酸序列的多肽(命名为p6p7),将肽p6、p7及p6p7分别包被酶标板,置4℃过夜,加入封闭液置37℃孵育2小时,用pbst缓冲液洗涤1次,甩干洗涤液。每孔分别加入100μl系列1:400稀释的h3n2血凝抑制(hi)抗体阳性的健康人血清,置37℃孵育1小时,甩掉液体,用pbst缓冲液洗涤5次。然后每孔加入100μl1:40,000稀释的辣根过氧化物酶山羊抗人igg(sigma公司产品,货号a8792),置37℃孵育1小时,甩掉液体,用pbst缓冲液洗涤5次。每孔加入100μltmb底物避光显色15分钟,加入50μl2mh2so4终止反应,测定450nm处的吸光值。结果显示,在92份h3n2hi抗体阳性的健康人血清中,79份为p6肽igg抗体阳性,80份为p7肽igg抗体阳性,82份为p6p7肽igg抗体阳性,符合率分别85.9%、87%和89.1%(表4)。
表4肽-elisa检测方法与血凝抑制试验方法的比较比较
a代表阳性数,b代表阳性。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种抗流感病毒广谱中和性的中和分子1f2的制作方法
- 特异于流感病毒h5亚型或者n1亚型的血凝素和神经氨酸酶的单克隆抗体及其应用的制作方法
- H5亚型水禽流感病毒血凝素抗体间接elisa检测试剂盒的制作方法
- H7亚型水禽流感病毒血凝素抗体间接elisa检测试剂盒的制作方法
- 用病毒抗原表达特异性免疫原的制作方法
- 抗h9亚型流感病毒血凝素蛋白的单克隆抗体及其应用的制作方法
- 抗h3n2猪流感病毒血凝素蛋白单克隆抗体,杂交瘤细胞株及抗原捕获elisa试剂盒的制作方法
- 一种基于重组表达流感病毒血凝素的真核细胞凝集反应的流感病毒抗体的检测方法
- 基于重组表达流感病毒血凝素和神经氨酸酶的真核细胞凝集反应的流感病毒抗体检测方法
- 一种检测流感病毒抗体的荧光微量细胞凝集方法