一种匙吻鲟心脏细胞系的构建方法与流程
本发明属于细胞培养技术领域,涉及一种匙吻鲟心脏组织细胞系的构建方法。
背景技术:
匙吻鲟(Polyodon spathula,Paddlefish)亦称鸭嘴鲟,隶属鲟形目、匙吻鲟科,是北美洲的一种名贵大型淡水经济鱼类。主要分布在美国密西西比河和密苏里河及其主要支流流域。匙吻鲟是匙吻鲟科仅存的两属两种之一,被世界自然保护联盟红色名录列为易危(VU)级物种,另一种为生活在中国长江的白鲟,后者几近灭绝。
匙吻鲟食性较广,主要摄食浮游动物,具有适应性强、生长迅速、经济价值高等优点。随着匙吻鲟养殖规模的不断扩大,集约化程度的不断提高,养殖过程中病害问题也日趋严重,给鲟鱼养殖业造成巨大的经济损失。细胞系的建立是研究鲟鱼病毒性疾病病原分离与鉴定、致病机制、疫苗制备和免疫预防技术的重要基础。但有关匙吻鲟心脏组织细胞培养研究尚属空白,而本发明首次在国内建立可连续传代的匙吻鲟心脏细胞系,不仅丰富了匙吻鲟的细胞资源,而且为今后开展匙吻鲟病毒性疾病的基础理论鱼防治技术研究提供了重要的实验材料,此法也可为中华鲟、白鲟等珍稀濒危鱼类细胞培养提供参照。
技术实现要素:
本发明的目的是利用匙吻鲟心脏组织,提供一种匙吻鲟心脏细胞系的构建方法,以满足对匙吻鲟及其它濒危鱼类物种保护研究的需要。
本发明技术方案:
一种匙吻鲟心脏组织细胞系的构建方法,所述方法具体步骤为:
1)选取健康的匙吻鲟,先用自来水冲去鱼的体表粘液及污物,后经 20ppm 高锰酸钾溶液药浴 10~20 分钟,再以75% 乙醇消毒体表,无菌条件下解剖取心脏组织,用预冷的杜氏磷酸盐缓冲液连续漂洗若干次;
2)将漂洗过的心脏组织,除去心耳,剪成 1mm3 的小块,用杜氏磷酸盐缓冲液清洗数次,消化,然后加入过量的完全培养液终止消化,过滤,将滤液离心,弃上清液,用完全培养液悬浮沉淀细胞,调整细胞浓度至 5×105 个/ml,接种细胞到培养瓶中,每瓶加入的完全培养液,25℃条件下,二氧化碳培养箱中静置培养,每隔 2~3 天换完全培养液1次,继续培养 3~5 天后,细胞可形成单层或细胞簇,按 1:2 的方式进行传代培养;
3)将长满致密单层的匙吻鲟心脏细胞培养瓶弃去培养基,用pH7.4无菌杜氏磷酸缓冲液洗涤数次,再加入0.25% 胰酶溶液,25℃培箱中消化18-25分钟,待细胞单层解离成单个细胞后,加入完全培养液以中和过量的胰酶溶液,1000~1600 r/min 离心3-6 分钟,收集细胞并用完全培养液重悬细胞沉淀,将重悬后得到的细胞悬液分别等量接种于两个培养瓶中,25℃培养箱中进行传代培养,每隔3-4d待细胞再次长满单层后,重复传代培养的步骤,得到传代培养的细胞;
4)在DMEM基础培养液中加入二甲基亚砜,胎牛血清,青霉素、链霉素、两性霉素B,配制成细胞冷冻保存液,置冰上预冷,取传代培养的细胞,用胰酶将单层细胞消化后,离心弃除培养基,将细胞沉淀用预冷的冷冻保存液重悬,转入冻存管中,将冻存管放入冻存盒中进行连续降温后,置入液氮中保存;复苏时,从液氮里取出冻存细胞,迅速投入37℃水浴解冻,离心重悬细胞沉淀,用移液枪将该细胞移入培养瓶,加入完全培养液,25℃恒温培养12-24h 后更换新鲜匙吻鲟心脏细胞完全培养液,得到贴壁生长的匙吻鲟心脏组织细胞,即完成匙吻鲟心脏组织细胞系的构建。
优选地,所述完全培养液制备步骤为:选取健康的匙吻鲟,尾静脉取血,分离得到血清,过滤除菌后,将血清添加到Dulbecco's Modified Eagle Medium即DMEM的基础培养液中,继续向培养液中加入胎牛血清、青霉素、链霉素、两性霉素B、人表皮生长因子、Ⅰ型人胰岛素样生长因子和人碱性成纤维样细胞生长因子,制备成匙吻鲟心脏细胞完全培养液,置于4℃保存备用。
优选地,所述完全培养液中匙吻鲟鱼血清的体积浓度为0.5%,胎牛血清的体积浓度为30%、青霉素的浓度为200IU/ml、链霉素的浓度为200 IU/ml、两性霉素B 浓度为0.5μg/ml、人表皮生长因子浓度为20ng/ml、Ⅰ型人胰岛素样生长因子20ng/ml、人碱性成纤维样细胞生长因子浓度为20ng/ml。
进一步优选地,所述完全培养液中按体积分数计体积浓度为0.5% 的匙吻鲟鱼血清200-300μl、体积浓度为30% 的胎牛血清10~18ml、10000 IU/ml 的青霉素0.6~1.4ml、10000 IU/ml 的链霉素0.6-1.4ml、25 μg/ml 的两性霉素B 0.6~1.4ml、10μg/ml 的人表皮生长因子80~120μl、10μg/ml 的Ⅰ型人胰岛素样生长因子80~120μl、10μg/ml 人碱性成纤维样细胞生长因子80-120μl、DMEM基础培养液30-33ml。
更进一步优选地,所述完全培养液中按体积分数计体积浓度为0.5% 的匙吻鲟鱼血清250μl、体积浓度为30% 的胎牛血清15ml、10000 IU/ml 的青霉素1ml、10000 IU/ml 的链霉素1ml、25μg/ml 的两性霉素B 1ml、10μg/ml 的人表皮生长因子100μl、10μg/ml 的Ⅰ型人胰岛素样生长因子100μl 、10μg/ml人碱性成纤维样细胞生长因子100μl、DMEM基础培养液31.45ml。
优选地,所述杜氏磷酸盐缓冲液含有青霉素和链霉素的浓度均为500IU/ml,两性霉素B 的浓度为1.25μg/ml。
优选地,步骤2)中消化方法具体为将组织块放入 0.1% 胶原酶溶液中,25℃ 水浴条件消化 2~4 小时,至组织呈松散状态为止,再加入 0.25% 胰蛋白酶溶液,25℃ 水浴搅拌消化 30~50 min,吸管吹打组织块,以分离细胞,完成消化;
所述滤液离心条件为800~1000r/min,3~5 分钟。
优选地,所述步骤3)传代培养中持续传5-8代时,可将含30%胎牛血清的DMEM培养液换成含20%胎牛血清的DMEM培养液。
优选地,所述步骤4)细胞冷冻保存液的二甲基亚砜的体积浓度为10%,胎牛血清的体积浓度为30%,青霉素的浓度为200 IU/ml,链霉素的浓度为200 IU/ml,两性霉素B 的浓度为0.5μg/ml,胰酶的质量浓度为0.25%。
进一步优选地,细胞冷冻保存液中按体积比计,体积浓度为10%的二甲基亚砜80-120μl、10000 IU/ml的青霉素15-25μl、10000 IU/ml的链霉素15-25μl、12.5μg/ml 的两性霉素B 15-25μl、质量浓度为0.25% 胰酶1.8-2.5ml。
更进一步优选地,按体积比计,体积浓度为10% 的二甲基亚砜100μl、10000 IU/ml 的青霉素20μl、10000 IU/ml 的链霉素20μl、25μg/ml 的两性霉素B 20μl、质量浓度为0.25% 胰酶2ml。
优选地,所述步骤4)中,所述的连续降温步骤为将含有细胞的冷冻保存管放入细胞冻存盒,先置于4℃冰箱中平衡10 分钟,然后在-80℃超低温冰箱中冷冻4 小时以上,再将冻存管取出放入液氮面平衡5 分钟,再转入液氮中长期保存。
技术原理:该培养方法是指从匙吻鲟体内组织取出细胞,模拟体内出现的环境,在无菌,适当温度及酸碱度和一定营养条件下,使其生长繁殖,并维持其结构和功能的一种培养技术。不同物种,即便同一种物种不同组织的细胞及原代细胞和传代细胞之间在培养基及培养的环境条件都有所差异。
本发明与已有技术对比,其优点在于:
(1)目前除本发明外,国内外尚无匙吻鲟心脏细胞培养的报道,本发明建立的匙吻鲟心脏细胞培养方法也适用于中华鲟、白鲟等其它鲟鱼。
(2)本发明方法,其所述的完全培养液中特别添加了促进心脏细胞分裂和迅速增殖的20ng/mlⅠ型人胰岛素样生长因子和按体积分数计体积浓度为0.5% 的匙吻鲟鱼血清,有利于匙吻鲟心脏组织细胞的培养与生长。
(3)本发明构建的方法为酶消化分离法,其中所用的消化酶是:质量浓度为0.25%的胰蛋白酶与质量浓度为0.1%的胶原酶。胰蛋白酶和胶原酶的消化的方式为25℃水浴搅拌消化。该法相对于组织块法,能进一步使细胞间的桥连结构松动,使团块膨松,使细胞团块得以较充分的分散,制成少量细胞群团和大量单个细胞的细胞悬液,接种培养后,细胞容易贴壁生长,也会在短时间内成长成片。
(4)本发明构建的匙吻鲟心脏细胞系增殖速度快,可以连续传代,并可超低温冻存和复苏,既可为鲟鱼类种质资源保存的相关研究奠定技术基础,又可作为鲟鱼病毒病体外研究的理想材料。
附图说明
下面结合附图和实施例对本发明作进一步说明:
图1 为实施例1 匙吻鲟心脏组织细胞,其中,图1-A 为原代培养的心脏细胞形态,图1-B 为第1 次传代后的心脏细胞形态。
图2 为实施例1 匙吻鲟心脏组织细胞密度。
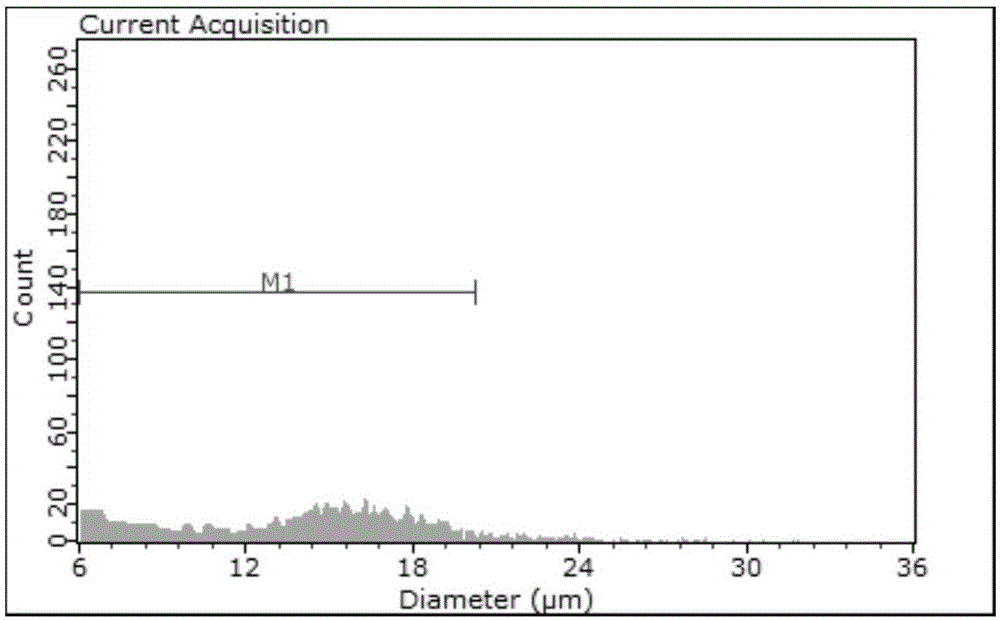
图3 为实施例1 匙吻鲟心脏组织细胞直径。
具体实施方式
下面结合实施例来进一步说明本发明,但本发明要求保护的范围并不局限于实施例表述的范围。
对于像匙吻鲟这种濒危物种通常是很难获得成对的成熟野生亲本,甚至很难得到存活的个体。为了尽力挽救这些濒危物种资源,该专利通过构建匙吻鲟心脏细胞系,在细胞水平上更加完整的保持生物体的遗传信息,为未来濒危物种的复活提供了可能,为更好的保护匙吻鲟种质资源提供技术支撑。从长远来讲,这对匙吻鲟资源的恢复和保护具有十分重要的意义。
实施例1
1)选取健康匙吻鲟,先用自来水冲去鱼的体表粘液及污物,75% 乙醇消毒尾部,抽取尾静脉血液,用0.22μm 的微孔滤膜过滤除菌后,取250μl 鲟鱼血清,加入15ml 胎牛血清,加入3ml 抗生素混合溶液 (青霉素质量浓度为200IU/ml 、链霉素质量浓度为200IU/ml、两性霉素B 质量浓度为0.5μg/ml),添加 DMEM的基础培养液至50ml,即制备成匙吻鲟心脏细胞完全培养液。为促进心脏细胞分裂和迅速增殖,在上述培养液中还特别添加了浓度为10μg/mlⅠ型人胰岛素样生长因子100μl、人表皮生长因子100μl、人碱性成纤维样细胞生长因子100μl。
2)将上述处理过的匙吻鲟,经20ppm 高锰酸钾溶液药浴20 分钟,再以75% 乙醇消毒体表2 分钟,无菌条件下解剖取心脏组织,用预冷的含高浓度抗生素的杜氏磷酸盐缓冲液(D-PBS)连续漂洗若干次。
3)将漂洗过的心脏组织,除去心耳,剪成 1mm3 的小块,用D-PBS清洗数次,将组织块放入 0.1% 胶原酶溶液中,25℃ 水浴条件消化 2 小时,至组织呈松散状态为止,再加入 0.25% 胰蛋白酶溶液,25℃ 水浴搅拌消化 50 min,吸管吹打组织块,以分离细胞。然后加入过量的完全培养液终止消化,用200目不锈钢筛网过滤,将滤液离心(800r/min,3 分钟)。弃上清液,用完全培养液悬浮沉淀细胞,调整细胞浓度至 5×105 个/ml,接种细胞到培养瓶中,每瓶加入上述配制的 5 ml 的完全培养液,25℃条件下,二氧化碳培养箱中静置培养,根据细胞生长情况,每隔 2 天换液 1 次。
继续培养3 天后,可见大量的心脏组织细胞贴壁生长,呈成纤维样(图1-A),可形成单层或细胞簇;
4)再将长满单层的匙吻鲟心脏细胞培养瓶弃去培养基,用3 ml 无菌磷酸缓冲液洗涤两次,再加入0.25% 胰酶溶液2ml,25℃培箱中消化18 分钟,轻拍培养瓶,待细胞单层解离成单个细胞后,迅速加入完全培养液3ml 以中和过量的胰酶溶液,1000r/min 离心5 分钟,收集细胞并用完全培养液重悬细胞沉淀,将重悬后得到的细胞悬液分别等量接种于两个培养瓶中,25℃培养箱中进行传代培养(图1-B)。之后,每隔4d 待细胞再次长满单层后,按以上步骤重复传代培养的步骤,得到传代培养的细胞,Scepter计数器测定细胞的的密度和直径(图2、图3)。持续传至第6 代时,将含30%胎牛血清的DMEM培养液换成含20%胎牛血清的DMEM培养液。
5)在DMEM基础培养液中加入二甲基亚砜,胎牛血清,青霉素、链霉素、两性霉素B,配制成细胞冷冻保存液,置冰上预冷,取传代培养的细胞,用胰酶将单层细胞消化后,离心弃除培养基,将细胞沉淀用预冷的冷冻保存液重悬,转入冻存管中,将冻存管放入冻存盒中进行连续降温后,置入液氮中保存;复苏时,从液氮里取出冻存细胞,迅速投入37℃水浴解冻,离心重悬细胞沉淀,用移液枪将该细胞移入培养瓶,加入完全培养液,25℃恒温培养24h 后更换新鲜匙吻鲟心脏细胞完全培养液,得到贴壁生长的匙吻鲟心脏组织细胞,即完成匙吻鲟心脏组织细胞系的构建。
所述杜氏磷酸盐缓冲液含有青霉素和链霉素的浓度均为500IU/ml,两性霉素B 的浓度为1.25μg/ml。
所述步骤4)中,所述的二甲基亚砜的体积浓度为10%,胎牛血清的体积浓度为30%,青霉素的浓度为200 IU/ml,链霉素的浓度为200 IU/ml,两性霉素B 的浓度为0.5μg/ml,胰酶的质量浓度为0.25%。
所述步骤4)中,所述的连续降温步骤为将含有细胞的冷冻保存管放入细胞冻存盒,先置于4℃冰箱中平衡10 分钟,然后在-80℃超低温冰箱中冷冻4 小时以上,再将冻存管取出放入液氮面平衡5 分钟,再转入液氮中长期保存。
实施例2
1)选取健康匙吻鲟,先用自来水冲去鱼的体表粘液及污物,75% 乙醇消毒尾部,抽取尾静脉血液,用0.22μm 的微孔滤膜过滤除菌后,取250μl 鲟鱼血清,加入15ml 胎牛血清,加入3ml 抗生素混合溶液 (青霉素质量浓度为200IU/ml 、链霉素质量浓度为200IU/ml、两性霉素B 质量浓度为0.5μg/ml),添加 DMEM的基础培养液至50ml,即制备成匙吻鲟心脏细胞完全培养液。为促进心脏细胞分裂和迅速增殖,在上述培养液中还特别添加了浓度为10μg/mlⅠ型人胰岛素样生长因子100μl、人表皮生长因子100μl、人碱性成纤维样细胞生长因子100μl。
2)将上述处理过的匙吻鲟,经20ppm 高锰酸钾溶液药浴10 分钟,再以75% 乙醇消毒体表5 分钟,无菌条件下解剖取心脏组织,用预冷的含高浓度抗生素的杜氏磷酸盐缓冲液(D-PBS)连续漂洗若干次。
3)将漂洗过的心脏组织,除去心耳,剪成 1mm3 的小块,用D-PBS清洗数次,将组织块放入 0.1% 胶原酶溶液中,25℃ 水浴条件消化3 小时,至组织呈松散状态为止,再加入 0.25% 胰蛋白酶溶液,25℃ 水浴搅拌消化40 min,吸管吹打组织块,以分离细胞。然后加入过量的完全培养液终止消化,用200目不锈钢筛网过滤,将滤液离心(800r/min,4 分钟)。弃上清液,用完全培养液悬浮沉淀细胞,调整细胞浓度至 5×105 个/ml,接种细胞到培养瓶中,每瓶加入上述配制的5 ml的完全培养液,25℃条件下,二氧化碳培养箱中静置培养,根据细胞生长情况,每隔2 天换液 1 次。
继续培养4 天后,可见大量的心脏组织细胞贴壁生长,呈成纤维样(图1-A),可形成单层或细胞簇,
4)再将长满单层的匙吻鲟心脏细胞培养瓶弃去培养基,用3 ml 无菌磷酸缓冲液洗涤两次,再加入0.25% 胰酶溶液2ml,25℃培箱中消化20 分钟,轻拍培养瓶,待细胞单层解离成单个细胞后,迅速加入完全培养液3ml 以中和过量的胰酶溶液,1200r/min 离心4 分钟,收集细胞并用完全培养液重悬细胞沉淀,将重悬后得到的细胞悬液分别等量接种于两个培养瓶中,25℃培养箱中进行传代培养(图1-B)。之后,每隔3d 待细胞再次长满单层后,按以上步骤重复传代培养的步骤,得到传代培养的细胞,Scepter计数器测定细胞的的密度和直径(图2、图3)。持续传至第5 代时,将含30%胎牛血清的DMEM培养液换成含20%胎牛血清的DMEM培养液。
5)在DMEM基础培养液中加入二甲基亚砜,胎牛血清,青霉素、链霉素、两性霉素B,配制成细胞冷冻保存液,置冰上预冷,取传代培养的细胞,用胰酶将单层细胞消化后,离心弃除培养基,将细胞沉淀用预冷的冷冻保存液重悬,转入冻存管中,将冻存管放入冻存盒中进行连续降温后,置入液氮中保存;复苏时,从液氮里取出冻存细胞,迅速投入37℃水浴解冻,离心重悬细胞沉淀,用移液枪将该细胞移入培养瓶,加入完全培养液,25℃恒温培养12h 后更换新鲜匙吻鲟心脏细胞完全培养液,得到贴壁生长的匙吻鲟心脏组织细胞,即完成匙吻鲟心脏组织细胞系的构建。
实施例3
1)选取健康匙吻鲟,先用自来水冲去鱼的体表粘液及污物,75% 乙醇消毒尾部,抽取尾静脉血液,用0.22μm 的微孔滤膜过滤除菌后,取280μl 鲟鱼血清,加入15ml 胎牛血清,加入3ml 抗生素混合溶液 (青霉素质量浓度为200IU/ml 、链霉素质量浓度为200IU/ml、两性霉素B 质量浓度为0.5μg/ml),添加 DMEM的基础培养液至50ml,即制备成匙吻鲟心脏细胞完全培养液。为促进心脏细胞分裂和迅速增殖,在上述培养液中还特别添加了浓度为10μg/mlⅠ型人胰岛素样生长因子100μl、人表皮生长因子100μl、人碱性成纤维样细胞生长因子100μl。
2)将上述处理过的匙吻鲟,经20ppm 高锰酸钾溶液药浴15 分钟,再以75% 乙醇消毒体表3 分钟,无菌条件下解剖取心脏组织,用预冷的含高浓度抗生素的杜氏磷酸盐缓冲液(D-PBS)连续漂洗若干次。
3)将漂洗过的心脏组织,除去心耳,剪成 1mm3 的小块,用D-PBS清洗数次,将组织块放入 0.1% 胶原酶溶液中,25℃ 水浴条件消化 4 小时,至组织呈松散状态为止,再加入 0.25% 胰蛋白酶溶液,25℃ 水浴搅拌消化 30 min,吸管吹打组织块,以分离细胞。然后加入过量的完全培养液终止消化,用200目不锈钢筛网过滤,将滤液离心(800r/min,5 分钟)。弃上清液,用完全培养液悬浮沉淀细胞,调整细胞浓度至 5×105 个/ml,接种细胞到培养瓶中,每瓶加入上述配制的 5 ml 的完全培养液,25℃条件下,二氧化碳培养箱中静置培养,根据细胞生长情况,每隔 3 天换液 1 次。
继续培养5 天后,可见大量的心脏组织细胞贴壁生长,呈成纤维样(图1-A),可形成单层或细胞簇,
4)再将长满单层的匙吻鲟心脏细胞培养瓶弃去培养基,用3 ml 无菌磷酸缓冲液洗涤两次,再加入0.25% 胰酶溶液2ml,25℃培箱中消化25 分钟,轻拍培养瓶,待细胞单层解离成单个细胞后,迅速加入完全培养液3ml 以中和过量的胰酶溶液,1600r/min 离心3 分钟,收集细胞并用完全培养液重悬细胞沉淀,将重悬后得到的细胞悬液分别等量接种于两个培养瓶中,25℃培养箱中进行传代培养(图1-B)。之后,每隔4d 待细胞再次长满单层后,按以上步骤重复传代培养的步骤,得到传代培养的细胞,Scepter计数器测定细胞的的密度和直径(图2、图3)。持续传至第8 代时,将含30%胎牛血清的DMEM培养液换成含20%胎牛血清的DMEM培养液。
5)在DMEM基础培养液中加入二甲基亚砜,胎牛血清,青霉素、链霉素、两性霉素B,配制成细胞冷冻保存液,置冰上预冷,取传代培养的细胞,用胰酶将单层细胞消化后,离心弃除培养基,将细胞沉淀用预冷的冷冻保存液重悬,转入冻存管中,将冻存管放入冻存盒中进行连续降温后,置入液氮中保存;复苏时,从液氮里取出冻存细胞,迅速投入37℃水浴解冻,离心重悬细胞沉淀,用移液枪将该细胞移入培养瓶,加入完全培养液,25℃恒温培养20h 后更换新鲜匙吻鲟心脏细胞完全培养液,得到贴壁生长的匙吻鲟心脏组织细胞,即完成匙吻鲟心脏组织细胞系的构建。
上述的实施例仅为本发明的优选技术方案,而不应视为对于本发明的限制,本申请中的实施例及实施例中的特征在不冲突的情况下,可以相互任意组合。本发明的保护范围应以权利要求记载的技术方案,包括权利要求记载的技术方案中技术特征的等同替换方案为保护范围。即在此范围内的等同替换改进,也在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!