绵羊胸膜肺炎支原体病毒荧光探针及快速检测方法与流程
本发明属于生物医学领域。具体涉及一种荧光特异性快速检测绵羊胸膜肺炎支原体病毒的荧光探针,并将其用于实际绵羊胸膜肺炎支原体感染的荧光检测。
背景技术:
绵羊胸膜肺炎支原体病毒(Mycoplasma Ovipneumoniae,MO)能够造成绵羊慢性呼吸道疾病,即传染性绵羊胸膜肺炎(Contagious Ovine Pleuropneumonia,COP)(Emerg Infect Dis.2012,18(3),406-414.,Vet Ital,2007,43(1):149-55.)。这是一种高度接触性传染疾病,在世界范围内传播,很难被彻底消除(Plos One,2014,9.)。COP会导致绵羊发烧、咳嗽、气喘、体重下降和增殖性胸膜肺炎等症状,并且会伴随其它病症的出现,如:贫血、发育迟缓、免疫力下降等(Veterinary Microbiology,1997,56,87-98.)。患该病的羊只病程较长,达数月至数年,导致养殖出栏率下降、毛质变差、毛量减少以及饲养成本的巨大浪费。COP还具有易传染、高发病率和高致死率等特点(J.Bacteriol,2011,193(18),5018.)。目前许多国家和地区对于COP缺乏有效的诊断和预防,使得其在世界范围内具有蔓延的趋势,给养羊业造成了巨大的经济损失,因此对于引发该病的MO病毒的研究显得十分重要(Plos One,2014,9.)。相关报道表明,在新西兰、匈利、冰岛、英国、澳大利亚、西班牙、土耳其、非洲及西亚的许多国家均有因MO引起COP疾病的发生。在我国由MO引起的疾病先后在甘肃、宁夏、江苏、云南、四川、辽宁、内蒙、山东、新疆、广西、湖北等地报道。表明这种传染性疾病已在我国分部和蔓延。
MO具有很复杂的组织结构,很难被分离出来,这个难题阻碍了其在分子水平上的研究(Veterinary microbiology,1985,10,541-548.)。目前MO的检测方法有分离培养法、电子显微镜法、血清学法和PCR法等,这些方法具有耗时长、所需实验设备昂贵、实验条件苛刻和操作复杂等缺点,这些缺点限制了它们在实际检测MO中的应用(Pakistan Veterinary Journal,2011,31,244-248.,Journal of Wildlife Diseases,2012,48,449-453.)。特别是,这些检测方法选择性和灵敏度都不好,甚至会造成与实际不符的检测结果。
荧光分析检测方法具有实时快速、廉价简便、选择性和灵敏度高等优点,目前在很多领域具有广泛的应用,如生物病毒检测,医学病变检测,环境污染物的检测等(Electroanalysis,2006,18,319-326.,AnalyticaChimicaActa,1999,401,91-94.,ACS Appl.Mater.Interfaces,2013,5,2800-2814.)。鉴于此,开发一种荧光分析检测MO的方法显得尤为重要。
技术实现要素:
为解决上述技术问题,本发明公开了一类绵羊胸膜肺炎支原体病毒(MO)荧光探针及其快速检测方法。所采用的技术方案是:该类探针由负载在氧化石墨、还原石墨烯、二氧化锰等不同材料表面,由Cy3、Cy5、FAM、罗丹明B(RB)等不同荧光染料标记的具有不同碱基数量的单链DNA序列组成。该类荧光探针可在10分钟左右对MO进行特异性荧光检测(MO序列为:5′-aatatggcaaaagaaataattttaggtattgacctaggaacaaca-3′),最低检测限可达到1.0416copies/μL。与传统的PCR检测技术相比较,本发明具有快速灵敏、简便价廉、荧光可视化等优势。可以实现对MO的实时、快速、准确检测,为绵羊胸膜肺炎的监控及防治创造条件,应用前景广阔。
氧化石墨,还原石墨烯,二氧化锰纳米微球,二氧化锰纳米片层等材料可以吸附单链DNA并作为猝灭基体猝灭Dye的荧光。这种混合体系遇到MO序列时,Dye标记的DNA序列会与MO病毒中的单链DNA特异性结合,使得Dye标记的DNA序列从材料表面脱离,形成Dye标记的双链DNA,释放出Dye的荧光,根据荧光强度变化对MO病毒浓度的变化可以实现MO的特异性检测。
本发明的目的是提供一类快速简便、高效特异检测MO的荧光探针及检测方法。绵羊胸膜肺炎支原体病毒荧光探针,其是由猝灭材料以及染料标记的人工序列构成;其中,所述的猝灭材料选自氧化石墨、还原石墨烯或二氧化锰中的一种;所述的染料为Cy3、Cy5、FAM、罗丹明B中的一种;所述的人工序列为下述中的一种:
5′-tgttgttcctaggtcaatacctaaaattatttcttttgccatat-3’;
5′-ttcctaggtcaatacctaaaattatttcttttgcc-3′;
5′-aggtcaatacctaaaattatttctt-3′;
5′-tgttgttcctaggtcaatacctaaaattatttcttttgccatat-3′;
5′-tgttgttcctaggtcaatacctaaaattatttcttttgccatat-3′;
5′-tgttgttcctaggtcaatacctaaaattatttcttttgccatat-3′。
该类荧光探针是由猝灭材料(QM)以及染料(Dye)标记的人工序列(Dye-ssDNA)构成。Dye-ssDNA能够与MO的单链DNA互补配对。
Dye-ssDNA能够被QM通过范德华力吸附,并且QM能够猝灭Dye-ssDNA的荧光。当加入热解的MO时,Dye-ssDNA能够与MO的DNA序列互补配对,形成Dye标记的双链DNA(Dye-dsDNA),Dye-dsDNA和QM之间存在静电斥力,使得Dye-dsDNA从QM表面脱离,QM对Dye荧光的猝灭作用减弱,从而Dye-dsDNA释放出Dye的荧光。(见图1)
Dye的荧光强度和MO的加入量之间存在一个很好的线性关系,并且检测限可达到1.0416copies/μL。通过测定任意浓度的MO质粒证实了这种方法具有良好的可靠性。结果显示,QM吸附Dye标记的ssDNA探针,对于MO的荧光检测具有简单、快速、廉价、高选择性、高灵敏性、荧光可视化等优点。
对于上述技术方案,优选的情况下,所述的绵羊胸膜肺炎支原体病毒荧光探针,其所述染料标记的人工序列为下述中的一种:
Cy5-ssDNA-1:5′-Cy5-tgttgttcctaggtcaatacctaaaattatttcttttgccatat-3’;
Cy5-ssDNA-2:5′-Cy5-ttcctaggtcaatacctaaaattatttcttttgcc-3′;
Cy5-ssDNA-3:5′-Cy5-aggtcaatacctaaaattatttctt-3′;
Cy3-ssDNA-1:5′-Cy3-tgttgttcctaggtcaatacctaaaattatttcttttgccatat-3′;
FAM-ssDNA-1:5′-FAM-tgttgttcctaggtcaatacctaaaattatttcttttgccatat-3′;
罗丹明B-ssDNA-1:5′-RB-tgttgttcctaggtcaatacctaaaattatttcttttgccatat-3′。
对于上述技术方案,优选的情况下,所述的绵羊胸膜肺炎支原体病毒荧光探针,其所述的二氧化锰材料为二氧化锰纳米微球或二氧化锰纳米片层。
最优选的情况下,上述氧化石墨片径0.5-5μm,单层厚度0.8~1.2nm;还原石墨烯片径0.2~5μm,单层厚度0.8~1.2nm;二氧化锰片层片径300~500nm,单层厚度0.4~0.8nm,二氧化锰微球粒径0.8~1.2μm。
所述本发明实施例中所使用的探针,均优选自上述技术方案,其所述探针为下述的一种:具体为猝灭材料以及染料标记的人工序列组成,为表述方便,简写为:探针=猝灭材料+染料标记的人工序列,
探针1:二氧化锰纳米微球以及Cy5-ssDNA-1;
探针2:二氧化锰纳米微球以及Cy5-ssDNA-2;
探针3:二氧化锰纳米微球以及Cy5-ssDNA-3;
探针4:二氧化锰纳米微球以及Cy3-ssDNA-1;
探针5:二氧化锰纳米微球以及FAM-ssDNA-1;
探针6:二氧化锰纳米微球以及罗丹明B-ssDNA-1;
探针7:二氧化锰纳米片层以及Cy5-ssDNA-1;
探针8:二氧化锰纳米片层以及Cy5-ssDNA-2;
探针9:二氧化锰纳米片层以及Cy5-ssDNA-3;
探针10:二氧化锰纳米片层以及FAM-ssDNA-1;
探针11:二氧化锰纳米片层以及Cy3-ssDNA-1;
探针12:二氧化锰纳米片层以及罗丹明B-ssDNA-1;
探针13:氧化石墨以及Cy5-ssDNA-1;
探针14:氧化石墨以及FAM-ssDNA-1;
探针15:氧化石墨以及Cy3-ssDNA-1;
探针16:氧化石墨以及罗丹明B-ssDNA-1;
探针17:还原石墨烯以及Cy5-ssDNA-1;
探针18:还原石墨烯以及FAM-ssDNA-1;
探针19:还原石墨烯以及Cy3-ssDNA-1;
探针20:还原石墨烯以及罗丹明B-ssDNA-1。
利用上文所述的荧光探针检测绵羊胸膜肺炎支原体病毒的方法:检测MO时,先将热解的MO加入测试液,再加入上文所述的荧光探针,待荧光探针的ssDNA和MO的DNA互补配对后,利用QM猝灭未成功配对的Dye-ssDNA的荧光,再对成功配对染料标记的双链DNA(Dye-dsDNA)进行荧光测试,藉此计算MO的浓度。
具体的方法步骤为:检测MO时,先将在92-97℃加热3-8mins后热解的MO加入测试液,然后在60-70℃下加入上文所述的荧光探针,即:猝灭材料+染料标记的人工序列,进行特异性互补配对3-8mins;最后根据荧光强度变化对MO病毒浓度的变化可以实现MO病毒的特异性检测。
附图说明
图1.荧光检测MO示意图
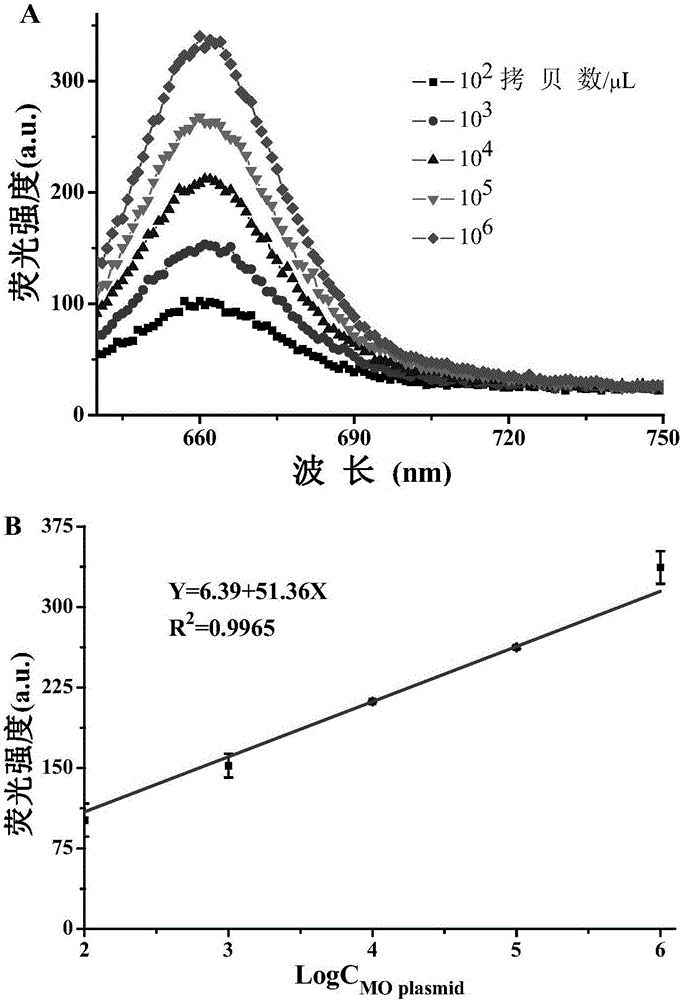
图2.A)探针1(0.2μM)加入不同量(102,103,104,105和106copies/μL)热解的MO质粒后的荧光光谱。B)探针1的荧光强度随着加入质粒浓度变化的线性关系图。激发和发射波长分别是630和660nm。
图3A)探针2(0.2μM)加入不同量(102,103,104和105copies/μL)热解的MO质粒后的荧光光谱。B)探针2的荧光强度随着加入质粒浓度变化的线性关系图。激发和发射波长分别是630和660nm。
图4A)探针3(0.2μM)加入不同量(102,103,104和105copies/μL)热解的MO质粒后的荧光光谱。B)探针3的荧光强度随着加入质粒浓度变化的线性关系图。激发和发射波长分别是630和660nm。
图5A)探针7(0.2μM)加入不同量(102,103,104和105copies/μL)热解的MO质粒后的荧光光谱。B)探针7的荧光强度随着加入质粒浓度变化的线性关系图。激发和发射波长分别是630和660nm。
图6A)探针8(0.2μM)加入不同量(102,103,104和105copies/μL)热解的MO质粒后的荧光光谱。B)探针8的荧光强度随着加入质粒浓度变化的线性关系图。激发和发射波长分别是630和660nm。
图7A)探针9(0.2μM)加入不同量(102,103,104和105copies/μL)热解的MO质粒后的荧光光谱。B)探针9的荧光强度随着加入质粒浓度变化的线性关系图。激发和发射波长分别是630和660nm。
图8A)探针13(0.2μM)加入不同量(102,103,104和105copies/μL)热解的MO质粒后的荧光光谱。B)探针13的荧光强度随着加入质粒浓度变化的线性关系图。激发和发射波长分别是630和660nm。
图9A)探针17(0.2μM)加入不同量(102,103,104和105copies/μL)热解的MO质粒后的荧光光谱。B)探针17的荧光强度随着加入质粒浓度变化的线性关系图。激发和发射波长分别是630和660nm。
具体实施方式
下述非限制性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思进行等同替换或改变均属于本发明保护范畴。
本发明下述实施例中使用的氧化石墨片径0.5-5μm,单层厚度0.8~1.2nm;还原石墨烯片径0.2~5μm,单层厚度0.8~1.2nm;二氧化锰片层片径300~500nm,单层厚度0.4~0.8nm,二氧化锰微球粒径0.8~1.2μm。
实施例1(二氧化锰纳米微球-Cy5-ssDNA-1)
利用探针1对MO进行检测。
探针1的构成:二氧化锰纳米微球+Cy5-ssDNA-1。
二氧化锰纳米微球的制备:5.915g MnSO4·H2O和13.925g NH4HCO3分别溶解在300mL的超纯水中。快速搅拌中将NH4HCO3溶液加入到MnSO4溶液中,溶液变为乳白色,混合液在室温下反应3h。将生成的沉淀过滤并用超纯水清洗三次。将生成的MnCO3真空干燥6h得到前体物。将500mL 0.05M的KMnO4溶液加入到得到的前体物中,反应2h。接着将混合物过滤并用超纯水清洗三次,将得到的固体加入到500mL 0.01M的HCl中,反应12h。过滤真空干燥6h,然后453K处理4h,得到二氧化锰纳米微球。
Cy5-ssDNA-1是由染料Cy5标记的人工合成序列ssDNA-1组成。
将MO质粒稀释成不同的浓度用于测试。
测试过程:将不同浓度(102,103,104,105和106copies/μL)的MO质粒95℃加热5mins,使MO质粒中双链DNA裂解,然后在65℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对5mins,然后对Dye-dsDNA的荧光进行测试。
测试结果及分析:
将探针加入到热解的MO质粒中,加入二氧化锰纳米微球后对其荧光性能进行测试。随着MO质粒量的增加,与探针互补形成Dye-dsDNA的量也增多,探针的荧光强度也逐渐增强。(见图2.)
探针1测试MO质粒时,MO质粒的浓度在102-106copies/μL之间和探针的荧光强度有很好的线性关系(F=51.357×lgC+6.3947,R2=0.99652,F代表探针在660nm处的荧光强度,C代表加入MO质粒的浓度)。计算出检测MO质粒的最低检测限为1.0416copies/μL。
为了验证这种测试的可靠性,利用任意浓度的MO质粒进行荧光测试。将浓度为3×103和3×105copies/μL的MO质粒用于准确性测试,测试结果显示其回收率分别可达到97.99±4.92%和99.03±3.03%,表明此方法准确度较高。(见表1.)
更重要的是,利用猝灭材料吸附Dye标记的ssDNA探针检测手段可以简单、廉价、快速、荧光可视化检测MO质粒。并且,不需要对MO进行复杂的培育和分离处理。因此,探针1能够提高检测MO的准确性,具有更高的灵敏性和选择性。
利用其它猝灭材料吸附Dye标记的ssDNA探针,也能够简单、快速、廉价、高灵敏度和高选择性的对MO质粒进行检测,无须复杂培养和分离处理。这种检测方法在生物医学方面具有巨大的应用潜力。
实施例2(二氧化锰纳米微球-Cy5-ssDNA-2)
利用探针2对MO进行检测。
探针2的构成:二氧化锰纳米微球+Cy5-ssDNA-2。
根据实施例1制备了二氧化锰纳米微球。
Cy5-ssDNA-2是由染料Cy5标记的人工序列ssDNA-2组成。
测试过程中使用的MO质粒与实施例1相同。
探针2检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于92℃加热7mins,然后在70℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对3mins。
测试结果及分析:
探针2测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为3.5544copies/μL。(见图3)
探针2测试MO质粒的准确度试验参照实施例1中所述方法。
实施例3(二氧化锰纳米微球-Cy5-ssDNA-3)
利用探针3对MO进行检测。
探针3的构成:二氧化锰纳米微球+Cy5-ssDNA-3。
根据实施例1制备了二氧化锰纳米微球。
Cy5-ssDNA-3是由染料Cy5标记的人工合成序列ssDNA-3组成。
测试过程中使用的MO质粒同实施例1。
探针3检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于97℃加热3mins,然后在70℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对3mins。
测试结果及分析:
探针3测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为4.2126copies/μL。(见图4)
探针3测试MO质粒的准确度试验参照实施例1中所述方法。
实施例4(二氧化锰纳米微球-Cy3-ssDNA-1)
利用探针4对MO进行检测。
探针4的构成:二氧化锰纳米微球+Cy3-ssDNA-1。
根据实施例1制备了二氧化锰纳米微球。
Cy3-ssDNA-1是由染料Cy3标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒同实施例1。
探针4检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于95℃加热5mins,然后在70℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对3mins。
测试结果及分析:
探针4测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为2.3268copies/μL。
探针4测试MO质粒的准确度试验参照实施例1中所述方法。
实施例5(二氧化锰纳米微球-FAM-ssDNA-1)
利用探针5对MO进行检测。
探针5的构成:二氧化锰纳米微球+FAM-ssDNA-1。
根据实施例1制备了二氧化锰纳米微球。
FAM-ssDNA-1是由染料FAM标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒同实施例1。
探针5检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于97℃加热3mins,然后在60℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对7mins。
测试结果及分析:
探针5测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为3.1334copies/μL。
探针5测试MO质粒的准确度试验参照实施例1中所述方法。(见表.2)
实施例6(二氧化锰纳米微球-罗丹明B-ssDNA-1)
利用探针6对MO进行检测。
探针6的构成:二氧化锰纳米微球+罗丹明B-ssDNA-1。
根据实施例1制备了二氧化锰纳米微球。
罗丹明B-ssDNA-1是由染料罗丹明B标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒同实施例1。
探针6检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于95℃加热5mins,然后在60℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对7mins。
测试结果及分析:
探针6测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为2.9678copies/μL。
探针6测试MO质粒的准确度试验参照实施例1中所述方法。
实施例7(二氧化锰纳米片层-Cy5-ssDNA-1)
利用探针7对MO进行检测。
探针7的构成:二氧化锰纳米片层+Cy5-ssDNA-1。
根据文献制备了二氧化锰纳米片层。0.6M NaOH和2M H2O2混合并快速加入到0.3M的Mn(NO3)2中,搅拌反应25min。过滤得到固体。将固体投入到2M的NaOH溶液中,150℃下水热反应16h。将固体用0.1M的HCl在25℃下清洗两天。过滤固体,用超纯水清洗三次。70℃真空干燥得到二氧化锰纳米片层。
Cy5-ssDNA-1是由染料Cy5标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒同实施例1。
探针7检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于92℃加热7mins,然后在65℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对5mins。
测试结果及分析:
探针7测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为3.0226copies/μL。(见图5)
探针7测试MO质粒的准确度试验参照实施例1中所述方法。
实施例8(二氧化锰纳米片层-Cy5-ssDNA-2)
利用探针8对MO进行检测。
探针8的构成:二氧化锰纳米片层+Cy5-ssDNA-2。
根据实施例7制备了二氧化锰纳米片层。
Cy5-ssDNA-2是由染料Cy5标记的人工合成序列ssDNA-2组成。
测试过程中使用的MO质粒同实施例1。
探针8检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于95℃加热5mins,然后在70℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对3mins。
测试结果及分析:
探针8测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为4.2328copies/μL。(见图6)
探针8测试MO质粒的准确度试验参照实施例1中所述方法。
实施例9(二氧化锰纳米片层-Cy5-ssDNA-3)
利用探针9对MO进行检测。
探针9的构成:二氧化锰纳米片层+Cy5-ssDNA-3。
根据实施例7制备了二氧化锰纳米片层。
Cy5-ssDNA-3是由染料Cy5标记的人工合成序列ssDNA-3组成。
测试过程中使用的MO质粒同实施例1。
探针9检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于97℃加热3mins,然后在65℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对5mins。
测试结果及分析:
探针9测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为4.2328copies/μL。(见图7)
探针9测试MO质粒的准确度试验参照实施例1中所述方法。
实施例10(二氧化锰纳米片层-FAM-ssDNA-1)
利用探针10对MO进行检测。
探针10的构成:二氧化锰纳米片层+FAM-ssDNA-1。
根据实施例7制备了二氧化锰纳米片层。
FAM-ssDNA-1是由染料FAM标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒同实施例1。
探针10检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于95℃加热5mins,然后在70℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对3mins。
测试结果及分析:
探针10测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为5.1467copies/μL。
探针10测试MO质粒的准确度试验参照实施例1中所述方法。(见表.3)
实施例11(二氧化锰纳米片层-Cy3-ssDNA-1)
利用探针11对MO进行检测。
探针11的构成:二氧化锰纳米片层+Cy3-ssDNA-1。
根据实施例7制备了二氧化锰纳米片层。
Cy3-ssDNA-1是由染料Cy3标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒同实施例1。
探针11检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于95℃加热5mins,然后在70℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对3mins。
测试结果及分析:
探针11测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为7.8974copies/μL。
探针11测试MO质粒的准确度试验参照实施例1中所述方法。
实施例12(二氧化锰纳米片层-罗丹明B-ssDNA-1)
利用探针12对MO进行检测。
探针12的构成:二氧化锰纳米片层+罗丹明B-ssDNA-1。
根据实施例7制备了二氧化锰纳米片层。
罗丹明B-ssDNA-1是由染料罗丹明B标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒同实施例1。
探针12检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于92℃加热7mins,然后在65℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对5mins。
测试结果及分析:
探针12测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为2.2302copies/μL。
探针12测试MO质粒的准确度试验参照实施例1中所述方法。
实施例13(氧化石墨-Cy5-ssDNA-1)
利用探针13对MO进行检测。
探针13的构成:氧化石墨+Cy5-ssDNA-1。
氧化石墨的制备。1g纯的石墨,34mL浓硫酸和0.75g硝酸钠加入到250mL的圆底烧瓶中,冰浴中搅拌反应。5g高锰酸钾缓慢加入到反应体系中,反应体系温度上升到35度。反应体系搅拌反应2小时,将50mL超纯水加入到体系中,再将4mL 30%的双氧水逐滴加入到体系中,反应液颜色变为亮黄色。过滤水洗,将得到的滤渣分散到超纯水中,调节pH至中性,超声处理。离心收集固体得到氧化石墨材料。
Cy5-ssDNA-1是由染料Cy5标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒同实施例1。
探针13检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于96℃加热3mins,然后在60℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对7mins。
测试结果及分析:
探针13测试MO质粒时,其检测范围在102-105copies/μL之间。计算出的检测限为3.6897copies/μL。(见图8)
探针13测试MO质粒的准确度试验参照实施例1中所述方法。(见表.4)
实施例14(氧化石墨-FAM-ssDNA-1)
利用探针14对MO进行检测。
探针14的构成:氧化石墨+FAM-ssDNA-1。
氧化石墨的制备参照实施例13中氧化石墨的制备过程。
FAM-ssDNA-1是由染料FAM标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒参照实施例1。
探针14检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于93℃加热7mins,然后在68℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对4mins。
测试结果及分析:
探针14测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为1.4256copies/μL。
探针14测试MO质粒的准确度试验参照实施例1中所述方法。
实施例15(氧化石墨-Cy3-ssDNA-1)
利用探针15对MO进行检测。
探针15的构成:氧化石墨+Cy3-ssDNA-1。
氧化石墨的制备参照实施例13中氧化石墨的制备过程。
Cy3-ssDNA-1是由染料Cy3标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒参照实施例1。
探针15检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于92℃加热7mins,然后在63℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对6mins。
测试结果及分析:
探针15测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为2.2336copies/μL。
探针15测试MO质粒的准确度试验参照实施例1中所述方法。
实施例16(氧化石墨-罗丹明B-ssDNA-1)
利用探针16对MO进行检测。
探针16的构成:氧化石墨+罗丹明B-ssDNA-1。
氧化石墨的制备参照实施例13中氧化石墨的制备过程。
罗丹明B-ssDNA-1是由染料罗丹明B标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒参照实施例1。
探针16检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于96℃加热4mins,然后在65℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对5mins。
测试结果及分析:
探针16测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为7.0202copies/μL。
探针16测试MO质粒的准确度试验参照实施例1中所述方法。
实施例17(还原石墨烯Cy5-ssDNA-1)
利用探针17对MO进行检测。
探针17的构成:还原石墨烯和Cy5-ssDNA-1。
还原石墨烯的制备。通过实施例13中的步骤制备出氧化石墨。1.4mL 25%的氨水,0.2mL 20%的水合肼加入到500mL氧化石墨(0.2mg/mL)的悬浮液中,充分震荡10分钟,将混合液95度搅拌反应1小时。收集固体,得到还原石墨烯。
Cy5-ssDNA-1是由染料Cy5标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒参照实施例1。
探针17检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于92℃加热7mins,然后在68℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对3mins。
测试结果及分析:
探针17测试MO质粒时,其检测范围在102-105copies/μL之间。计算出的检测限为4.3076copies/μL。(见图9.)
探针17测试MO质粒的准确度试验参照实施例1中所述方法。(见表.5)
实施例18(还原石墨烯-FAM-ssDNA-1)
利用探针18对MO进行检测。
探针18的构成:还原石墨烯+FAM-ssDNA-1。
还原石墨烯的制备参照实施例17中还原石墨烯的制备过程。
FAM-ssDNA-1是由染料FAM标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒参照实施例1。
探针18检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于92℃加热7mins,然后在70℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对3mins。
测试结果及分析:
探针18测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为4.5854copies/μL。
探针18测试MO质粒的准确度试验参照实施例1中所述方法。
实施例19(还原石墨烯-Cy3-ssDNA-1)
利用探针19对MO进行检测。
探针19的构成:还原石墨烯+Cy3-ssDNA-1。
还原石墨烯的制备参照实施例17中还原石墨烯的制备过程。
Cy3-ssDNA-1是由染料Cy3标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒参照实施例1。
探针19检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于95℃加热5mins,然后在65℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对5mins。
测试结果及分析:
探针19测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为5.5479copies/μL。
探针19测试MO质粒的准确度试验参照实施例1中所述方法。
实施例20(还原石墨烯-罗丹明B-ssDNA-1)
利用探针20对MO进行检测。
探针20的构成:还原石墨烯+罗丹明B-ssDNA-1。
还原石墨烯的制备参照实施例17中还原石墨烯的制备过程。
罗丹明B-ssDNA-1是由染料罗丹明B标记的人工合成序列ssDNA-1组成。
测试过程中使用的MO质粒参照实施例1。
探针20检测MO是参考实施例1中探针1对MO的检测过程。其中,MO质粒于93℃加热6mins,然后在68℃下加入Dye标记的单链DNA荧光探针进行特异性互补配对3mins。
测试结果及分析:
探针20测试MO质粒时,其检测范围在102-106copies/μL之间。计算出的检测限为8.5567copies/μL。
探针20测试MO质粒的准确度试验参照实施例1中所述方法。
表1.
表1.利用探针1检测不同浓度MO质粒。CMO plasmid,MO质粒的浓度;F为在660nm处测得荧光的强度;F0为浓度对应线性关系上的荧光强度,每组平行测试四次,求平均值,根据做出的线性关系计算检测到的MO质粒浓度。
表2.
表2.利用探针5检测不同浓度MO质粒。CMO plasmid,MO质粒的浓度;F为在530nm处测得荧光的强度;F0为浓度对应线性关系上的荧光强度,每组平行测试四次,求平均值,根据做出的线性关系计算检测到的MO质粒浓度。
表3.
表3.利用探针10检测不同浓度MO质粒。CMOplasmid,MO质粒的浓度;F为在530nm处测得荧光的强度;F0为浓度对应线性关系上的荧光强度,每组平行测试四次,求平均值,根据做出的线性关系计算检测到的MO质粒浓度。
表4.
表4.利用探针13检测不同浓度MO质粒。CMO plasmid,MO质粒的浓度;F为在660nm处测得荧光的强度;F0为浓度对应线性关系上的荧光强度,每组平行测试四次,求平均值,根据做出的线性关系计算检测到的MO质粒浓度。
表5.
表5.利用探针17检测不同浓度MO质粒。CMO plasmid,MO质粒的浓度;F为在660nm处测得荧光的强度;F0为浓度对应线性关系上的荧光强度,每组平行测试四次,求平均值,根据做出的线性关系计算检测到的MO质粒浓度。
- 还没有人留言评论。精彩留言会获得点赞!