一种细菌性阴道病的LH‑PCR细菌基因指纹图谱的制备方法及应用与流程
本发明涉及一种细菌基因指纹图谱的制备方法,具体的说涉及一种应用LH-PCR技术制备细菌性阴道病的细菌基因指纹图谱的方法。
背景技术:
细菌性阴道病(Bacterial Vaginosis,BV)是由细菌引起的阴道感染,是育龄期女性常见的下生殖道感染性疾病,其可引发多种不良妊娠结局,如自然流产、早产、羊水感染、产后子宫内膜炎和剖腹产切口感染及围产儿并发症等。近年来的研究发现,细菌性阴道病的复发和持续感染还能增加滴虫性阴道炎、白假丝酵母菌性阴道炎、宫颈癌和人类免疫缺陷病毒(human immunodeficiency virus,HIV)的风险。
目前对细菌性阴道病的病因,特别是对细菌性阴道病患者的阴道菌群构成的差异,缺乏深入研究。以往使用的培养法并不能全面地反映阴道菌群的构成,导致对细菌性阴道病患者的病原菌研究受到局限,有时患者临床评价虽已是治愈状态,但其阴道菌群构成却还没有恢复到正常状态,致病菌仍存在,此时如仅通过临床评价停止治疗,则会导致细菌性阴道病复发,耽误疾病治疗,增加疾病的复发率。
随着近20年来分子生物学技术的快速发展,使用分子生物学方法研究细菌性阴道病复发的机理和细化诊断临床不同细菌性阴道病亚型成为一种趋势,人们对细菌性阴道病的菌群结构研究也在不断深入。长度多态片段PCR(length heterogeneity PCR,LH-PCR)是运用荧光标记的探针来决定来源于不同微生物扩增序列的相对数量,带标记的片段通过毛细管电泳被分离出来,而后被一个带有荧光性的自动基因序列分析仪所监测到。LH-PCR是一种分析微生物结构的方法,其原理是由于基因或基因操纵子的插入或剪切造成某些特定基因固有长度呈现多态性。因此,可以利用这种多态性来确定微生物的种群信息。LH-PCR测定的超变量区域主要存在于核糖体的小亚基(rrn)。
LH-PCR作为一种基于PCR的分子指纹图谱技术,其与高通量测序技术相比具有技术操作灵敏,快速简单,成分低廉等的优点。但是,目前尚未有将该技术应用于医学领域,尤其是将其作为一种疾病的诊断技术的报道。
技术实现要素:
本发明的目的是提供一种应用LH-PCR技术,制备细菌性阴道病的细菌基因指纹图谱的方法,以及应用该细菌基因指纹图谱精确判断样品中是否存在细菌性阴道病致病菌群的用途。本发明所述的细菌基因指纹图谱能用于细菌性阴道病的临床快速诊断,避免传统的细菌分离培养的诊断不准确、操作繁琐、耗时长、工作量大以及高通量测序价格昂贵等缺点,能够准确、快速有效地检测阴道内的菌群分布状况。
为达到上述目的,本发明提供一种细菌性阴道病的LH-PCR细菌基因指纹图谱的制备方法,其中所述细菌为阴道内细菌,所述基因为16S rRNA基因。
进一步的,所述细菌性阴道病的LH-PCR细菌基因指纹图谱的制备方法,是对扩增片段长度为310-380bp的基因片断进行分析。
更进一步的,所述细菌性阴道病的LH-PCR细菌基因指纹图谱的制备方法,其中当片段长度340-374bp中的任何一个片断的相对峰面积大于10%时,确定为有细菌性阴道病致病菌群存在;当片段长度340-374bp中所有片段的相对峰面积都小于10%,确定为正常菌群,没有细菌性阴道病致病菌群存在。
优选的,所述细菌性阴道病的LH-PCR细菌基因指纹图谱的制备方法,其中LH-PCR的引物为:5'-AGAGTTTGATCCTGGCTCAG-3'和5'-ATTACCGCGGCTGCTGG-3',其中5'-ATTACCGCGGCTGCTGG-3'的5'端用FAM荧光标记。
进一步的,所述细菌性阴道病的LH-PCR细菌基因指纹图谱的制备方法,包括:
1.提取阴道分泌物的细菌基因组DNA;
2.对细菌基因组DNA中的16S rRNA基因进行PCR扩增:
引物:5'-AGAGTTTGATCCTGGCTCAG-3',和
5'-ATTACCGCGGCTGCTGG-3',其中5'端用FAM荧光标记;
PCR的反应体系(50μL):10×缓冲液5μL,dNTPs1μL,引物各1.5μL,DNA聚合酶1μL,BSA2.5μL,模板DNA1μL,ddH2O补足50μL;同时设置不添加模板的阴性对照;
反应程序:95℃预变性5min,94℃变性45s,55℃退火1min,72℃延伸2min,30个循环,最后于4℃恒温保存;
3.毛细管电泳LH-PCR产物:
将所述PCR产物用1.0%琼脂糖凝胶电泳进行富集,收集300-400bp的片断;然后用Qiagen凝胶回收纯化,并与Hi-Di甲酰胺及GS500 Liz内部尺寸标准混合,混合物在PCR仪中在95℃下变性5min,再进行毛细管电泳检测,注射时间为10s,注射和运行电压为15.0kV,运行温度为60℃,运行时间为70min;
4.毛细管电泳图谱的分析
将样品的指纹电泳图谱用GeneScan 3.7进行收集,LH-PCR数据运用BioNumerics 6.0软件进行处理,对扩增片段长度为310-380bp的片断进行分析。
优选的,所述细菌性阴道病的LH-PCR细菌基因指纹图谱的制备方法,其中所述细菌的种类选自Mycobacterium、Ureaplasma、Mycoplasma、Sneathia、Corynebacterium、Atopobium、Gardnerella、Mobiluncus、Prevotella、Actinomyces、Staphylococcus、Anaerococcus、Peptoniphilus、Megasphaera、Lactobacillus。
优选的,所述细菌性阴道病的LH-PCR细菌基因指纹图谱的制备方法,其中所述细菌种类和对应的扩增片段长度为:
本发明还提供了一种应用上述制备方法制备的细菌基因指纹图谱在诊断细菌性阴道病中的用途。
本发明还提供了一种应用上述制备方法制备的细菌基因指纹图谱在判断样品中是否存在细菌性阴道病致病菌群中的用途。
本发明还提供了一种应用上述制备方法制备的细菌基因指纹图谱在判断样品中是否存在Mycobacterium、Ureaplasma、Mycoplasma、Sneathia、Corynebacterium、Atopobium、Gardnerella、Mobiluncus、Prevotella、Actinomyces、Staphylococcus、Anaerococcus、Peptoniphilus、Megasphaera、Lactobacillus细菌中的应用。
任何的指纹图谱技术都是为了提供一个菌群的整体情况,而不是区分每个单独的菌种。因此,其主要是反映出环境中菌群结构的演变或差异,以分析出疾病状态与菌群结构的相关性。LH-PCR通过分析峰形变化,较容易跟踪菌群结构的变化,可以精确的分析出阴道分泌物的菌群结构,可对主要致病菌进行分类与鉴定。且该方法操作相对简单,较少的操作步骤减少了误差产生概率,因此重现性非常好。此外,LH-PCR与高通量测序及其他指纹图谱技术如T-RFLP(末端限制性酶切多态性检测,Terminal restriction fragment length polymorphism)相比,PCR产物不需要进行限制性酶切,可以直接进行基因分析,即可得到微生物种群的构成信息,具有成本低,操作简便快速的优点,同时相对于Amsel标准和Nugent评分来说又可以精确的分析出阴道分泌物的菌群结构,因此可作为分子生物学技术应用于临床分析阴道菌群变化,在临床上可通过构建不同的LH-PCR图谱对疾病状态进行分类诊断。
附图说明
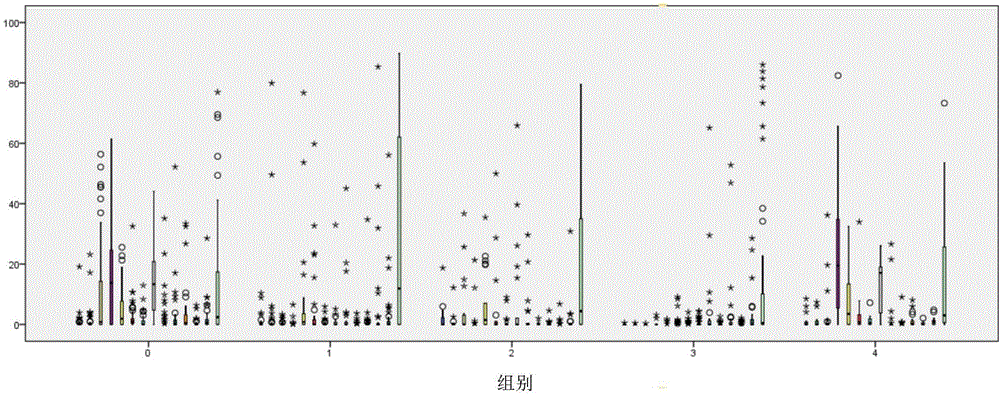
图1:D0组(0)、SG-D7组(1)、FG-D7组(2)、SG-D30组(3)、FG-D30组(4)5组样品的LH-PCR特征峰的主成分分析结果(Principal Component Analysis,PCA)。
图2:D0组(0)、SG-D7组(1)、FG-D7组(2)、SG-D30组(3)、FG-D30组(4)5组样品的LH-PCR特征峰;横轴为片段长度,纵轴为每一种片段长度的相对峰面积(单位%)。
图3:实施例2患者1用药前(D0)的LH-PCR图谱;横轴为片段长度,纵轴为每一种片段长度的相对峰面积(单位%)。
图4:实施例2患者1用药后7天(D7)的LH-PCR图谱;横轴为片段长度,纵轴为每一种片段长度的相对峰面积(单位%)。
图5:实施例2患者1用药后30天(D30)的LH-PCR图谱;横轴为片段长度,纵轴为每一种片段长度的相对峰面积(单位%)。
图6:实施例2患者2用药前(D0)的LH-PCR图谱;横轴为片段长度,纵轴为每一种片段长度的相对峰面积(单位%)。
图7:实施例2患者2用药后7天(D7)的LH-PCR图谱;横轴为片段长度,纵轴为每一种片段长度的相对峰面积(单位%)。
图8:实施例2患者2用药后30天(D30)的LH-PCR图谱;横轴为片段长度,纵轴为每一种片段长度的相对峰面积(单位%)。
具体实施方式
下面实施例对本发明进一步详细说明,本领域技术人员应当意识到在不脱离本发明的范围和精神的情况下所作的改动,均属于本发明的范围。
细菌基因组DNA提取试剂盒(DP302)购自:天根生化科技有限公司。
所有数据均使用SPSS15.0(Chicago,IL,USA)进行分析,如果P<0.05,说明数据存在统计学差异。
实施例1:应用LH-PCR技术制备细菌性阴道病的细菌基因指纹图谱
1.研究对象及标准:
1.1 研究对象:选取63例诊断为细菌性阴道病的育龄期女性,规范使用甲硝唑凝胶治疗5天,并在用药前(0天)、用药后7天、用药后30天取样。
1.2 入组标准:采用Amsel临床诊断标准和Nugent实验室诊断标准诊断细菌性阴道病(Bacterial Vaginosis,BV)。所有的分泌物涂片均由微生态实验室2名有经验的微生物专家判读。
1.3 排除标准:
①妊娠期、哺乳期和绝经期女性
②因其他疾病长期服用激素类药物者
③服用免疫抑制剂者
④有心、肝、肾、内分泌等内科疾病者(主要通过问诊)
⑤患有滴虫、外阴阴道白假丝酵母菌病等其它阴道感染者
⑥甲硝唑过敏者
⑦依从性差者
1.4 随访时间:对入组的BV患者进行两次随访,分别为用药后7天、用药后30天。记录患者每次就诊时的症状、体征、pH值及Nugent评分。
1.5 治疗方法和治愈标准:入组的BV患者使用甲硝唑凝胶(37.5mg,qd,阴道上药),连续给药5天。在用药后第7天和第30天分别随访,评价治疗效果。治愈标准:同时满足微生态评价痊愈标准和临床评价痊愈标准为治愈。微生态评价痊愈标准:Nugent评分0-3分。临床痊愈标准:阴道分泌物性状正常,Whiff试验阴性,线索细胞消失,阴道分泌物pH值<4.5。
2.样品制备:
2.1.样本采集:分别用两个无菌棉拭子从研究对象阴道侧壁上1/3处取得阴道分泌物,一个迅速放入含有1ml PBS(pH:7.4)无菌离心管中,放于-80℃超低温冰箱以便基因组提取。另一个均匀涂在载玻片上,行革兰染色,油镜下观察,进行Nugent评分。
2.2.细菌基因组DNA的提取(应用天根生化科技有限公司的细菌基因组提取剂盒及其内试剂):
1)取冻存阴道分泌物,10000rpm(约11500×g)离心1min,尽量吸净上清。
2)加入180μl缓冲液(20mM Tris,pH 8.0;2mMNa2-EDTA;1.2%Triton);终浓度为20mg/ml的溶菌酶(溶菌酶用溶菌酶干粉溶解在缓冲液中进行配制),37℃处理30min以上。
3)向管中加入20μl蛋白酶K溶液,混匀。
4)加入220μl缓冲液GB,振荡15sec,70℃放置10min,溶液应变清亮,简短离心以去除管盖内壁的水珠。
5)加220μl无水乙醇,充分振荡混匀15sec,出现絮状沉淀,简短离心以去除管盖内壁的水珠。
6)将上一步所得溶液和絮状沉淀都加入一个吸附柱CB3中(吸附柱放入收集管中),12000rpm(约13400×g)离心30sec,倒掉废液,将吸附柱CB3放入收集管中。
7)向吸附柱CB3中加入500μl缓冲液GD(使用前请先检查是否已加入无水乙醇),12000rpm(约13400×g)离心30sec,倒掉废液,将吸附柱CB3放入收集管中。
8)向吸附柱CB3中加入600μl漂洗液PW(使用前请先检查是否已加入无水乙醇),12000rpm(约13400×g)离心30sec,倒掉废液,吸附柱CB3放入收集管中。
9)重复操作步骤8。
10)将吸附柱CB3放回收集管中,12000rpm(约13400×g)离心2min,倒掉废液。将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液(这一步的目的是将吸附柱中残余的漂洗液去除,漂洗液中乙醇的残留会影响后续的酶反应(酶切、PCR等)实验)。
11)将吸附柱CB3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200μl洗脱缓冲液TE,室温放置2-5min,12000rpm(约13400×g)离心2min,将溶液收集到离心管中。
12)加入4μl RNase A(100mg/ml)溶液,振荡15sec,室温放置5min。
2.3. DNA浓度及纯度检测:
分别用琼脂糖凝胶电泳和紫外分光光度法检测总基因组DNA的浓度和纯度,测得所有样本DNA在OD260处均有显著吸收峰,DNA浓度大于10ng/μl,总量大于0.1μg且OD260/OD280比值均在1.8-2.0之间,说明步骤2.1所提取的DNA浓度和纯度符合PCR和毛细管电泳的实验要求。
3.应用LH-PCR技术制备细菌基因指纹图谱的步骤
3.1.细菌PCR扩增
选用引物
fD1(5'-AGAGTTTGATCCTGGCTCAG-3')和
5'FAM-PRUN518r(5'-ATTACCGCGGCTGCTGG-3')
扩增细菌16S rRNA基因,其中5'FAM-PRUN518r的5'端用FAM荧光标记。
PCR的反应体系(50μL):10×缓冲液5μL,dNTPs1μL,引物各1.5μL,DNA聚合酶1μL,BSA2.5μL,模板DNA1μL,ddH2O补足50μL。
同时设置不添加模板的阴性对照。
反应程序为:95℃预变性5min,94℃变性45s,55℃退火1min,72℃延伸2min,30个循环,最后于4℃恒温保存。
3.2.毛细管电泳LH-PCR产物
将步骤3.1的PCR产物用1.0%琼脂糖凝胶电泳进行富集,收集300-400bp的片断。然后用Qiagen凝胶纯化试剂盒切胶回收纯化,并与Hi-Di甲酰胺及GS500Liz内部尺寸标准混合,混合物先放入PCR仪(Peltier Thermal Cycler DNAEngine),在95℃下变性5min,立刻放入冰盒中。再放入ABI PRISM 310遗传分析仪(Applied Biosystems,美国)中进行毛细管电泳检测,注射时间为10s,注射和运行电压为15.0kV,运行温度为60℃,运行时间为70min。
3.3.毛细管电泳图谱的分析
每个样品的指纹电泳图谱用GeneScan 3.7进行收集。LH-PCR数据运用BioNumerics 6.0软件进一步处理。电泳图谱转换为BioNumerics曲线格式,并且使用规范化的内部尺寸标准,对扩增片段长度为310-380bp的片断进行分析。
4.细菌基因指纹图谱制备
4.1.样品数据分组:
按步骤1.5对63例研究对象连续给药5天,在用药后第7天随访,临床评价均为治愈;在用药后第30天随访,42名治愈未复发,21名复发,治愈率为66.67%。
上述63例研究对象,每例分别在第0天、第7天、第30天取3次样,共189个样品。根据上述治疗结果,样品数据共分为5组:
0组:D0组(用药前患者取样的样品,供63例)、
1组:SG-D7组(用药后30天未复发的患者在7天时取样的样品,共42例)、
2组:FG-D7组(用药后30天复发的患者在7天时取样的样品,共21例)、
3组:SG-D30组(用药后30天未复发的患者在30天时取样的样品,共42例)、
4组:FG-D30组(用药后30天复发的患者在30天时取样的样品,共21例)。
4.2. LH-PCR特征峰
通过对189个(63个患者,每个患者取样3次)阴道分泌物样本进行LH-PCR扩增片段进行分析,发现LH-PCR的扫描峰主要集中340-375bp,但是不同样品数据组的LH-PCR特征峰各不相同。
图1显示的D0组、SG-D7组、FG-D7组、SG-D30组、FG-D30组这5组样品的LH-PCR特征峰的主成分分析结果(Principal Component Analysis,PCA),从图1中可以看出:
针对D30的样品,SG-D30组群(实心圆圈)和FG-D30组群(空心圆圈)的阴道微生物群落明显的分成了两个集群,说明治愈组(未复发组)和复发组的集落明显不同;
FG-D30组群(空心圆圈)与D0组(空心方块)的微生物群落分布相重叠,说明复发组和未治疗组的集落具有相似性;
SG-D7组(实心三角)和FG-D7组(空心三角)的样本分布存在部分重叠,却又不完全相同,说明即便是第7天时临床评价同为治愈,后续复发的和未复发的样品集落在中间状态中也存在差异。
因此,基于本发明形成的LH-PCR特征峰,可以通过对BV和健康女性阴道内微生物菌群的主成分分析,明显区分出不同时间点时阴道菌群的差异,能将疾病与健康状态下的阴道菌群明显的区分开来。
进一步对LH-PCR特征峰进行Kruskal Wallis Test检验,结果见图2和表1。图2显示的是D0组、SG-D7组、FG-D7组、SG-D30组、FG-D30组这5组样品的LH-PCR特征峰。在每一组峰谱中,纵轴为每一个片段的相对峰面积,横轴为14个通过Kruskal Wallis Test检验后有显著性差异的片段长度,自左到右依次为340bp、341bp、343bp、344bp、345bp、347bp、349bp、353bp、354bp、356bp、361bp、363bp、368bp、375bp。表1显示的是这14个片段长度的相对峰面积的四分位数间距。
表1 具有显著性差异的片段长度的相对峰面积的四分位数间距
从图2和表1的结果可以计算出,当片段长度340-374bp中的任何一个片断的相对峰面积(四分位数间距)大于10%时,确定为有细菌性阴道病致病菌群存在;当片段长度340-374bp中所有片段的相对峰面积(四分位数间距)都小于10%,确定为正常菌群,没有细菌性阴道病致病菌群存在。
为了确定产生显著性差异的基因片段长度所对应的细菌种类,申请人将LH-PCR的分析结果与高通量测序结果进行了对比比较。
其中高通量测序是使用标准的454/Roche GS-FLX方案完成对16S rRNA基因V1-V3区的测序工作。高通量测序共产生了1,622,359条高质量的reads,每个样本平均有8071条序列(3424–18517)。所有样本共检测到8967个OTU(操作分类单元,operation taxonomy units),并且每个样本的OTUs数在54–706之间。在对原始序列进行筛选后,通过比对RDP数据库完成细菌种类的比较。最终确认差异片段长度所对应的细菌种类为表2所示:
表2 细菌种类和对应的片段长度
实施例2:应用本发明LH-PCR图谱进行细菌性阴道病诊断
患者1:
用药前(0天)LH-PCR图谱(图3)显示有343bp、353bp、366bp三处相对峰面积大于10%,因此诊断为患有细菌性阴道病。同时进行微生态评价和临床标准评价进行验证,其Nugent评分为9,阴道分泌物稀薄,有鱼腥臭味,Whiff试验阳性,线索细胞阳性,阴道分泌物pH值为5.1,临床诊断为患有细菌性阴道病,与通过本发明LH-PCR基因指纹图谱诊断的结果一致。
对该患者规范使用甲硝唑凝胶治疗5天,在用药后7天再对其进行分析,此时该患者的微生态评价和临床标准评价显示其BV已治愈,通过LH-PCR图谱(图4)分析,显示片段长度340-374bp中所有片段的相对峰面积<10%,根据实施例1的图谱分析,说明此时患者已治愈,并且菌群恢复到正常状态,没有致病菌存在,预测其没有复发风险。
在用药后30天,第3次进行LH-PCR分析,图谱(图5)显示片段长度340-374bp中所有片段的相对峰面积<10%,诊断为其细菌性阴道病未复发,已治愈。同时对30天时的样品也进行微生态评价和临床标准评价进行验证,其Nugent评分为1,阴道分泌物性状正常,Whiff试验阴性,线索细胞阴性,阴道分泌物pH值为4.1,临床诊断为也同样为治愈未复发,与通过本发明LH-PCR基因指纹图谱诊断的结果一致,且与用药后7天的LH-PCR分析预测正确。
患者2:
用药前(0天)LH-PCR图谱(图6)显示有343bp、353bp两处相对峰面积大于10%,诊断为患有细菌性阴道病。同时进行微生态评价和临床标准评价进行验证,其Nugent评分为9,阴道分泌物性状稀薄,有鱼腥臭味,Whiff试验阳性,线索细胞阳性,阴道分泌物pH值4.8,临床诊断为患有细菌性阴道病,与通过本发明LH-PCR基因指纹图谱诊断的结果一致。
对该患者规范使用甲硝唑凝胶治疗5天,在用药后7天再对其进行分析,此时该患者的微生态评价和临床标准评价显示其BV已治愈,但是通过LH-PCR图谱(图7)分析,显示仍有364bp、368bp两处相对峰面积大于10%,根据实施例1的图谱分析,此时菌群并没有恢复到正常,还属于异常菌群状态,致病菌仍存在,预测其可能后续有复发风险。
在用药后30天,第3次进行LH-PCR分析,图谱(图8)显示有353bp、366bp两处相对峰面积大于10%,诊断为其仍患有细菌性阴道病。同时对30天时的样品也进行微生态评价和临床标准评价进行验证,其Nugent评分为8,阴道分泌物性状稀薄,有鱼腥臭味,Whiff试验阳性,线索细胞阳性,阴道分泌物pH值5.2,临床诊断为也同样为患有细菌性阴道病,与通过本发明LH-PCR基因指纹图谱诊断的结果一致,且与用药后7天的LH-PCR分析预测正确。
- 还没有人留言评论。精彩留言会获得点赞!