猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT‑PCR检测方法与流程
本发明涉及猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT-PCR检测方法,属于荧光定量RT-PCR
技术领域:
。
背景技术:
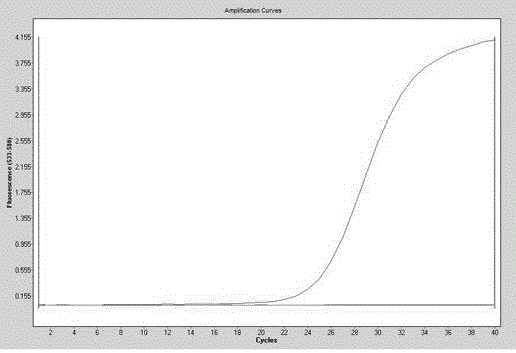
:猪瘟病毒(Classicalswinefevervirus,简称CSFV)和牛病毒性腹泻病毒(Bovineviraldiarrheavirus,简称BVDV)同属于黄病毒科、瘟病毒属,长久以来,它们所引起的传染病给养牛、养猪和养羊业造成了巨大的经济损失。BVDV在世界范围内广泛分布,山羊、绵羊、猪,鹿及小袋鼠等动物都是BVDV的宿主和传染源。BVDV与CSFV的核苷酸序列约有60%的同源性,氨基酸约有85%的同源性,多克隆抗体对两种病毒具有血清学交叉反应。首先,CSFV与BVDV在自然条件下感染猪,其临床症状和病理变化相似;其次,在兽用疫苗生产中,常使用牛血清、牛睾丸细胞、胰酶等牛源材料作为原材料,一旦这些原料被污染了BVDV,则必将导致疫苗产品的污染,尤其是猪用疫苗被污染BVDV后,会导致免疫猪感染,造成自身类似猪瘟的临床症状,给猪瘟的诊断带来困难外,还会成为污染源。CN101058830A公开了“猪瘟病毒荧光定量一诊断试剂盒”,CN101328506A公开了“一种特异检测猪瘟病毒野毒感染的荧光定量快速诊断试剂盒及其应用方法”;两篇文献均只对CSFV进行了单独检测。OIE公布了检测BVDV的引物探针序列,标注不能区分猪瘟病毒;CN103397107A公开了“牛病毒性腹泻病毒荧光定量一检测试剂盒”,但只对BVDV进行单独检测。临床检测结果表明,现有的CSFV或BVDV荧光定量RT-PCR试剂盒无法区分CSFV与BVDV。目前,针对CSFV和BVDV感染的联合检测方法还未完善,而对猪源BVDV的检测也仍然在探索阶段;还没有能够同时对猪瘟病毒和牛病毒性腹泻病毒进行同时检测的相关试剂。技术实现要素:基于CSFV与BVDV基因序列相似,普通RT-PCR难以区分两者的事实;本发明的目的在于提供一种具可区分猪瘟病毒和牛病毒性腹泻病毒的双重荧光定量RT-PCR的检测方法。技术方案一组荧光定量RT-PCR检测用引物和探针,由第一组引物和探针或/和第二组引物和探针组成;所述第一组引物和探针为:CSFV-F:ATACATAAAGCCCGGCCCTG,如SEQIDNO.1所示;CSFV-R:CTTGCCATCACTACCCGTGA,如SEQIDNO.2所示;CSFV探针P:FAM-CCAGGACTACATGGGCCCAGTCTATCAC-BHQ1,如SEQIDNO.3所示;所述第二组引物和探针为:BVDV-F:AGCAACAGTGGTGAGTTCGT,如SEQIDNO.4所示;BVDV-R:CGTGGCATCTCGAGACCTTT,如SEQIDNO.5所示;BVDV探针P:HEX\VIC-ATGGCTTAAGCCCTGAGTACA-BHQ1,如SEQIDNO.6所示。本发明的上述引物和探针:其中第一组引物和探针用于扩增猪瘟病毒特异序列,第二组引物和探针用于扩增牛病毒性腹泻病毒特异序列。第一组引物和探针的扩增产物的序列唯一与猪瘟病毒基因序列保守区(533bp-671bp)一致;第二组引物和探针的扩增产物的序列唯一与BVDV基因序列保守区(142bp-237bp)一致。采用本发明的上述引物进行荧光定量RT-PCR检测,能够将CSFV与BVDV区分开来,解决了现有CSFV或BVDV荧光定量RT-PCR试剂盒无法区分CSFV与BVDV的技术问题。一种猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT-PCR检测试剂,含有上述引物和探针。上述检测试剂,其组成为:DEPCH2O:2.75ul5×Buffer:2.5ul10×Buffer:1.25ul2.5mMdNTP:2ulCSFV-F:0.5ulCSFV-R:1ulCSFV探针P:0.5ulBVDV-F:0.5ulBVDV-R:1ulBVDV探针P:0.5ul20uMMgCl2:1.5ul酶混合物:1ul;所述CSFV-F、CSFV-R、CSFV探针P、BVDV-F、BVDV-R、BVDV探针P的浓度均为10μmol/L。上述检测试剂,为检测一份样品的用量。一种猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT-PCR检测方法;将待测样品的核酸10ul与15ul上述检测试剂配成25ul的反应体系,然后进行荧光定量RT-PCR反应,读取结果;所述荧光定量RT-PCR反应:第一阶段:反转录42℃/30min;第二阶段:预变性94℃/3min;第三阶段:92℃/15sec,45℃/30sec,72℃/60sec,共5个循环;第四阶段:92℃/10sec,56℃/60sec,共40个循环;最后40℃/10sec;在第四阶段每次循环的退火56℃延伸时收集荧光;所述读取结果:如果FAM检测通道出现“S”形扩增曲线,且Ct值小于或等于30,则样品中含有CSFV;如果HEX\VIC检测通道出现“S”形扩增曲线,且Ct值小于或等于30,则样品中含有BVDV。上述检测方法,用于扩增猪瘟病毒特异序列的引物和探针为:引物CSFV-F、CSFV-R和CSFV探针P;用于扩增牛病毒性腹泻病毒特异序列的的引物和探针为:BVDV-F、引物BVDV-R和BVDV探针P。对上述检测方法获得的扩增产物进行测序,CSFV探针P仅出现在与猪瘟病毒基因序列保守区(533bp-671bp)一致的扩增产物中,BVDV探针P仅出现在与牛病毒性腹泻病毒病毒基因序列保守区(142bp-237bp)一致的扩增产物中。说明,每组引物和探针能排除另外一组引物和探针的干扰;因此,本发明的检测方法能够同时检测猪瘟病毒和牛病毒性腹泻病毒。有益效果采用本发明的上述引物进行荧光定量RT-PCR检测,能够将CSFV与BVDV区分开来。本发明的检测方法能够同时检测猪瘟病毒和牛病毒性腹泻病毒。在本发明的检测方法中,猪瘟病毒和牛病毒性腹泻病毒双重荧光定量RT-PCR检测方法采用病毒RNA柱式提取试剂盒,提取时间短,整个检测过程不到3个小时,采取闭管反应,检测完毕直接处理,避免开盖造成气溶胶污染。过程简单、检测时间短、灵敏度高。附图说明图1-2为特异性实验的扩增结果图;图1中的“S”型曲线为CSFV的扩增曲线,图2中的“S”型曲线为BVDV的扩增曲线,图1、2中的直线均为猪蓝耳病病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒和阴性对照的阴性检测结果;图3-4为重复性实验的扩增结果图;图3中的“S”型曲线为猪瘟病毒不同毒株的扩增曲线,图4中的“S”型曲线为牛病毒性腹泻病毒不同毒株的扩增曲线,图3、4中的直线均为阴性对照的检测结果;图5-6为灵敏度实验的扩增结果图;图5中的“S”型曲线为不同浓度的猪瘟病毒的扩增曲线,其中,从上到下的四条曲线依次对应稀释10-1、10-2、10-3、10-4倍后的CSFV的扩增曲线,稀释10-5、10-6倍后的CSFV的扩增曲线呈直线,阴性对照的检测结果为直线;图6中的“S”型曲线为不同浓度的BVDV的扩增曲线,其中,从上到下的5条曲线依次对应稀释10-1、10-2、10-3、10-4、10-5倍后的BVDV的扩增曲线,稀释10-6倍后的CSFV的扩增曲线呈直线,阴性对照的检测结果为直线;由此可见,稀释10-5、10-6倍后的CSFV的检测结果呈阴性,稀释10-6倍后的CSFV的检测结果呈阴性。具体实施方式本具体实施方式中,所涉及的猪瘟病毒(Classicalswinefevervirus),记载于2015年1月至2016年7月从发病的猪中分离鉴定得到的;现保存在山东省动物疫病预防与控制中心。所涉及的牛病毒性腹泻病毒(Bovineviraldiarrheavirus),记载于2013年1月至2014年7月从发病的猪中分离鉴定得到的;现保存在山东省动物疫病预防与控制中心。所涉及的猪蓝耳病病毒(Porcinereproductiveandrespiratorysyndromevirus),记载于2015年1月至2016年7月从发病的猪中分离鉴定得到的;现保存在山东省动物疫病预防与控制中心。所涉及的猪流行性腹泻病毒(Porcineepidemicdiarrheavirus)记载于2015年1月至2016年7月从发病的猪中分离鉴定得到的;现保存在山东省动物疫病预防与控制中心。所涉及的猪传染性胃肠炎病毒(Transmissiblegastroenteritisvirus)记载于2015年1月至2016年7月从发病的猪中分离鉴定得到的;现保存在山东省动物疫病预防与控制中心。设计引物和探针用于扩增猪瘟病毒特异序列的引物和探针:上游引物CSFV-F:ATACATAAAGCCCGGCCCTG,如SEQIDNO.1所示;下游引物CSFV-R:CTTGCCATCACTACCCGTGA,如SEQIDNO.2所示;CSFV探针P:FAM-CCAGGACTACATGGGCCCAGTCTATCAC-BHQ1,如SEQIDNO.3所示;用于扩增牛病毒性腹泻病毒特异序列的的引物和探针:上游引物BVDV-F:AGCAACAGTGGTGAGTTCGT,如SEQIDNO.4所示;下游引物BVDV-R:CGTGGCATCTCGAGACCTTT,如SEQIDNO.5所示;BVDV探针P:HEX\VIC-ATGGCTTAAGCCCTGAGTACA-BHQ1,如SEQIDNO.6所示。特异性试验1.2.1选取CSFV和BVDV原毒液,各取200ul于1.5ml离心管中。采用北京森康生物技术开发有限公司的病毒RNA柱式提取试剂盒,参照说明书分别提取病毒液的核酸。同时将实验室保存的猪蓝耳病病毒3株,猪流行性腹泻病毒3株,猪传染性胃肠炎病毒3株,共9株病毒液。取这9株病毒液各200ul于1.5ml离心管中,采用北京森康生物技术开发有限公司的病毒RNA柱式提取的试剂盒,参照说明书提取9份病毒液的核酸。将上述3株猪蓝耳病病毒、3株猪流行性腹泻病毒、3株猪传染性胃肠炎病毒的核酸及猪瘟病毒和牛病毒性腹泻病毒的核酸进行下述检测:取配好的反应液15ul,分别加入10ul上述核酸,最终配成25ul的反应体系。反应液配方如表1所示:表1组成量(uL)10μmol/L的CSFV-F0.510μmol/L的CSFV-R110μmol/L的CSFV探针P0.510μmol/L的BVDV-F0.510μmol/L的BVDV-R110μmol/L的BVDV探针P0.5DEPCH2O2.7510×Buffer1.255×Buffer2.5MgCl2(20mmol/L)1.5dNTP(25mmol/L)2酶混合物1将反应体系上机进行荧光定量RT-PCR反应,然后读取结果。荧光定量PCR的反应参数如下设置:第一阶段:反转录42℃/30min;第二阶段:预变性94℃/3min;第三阶段:92℃/15sec,45℃/30sec,72℃/60sec,共5个循环;第四阶段:92℃/10sec,56℃/60sec,共40个循环;最后40℃10sec;在第四阶段每次循环的退火56℃延伸时收集荧光。结果读取:对于多通道PCR仪,分别利用FAM(465-510)通道和HEX\VIC(533-580)通道读取结果;若用ABI仪器,分别选择FAM荧光素对应的通道和HEX荧光素对应的通道无荧光淬灭基团,读取结果。本发明采用的是多通道PCR仪(包括ABI仪器):在FAM(465-510)通道出现一条“S”型扩增曲线,如图1所示;因为检测CSFV的探针以FAM荧光素标记的,所以用FAM(465-510)通道接收的荧光信号为标记FAM荧光素探针的扩增产物的扩增曲线,为CSFV的扩增曲线。在HEX\VIC(533-580)通道出现一条“S”型扩增曲线,如图2所示;因为检BVDV的探针以HEX荧光素标记的,所以用HEX(533-580)通道接收的荧光信号为标记HEX荧光素探针的扩增产物的扩增曲线,为BVDV的扩增曲线。对反应体系中的扩增产物进行测序;其中,标记有CSFV探针P的扩增产物,其序列为:atacataaagcccggccctgtctactaccaggactacatgggcccagtctatcacagagctcctttagagttctttgatgaggcccagttctgcgaggtgactaagagaataggcagggtcacgggtagtgatggcaag,如SEQIDNO.7所示,该序列唯一与猪瘟病毒基因序列保守区(533bp-671bp)一致;标记有BVDV探针P的扩增产物,其序列为:agcaacagtggtgagttcgttggatggcttaagccctgagtacagggtagtcgtcagtggttcgacgccttggaataaaggtctcgagatgccacg,如SEQIDNO.8所示,该序列唯一与BVDV基因序列保守区(142bp-237bp)一致。说明,引物CSFV-F、CSFV-R和CSFV探针P能特异性扩增CSFV基因序列保守区,图1的“S”型曲线为CSFV基因序列保守区扩增产物的量的变化曲线。引物BVDV-F、BVDV-R和BVDV探针P能特异性扩增BVDV基因序列保守区,图2的“S”型曲线为BVDV基因序列保守区扩增产物的量的变化曲线。而引物CSFV-F、CSFV-R和CSFV探针P,引物BVDV-F、BVDV-R和BVDV探针P,均不会对猪蓝耳病病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒进行扩增。猪瘟病毒和牛病毒性腹泻病毒双重荧光定量RT-PCR不能检测出混淆程度比较大的猪蓝耳病病毒、猪流行性腹泻病毒和猪传染性胃肠炎病毒,具有很好的特异性。另外,CSFV探针P仅出现在与猪瘟病毒基因序列保守区(533bp-671bp)一致的扩增产物中,BVDV探针P仅出现在与牛病毒性腹泻病毒病毒基因序列保守区(142bp-237bp)一致的扩增产物中,说明,每组引物和探针能排除另外一组引物和探针的干扰。重复性试验选取经鉴定的猪瘟病毒毒株10株,选取经鉴定的猪源牛病毒性腹泻病毒毒株3株。取10株CSFV病毒液各200ul于10个不同的1.5ml离心管中;取3株BVDV(BVDV-1型2株、BVDV-2型1株)200ul于1.5ml离心管中;采用北京森康生物技术开发有限公司的病毒RNA柱式提取的试剂盒,参照说明书分别提取13份病毒液的核酸。将10株猪瘟病毒的核酸与3株牛病毒性腹泻病毒的核酸混合后分成30份,最后形成30份两种病毒液混合的核酸;把两种病毒液的混合核酸当作荧光定量RT-PCR反应的模板。荧光定量RT-PCR反应采用15ul反应液,10ul模板,共25ul的体系;反应液配方如表1所示。取配好的反应液15ul,加入混合好的两种病毒液的核酸10ul,最终配成25ul的反应体系,同时设定阴性对照(反应液15ul+DEPC水10ul),采用多通道PCR仪进行荧光定量RT-PCR反应,然后读取结果。荧光定量RT-PCR的反应参数如下设置:第一阶段:反转录42℃/30min;第二阶段:预变性94℃/3min;第三阶段:92℃/15sec,45℃/30sec,72℃/60sec,共5个循环,第四阶段:92℃/10sec,56℃/60sec,共40个循环;最后40℃10sec;在第四阶段每次循环的退火56℃延伸时收集荧光。结果读取:利用FAM(465-510)通道读取结果,如图3所示;利用HEX\VIC(533-580)读取结果,如图4所示。由图3可知,10株不同的猪瘟病毒都能检测出阳性,结果在可控的范围之内;可见,此双重荧光定量RT-PCR对于猪瘟病毒的检测比较稳定。由图4可知:3份牛病毒性腹泻病毒都能检测出阳性,结果在可控的范围之内,可见此双重荧光定量RT-PCR对于牛病毒性腹泻病毒的检测比较稳定。灵敏度试验选取经鉴定纯化的猪瘟病毒和猪源牛病毒性腹泻病毒毒株各1株,应用病毒RNA柱式提取试剂盒操作流程提取核酸,全波长酶标仪(SpectraMax®i3x)测定OD260,OD260/280计算核酸浓度为40.748ng/ul(CSFV)、39.803ng/ul(BVDV),做10-1,10-2,10-3,10-4,10-5,10-6十进位倍比稀释。将稀释浓度相同的病毒液的核酸各取10ul后充分混合,最后形成6份不同稀释度的两种病毒液混合的核酸,把不同稀释度的两种病毒液的混合核酸当作荧光定量RT-PCR反应的模板。荧光定量RT-PCR反应采用15ul反应液,10ul模板,共25ul的体系;反应液配方如表1所示。取配好的反应液15ul,加入混合好的三种细菌的核酸10ul,最终配成25ul的反应体系;同时设定阴性对照(反应液15ul+DEPC水10ul),采用多通道PCR仪进行荧光定量PCR反应,然后读取结果。荧光定量PCR的反应参数如下设置:第一阶段:反转录42℃/30min;第二阶段:预变性94℃/3min;第三阶段:92℃/15sec,45℃/30sec,72℃/60sec,共5个循环;第四阶段:92℃/10sec,56℃/60sec,共40个循环;最后40℃10sec;在第四阶段每次循环的退火56℃延伸时收集荧光。结果读取:利用FAM(465-510)通道读取结果,如图5所示;图5显示,CSFV的检测极限是40.748pg/ul。利用HEX\VIC(533-580)读取结果,如图6所示;图6显示,BVDV的检测极限是3.9803pg/ul。与现有无法区分CSFV与BVDV的荧光定量RT-PCR检测试剂相比,本发明的双重荧光RT-PCR试剂盒的灵敏性并没有降低。<110>山东省动物疫病预防与控制中心<120>猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT-PCR检测方法<160>8<210>1<211>20<212>DNA<213>人工合成<400>1ATACATAAAGCCCGGCCCTG20<210>2<211>20<212>DNA<213>人工序列<400>2CTTGCCATCACTACCCGTGA20<210>3<211>28<212>DNA<213>人工序列<400>3CCAGGACTACATGGGCCCAGTCTATCAC28<210>4<211>20<212>DNA<213>人工序列<400>4AGCAACAGTGGTGAGTTCGT20<210>5<211>20<212>DNA<213>人工序列<400>5CGTGGCATCTCGAGACCTTT20<210>6<211>21<212>DNA<213>人工序列<400>6ATGGCTTAAGCCCTGAGTACA21<210>7<211>139<212>DNA<213>人工序列<400>7atacataaagcccggccctgtctactaccaggactacatgggcccagtctatcacagagc60tcctttagagttctttgatgaggcccagttctgcgaggtgactaagagaataggcagggt120cacgggtagtgatggcaag139<210>8<211>96<212>DNA<213>人工序列<400>8agcaacagtggtgagttcgttggatggcttaagccctgagtacagggtagtcgtcagtgg60ttcgacgccttggaataaaggtctcgagatgccacg96当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种C型EV71病毒的TaqMan荧光实时定量PCR检测方法
- 一种鲤春病毒血症病毒的荧光定量pcr检测方法
- 一种利用实时荧光pcr检测偏肺病毒的方法和组合物的制作方法
- 一种病毒三重荧光定量rt-pcr检测方法及其试剂盒的制作方法
- 一种麻疹病毒一步实时荧光定量rt-pcr试剂盒的制作方法
- 一种用于检测日本乙型脑炎病毒的荧光rt-pcr试剂盒的制作方法
- 尼帕病毒和猪瘟病毒二重荧光rt-pcr检测试剂及其制备方法与用图
- 尼帕病毒和猪繁殖与呼吸综合症病毒二重荧光rt-pcr检测试剂及其制备方法与用图
- 用于辛德比斯病毒荧光rt-pcr检测的引物和lna探针及其试剂盒的制作方法
- 鸭痘病毒的实时荧光pcr检测方法及检测用引物和探针的制作方法
- 猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT‑PCR检测方法与流程
- 一种南瓜花叶病毒实时荧光RT‑PCR检测试剂盒及其方法与流程
- 鹿流行性出血病病毒实时荧光RT‑PCR检测试剂盒的制作方法与工艺
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 一种燕麦花叶病毒的实时荧光RT‑PCR检测方法、引物和探针及试剂盒与流程
- 一种检测羊边界病毒的实时荧光定量RT‑PCR试剂盒及应用的制造方法与工艺
- 检测口蹄疫病毒的荧光定量PCR试剂盒及系统的制造方法与工艺
- 五种猪腹泻病毒多重实时荧光定量PCR快速诊断试剂盒及应用的制造方法与工艺
- Sweepoviruses病毒实时荧光定量PCR检测的通用引物、探针及其检测方法与流程
- 一种鹅星状病毒实时荧光定量PCR检测的引物和探针的制作方法与工艺
- 一种葡萄斑点病毒荧光定量PCR检测的专用引物和方法与流程
- 一种樱桃病毒A荧光定量PCR检测的专用引物和方法与流程
- 猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT‑PCR检测方法与流程
- 一种南瓜花叶病毒实时荧光RT‑PCR检测试剂盒及其方法与流程
- 检测禽呼肠孤病毒的通用PCR引物及其检测试剂盒的制作方法与工艺
- 鹿流行性出血病病毒实时荧光RT‑PCR检测试剂盒的制作方法与工艺
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 一种用于绝对定量检测猪繁殖与呼吸综合征病毒的ddPCR方法、引物及其应用和试剂盒与流程
- 猪瘟病毒抗体竞争AlphaLISA检测试剂盒及检测方法
- 双峰驼源抗猪瘟兔化弱毒疫苗株e2抗原重链抗体vhh和用途
- 用于检测非洲猪瘟病毒抗体的间接elisa试剂盒及其用途的制作方法
- 猪瘟病毒抗体、猪蓝耳病病毒抗体和猪伪狂犬病病毒抗体的elisa检测试剂盒的制作方法
- 一种猪瘟抗体快速金标检测卡的制作方法
- 用于检测非洲猪瘟病毒抗体的竞争elisa试剂盒及其用途的制作方法
- 一种用于检测非洲猪瘟病毒抗体的竞争elisa试剂盒及其用途的制作方法
- 抗非洲猪瘟病毒单克隆抗体的杂交瘤细胞系及其所分泌的单克隆抗体的制作方法
- 一种非洲猪瘟病毒vp73基因的原核表达蛋白及其制备方法
- 一种猪瘟病毒阻断elisa抗体检测试剂盒及应用的制作方法