OsSCAMP13基因及编码蛋白与抗逆性的应用及获取方法与流程
本发明涉及植物基因工程领域,具体地说,涉及一种新的水稻抗逆相关基因OsSCAMP13及其编码蛋白与应用,本发明还提供了一种获取OsSCAMP13基因的方法,利用此基因可培育抗旱能力增强的转基因植物。
背景技术:
植物的生长受到众多环境因素的影响,其中一些不利的非生物胁迫(包括干旱、盐害、低温、高温等)对作物的产量造成了极大的影响,因此,利用基因工程技术,将一些抗逆相关基因转入到优良作物品种中,培育既高产又抗逆且优质的农作物新品种是应对水资源短缺、保障粮食安全的有效途径之一。深入发掘并研究植物节水抗旱基因,是解析植物抗旱机制的基础工作,为培育节水抗旱作物提供理论依据和基因资源。
细胞膜上存在两类主要的转运蛋白,即:载体蛋白(carrier protein)和通道蛋白(channel protein)。载体蛋白能够与特定溶质结合,通过自身构象的变化,将与它结合的溶质转移到膜的另一侧。OsSCAMP13属于一种分泌的载体蛋白(Secretory carrier membrane proteins,SCAMP),这种蛋白最初被确定为哺乳动物的外分泌腺分泌小泡组件,但是后来发现它们在真核生物中无处不在(Fernandez-Chacon and Sudhof, 2000)。这种蛋白能够在质膜和液泡之间来回穿梭(Brand and Castle, 1993)。水稻、拟南芥以及豌豆中都发现了SCAMP,该蛋白在其它植物中也应该存在(Fernandez-Chacon and Sudhof, 2000)。SCAMP是否参与了植物抗逆则鲜有报道。
技术实现要素:
本发明的目的在于提供一种新的水稻抗逆相关基因OsSCAMP13,可响应逆境胁迫。
本发明的另一目的是提供利用水稻基因OsSCAMP13培育抗逆能力增强的转基因植物的方法。
本发明从水稻中分离克隆的一段完整编码区段的DNA片段,对这个基因编码的蛋白序列进行分析表明,它属于一个分泌载体膜蛋白,因此命名为OsSCAMP13。
本发明分离和应用一种包含OsSCAMP13基因的DNA片段,该基因能响应脱水、PEG、高盐、低温、高温、H2O2、ABA、GA、KT,发生表达变化。
本发明所述OsSCAMP13基因DNA序列为序列表SEQ ID NO:1所示,或者与SEQ ID NO:1同源度达90%的DNA序列,或者其功能相当于SEQ ID NO:1所示序列的亚片段。
本发明所述OsSCAMP13基因DNA序列还可为序列表SEQ ID NO:2所示,或者与SEQ ID NO:2同源度达90%的DNA序列,或者其功能相当于SEQ ID NO:1所示序列的亚片段。
一种抗逆性水稻,其包含有上述OsSCAMP13基因编码的蛋白。
所述蛋白的氨基酸序列还包含下列之一:
(a)所述氨基酸序列为序列表SEQ ID NO:3所示;
(b)所述氨基酸序列为SEQ ID NO:3序列的同源序列、保守性变异体、等位变异体、天然突变体或诱导突变体。
OsSCAMP13基因编码的蛋白还包含上述的OsSCAMP13基因在高或低的严谨条件下杂交的编码DNA。
本发明获得OsSCAMP13基因的方法如下:(1)、采用已克隆的OsSCAMP13基因为探针,从cDNA文库和基因组文库中筛选得到本发明的基因或同源基因。(2)、采用PCR(polymerase chain reaction)技术,从基因组,mRNA和cDNA中扩增得到OsSCAMP13基因以及任何感兴趣的一段DNA或与其同源的一段DNA。采用以上技术,可以分离得到包含OsSCAMP13基因序列,将OsSCAMP13基因序列与引导外源基因在植物中表达的载体连接后转化植物,可获得抗逆能力提高的转基因植株。
OsSCAMP13基因在构建到表达载体上时,在其转录起始核苷酸前加上任何一种强启动子或诱导启动子。
OsSCAMP13基因在构建到表达载体上时,可以使用增强子OsSCAMP13基因需要与编码序列的阅读框相同,以保证整个序列的正确翻译。
本发明的优选实施方案是,还提供了包含OsSCAMP13基因的重组载体。携带OsSCAMP13基因的表达载体可通过使用Ti质粒,植物病毒载体,直接DNA转化,微注射,电穿孔等常规生物技术方法导入植物细胞。
包含本发明中的OsSCAMP13基因的表达载体的转化宿主是包括水稻在内的多种植物,培育抗旱、抗旱的植物品种。
本发明还提供一种OsSCAMP13基因在水稻抗逆性的应用,水稻抗逆性的应用中的OsSCAMP13基因克隆自水稻第4染色体的抗旱QTL区段,在脱水、PEG、高盐、低温、高温、H2O2、ABA、GA、KT处理下的基因可响应逆境胁迫及外源激素的超表达,其中,超表达该基因的转基因水稻表现出显著增强的抵抗干旱胁迫的能力。
本发明的技术效果是,水稻基因对逆境产生明显响应,可应用于在植物抗逆育种,提高植物的抗逆性。
附图说明
图1为本发明的OsSCAMP13基因在苗期冷、热、盐、PEG、H2O2和外源ABA、GA、KT处理下的表达水平。
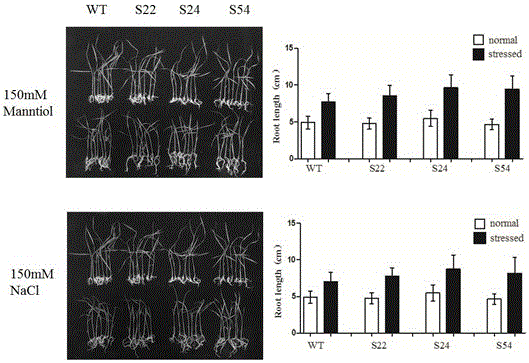
图2为本发明的OsSCAMP13基因的超表达转基因水稻的苗期甘露醇、NaCl处理分析。
图3为本发明的OsSCAMP13基因超表达转基因水稻的成株期干旱胁迫处理。
具体实施方式
下述实施例进一步描述本发明,但所述实施例仅用于说明本发明而不是限制本发明。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
下述实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等分子克隆:实验室手册(New York: Cold Spring Harbor Laboratory Press, 1989)中所述的条件,或按照制造厂商所建议的条件。
实施例1
水稻OsSCAMP13基因的克隆
1.幼苗培育
将旱稻品种IRAT109置于30℃萌发48小时,然后播种于温室中,待水稻叶片为3-5片时,准备抽取DNA或RNA。
2.RNA提取与第一链cDNA合成
RNA的提取:所取样品在研钵中用液氮冷冻后研磨成粉状,加入盛有1mL TRNzol-A+试剂的2mL EP管,充分振荡后,室温放置5min,之后加0.2mL氯仿,剧烈震荡15s后,室温放置3min;后在4℃,12000rpm离心10min后,上清液移至新的2mL EP管中,加等体积异丙醇沉淀RNA,加100µL RNase-free ddH2O溶解。电泳鉴定总RNA质量,然后在分光光度计上测定RNA含量。
反转录之前需用DNaseI消化所提取样品,反应体系如下:
37℃反应15min后,加入0.25µl 0.1M EDTA(保证终浓度>2mM),70℃温育10 min终止反应,短暂离心后置于冰上备用。
第一链cDNA的合成参照Promega 反转录系统A3500操作手册,具体步骤如下:
(1)DNaseI消化过的样品中依次加入下列各试剂配制20µL 的反应体系:
(2)将上反应体系于42℃温育 15 min;
(3)然后95℃加热5min,使AMV反转录酶失活并阻止其与DNA结合;
(4)4℃或冰上放置5 min。
制备好的cDNA可以立即使用或存放于-20℃备用。
3.基因的克隆
从水稻第4染色体的抗旱QTL区段内定位到候选基因LOC_Os04g50890,对水稻基因组及全长基因数据库进行BLAST搜索,获得其对应的全长cDNA(AK058642)。根据预测信息设计上下游引物F1:5’- ATGCATCACGACCCCAACC-3’和R1:5’-TCACTTGTTCCCTCTGAAGTACATG-3’,从cDNA中直接克隆获得了OsSCAMP13基因,回收,连接到pEASY-Blunt Simple载体上,用M13F或M13R作为通用引物,采用终止物荧光标记(Big-Dye, Perkin-Elmer, USA)的方法,在ABI 3730测序仪(Perkin-Elmer, USA)上进行测序,测序结果同SEQ ID NO:2比对确认,SEQ ID NO:2为构建超表达载体所用序列。其中SEQ ID NO:1为其DNA序列,SEQ ID NO:2为该基因的CDS序列,CDS翻译即得该基因的氨基酸序列SEQ ID NO:3。
实施例2
水稻基因OsSCAMP13在逆境胁迫下的表达分析
1. 逆境胁迫处理
选取饱满的日本晴种子,蒸馏水清洗,3% NaClO消毒10 min后清洗干净,30℃催芽,种子露白后转放到发芽盒内水培生长,三叶期后施加营养液(国际水稻所标准营养液)。在28℃,16h/8h的光照培养室中培养,至四叶期时进行各种逆境和激素处理:脱水、15% PEG6000、150mM NaCl、10% H2O2、4℃、42℃和100μM 脱落酸(ABA) 、100μM 赤霉素(GA) 、100Μm 激动素(KT)。分别在胁迫前、胁迫后3h、6h、12h、24h对逆境处理材料进行取样。在处理前、处理后0.5h、1h、2h、4h、8h、812h、24h对处理样品取样。所有处理和取样过程都是在持续光照的条件下进行。
2. RNA提取与第一链cDNA合成
同实施例1。
3.定量PCR分析
基因表达的定量分析使用Takara公司的SYBR®Premix Ex TaqTM(Perfect Real Time)试剂盒和Bio-Rad cfx96定量PCR仪进行。根据OsSCAMP13全长cDNA序列设计定量引物。以水稻持家基因actin(GenBank accession No. AY212324)为参照基因,根据其cDNA序列设计引物。所用基因定量前引物为F2:5’- GTGCCAATGGAGGATAAGAA-3’。
基因定量后引物R2:5’- GGCAATGTCATGGTGAATG-3’,Actin F:5’- CTTCCTCATGCCATCCTGC-3’,Actin R:5’- GCAAGCTTCTCCTTGATGTCC-3’。20 µL反应体系的配制:
反应条件为:95℃ 30s,然后在95℃ 5s,60℃ 31s,循环40次,并增设Dissociation Stage。设定在每个循环中60℃ 31s时收集数据,其它具体操作按仪器使用说明书进行。计算目的基因与参照基因的平均CT值以及△CT值,利用2-ΔΔCT法进行结果分析,最后将数据导入GraphPad Prism5.0做出目的基因的相对表达量柱状图。
定量分析结果显示,如图1所示,该基因能够受到脱水、PEG、高盐、低温、高温、H2O2、ABA、GA、KT的诱导表达,因而该基因在逆境应答反应中可能起着重要的作用。
实施例3
水稻基因OsSCAMP13超量表达转化水稻
1.利用GATEWAY重组克隆技术构建含OsSCAMP13基因的超量表达载体:
以实施例1中已获得含有旱稻IRAT109的OsSCAMP13基因的pEASY-Blunt Simple载体为模板,
用前引物
F3:5’-AAAAAGCAGGCTATGCATCACGACCCCAACC-3’,后引物R3:5’-AGAAAGCTGGGTTCACTTGTTCCCTCTGAAGTACATG-3’进行第一轮PCR扩增。再利用通用引物attB1 adapter: 5’-GGGGACAAGTTTGTACAAAAAAGCAGGCT-3’,attB2 adapter: 5’-GGGGACCACTTTGTACAAGAAAGCTGGGT-3’进行第二轮PCR扩增,扩增产物经回收纯化后,通过BP反应,将扩增产物片断克隆到入门载体pDONR207,筛选阳性克隆,通过LR反应,将目的基因重组克隆到GATEWAY超表达载体pCB4004(该载体是在pCB2004基础上,将除草剂抗性基因替换为潮霉素抗性基因改造而来,命名为pCB4004)。具体过程如下:
(1)第一轮PCR扩增
20μl反应体系:
扩增程序:
Step Time Temperature Cycles
预变性 2min 98℃ 1X
变性 15s 98℃
退火 30s 60 ℃ 10X
延伸 1 min/kb 72℃
(2)第二轮PCR扩增
取上述PCR产物10uL作为模板,加入到下面PCR配置的40uL反应体系。
紧接着严格按照下面的循环来进行PCR扩增:
Step Time Temperature Cycles
预变性 1min 98℃ 1X
变性 15s 98℃
退火 30s 45 ℃ 5X
延伸 1 min/kb 72℃
然后设置下一步的PCR程序。
Step Time Temperature Cycles
变性 15s 98℃
退火 30s 55℃ 25X
延伸 1 min/kb 72℃
最后取5ul电泳检测PCR质量。
(1) PCR产物的回收
采用普通琼脂糖凝胶DNA回收试剂盒进行纯化回收。
(2)BP重组反应
BP反应的目的在于将含有attB接头的PCR产物重组到含有attP的供体载体上,以产生入门克隆。重组反应可在室温配制混匀,0.5mL的离心管中进行。反应体系如:
Components Sample
attB-PCR product(>10ng) 3µL
pDONR207 vector (150 ng/µL) 1µL
5×BP Clonase Clonase enzyme mix 1µL
25℃温浴16h左右,随后将BP反应液转化大肠杆菌感受态细胞。重组大肠杆菌需在含庆大霉素平板上生长。接着挑取单菌落以进行PCR验证,最后抽提质粒。
(3)LR重组反应
重组反应可在室温配制,0.5mL的离心管中进行。反应体系如下:
Components Sample
Entry clone(50-150ng) 3 µL
Destination vector(150 ng/µL) 1 µL
5×LR Clonase enzyme mix 1 µL
25℃温浴16h左右,然后将反应液转化大肠杆菌感受态细胞。转化完成的大肠杆菌液涂布在含有卡那霉素的平板上生长。接着挑取单菌落,进行PCR验证,然后送测序,测序结果与该基因cDNA序列比对以确认序列正确与否,最后提取质粒,即可转化农杆菌EHA105。
2. 农杆菌转化
根癌农杆菌(EHA105)感受态细胞的制备:
根癌农杆菌菌液于28℃培养至OD600=0.5时,4℃离心收集菌体,用500µL、0.1mol/L冰浴CaCl2重悬,冰浴30 min后离心,去上清,用100µL,0.1 mol/L冰CaC12重悬后,于4℃保存。
农杆菌转化(冻融法):
(1)向感受态农杆菌(100µL)中加入5µL植物表达载体质粒DNA,轻轻混匀,冰水浴30 min后,于液氮中速冻冷激2 min;
(2)取出,加入400~800µL YEP培养液(含卡那霉素,Kan);28℃,200 r/min振荡培养3-5 h;
(3)室温离心(5000 r/min,5min),保留100µL上清重悬菌体,涂布于LB固体培养基(含Kan)上,28℃倒置培养2 天直至长出合适大小的菌落。
(4)挑取单克隆进行PCR检测,得到阳性菌株。
3.愈伤诱导:种子用无菌水漂洗15-20min,再用75%的乙醇消毒1min,然后用1.5%有效浓度的次氯酸钠溶液振荡消毒20 min。最后再用无菌水冲洗5遍。将洗好的种子用吸水纸吸干接种在诱导愈伤培养基中,25℃暗培养2周。
愈伤诱导培养基:采用表1的诱导培养基,加入0.3 g脯氨酸、0.6 g水解酪蛋白酶、30 g蔗糖和2.5 mL 2,4-D (浓度1 mg/mL),配成1 L溶液,调pH至5.9,加入7 g琼脂粉,高温高压灭菌。
4. 继代培养:把胚性愈伤组织切下,接入继代培养基中,25℃暗培养2周。
继代培养基:采用表1的继代培养基,加入0.5 g脯氨酸、0.6 g水解酪蛋白酶、30 g蔗糖和2 mL2,4-D(浓度1 mg/mL),配成1 L溶液,调pH至5.9,加入7 g琼脂粉,高温高压灭菌。
5. 农杆菌浸染和愈伤组织共培养:培养农杆菌挑,取阳性单菌落,在1 mL含抗生素的农杆菌培养液中,28℃培养过夜;取以上培养物,加入50 mL含抗生素的农杆菌培养液中,28℃培养至OD600=0.6-1.0。将获得的农杆菌菌液离心,将收集到的菌体加入悬浮培养液中,震荡培养30 min至OD600=0.6-1.0。然后将愈伤组织放入含有农杆菌菌液的悬浮培养液中,振荡培养20 min左右。将愈伤组织在灭菌滤纸上晾干,转入共培养培养基中,25℃暗培养5 d。
悬浮培养液:采用表1的悬浮培养液,加入0.08 g水解酪蛋白酶、2 g蔗糖和0.2 mL 2,4-D(浓度1 mg/mL),配成100 mL溶液,调pH至5.4,分成两瓶(每瓶50 mL),高温高压灭菌。使用之前加入1 mL 50%的葡萄糖和100 μL AS(100 mM)。
共培养培养基:采用表1的共培养培养基,加入0.8 g水解酪蛋白酶、20 g蔗糖和3.0 mL 2,4-D (浓度1 mg/mL),配成1 L溶液,调pH至5.6,加入7 g琼脂粉,高温高压灭菌。使用之前加入20 mL 50%的葡萄糖和1 mL AS(100 mM)。
6.筛选培养:共培养3d后,选取好的愈伤组织,转入筛选培养基中,25℃暗培养2周,筛选两次。
筛选培养基:采用表2的筛选培养基,加入0.6 g水解酪蛋白酶、30 g蔗糖和2.5 mL 2,4-D (浓度1 mg/mL),配成1 L溶液,调pH至6.0,加入7 g琼脂粉,高温高压灭菌。使用之前加入1 mL Hn和1 mL Cn(100 ppm)。
7.分化培养:挑取胚性愈伤组织接入分化培养基,24℃,16 h/8 h光暗培养诱导分化芽(4-6周)。
分化培养基:采用表2的分化培养基,加入2.0 mg/L 6-BA、2.0 mg/L KT、0.2 mg/L NAA、0.2 mg/L IAA、1.0 g水解酪蛋白酶和30 g蔗糖,配成1 L溶液,调pH至6.0,加入7 g琼脂粉,高温高压灭菌。
8.生根培养:待芽长至2 cm左右时,将幼芽切下,插入生根培养基中,25℃左右,16 h/8 h光暗培养,诱导生根。
生根培养基:采用表2的生根培养基,加入30 g蔗糖,配成1L溶液,调pH值至5.8,加入7 g琼脂粉,高温高压灭菌。
9.转化植株培养:待根系发达后,打开试管口,加入无菌水炼苗2-3d后,将植株取出,用无菌水洗净附着的固体培养基,移入土壤中,刚开始遮荫避风,待植株健壮后进行常规田间或温室管理培养。
表1 基本培养基成分1
表2 基本培养基成分2
实施例 4
转基因水稻的苗期甘露醇、NaCl处理
将超量表达转基因家系种子去壳消毒,经过75%酒精处理1 min,1.5%NaClO处理20 min,无菌水清洗5次,在含有50mg/L潮霉素的1/2 MS培养基上发芽,野生型对照晚一天播于不含潮霉素的1/2 MS 培养基上。待发芽2~3天后挑选发芽好且长势一致的种子,分别转移到含有0,150 mmol/L甘露醇或150 mmol/L NaCl的1/2 MS培养基上,在光照培养室生长7~10天后观察表型,并测量植株的根长。处理过程中观察表型并拍照。
如图2所示,实验结果可以看出,无甘露醇处理的正常生长条件下,转基因植株与野生型植株根长没有明显的差异;在渗透胁迫后,3个转基因株系的根长与野生型植株的根长达极显著差异,3个转基因株系分别为8.56cm、9.66cm、9.45cm,而野生型植株为7.71cm。无NaCl处理的正常生长条件下,转基因植株与野生型植株根长没有明显的差异;在高盐胁迫后,3个转基因株系的根长与野生型植株的根长达显著或者极显著差异,3个转基因株系分别为7.76cm、8.73cm、8.18cm,而野生型植株为7.06cm。该结果表明超表达OsSCAMP13提高了水稻苗期对高渗胁迫以及高盐胁迫的抗性。
实施例 5
转基因水稻成株期干旱胁迫。
将转基因及野生型ZH11种子于30℃萌发48小时,发芽后,将其播种于PVC管中,每根管中播种1粒种子。保持正常水分使其生长,至幼穗分化期去除管中积水并不再补充,使其慢慢进入干旱胁迫。如图3所示,干旱胁迫20天左右,野生型ZH11叶片干枯卷叶并出现白穗,而转基因植株则能够正常生长。该结果表明超表达OsSCAMP13提高了水稻成柱期对干旱胁迫的抗性。
本发明的范围不受所述具体实施方案的限制,所述实施方案只作为阐明本发明各个方面的单个例子,本发明范围内还包括功能等同的方法和组分。实际上,除了本文所述的内容外,本领域技术人员参照上文的描述和附图可以容易的掌握对本发明的多种改进。所述改进也落入所附权利要求书的范围之内。
序列表
<110> 上海市农业生物基因中心
<120> OsSCAMP13基因及编码蛋白与抗逆性的应用及获取方法
<130> OsSCAMP13
<160> 3
<170> PatentIn version 3.3
<210> 1
<211> 4371
<212> DNA
<213> Oryza sativa
<400> 1
cgttggatcc ctcgtgctcc gcaatctcag ccgtccgttt ccccctatag tcccccttac 60
ctccccttct acagttctac gaagtacgat ccaaacacca gcggcgaagg cgacgaagac 120
gagggcaaaa acaccagaag gggaaaactt ttgctctccc ggcgatctcg agatctctca 180
agatggtaat cccccatcca atttctctct acttttcctc ggatttgcgc cgcactcccg 240
atcgatgtct tcgacgcggt taactgcgat ggatttgcgc gagatcggat cctatggtct 300
agaatttcga gtcgattagg cttttttttg ggtggtgttt tgcgttgggt gatttcagat 360
tggaagtaga acggggggac gaggattctg agaagaatct actggtcttt gtcgtactga 420
atgctctcga tttcctcctg ttttgatcgc gtctgtgtgg tttggtctgg tcaggtggtg 480
ctgcaaccag atccgtttct gagcgagttg acgagcatgt acgagcggag cacggagaag 540
ggatctgtct gggtcaccat gaagcgatgt gagtgcgcgc tttcatctgg caatctggtt 600
tgtgatttgg gtggctgaag aactgatgct tgagttgatg ggggttgttt gatatgtgca 660
gcatcgatga agtgccaggc aaggttgaag aagatggcgg cgaagggaga ggcagtggag 720
taccggtgcc tcgtccgtgc caccgatggc aagaagaaca tctgcaccgc ggtacagtga 780
ctgtcctatt gtcctttgct gtgctgattt tgaattatta ttttgcttat ggttgttagt 840
tttgtgcata atggttaccg attatctggt attcgatgct aattatgcca ccaggcggta 900
agtgaggaat gtgaatatga cattaggcgc ttttggtatt gcactaaaac ctctcggata 960
tgaaatttcg gtactgagcc agtttatttg gtattcaagt cagcaaggta tattgtttta 1020
agagatagat aaaagtatgg aactgtagaa gtgctgcaat aagtatgatc caaactgtga 1080
actgtatata tagtgaacat atattgtaga ttggtctatg tagaagatat acagtacgtt 1140
ggtttcttgc ttaagcttct cacaagcatc ctttcgcggt aacatgtgta ggcactcgtg 1200
aagcatgatc ataaacagcg aggtaccgta gaatcagatg cttactcata ggacatctta 1260
actcgcatcc tattgaagta gaatgtgtaa cataatcata agttggaaca gactatacta 1320
tcacatgctt agttgtagca tggtaaattg ataataaaca tgaatgaact ttgttcaata 1380
gacaaactag ccaagaaaac gtttagtgcc attcatggtg ttaatattgc atgtttgcct 1440
gccctacact accgcagtct cattttcatc ctatgctaag ataactctca agttggtgta 1500
gatattgagt atgaaactca tttgtgtgct cttgccaagt tttgattgca ttaagtagtg 1560
aggtttctca ttaattgcac catcttgcat tttctgaaag cgtcatcaag ttgtttgagc 1620
ttaaatttat atggtgaaag tattgtttct aatgataaga ctgtagtatc gatgggcatc 1680
cactggccac tttttcccat gtgattaatc tttaccacca aacagttggg tcgataatct 1740
ttttccacaa gagtaagaac gccatgataa gttcagagtc ccaagatcta tgttctgaac 1800
agtttatttt ctcctctacc ctatatgtgg tgaaaattca catggtgatg tgaggtattc 1860
catatgaagg ctaaaaagtt ggtgattata tctcccatgc tgttcatgta gatacagaat 1920
aatagctggt ttggaaccat gtgtgtccat atctatttgt ccctgctaaa ttacatttgt 1980
caaagctcgc ccaatggagc atttatttgc ccctgctatt gcaataatgc ctcctagggg 2040
tcgatagtgc aattacgagc tgaggtaaac tactatattt acttagatgt tagtgatact 2100
atgttttttt ccttcaatac tatttatagg acagtcattt gcaatacttt tttttttgta 2160
attttgatga aaactggata tctgagttga ctaattacat gttcgtagtt ttgatgaaat 2220
aatggatatt tgaactgatt aatgatggat ttattcatct ttctgaagcc ataaacatta 2280
gccatactta tttgagatgc gtaaattatt ctcctgtcac ttccttagct ttttgggcta 2340
cccaataagt ctaacttaaa aagctcgcca tgtctttcag ctctctgcaa aggagtacct 2400
gaagttccaa gcttcatatg ccacagttct taaagcccat atgcacgctt tgaagaagag 2460
ggagaggaaa gacaagaaga aggctgcaga ggttgagaag ataccagaga aggcaccgaa 2520
gaagcagaag aaagcaccgt cttcaaagaa atctgcaggg tccaagtcgt aagttactga 2580
aagaatttgc taagcccttt tttggccaca ggcctgagta agatgggtgt agtcaagaca 2640
ttatcctcca ttttactctt attcatgtct gcgagatgaa gcatgtgaat acctttatag 2700
agctgtgccg tcgacattag caatttttga agcagctttg gttgtctaga tgtaagccgc 2760
cctggaattt tctatttcta tcatagaaag gcatctctta aactgtgcct gatctgatcg 2820
tcaagttagt gcaactttca attgacagaa ttacgtctgg aacatgaagt tatgcaacta 2880
agactgcaga aggaaattgc agaactgtta tctggatgtc tgtgttcctt caattttgtt 2940
tttctggttg gggagaaaaa gtgtgaaggt atgtctgtgt cacgattccc acatgcaagt 3000
ggtgatcaga atataagcag attccatgtt taggttggtg cataagcaaa cggcgtacta 3060
ctatgggcct atttggtaga gcttcaactc tggattttag ctctaggagt tgggtctgga 3120
gtggagttgt agagctgcct gaacctagct ctatctctga gattttcacc cttctatttt 3180
aagtggagct gaggtgccaa acaggcccta tctctcagca attgctgcat caacatggag 3240
cattggaggg ccgtatgccc gtatcctgtg tatgggcaca gcattgtcgg ttcctagcta 3300
tttgttctgc catcccccgg tcccaactga ttctcgtatc ggtccagaca agtccaaaag 3360
ctccaagctc cagtttttac accatttcgt ttttctttaa cacggttaga atttataaac 3420
catatcatgt ggtggtattt ttgtccagag attcacctca gaagtggcga atttttatcg 3480
taccaattgc agagacgaat ctttgctgag taggaggcag caaccactat gagcagccgt 3540
caccatccaa ccggacaaaa tccatcaaaa aataacccaa agaaatcaaa acaaaagcga 3600
gcacccaccg atgatcactc actgatctct catcaccaaa cgcctccgac ctcgctcgcg 3660
tcgcgcgccg cgcacccatc cccccggcct cgccaccacc cactcccgat cgcccccgtc 3720
gccacccacc ccctcagaaa tctcatcttt tccgcctcct ctcgccaacc aaacccgcga 3780
aacccccaca aacgacggtg gtgaaagaag atgagagggc tactcgcgtg cgccacgctc 3840
gcccgccgcg ccgccggcgc gacgtcgacg gcgcggcggc acctggcggg cgcggccgag 3900
gcggcggagg cggagctgaa gaagacggcg ctgtacgact tccacgtcgc gcacggcggg 3960
aagatggtgc cgttcgccgg gtggagcatg cccatccagt acaaggacac catcatggac 4020
tccaccctca actgccgcgc caacggcagc ctcttcgacg tctcccacat gtgcggcctc 4080
agcctccacg gccgccaggc catccccttc ctcgagtccc tcgtcgtcgc cgacgtcgcg 4140
gcgctcaagg acggcaccgg gacgctcacc gtcttcacca acgaccgcgg cggcgccatc 4200
gacgactccg tcgttaccaa ggtcaccgac cagcacatct acctcgtcgt caacgccggg 4260
tgcagggaca aggatctcgc ccacattggg gagcacatgg aggccttcaa caagaagggc 4320
ggcgacgtca agtggcacgt ccacgatgag cgctcgcttc ttgcattgca g 4371
<210> 2
<211> 822
<212> DNA
<213> Oryza sativa
<400> 2
atgcatcacg accccaaccc gttcgacgag ggcaacgccg acgacaaccc cttctccaat 60
gggggaggtg gtggtggcgg cggcggcagc aggcagcagt acgggttccg ccccacggag 120
cccgccggct tcggcgccgg caggggggac gccaccgtcg atgtcccgct cgacaccatg 180
ggcgactcca agagcaaggc aagggagctc tcatcgtggg aaacagatct gaagcggcgg 240
gaggcggata tcaaaaggag ggaggaagcg ctgaggaatg ctggagtgcc aatggaggat 300
aagaactggc caccattctt cccgatcatt caccatgaca ttgccaatga gataccggct 360
aatttgcaga aattgcagta tctcgcgttc gcaagctggc ttggtatcgt gctttgcctc 420
tcatggaact tcatcgctgt catagtctgt tggatcaagg agggagattc gaagctgttt 480
ttccttgcca ctatctatgc cttgcttgga attcccctct cgtacttgat atggtatagg 540
cctctctacc gtgctatgag gactaacagt gcgttcagtt ttggatggtt ctttctctgt 600
tacttgatcc acattggctt ttgcattatt gctgccattg ccccgccaat tgtgtttcat 660
ggaaaatcat taacgggcat actggctgcc atagacacct tttctgagca tgtgataatt 720
gggatctttt actttgtggg gttcgcgctg ttttgcttgg agacactgct gagcattgga 780
gttcttcaga gagtgtacat gtacttcaga gggaacaagt ga 822
<210> 3
<211> 273
<212> PRT
<213> Oryza sativa
<400> 3
Met His His Asp Pro Asn Pro Phe Asp Glu Gly Asn Ala Asp Asp Asn
1 5 10 15
Pro Phe Ser Asn Gly Gly Gly Gly Gly Gly Gly Gly Gly Ser Arg Gln
20 25 30
Gln Tyr Gly Phe Arg Pro Thr Glu Pro Ala Gly Phe Gly Ala Gly Arg
35 40 45
Gly Asp Ala Thr Val Asp Val Pro Leu Asp Thr Met Gly Asp Ser Lys
50 55 60
Ser Lys Ala Arg Glu Leu Ser Ser Trp Glu Thr Asp Leu Lys Arg Arg
65 70 75 80
Glu Ala Asp Ile Lys Arg Arg Glu Glu Ala Leu Arg Asn Ala Gly Val
85 90 95
Pro Met Glu Asp Lys Asn Trp Pro Pro Phe Phe Pro Ile Ile His His
100 105 110
Asp Ile Ala Asn Glu Ile Pro Ala Asn Leu Gln Lys Leu Gln Tyr Leu
115 120 125
Ala Phe Ala Ser Trp Leu Gly Ile Val Leu Cys Leu Ser Trp Asn Phe
130 135 140
Ile Ala Val Ile Val Cys Trp Ile Lys Glu Gly Asp Ser Lys Leu Phe
145 150 155 160
Phe Leu Ala Thr Ile Tyr Ala Leu Leu Gly Ile Pro Leu Ser Tyr Leu
165 170 175
Ile Trp Tyr Arg Pro Leu Tyr Arg Ala Met Arg Thr Asn Ser Ala Phe
180 185 190
Ser Phe Gly Trp Phe Phe Leu Cys Tyr Leu Ile His Ile Gly Phe Cys
195 200 205
Ile Ile Ala Ala Ile Ala Pro Pro Ile Val Phe His Gly Lys Ser Leu
210 215 220
Thr Gly Ile Leu Ala Ala Ile Asp Thr Phe Ser Glu His Val Ile Ile
225 230 235 240
Gly Ile Phe Tyr Phe Val Gly Phe Ala Leu Phe Cys Leu Glu Thr Leu
245 250 255
Leu Ser Ile Gly Val Leu Gln Arg Val Tyr Met Tyr Phe Arg Gly Asn
260 265 270
Lys
- 还没有人留言评论。精彩留言会获得点赞!
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺
- 植物抗病毒相关蛋白GmSN1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺