一种造纸用甾醇脂酶的基因、表达载体、菌株及其应用的制作方法
本发明属于生物工程领域,具体涉及一种能够高效表达造纸用甾醇脂酶的基因、表达载体、菌株及其应用。
背景技术:
造纸工业是支撑我国国民经济的重要产业之一,但是资源匮乏、能源短缺和污染严重等问题正制约造纸工业的发展,扩大废纸利用正是解决这些问题的有效途径。但是废纸因其成分复杂,含有大量的细小组分和阴离子杂质,在这些杂质中尤其是胶黏物很难除去,一方面胶黏物的存在会增加纸张上的孔洞、尘埃点,降低纸张质量;另一方面,其在成形网、压榨部以及干燥部沉积易引起断纸,导致滤水性能变差,纸机的车速减低,因而胶黏物的处理也是废纸制浆中的重大课题。
在废纸制浆中,胶黏物的来源比较复杂,主要有以下几个来源:(1)天然树脂。在废纸浆中主要是一些残余脱墨剂;(2)热融物。一部分来源于用于封装纸箱、纸袋和书本杂质的胶黏剂,另一部分来源于某些具有特殊用途纸品中的防水、防油剂,如蜡和蜡质化合物;(3)压敏胶黏剂。来源于各种包装用标签和自封袋;(4)涂布粘合剂。来源于加工纸生产过程中所使用的各种涂布黏合剂;(5)施胶剂。来源于各种施胶纸;(6)油墨联接料和残余油墨;(7)无机填料和细小纤维。
目前,去除和控制浆料中胶黏物的方法主要有机械法和化学法。筛选、净化、洗涤、热分散和浮选等物理机械法能去除大部分原生胶黏物。而化学法主要是通过化学吸附、改性、分散、固定、表面钝化等作用来达到控制胶黏物的目的。随着生物技术的发展,具有高效性、专一性、对环境无污染性等优点的生物酶在制浆造纸领域中得到了越来越广泛的应用。生物酶控制纸浆中胶黏物也成为一个新的研究方向。大多数胶黏物都含有大量能将胶黏物的基本结构组分连接在一起的酯键,酯类酶能催化酯键断裂,把胶黏物分解成较小的基本组分。而且酯键一旦断裂,胶黏物的基本组分就很难在系统中重新聚合。
巴克曼实验室化工(上海)有限公司创造了用于解决二次纤维中胶黏物问题的最新技术—生物酶Optimyze。该酯类酶制剂能使胶黏物中的酯键断裂,不仅将大胶黏物分解为微小胶黏物,而且使胶黏物的基本组分失去或降低黏性,使微小胶黏物很难在系统中重新聚合,从根本上解决了利用二次纤维的造纸过程由于胶黏物而引起的一系列问题。
采用生物酶法是近年来处理废纸浆胶黏物研究的热点。油墨中一般含有天然或合成的树脂成分,使颜料和纸页结合。因此可以利用酯类酶来部分水解油墨中所含有的树脂或粘结剂,碎解油墨,使其与纤维分离。处理过程中主要是以分解油墨与纤维表面的连接料的方式释放出油墨粒子,对纤维强度和纸浆得率的影响较小,同时对去除废纸浆中其他黏性物质也有一定的效果。
技术实现要素:
为了克服现有技术的缺点与不足,本发明的目的在于提供一种能够高效表达造纸用甾醇脂酶的基因。该基因能够编码耐高温、耐碱、高效稳定的甾醇脂酶。
本发明的另一目的在于提供一种表达载体。
本发明的另一目的在于提供一种生产菌株。
本发明的另一目的在于提供一种重组甾醇脂酶。
本发明的再一目的在于提供上述重组甾醇脂酶的应用。
本发明的目的通过下述技术方案实现:
一种能够高效表达造纸用甾醇脂酶的基因,所述的甾醇脂酶CHE的核苷酸编码序列如SEQ ID NO:1所示。
M.Nishimura等在1994年首次克隆了淡紫链霉菌(Streptomyces lavendulae H646-SY2)的甾醇脂酶(CHE)基因,Hongyu Xiang等在2006年将其在大肠杆菌中成功表达并研究了其主要的酶学性质,发现该甾醇脂酶具有耐热性、耐弱碱性,可能具有应用于造纸工业的理想特性。但此后并没有看到关于该酶应用于生产的报道。其原因可能在于,其一,在原始菌株的表达量低;其二,尽管Gashaw Mamo等将其基因在大肠杆菌中表达,但表达的酶活相对较低,分泌的酶活不足0.05U/mL,该酶不能完全分泌,有部分分布在在胞内及周质空间而且表达量不高,因而限制了其作为造纸工业用酶制剂的进一步开发。
本发明采用密码子优化、基因全合成等方法,实现对CHE(淡紫链霉菌的甾醇脂酶)基因的分子改造和人工组建,得到一种能够高效表达甾醇脂酶的基因。发明人根据美国国立生物技术信息中心(NCBI,http://www.ncbi.nlm.nih.gov/)上公布的CHE基因序列,对序列进行优化,替换成毕赤酵母偏好的密码子,再将优化后的基因序列用DNAWORKS软件(http://mcl1.ncifcrf.gov/lukowski.html),设计全基因合成的引物,设计了2条引物来合成CHE基因序列,得到的甾醇脂酶基因的核苷酸编码序列如SEQ ID NO:1所示。
本发明提供一种携带上述CHE基因的表达载体;
所述的表达载体是适用于毕赤酵母中表达的载体。
所述的表达载体是将上述CHE基因插入至pPICZαA中。
所述的表达载体是将上述CHE基因插入至pPICZαA中EcoRI和NotI酶切位点之间;命名为pPICZαA-CHE。
通过在商用毕赤酵母分泌表达载体pPICZαA中连入CHE基因,构成重组质粒pPICZαA-CHE。
表达载体pPICZαA-CHE可以通过以下技术措施实现:
采用第一个发明目的所述方法全基因合成CHE时,在上游和下游已分别引入了限制性内切酶EcoRI和NotI酶切位点。因此将全基因PCR产物和毕赤酵母分泌表达载体pPICZαA质粒(invitrogen)都用EcoRI和NotI双酶切,体外连接构建重组质粒pPICZαA-CHE,得到重组表达载体pPICZαA-CHE。
本发明又提供一种含有上述CHE基因的毕赤酵母菌株;
所述的毕赤酵母菌株含有上述表达载体之一所述的表达载体。
毕赤酵母是甲醇营养型酵母中的一类酵母菌,可以利用甲醇作为唯一碳源和能源。作为真核表达系统,具有许多其它蛋白表达系统所不具备的优点:具有强有力的乙醇氧化酶(AOX1)基因启动子,可严格调控外源蛋白的表达;酵母生长繁殖速度快、营养要求低、培养基廉价;外源基因能通过质粒整合到巴斯德毕赤酵母基因组上,外源基因不会发生随生长繁殖而丢失;表达量高,许多蛋白可达到每升克级以上;同时,毕赤酵母自身分泌的蛋白(背景蛋白)非常少,有利于纯化。
毕赤酵母基因工程菌株Pichia Pastoris X33/pPICZαA-CHE可以通过以下技术措施实现:以LiCl法将Sac I线性化的重组质粒pPICZαA-CHE转化毕赤巴斯德酵母宿主菌Pichia Pastoris X33,转化物涂布于MD平板,培养2~3天。将MD平板上的转化子分别接种于含不同浓度的Zeocin(博莱霉素)抗性YPD平板上,培养3~5天。将高浓度Zeocin-YPD平板上出现的转化子挑取其对应的单克隆,按Invitrogen操作指南提取酵母基因组DNA作为模板,进行酵母基因组PCR鉴定,获得重组转化子。
在超净工作台内挑取经重组毕赤酵母菌落PCR鉴定为阳性的转化子接种至25mL BMGY液体培养基中(250mL锥形瓶装液量为25mL),30℃、250rpm振荡培养至OD600=2~6,同时接种重组毕赤酵母X33/pPICZαA作为阴性对照;收集部分培养液在室温8000rpm离心2min;转移菌体至25mL BMMY培养基中(250mL锥形瓶装液量为25mL),控制起始OD600=1,30℃、250rpm震荡培养,每24h取样分析菌体生长情况及产酶情况,并补加1%甲醇至培养基以持续诱导菌体产酶,发酵120~140h后结束,发酵液中甾醇脂酶酶活为0.4U/mL左右。
一种重组甾醇脂酶,是将上述毕赤酵母菌株进行发酵得到。所述的重组甾醇脂酶的酶活为0.4U/mL。
所述的基因、表达载体、毕赤酵母菌株、重组甾醇脂酶在废纸脱墨中的应用。
本发明相对于现有技术,具有如下的优点及效果:
本发明提供的甾醇脂酶基因利用密码子优化、大肠杆菌表达、毕赤酵母表达等技术实现在毕赤酵母中的高表达;表达的甾醇脂酶具有耐高温、耐弱碱性质;本发明所述的甾醇脂酶可应用于废纸脱墨,通过水解废纸表面和纸张之间的胶黏物来去除油墨粒子,可以保证再生纸质量的稳定与纸机的运行效率。
附图说明
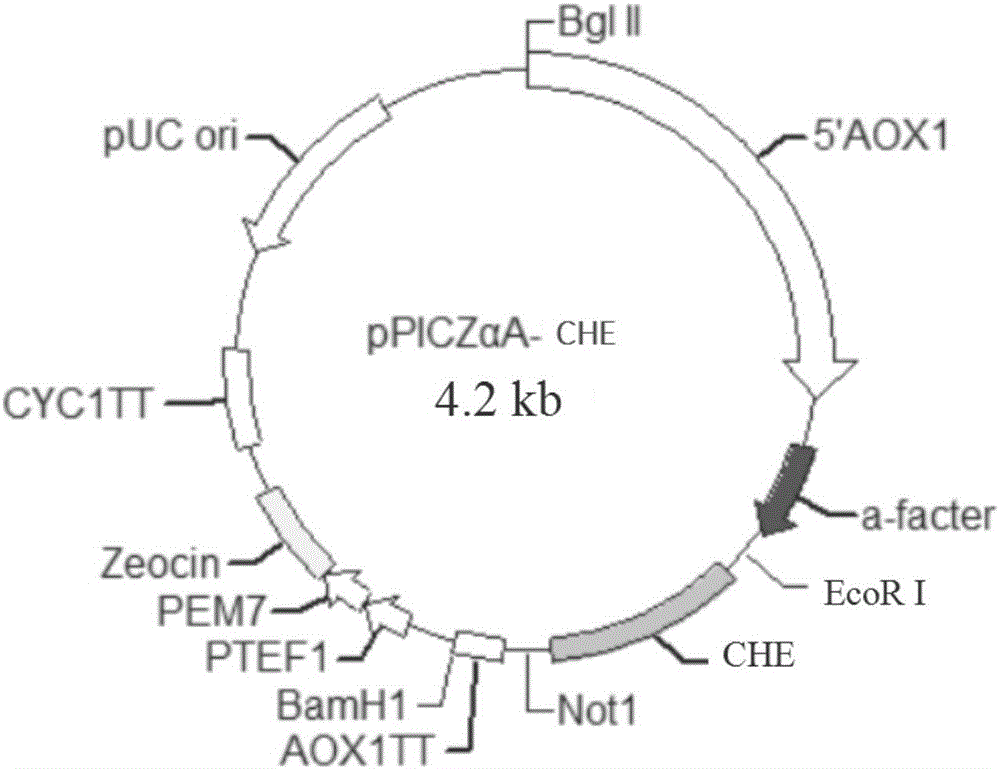
图1是构建pPICZαA-CHE载体示意图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
本发明的具体实验方法可以参照分子克隆实验指南(第三版,冷泉港出版社出版)以及Pichia Fermentation Process Guidelines(Invitrogen)。
以下实施例中除特别说明外,均为本领域内的常规实验方法和操作步骤。
实施例1合成甾醇脂酶基因(CHE)
淡紫链霉菌(S.lavendulae H646-SY2)的甾醇脂酶(CHE)基因序列及蛋白结构信息来源于美国国立生物技术信息中心(NCBI,http://www.ncbi.nlm.nih.gov/)和蛋白数据库(PDB,http://www.rcsb.org/pdb/search/advSearch.do)。
根据NCBI上公布的CHE基因序列,对序列进行优化,全部替换成毕赤酵母偏好的密码子,再将优化后的基因序列用DNAWORKS软件(http://mcl1.ncifcrf.gov/lukowski.html),设计全基因合成的引物,设计了2条引物,其中2条引物分别引入了EcoRI和NotI酶切位点以及酶切保护碱基,引物序列为:
CHE-F:5′-CCGGAATTCATGTCCTCCCAAGTT-3′;(横线部分为EcoRI酶切位点)
CHE-R:5′-ATAAGAATGCGGCCGCTTAATGG-3′;(横线部分为NotI酶切位点)
在25μL发应体系中进行PCR扩增,反应条件为:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸10min,共30个循环;第30个循环72℃延伸10min,PCR产物用凝胶电泳鉴定后存于-20℃备用。
实施例2制备含CHE基因的质粒
将实施例1得到的PCR产物电泳,切胶回收约700bp处的目的条带,回收产物经EcoRI和NotI双酶切处理,与同样经EcoRI和NotI双酶切、胶回收的表达载体pPICZαA用T4DNA连接酶连接。10μL体积反应体系如下:pPICZαA 1μL(50ng),加入全合成基因产物6μL,含ATP的10×Buffer 1μL,T4DNA连接酶1μL,用ddH2O补足至10μL。稍加离心,16℃水浴连接过夜,并转化E.coli Top10(invitrogen)中,在含有Zeocin(博莱霉素,25μg/mL)的LB平板上筛选阳性转化子。随机挑取一定量的转化子,小量制备质粒,经限制性内切酶EcoRI和NotI双酶切处理后,进行电泳分析。成功连接目的基因的质粒经酶切后,预计可得到700bp,和3.5kb两个片段,质粒酶切鉴定正确。将重组质粒测序,证实甾醇脂酶CHE基因编码框完全正确。将重组质粒命名为pPICZαA-CHE重组质粒。pPICZαA-CHE载体的构建示意图如图1所示。
实施例3甾醇脂酶CHE在毕赤酵母中的高效表达
通过LiCl法将经SacⅠ酶线性化完全的实施例2的pPICZαA-CHE转化Pichia pastoris X33(invitrogen)。转化物涂布MD平板,30℃培养2天。将MD平板上的转化子分别接种于含Zeocin 100μg/mL,200μg/mL,300μg/mL,400μg/mL,500μg/mL的YPD平板上,30℃培养3天。将较高浓度Zeocin-YPD平板上出现的转化子挑取单克隆。按Invitrogen操作指南提取酵母基因组DNA作为模板,利用目的基因序列的PCR引物进行酵母基因组PCR鉴定,总反应体积为20μL,Taq酶量为2U,取2μL PCR产物进行0.8%琼脂糖凝胶电泳鉴定。
PCR扩增产物经1%的琼脂糖凝胶电泳检测发现,扩增出预期大小为700bp的目的条带。
在超净工作台内挑取经重组毕赤酵母菌落PCR鉴定为阳性的转化子接种至25mL BMGY液体培养基中(250mL锥形瓶装液量为25mL),30℃、250rpm振荡培养至OD600=2~6,同时接种重组毕赤酵母X33/pPICZαA作为阴性对照;收集部分培养液在室温8000rpm离心2min;转移菌体至25mL BMMY培养基中(250mL锥形瓶装液量为25mL),控制起始OD600=1,30℃、250rpm震荡培养,每24h取样分析菌体生长情况及产酶情况,并补加1%甲醇至培养基以持续诱导菌体产酶,发酵120~140h后结束,发酵液中甾醇脂酶酶活为0.4U/mL左右。
酶活的测定原理:甾醇脂酶在一定温度与pH条件下,水解对硝基苯酚辛酸酯底物,然后高速离心,终止酶反应,并使未水解的对硝基苯酚丁酸酯沉降,反应液对紫外光有吸收,可用酶标仪测定405nm波长下的吸光值,再根据标准曲线计算酶活力。
酶活的测定方法:
(1)配制对硝基苯酚丁酸酯底物反应液:0.523g对硝基苯酚丁酸酯,0.25mL Trion X-100,100mL超纯水。高速均浆乳化5min。以每管1mL的量分装到2mL EP管中。-20℃避光保存。
(2)取900μL的磷酸缓冲液于2mL EP管中,加入50μL发酵上清液。50℃,800rpm保持5min。
(3)加入50μL底物反应液,5℃,800rpm反应15min。以灭活上清液为对照。
(4)反应结束后立即进行10000rpm,1min离心终止反应。
(5)取200μL反应液于酶标板中,每个样品设置3个平行样,用酶标仪测OD600。
酶活力的定义为:在50℃、pH8.0的条件下,每分钟分解底物产生1μmol对硝基苯酚为一个酶活单位。
实施例4CHE甾醇脂酶的酶学性质
本实施例采用的CHE甾醇脂酶为实施例3的发酵后上清液。
1、CHE甾醇脂酶的最适pH值和最适温度
分别取900μL pH 8.0的缓冲液加入1.5mL离心管中,加入纯化后的发酵上清液50μL后30℃、35℃、40℃、45℃、50℃、55℃、60℃预热5min,加入50μL底物p-NPC(对硝基苯酚辛酸酯)反应5min,使用多功能酶标仪测量相对酶活。在pH8.0下,最适作用温度为50℃。在45℃~55℃范围内,酶活均能维持在75%以上的,即使pH9.0条件,温度为60℃时,相对酶活仍保持在60%以上。
分别取900μL pH 6.0~pH 11.0的缓冲液加入1.5mL离心管中,加入纯化后的发酵上清液50μL后50℃预热5min,加入50μL底物p-NPC(对硝基苯酚辛酸酯)反应5min,使用多功能酶标仪测量相对酶活。CHE甾醇脂酶最适作用pH值为8.0,pH7.0~9.0范围内相对酶活维持在70%以上;当pH<5.0或>10.0后,CHE甾醇脂酶的酶活降到30%以下。
2、CHE甾醇脂酶的耐热性及耐碱性
为了考察该重组酶的温度稳定性,将纯化后的脂肪酶分别在30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃水浴中保温1小时后,在pH 9.0,温度50℃条件下测量剩余的酶活力。CHE甾醇脂酶在45℃、50℃及55℃保温1h后,甾醇脂酶活性都可以维持在80%以上;50℃及45℃时、CHE半衰期为6h以上(6h时,活力仍保留60%),55℃条件下,CHE半衰期长达2.5h(3h时,酶活力保持在40%)。
CHE甾醇脂酶分别在pH5.0~pH11.0的缓冲液中50℃处理12h后,然后在最适温度50℃和最适pH8.0条件下测定相对酶活变化。经上述处理后,相对酶活均能维持50%以上,而pH7.0~pH9.0时,相对酶活为最大酶活80%以上,CHE甾醇脂酶适合在弱碱性条件下作用。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 华南理工大学
<120> 一种造纸用甾醇脂酶的基因、表达载体、菌株及其应用
<130> 1
<160> 3
<170> PatentIn version 3.5
<210> 1
<211> 684
<212> DNA
<213> Artificial Sequence
<220>
<223> 甾醇脂酶CHE的核苷酸编码序列
<400> 1
atgtcctccc aagttcgggg aggtactaga tggaagagat ttgctttggt tatggttcct 60
tctattgctg ctactgctgc tgttggagtt ggtttggctc aaggggcttt ggctgcttcc 120
ttttccgtta gtggtcaaga ttttaaggtt tccgctgata agttggatgg agataacttg 180
attcaatacg gaggtattgc tgaaggtcat gatttgaagg gaaacgctca acatcatcca 240
gttactattt caggtttttc tcatgctgaa attactaata tgtgtcaatc cttggttact 300
ccaactccat tgggtaacat tactttgcaa ttgagaactg gtcataaggg aaagccagct 360
gttgctgata acatctactt ggatgttgct gaattggata ctgatgctga gtttaagaac 420
ttggatattg gtgttgctgt tggagaccct aaccataaga ctaagccaca agctggaact 480
gttgcttctc catacgcttt ttcacaacgt gctcatcaag ataaggctta cttgattttg 540
actaacgtta gacaaaaggc ttgggctact actagggctc attttcaaaa gggaactttt 600
aagttgccag atttgaagtt gagattgttg ggtggagatc aaagacattt tgatcaacca 660
tgttaccaag atattaagga ttaa 684
<210> 2
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> CHE-F
<400> 2
ccggaattca tgtcctccca agtt 24
<210> 3
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> CHE-R
<400> 3
ataagaatgc ggccgcttaa tgg 23
- 还没有人留言评论。精彩留言会获得点赞!