由辅助寡核苷酸物质对核酸杂交探针的化学计量调节的制作方法
相关申请的交叉引用
本申请要求2015年4月16日提交的美国临时专利申请第62/148,555号的优先权,其通过引用全文纳入本文。
政府权益的声明
本发明是在政府支持下由国立卫生研究院授予的基金号r00eb015331资助完成的。政府对本发明拥有某些权利。
序列表
本申请包含以ascii格式电子提交的序列表,并通过引用全文纳入本文。2016年4月8日创建的所述ascii拷贝命名为15-21010-wo_(260947.00262)_sl.txt,大小为2,437字节。
背景技术:
核酸编码大量的生物和临床信息,并且下一代测序(ngs)是改善对生物学理解和对医疗决定提供信息的具有前景的一类方法。标准ngs平台(illumina和iontorrent)在单次运行中提供了大约1000万个长至250个核苷酸(nt)子序列的“读数”,总计大约2千兆碱基的信息。
为了从有限的ngs读数中获得最大的有用信息,研究人员和诊断开发人员采用方法来针对生物样品富集感兴趣核酸序列。例如,来自白细胞的dna和来自红细胞的rna几乎不含临床上有用的信息,而稀有的循环肿瘤细胞(ctc)、外显子组中的无细胞dna(cfdna)、或导致浓度血症的细菌可提供指导临床行动的信息。或者,在活检边缘样品中,研究人员或临床人员希望富集特定基因(或外显子组)的序列。当前,这类“靶向”测序代表了现有ngs使用的主导性的大部分。
本发明描述了通过调整辅助寡核苷酸相对于探针和靶标的相对浓度来控制核酸探针的杂交产率的方法。辅助寡核苷酸与探针或靶标部分或完全互补,并且在探针与靶标杂交之后释放。
期望序列的富集可以多种形式出现,从简单样品制备方案(例如,离心),到用于基于形态捕获特定细胞的设备,到选择性捕获特定核酸序列的试剂盒。在本发明中,富集将特定指代最后一类:分子技术,其与不同核酸序列差异性相互作用以产生具有较高分数的期望序列组的富集的样品。
有两种分子富集的通用方法:杂交-捕获和多重化pcr。杂交-捕获采用沃森-克里克杂交的特异性来使用互补“探针”分子“捕获”靶核酸序列;样品中的非关联序列不被捕获并通过洗涤过程去除。多重化pcr采用大量的引物来通过pcr同时扩增所有感兴趣序列(一般仅8-10个循环);样品中的非关联序列不被扩增。当前,两种方法都具有明显的错误和偏差:多重化pcr是因为聚合酶本质上偏好某些序列并具有有限的保真度,并且杂交-捕获是因为杂交探针设计是不完美的并导致非特异性相互作用以及捕获产率的偏差。本发明解决了杂交-捕获分子富集技术中的偏差。
核酸探针/引物的亲和性(灵敏度)和选择性(特异度)是负相关的性质;一个度量的改进通常导致另一个度量的恶化。核酸探针的不同应用对灵敏度和特异度有不同的要求。例如,ngs靶富集测定需要dna的高特异性捕获(例如,illuminanextera,agilentsureselect和idtxgen);在耗竭测定中,需要高产率(灵敏度)(例如,nebnugen)。另外,高度多重化的应用需要不同靶标的一致产率以最小化偏差。
探针设计的当前实践通常基于生物信息学软件预测的热力学性质。然而,由于不完善的生物物理学模型和文献参数,仍然出现高达3kcal/mol的反应能量不准确性,尤其是在多重化环境中。操作条件和探针序列的经验性调整通常用于补偿探针设计中的不准确性;但这些方法昂贵且耗时,并且往往缺乏精确性。
技术实现要素:
本公开提供了使用竞争性辅助核酸物质化学计量地调节杂交探针的方法。这些方法大致分为其中辅助物质与靶标(阻断剂)互补的设计以及其中辅助物质与探针(保护剂)互补的设计。两种实施方式都提供对杂交产率的实时调整,提供比探针序列调整更具可预测性和精确性的控制,并允许针对多重化测定和复杂靶序列的迭代调整。
在一个实施方式中,提供了一种提供用于以期望产率选择性捕获或富集带靶核酸序列的核酸分子的核酸探针的方法,所述方法包括使含有带靶核酸序列的核酸分子的第一样品与包含核酸探针的测试溶液在有利于靶核酸序列与核酸探针杂交的温度和缓冲条件下接触。核酸探针包括第一核酸分子和第二核酸分子。第一和第二核酸分子分别以第一浓度和第二浓度存在于核酸探针中,并且第二浓度大于第一浓度。第一核酸序列包括分别与核酸分子的第一靶子序列和第二靶子序列互补的第一探针子序列和第二探针子序列。第二核酸序列包括与至少第一探针子序列的子序列互补的第三探针子序列。然后该方法包括确定实验产率的步骤,所述实验产率是与第一核酸分子杂交的靶核酸序列的比例。一旦确定了实验产率,根据等式1确定第二核酸分子的第三浓度[p]’0,其中[p]0是第二浓度,χ1是实验产率,χ2是期望产率,其是与第一核酸分子杂交的靶核酸序列的期望比例。一旦确定了第三浓度,该方法进一步包括提供使用第三浓度的第二核酸分子来制备核酸探针的指令或以第三浓度的第二核酸分子制备核酸探针。
在另一个实施方式中,提供了一种提供用于以期望产率选择性捕获或富集带靶核酸序列的核酸分子的核酸探针的方法,所述方法包括使含有带靶核酸序列的核酸分子的第一样品与包含核酸探针的测试溶液在有利于靶核酸序列与核酸探针杂交的温度和缓冲条件下接触。核酸探针包括第一核酸分子和第二核酸分子。第一和第二核酸分子分别以第一浓度和第二浓度存在于核酸探针中。第一核酸序列包括分别与核酸分子的第一靶亚序列和第二靶亚序列互补的第一探针亚序列和第二探针亚序列。第一靶子序列包含靶核酸序列的至少一部分。第二核酸序列包括与第一靶子序列互补的第三探针子序列。第二核酸分子不含有与第二靶子序列互补的子序列。然后该方法包括确定实验产量的步骤,实验产量是与第一核酸分子杂交的靶核酸序列的比例。一旦确定了实验产率,根据等式2确定第二核酸分子的第三浓度[b]’0,其中[b]0是第二浓度,χ1是实验产率,χ2是期望产率,其是与第一核酸分子杂交的靶核酸序列的期望比例。一旦确定了第三浓度,该方法进一步包括提供使用第三浓度的第二核酸分子来制备核酸探针的指令或以第三浓度的第二核酸分子制备核酸探针。
在又一个实施方式中,提供了用于选择性捕获或富集带靶核酸序列的核酸分子的核酸探针组合物。核酸探针组合物分别包含第一浓度和第二浓度的第一核酸分子和第二核酸分子。第一核酸分子包括与核酸分子的第一靶子序列互补的第一探针子序列和与核酸分子的第二靶子序列互补的第二探针子序列。第一靶子序列包含靶核酸序列的至少一部分。第二核酸分子包括第三探针子序列和第四探针子序列。第三探测子序列与第一靶子序列或包含在第一靶子序列内的子序列互补。第四探针子序列与第三靶子序列互补,第三靶子序列与第一和第二靶子序列分开,但在第一或第二靶子序列的30个核苷酸之内。
附图说明
图1a描绘了保护物(pc)实施的示例性实施方式。第一核酸分子被称为c,并且可以被功能化以允许捕获或检测。产率计算为与c结合的靶标t的分数。c包括第二区域(表示为“2”),第一区域(表示为“1”),和第四区域(表示为“4”)。第二核酸分子被称为保护物p,其包含第五区域(表示为“5”)和第三区域(表示为“3”)。这里,第三区域与第一区域互补,且第五区域与第四区域互补。p在pc与靶标t杂交后释放。p的浓度高于c,并且通过初始p浓度调节产率。
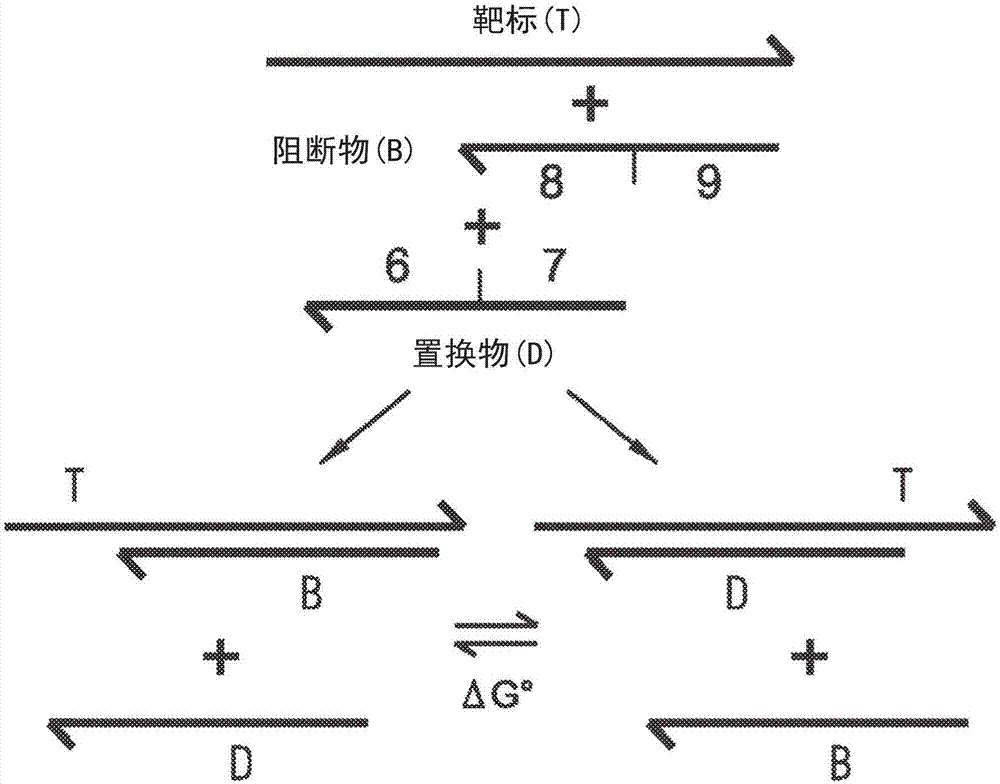
图1b描绘了阻断物(pc)实践的示例性实施方式。第一核酸分子被称为d,并且可以被功能化以允许捕获或检测。产率计算为与d结合的靶标的分数。d包括第二区域(表示为“7”)和第一区域(表示为“6”)。第二核酸分子被称为阻断物b,其包含第四区域(表示为“9”)和第三区域(表示为“8”)。这里,第三区域与第二区域的序列相同。当b和d添加到含有t的样品中时,t由于其比d更高的浓度而更可能与b初始杂交;然后tb与d杂交释放b。产率通过初始b浓度进行调整。
图2a描绘了t,p,c(分别为seqidno1-3)的核酸序列和用于保护物实施的实验证明的预期反应。图1a中显示了p和c上子序列的排列。c在3′末端由tamra荧光团修饰,并且p在5′末端由iowa
图2b描述了化学计量调节的实验结果。每个数据点显示在特定的[p]0/[pc]0值(n=3)处的平均观察到的荧光和对应的产率,误差线显示±1的标准偏差。黑色s形曲线显示基于最佳拟合反应的预测(分析)产率δg°=-2.15kcal/mol。插图显示以100.02(4.7%)间隔的[p]0/[pc]0的六组实验的放大。所有实验一式三份,在25℃下,1×pbs,[pc]0=100pm,和[t]0=200pm。
图3a描绘了与x探针的靶反应。31个不同的探针被设计成针对31个dna靶标,其g/c含量范围从0%到100%。
图3b描绘了在[p]0/[c]0=3(调节前),1轮调节后(1轮调节),和2轮调节后(2轮调节)用相应靶标对具有100%和0%gc含量的示例性序列和探针(按出现顺序分别为seqidno:4-5)的观察到的产率的捕获一致性的化学计量调节。无论gc含量如何,我们都能将产率分布从57.3%和13.4%之间收紧至37.2%和24.0%之间。所有实验均在37℃下在含0.1%吐温20的5xpbs中的5倍过量的人基因组dna(100ng)中一式三份进行。
图4a描绘了两种snp变体之间的结合产率的差异,这些差异是由它们各自与探针的杂交的δg°所产生的。
图4b描绘了理论图表,显示相同的δg°值基于[p]0/[pc]0值产生不同的产率差异。
图4c描绘了在[p]0/[pc]0=1(seqidno:6)处观察到的预期靶标(条形的顶部边缘)和11个单核苷酸变体(条形的底部边缘)的产率。所有实验一式三份,在37℃下,1×pbs,[pc]0=100nm,且[t]0=200nm。
图4d描绘化学计量调节后的产率(seqidno:6)。每个snp对使用不同的[p]0/[pc]0,范围从3.74到29.5。在化学计量调节中,产率差异范围从17.2-83.3%改善为47.0-88.6%。
图5a描绘了bd实施的示例性的证明的方案,其包括t,b,d的核酸序列(分别为seqidno7-9)和预期的反应。图1b中显示了b和d上子序列的排列。t在3′末端由tamra荧光团修饰,并且d在5′末端由iowa
图5b描绘了根据图5a中的方案的化学计量调节的实验结果。每个数据点显示在特定的[b]0/[d]0值处观察到的荧光和相应的产率。黑色s形曲线显示基于最佳拟合反应的预测(分析)产率δg°=-1.79kcal/mol。所有实验一式三份,在25℃下,1×pbs,且[d]0=200pm。
图6a描绘了pc实施方式的变体结构,其中p包含2个寡核苷酸,所述寡核苷酸通过另外的区域结合在一起。
图6b描绘了被称为x探针结构的pc实施方式的变体结构。p和c都包含2个寡核苷酸。
图6c描述了bd实施方式的变体结构,其中d包含2个预杂交的寡核苷酸。
图6d描绘了bd实施方式的变体结构,其中b包含在b与靶标杂交时释放的额外的互补链。
图7a描述了pc实施的预平衡化学计量调节的不同反应时间的模拟产率。反应pc+t<->tc+p的ode模拟表明,可以通过类似于平衡产率的化学计量来调节预平衡产率。在预平衡条件下,最大可得产率小于1。假定[pc]0=100pm,[t]0=10fm,kf=3×106s-1m-1,δg°=-2kcal/mol,并且τ=25℃。
图7b描绘了作为t·kf·[pc]0的函数的最大信号%,以建立预平衡化学计量调节的标准。当t·kf·[pc]0变小时,最大信号百分比的变化对化学计量变得较不敏感。标准t·kf·[pc]0>1表示可以使用平衡法来实现化学计量调节。
图7c描绘1/χ与[p]0的线性拟合。满足t·kf·[pc]0>1的反应时间长度表现出高线性(r2>0.999)。
图8a描绘bd实施的预平衡化学计量调节的模拟,显示在不同反应时间下的模拟产率。
图8b描绘1/χ与[b]0的线性拟合。图8a和8b显示了与图7a和7c类似的结果。假定[d]0=100pm,[t]0=10fm,kf=3×106s-1m-1,δg°=-2kcal/mol,并且τ=25℃。
发明详述
保护物实施:
保护物实施包括探针核酸分子(表示为c)和辅助核酸分子(表示为保护物或p),该探针核酸分子包含与靶标的相邻子序列互补的第一和第二子序列,该辅助核酸分子包含与第一子序列互补的第三子序列;p具有比c更高的初始浓度。在一些实施方式中,c还包含与靶序列不互补的第四子序列,并且p还包含与第四子序列互补的第五子序列。在一些实施方式中,c和p各自是寡核苷酸,并且c和p的混合物被称为粘性末端(toehold)探针;图la中显示了该实施方式的示例。可在wo2015/094429a1中找到关于粘性末端探针的更多信息,其通过引用全文纳入本文。
如本文所用,术语“子序列”是指至少5个连续碱基对的序列。
p和c相对于靶序列t的序列设计是这样的,t和p分子在数量上的优势在与c杂交时是相互排斥的,在任何给定的时间点只有低浓度的三分子中间体物质tpc。另外,c被设计为稳定地结合p和t,当p和t的浓度总和超过c时,在任何给定时间点只有低浓度的游离c存在。当满足这些假设时,系统可以简单地由以下化学反应表示:
其中[tc]t是指时间t处tc的浓度,[pc]0和[t]0分别是指pc和t的初始浓度。本公开内容提供了调节该反应以在平衡时或平衡之前的特定时间达到期望产率的方法。具体而言,p([p]0)的初始浓度对平衡和预平衡产率均具有实质性影响,因此,对于充分合理设计的p和c序列,可以连续调节捕获产率到基本上0.01%和99.9之间%。以下描述了几种确定[p]0的值的方法,其在平衡时导致期望产率。
(1)基于预测的反应标准自由能δg°以计算机模拟方式测定[p]0。反应标准自由能可以基于文献参数或使用生物信息学软件来计算,并且已经在wo2015/094429a1中详细描述。
对于[pc]0>[t]0的应用,达到平衡产率χ期望的过量[p]0的值可以通过以下分析计算:
这里,r代表气体常数,τ代表开尔文温度。
如果初始浓度进一步满足[p]0>[t]0,则上式可近似为:
当[t]0>[pc]0时,[p]0的精确计算是:
如果初始浓度进一步满足[p]0>[pc]0,则上式可近似为:
这些[p]0浓度将在理想系统中产生期望产率。实际上,由于预测的δg°中的误差,探针合成误差,靶标定量误差以及多重化设置中的不可预测的探针或靶标相互作用,产率可能与预期/期望显著不同。因此,迭代调节对于获得期望产率可能是必需的或期望的。
(2)基于实验观察到的产率-[p]0对,推断期望产率的[p]0。与基于序列的计算机模拟预测相比,将[p]0浓度与产率配对的实验数据提供了更精确的δg°校准。假设在初始p浓度[p]0时获得产率χ1,并且期望产率为χ2,则可以从第一次实验的结果计算第二次调节([p]0’)的初始p浓度。
当[pc]0>[t]0时,[p]0’的精确计算是:
并且当[t]0>[pc]0时,[p]0’计算为:
如果初始浓度满足[pc]0>[t]0和[p]0>[t]0,或[t]0>[pc]0和[p]0>[pc]0,上述2个等式都可以近似为等式1:
(3)基于实验观察到的信号-[p]0对,推断期望产率的[p]0。在某些情况下,对应于100%产率的最大信号难以确定,因此产率无法准确计算。如果初始浓度满足[pc]0>[t]0和[p]0>[t]0,或[t]0>[pc]0和[p]0>[pc]0,则用于化学计量调节的推荐方法是用不同的[p]0(保持其他浓度和条件不变)进行至少2次实验,获得相应的减去背景的信号强度(is),并按照下式进行线性拟合:
其中k和b分别表示斜率和截距。通过这种线性拟合可以推出实现特定is的[p]0。请注意,由于背景扣除可能不准确,所以此方法在更高产率(χ>10%)下更准确。
已经进行使用粘性末端探针进行保护物实现化学计量调节的概念验证。在c的3′末端处用tamra荧光团对粘性末端探针进行功能化,并且在p的5′末端处用iowablackrq淬灭剂进行功能化。p和c预杂交并形成暗探针。当靶标与暗探针杂交时,p发生位移,并且荧光信号增加(图2a)。保持[pc]0和[t]0不变,我们观察到具有不同[p]0的探针的荧光,导致不同的产率(图2b)。使靶标与探针混合物反应12-24小时,然后测量荧光。根据我们的动力学知识,在实验条件下4小时内达到平衡。实验结果与我们的分析预测一致。
在另一个实施方式中,p和c可以是包含2个或更多个通过沃森-克里克杂交反应形成的寡核苷酸的复合物。在图3a中显示了示例性的这种pc实施,称为x-探针。我们设计了31种不同的靶序列,gc含量在0%和100%之间均匀变化。设计相应的x-探针以实现δg°=0kcal/mol,相当于约50%的产率。在实验中,我们观察到[p]0/[c]0=3(图3b,调节之前),产率在57.3%和13.4%之间变化,对应于预测的δg°的误差。通过改变p和c的浓度比进行两轮化学计量调节后,我们能够将产率分布收紧至37.2%和24.0%之间(图3b,2轮调节)。所有的实验在5倍过量的基因组dna(100ng)中进行。
pc实施的另一个示例性应用是snp鉴别。许多snp检测方法基于snp变体与特异性靶向一种变体[ref]的探针的差异产率。由于与单核苷酸错配相关的小的热力学变化(δδg°),snp探针例示了平衡产率和选择性的挑战(图4a)。基于简单的反应分析,当以下发生时,达到最大产率差(δχ)
[p]0≈e-(δg°+δδg°/2)/rτ·[t]0
此时,初始浓度满足[t]0>[pc]0和[p]0>[pc]0(图4b)。由于δδg°值根据序列在+1到+6kcal/mol之间变化,所以不同的snp对针对最佳鉴别需要不同的[p]0。图4c显示了当与其dna靶标和11个snp反应时,由粘性末端探针产生的荧光信号。基于这些结果,我们计算了粘性末端探针与预期靶标和每个snp的δg°,从中我们以数字方式计算每个snp对的δδg°。由此,我们计算了每个单个snp期望的[p]0,并且对于每个snp对的化学计量调节的探针的实验结果如图4d所示。产率差异的范围从17.2-83.3%改善至47.0-88.6%。
阻断物实施:
第二实施,或阻断物实施,包括探针核酸分子(表示为d)和辅助核酸分子(表示为阻断物或b),该探针核酸分子包含与靶标的相邻子序列互补的第一和第二子序列,该辅助核酸分子包含与第二子序列同源但不与第一子序列同源的第三子序列;b具有比d更高的初始浓度。在一些实施方式中,b还包含与靶序列互补且不与第一或第二子序列同源的第四子序列。在一些实施方式中,b和d各自是寡核苷酸;图1b中显示了该实施方式的一个例子。
b和d相对于靶序列t的序列设计是这样的,b和d分子在数量上的优势在与t杂交时是相互排斥的,在任何给定的时间点只有低浓度的三分子中间体物质tbd。另外,b和d都被设计为稳定地结合t,当b和d的浓度总和超过t时,在任何给定时间点只有低浓度的游离t存在。当满足这些假设时,系统可以简单地由以下化学反应表示:
(1)基于预测的反应标准自由能δg°以计算机模拟测定[b]0。达到特定产率χ期望的b的初始浓度([b]0)可由反应
当初始浓度进一步满足[b]0>2[t]0时,则上式可近似为:
(2)基于实验观察到的产率-[b]0对,推断期望产率的[b]0。如果初始b浓度[b]0产生产率χ1,则实现产率χ2期望的初始b浓度([b]0’)为:
如果[b]0>2[t]0,上面的等式可以近似为等式2:
(3)基于实验观察到的信号-[b]0对,推断期望产率的[b]0。在某些情况下,对应于100%产率的最大信号难以确定,因此产率无法准确计算。如果[b]0>2[t]0,[b]0和信号强度is近似满足:
因此,可以对获得的实验数据(至少2个不同的[b]0)应用线性拟合,并且可以从线性拟合推断出用于实现期望is的[b]0。
为了验证阻断物实施,我们使用了在3′末端处用tamra功能化的靶标,以及在5′末端处用iowablackrq功能化的置换物。t和d杂交导致荧光信号减弱,所以最大信号表示0%产率,并且背景信号表示100%产率(图5a)。我们观察到不同[b]0处的荧光,[d]0和[t]0保持不变(图5b)。t,b和d混合在一起并孵育12-24小时,然后测量荧光。实验结果与分析预测一致。请注意,化学计量调节不需要靶被功能化;这种具体修饰只是为了演示的目的。
在以上所示的典型实施方式中,探针(c或d)和辅助物质(p或b)都是单链的。在其他实施方式中,这些分子中的任何一个均可以包含另外的预杂交的寡核苷酸,以便于附着化学修饰,捕获或控制动力学/热力学。
在图6a和c中,分子中的一个是部分双链的,并且该分子中的两个寡核苷酸通过与靶标不同源的区域杂交。图6b显示了典型的x-探针结构,其中p和c都包含2个寡核苷酸,使得荧光团修饰链和淬灭剂修饰链的序列与靶序列分开。图6d显示了一种特殊情况,其中b还包含当b与靶标杂交时解离的互补寡核苷酸;这可以用于高度结构化的序列以改善反应动力学。
预平衡化学计量调节;
在一些测定条件下,由于较长的温育时间,试剂不稳定性或样品降解,不能实现平衡。我们进行了ode模拟,并显示化学计量调节也可以在预平衡条件下实现期望产率的子集。
对于保护物实施,ode模拟是基于以下反应:
并且模拟结果如图7a-7c所示。假定[pc]0>>[t]0和[p]0>>[t]0,特定反应时间(χt)的产率可近似计算为:
其中χ∞表示平衡产率,kf表示正向反应速率常数,并且t表示反应时间。在预平衡条件下,可达到的最大产率低于100%,并且其可近似计算为:
可从上述等式中推出标准kf·t·[pc]0<χ∞表示预平衡条件“抵抗”化学计量调节,即产率在[p]0变化时几乎保持恒定。为了确保化学计量调节是适用的,需要反应时间t和[pc]0满足kf·t·[pc]0>1(图7b)。在这种情况下,可类似于平衡调节方法(3)来计算化学计量调节:可从线性拟合中推出实现特定背景扣除信号强度is期望的[p]0(图7c):
需要至少2个数据点(2个不同的[p]0和相应的is或χt)来获得k和b值。
对于阻断物实施,ode模拟是基于以下反应:
并且图8a-8c所示的结果表明一些预平衡条件可以使用类似于平衡调节方法的线性拟合来调节。
在预平衡条件和高度多重化设置下,化学计量调节可能更困难。寡核苷酸链置换和杂交反应的动力学并不像它们的热力学那样被充分掌握,因此kf的预测仍然不够准确。平衡或预平衡的高度多重化设置可包括导致产率变化的意想不到的相互作用。在这些情况下,推荐基于先前观察到的产率或信号进行迭代调节。计算方法(2)和(3)可以应用于迭代调节。
除非另有明确说明,否则本文件中的“互补”是指“部分或完全互补”。如果各自的核苷酸可同时互相形成几个沃森-克里克碱基对,则一个核酸分子与另一个核酸分子互补。在这种情况下,互补可意指完全和/或部分互补,并可包含错配的碱基对。在一些方面,本公开内容供于核酸分子子序列之间的微小序列差异。例如,在pc实施中,第一核酸分子的第一探针子序列和第一核酸分子的第二探针子序列可分别与第一靶子序列和第二靶子序列互补。然而,在第一和第二靶子序列与第一和第二探针子序列之间可能分别存在错配,同时仍保持互补性。图4c描绘了这种互补性的示例,尽管存在错配。因此,就探针可以与靶形成几个沃森-克里克(watson-crick)碱基对而言,所得到的探针与本文所述的探针构建的原理保持一致。
在一个实施方案中,提供了一种提供用于以期望的产率选择性捕获或富集带靶核酸序列的核酸分子的核酸探针的方法,所述方法包括使含有带靶核酸序列的核酸分子的第一样品与包含核酸探针的测试溶液在有利于靶核酸序列与核酸探针杂交的温度和缓冲条件下接触。核酸探针包括第一核酸分子和第二核酸分子。第一和第二核酸分子分别以第一浓度和第二浓度存在于核酸探针中,并且第二浓度大于第一浓度。第一核酸序列包括分别与核酸分子的第一靶亚序列和第二靶亚序列互补的第一探针亚序列和第二探针亚序列。第二核酸序列包括与至少第一探针子序列的子序列互补的第三探针子序列。然后该方法包括确定实验产量的步骤,实验产量是与第一核酸分子杂交的靶核酸序列的比例。一旦确定了实验产率,根据等式1确定第二核酸分子的第三浓度[p]’0,其中[p]0是第二浓度,χ1是实验产率,χ2是期望产率,其是与第一核酸分子杂交的靶核酸序列的期望比例。一旦确定了第三浓度,该方法进一步包括提供使用第三浓度的第二核酸分子来制备核酸探针的指令或以第三浓度的第二核酸分子制备核酸探针。
在前述实施方式的某些方面,第一核酸还可包括第四探针子序列,其不与靶核酸序列互补,也不与靶核酸序列的30个核苷酸之内的核酸分子上的任何序列互补,并且第二核酸分子还可包括与第四探针子序列至少80%互补的第五探针子序列。在前述实施方式的某些方面中,核酸探针中的第二浓度可以在第一浓度的1.1至10,000倍之间。
在另一个实施方案中,提供了一种提供用于以期望的产率选择性捕获或富集带靶核酸序列的核酸分子的核酸探针的方法,所述方法包括使含有带靶核酸序列的核酸分子的第一样品与包含核酸探针的测试溶液在有利于靶核酸序列与核酸探针杂交的温度和缓冲条件下接触。核酸探针包括第一核酸分子和第二核酸分子。第一和第二核酸分子分别以第一浓度和第二浓度存在于核酸探针中。第一核酸序列包括分别与核酸分子的第一靶亚序列和第二靶亚序列互补的第一探针亚序列和第二探针亚序列。第一靶子序列包含靶核酸序列的至少一部分。第二核酸序列包括与第一靶子序列互补的第三探针子序列。第二核酸分子不含有与第二靶子序列互补的子序列。然后该方法包括确定实验产量的步骤,实验产量是与第一核酸分子杂交的靶核酸序列的比例。一旦确定了实验产率,根据等式2确定第二核酸分子的第三浓度[b]’0,其中[b]0是第二浓度,χ1是实验产率,χ2是期望产率,其是与第一核酸分子杂交的靶核酸序列的期望比例。一旦确定了第三浓度,该方法进一步包括提供使用第三浓度的第二核酸分子来制备核酸探针的指令或以第三浓度的第二核酸分子制备核酸探针。
在前述实施方式的某些方面,第二核酸还可包括与核酸分子的第三靶子序列互补的第四探针子序列,其中第三靶子序列与第一和第二靶子序列分开,并且在第一或第二靶子序列的30个核苷酸之内。在前述实施方式的某些方面中,核酸探针中的第二浓度可以在第一浓度的0.001至1,000倍之间。
在某些方面,前述实施方式的核酸探针的第一核酸分子可以包含(例如但不限于)dna寡核苷酸,脱氧尿嘧啶,rna核苷酸或光裂解接头部分。在前述实施方式的一些方面中,第一核酸分子是dna寡核苷酸。在前述实施方式的某些方面中,核酸探针的第二核酸分子是dna寡核苷酸。
在前述实施方式的一些情况下,核酸探针的第一核酸分子还可包含能够与结合伴侣相互作用的功能部分。在这种情况下,确定实验产率的步骤可以通过由功能部分和结合伴侣的相互作用捕获第一核酸分子来进行。
在一些实施方式中,前述方法可以进一步包括,在确定实验产率之前,通过固相分离捕获与第一核酸分子杂交的核酸分子。在一些实施方式中,前述方法可以进一步包括,在确定实验产率之前,通过固相分离捕获后选择性降解第一核酸分子。在一些情况下,第一核酸的选择性降解可以通过核酸酶进行。在一些方面中,第一核酸分子可包含光裂解接头部分。在一些情况下,在第一核酸分子包含光裂解接头部分的情况下,第一核酸的选择性降解是通过足以裂解光裂解接头部分的波长的光照射进行。
在前述实施方式的一些方面中,以期望产率选择性捕获或富集带靶核酸序列的核酸分子的方法包括使含有带靶核酸序列的核酸分子的样品与任何前述实施方式的核酸探针接触。
在又一个实施方案中,提供了用于选择性捕获或富集带靶核酸序列的核酸分子的核酸探针组合物。核酸探针组合物分别包含第一浓度和第二浓度的第一核酸分子和第二核酸分子。第一核酸分子包括与核酸分子的第一靶子序列互补的第一探针子序列和与核酸分子的第二靶子序列互补的第二探针子序列。第一靶子序列包含靶核酸序列的至少一部分。第二核酸分子包括第三探针子序列和第四探针子序列。第三探测子序列与第一靶子序列或包含在第一靶子序列内的子序列互补。第四探针子序列与第三靶子序列互补,第三靶子序列与第一和第二靶子序列分开,但在第一或第二靶子序列的30个核苷酸之内。
在前述实施方式中,第一核酸分子还可包含能够与结合伴侣相互作用的功能部分。在一些方面,第二浓度在第一浓度的0.001和1,000倍之间。第一和/或第二核酸分子可以是dna寡核苷酸。第一核酸分子还可以包括脱氧尿嘧啶,rna核苷酸或光裂解接头部分。
- 还没有人留言评论。精彩留言会获得点赞!