GPR55受体活性选择性调节剂:苯并吡喃吡唑衍生物的制作方法
本发明涉及药学领域。具体地,本发明涉及由7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑和7-甲氧基-4,4-二甲基-2,4-二氢苯并吡喃[4,3-c]吡唑衍生的哌嗪,其在制备药物中的用途,该药物用于治疗和/或预防与gpr55受体有关的失调的用途以及所述化合物用于与gpr55相关的药理学测定的用途。
背景技术:
gpr55受体在1999年被克隆并首次鉴定。它是g蛋白偶联的跨膜受体。尽管它与cb1和cb2大麻素受体仅有14%的同源性,但它被提出是内源性大麻素系统的新成员。事实上,据发现,大麻素受体配体能够激活gpr55受体(glaxosmithklinewo0186305;astrazenecawo2004074844)。目前围绕着gpr55的药理学存在争议。今天,gpr55仍被认为是孤儿受体。然而,已报道内源性溶血磷脂酰肌醇(lpi)衍生物在过表达hgpr55的hek293细胞中的erk1/2磷酸化测定中刺激gpr55受体。迄今为止,gpr55受体特异性激动剂和/或拮抗剂非常少。一些苯甲酰哌嗪衍生物被鉴定为gpr55激动剂,其对cb1和cb2大麻素受体不产生作用。在hgpr55-u2os细胞中使用β-抑制蛋白测定的高筛选药理学评估,鉴定了gpr55激动剂和选择性gpr55拮抗剂的几个家族,其后进行了分子建模研究。
已显示gpr55受体参与炎症性疼痛、神经性疼痛、代谢性疾病、骨发育和肿瘤细胞增殖的过程。因此,gpr55被认为是治疗gpr55相关疾病如糖尿病、帕金森病、多发性硬化症、神经性疼痛、骨质疏松症、胆管癌、乳腺癌、卵巢和前列腺癌、成胶质细胞瘤和皮肤癌的生物靶标。
本发明要求保护的化合物是基于苯并吡喃吡唑的结构。wo2010109050描述了苯并吡喃吡唑类化合物作为具有镇痛活性的大麻素。最近,在wo2014013117和p201430372中将苯并吡喃吡唑类描述为与大麻素活性有关的抗肿瘤药物。
技术实现要素:
本发明公开了可用作用于验证gpr55受体的药理学工具和用作与gpr55相关的治疗剂的新化合物。本发明的新型化合物作用于gpr55受体。因此,它们可用于治疗gpr55受体相关的疾病和失调,如糖尿病、帕金森病、多发性硬化症、神经性疼痛、骨质疏松症、胆管癌、乳腺癌、卵巢癌和前列腺癌、成胶质细胞瘤和皮肤癌。
本发明的发明人已经发现,式(i)化合物选择性地作用于孤儿受体gpr55,因此可用于调节gpr55参与的过程。
本发明的一个方面涉及一种化合物,如通式(i)所示:
或其互变异构体、其药学上可接受的盐或其溶剂化物;其中:
·r1选自任选取代的芳基或-c(o)r3基团;r3选自芳基、杂环基、c1-c6烷基、c3-c6环烷基或-(ch2)n-o-芳基,其中n是选自1、2、3或4的值。
·r2为选自c1-c6亚烷基或-r4-c(o)-nh-r5-基,r4和r5为相同或不同的c1-c6亚烷基。
本发明的另一个方面涉及一种通式(ii)的化合物:
或其互变异构体、其药学上可接受的盐或溶剂化物;其中r1和r2如上所定义。
本发明的另一个方面涉及一种通式(iii)的化合物:
或其互变异构体、其药学上可接受的盐或溶剂化物;其中r1和r2如上所定义。
在一个优选的实施例中,r1是-c(o)r3基团,其中r3是任何上述可能的基团,尽管r3优选为芳基并且更优选为苯基。
在另一个优选的实施例中,r3是杂环基,更优选地r3选自呋喃基、噻吩基或四氢呋喃基。
在另一个优选的实施例中,r3是环己基。
在另一个优选的实施例中,r3是c1-c4烷基。
在另一个优选的实施方案中,r2是c1-c4亚烷基,更优选地为亚乙基。
根据一个优选的实施例中,式(i)的化合物选自下列:
-1-(2-(4-(2-呋喃甲酰基)哌嗪基)乙基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-2-(2-(4-呋喃甲酰基哌嗪基)乙基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-1-(2-(4-苯甲酰基哌嗪基)乙基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-2-(2-(4-苯甲酰基哌嗪基)乙基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-1-(2-(4-(2-噻吩甲酰基)哌嗪基)乙基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-2-(2-(4-(2-噻吩甲酰基)哌嗪基)乙基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-2-(2-(4-苯氧基乙酰基哌嗪基)乙基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-2-(2-(4-(2-四氢呋喃基)哌嗪基)乙基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-2-(2-(4-环己基羰基-哌嗪基)乙基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-2-(2-(4-新戊酰基哌嗪基)乙基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑。
在另一个优选的实施例中,r1是任选取代的苯基。在更优选的实施中,r1为被c1-c4烷基或c1-c4烷氧基取代的苯基,更优选为被甲基或甲氧基所取代。
在另一个优选的实施例中,r2是-r4-c(o)-nh-r5-基团,r4和r5是相同或不同的c1-c4亚烷基。在更优选的实施例中,r4和r5是亚甲基。
根据一个优选的实施例中,式(ii)的化合物选自下列:
-1-(2-(4-苯基哌嗪基)乙酰氨基甲基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-2-(2-(4-苯基哌嗪基)乙酰氨基甲基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-1-(2-(4-(2-甲氧苯基)哌嗪基)乙酰氨基甲基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-2-(2-(4-(2-甲氧苯基)哌嗪基)乙酰氨基甲基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-1-(2-(4-(2,3-二甲基苯基)哌嗪基)乙酰氨基甲基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-2-(2-(4-(2,3-二甲基苯基)哌嗪基)乙酰氨基甲基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑;
-1-(2-(4-(4-甲氧基苯基)哌嗪基)乙酰氨基甲基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑。
术语“烷基”在本发明中是指具有1至6个碳原子的饱和或不饱和的脂族链、直链、环化链或支链。例如但不限于,烷基可以是甲基、乙基、环己烷等。烷基可以被一个或多个取代基如卤素、羟基或羧酸任选取代。
在本发明中,术语“芳基”是指具有5至18个键的单个或多个芳族环,其中一个质子从环中去除。芳基例如但不限于苯基、萘基、二苯基、茚基、菲基或蒽基。芳基优选具有5至7个碳原子,更优选地,芳基为苯基。芳基自由基可以被一个或多个取代基任选取代,如(c1-c6)烷基、烷氧基、卤素、羟基或羧酸取代,更优选地,芳基被一个或两个甲氧基取代。
在本发明中,术语“环烷基”是指环状烃链自由基,优选具有3至6个碳原子,更优选6个,其为饱和或部分饱和并且仅由碳和氢原子组成,例如,环丙基、环戊基或环己基,并且其可被一个或多个基团如烷基、卤素、羟基、胺、酰胺、氰基等任选取代。
术语“杂环基”在本发明中是指含有1至4个选自氮、氧和硫的杂原子的环状结构。其结构可以是芳族的或氢化的。优选地,杂环基可以选自噻吩基、呋喃基、四氢呋喃基、吡啶基、咪唑基、吡唑基、吗啉基,但不限于此。杂环自由基可以被一个或多个取代基如(c1-c6)烷基、烷氧基、卤素、羟基或羧酸任选取代。
除非另有说明,本发明的化合物还涉及包括差异仅存在于一个或多个同位素富集的原子的化合物。例如,具有本发明结构,差异仅在于用氘或氚取代氢、或用13c或14c富集的碳取代碳、或富含15n的氮的化合物,都在本发明的范围内。
如本申请所用,术语“互变异构体”或“互变异构形式”是指可通过低能量障碍相互转换的不同能量的结构异构体。例如,质子互变异构体(也称为质子转移互变异构体)包括质子迁移(例如酮-烯醇或亚胺-烯胺异构化)引起的相互转换。价键互变异构体包括通过一些结合电子重排而相互转换。
术语“药学上可接受的盐或溶剂化物”是指任何药学上可接受的盐、酯、溶剂化物或任何其它化合物,其在给予接受者时能够(直接或间接)提供如本申请所述的化合物。然而,可以理解,药学上不可接受的盐也在本发明的范围内,因为它们可用于制备药学上可接受的盐。盐和衍生物的制备可以通过本领域已知的方法进行。
例如,本申请提供的化合物的药学上可接受的盐,由含有碱性部分或酸的原始化合物通过常规化学方法合成。通常,这些盐例如通过使化合物的酸或游离碱形式与化学计量的适当碱或酸在水或有机溶剂或两者的混合物中反应来制备。通常,非水介质如乙醚、乙酸乙酯、乙醇、异丙醇或乙腈是优选的。酸加成盐的实例包括:无机酸加成盐,例如盐酸盐、氢溴酸盐、氢碘酸盐、硫酸盐、硝酸盐、磷酸盐;和有机酸加成盐,例如乙酸盐、马来酸盐、富马酸盐、柠檬酸盐、草酸盐、琥珀酸盐、酒石酸盐、苹果酸盐、扁桃酸盐、甲磺酸盐和对甲苯磺酸盐。碱加成盐的实例包括:无机盐,如钠、钾、钙、铵、镁、铝和锂盐;以及有机碱的盐,例如乙二胺、乙醇胺、n,n-二甲基乙醇胺、三乙醇胺、葡糖胺和碱性氨基酸的盐。
特别优选的衍生物,是对患者给药时,能提高本发明化合物的生物利用度(例如通过使口服给药的化合物更容易地被吸收到血液中)的化合物,或能增强原始化合物相对于其原始种类在生物区室(例如脑或淋巴系统)内的释放的化合物。
式(i)、(ii)或(iii)的化合物可以作为游离化合物呈结晶形式,或作为溶剂化物的形式,并且这两种形式都在本发明的范围内。溶剂化的方法在本领域中通常是已知的。合适的溶剂化物是药学上可接受的溶剂化物。在一个特定的实施例中,所述溶剂化物是水合物。
式(i)、式(ii)和式(iii)的化合物或其盐或溶剂化物,优选为药学上可接受的形式或基本上是纯的。药学上可接受的形式尤其意指除正常药物添加剂如稀释剂和载体之外,其具有药学上可接受的纯度水平,并且不含在正常剂量水平下被认为有毒的物质。活性成分的纯度优选高于50%,更优选高于70%,更优选高于90%。在一个优选的实施例中,其高于式(i)化合物或其盐的95%。
上面定义的式(i)、式(ii)和式(iii)化合物可以通过本领域已知的合成反应的组合获得,例如描述于文章pressjb,j.heterocyclicchem.,1985,22,561-564。
另一方面,本发明涉及式(i)、式(ii)或式(iii)化合物在制备药物中的用途。
另一方面,本发明涉及式(i)、式(ii)或式(iii)化合物在制备用于治疗和/或预防与gpr55受体有关的失调的药物的用途。
根据优选的实施例,与gpr55受体有关的失调选自糖尿病、帕金森病、多发性硬化症、神经性疼痛、骨质疏松症、胆管癌、乳腺癌、卵巢癌和前列腺癌、成胶质细胞瘤和皮肤癌。
另一方面,本发明涉及用于治疗和/或预防与大麻素受体相关失调的式(i)或式(ii)或式(iii)化合物。
本发明中使用的术语“失调”是指存在临床实践中可识别的行为或一组症状,其在大多数情况下伴随有不适或对个人习惯性活动的干扰。
因此,式(i)、式(ii)或式(iii)的化合物,其药学上可接受的盐或溶剂化物可用于预防和/或治疗需要调节gpr55受体的失调。含有治疗有效量的式(i)或式(ii)化合物的药物组合物,其药学上可接受的盐或溶剂化物以及药学上可接受的赋形剂,构成本发明的又一方面。
对于式(i)、式(ii)或式(iii)化合物及其药学上可接受的盐或溶剂化物,其有效治疗的给药量,以及所述化合物用于治疗疾病状态的所述化合物的剂量,取决于许多因素,包括年龄、患者状况、疾病严重程度、给药途径和频率、使用的调节剂化合物等等。
另一方面,本发明还涉及用于对患者给药的药物组合物,其包含至少一种本发明化合物或其互变异构体、其药学上可接受的盐、其溶剂化物或其药物前体,以及药学上可接受的载体或载体、赋形剂或载体。
在一个优选实施例中,所述药物组合物进一步包括另外的活性成分。
所述药物组合物的一些实例是为口服给药、鼻腔给药、局部给药或胃肠外给药而制备的固体(片剂、丸剂、胶囊、颗粒状固体等)或液体(溶液、悬浮液或乳剂)。
在本发明的一个优选实施例中,所述药物组合物适于以固体或液体形式口服给药。可能的口服给药形式是片剂、胶囊剂、糖浆剂或溶液、并且可以含有制药领域已知的赋形剂、其作为粘合剂(例如糖浆、阿拉伯胶、明胶、山梨醇、黄蓍胶或聚乙烯吡咯烷酮)、填充剂(例如乳糖、糖、玉米淀粉、磷酸钙、山梨糖醇或甘氨酸)、崩解剂(例如淀粉、聚乙烯吡咯烷酮或微晶纤维素)或药学上可接受的表面活性剂如月桂基硫酸钠。
用于口服的组合物可以通过植物药学的常规方法以混合物和分散体的形式制备。片剂可以按照制药工业中已知的方法进行包衣。
所述药物组合物可以使用合适的剂量用作肠胃外给药,如作为本发明产品的无菌溶液、混悬液或冻干物。可以使用合适的赋形剂,例如ph缓冲剂或表面活性剂。
本发明的化合物或组合物的给药可以通过任何合适的方法来完成,例如静脉内输注和口服、腹膜内或静脉内途径。出于患者的方便性和待治疗疾病的慢性性质,口服给药是优选的。
本发明化合物的给药量取决于所选化合物的相对功效、待治疗疾病的严重程度和患者的体重。然而,本发明的化合物的给药为每天给药一次或多次,例如每日1、2、3或4次,总剂量为0.1-1000mg/kg/天。需要注意的是,剂量变化可能是必要的,取决于患者的年龄和状况、以及给药途径的变化。
本发明的化合物和组合物可以单独使用,或与其他药物组合使用以提供组合疗法。其他药物可以形成同一组合物的一部分,或提供为在相同时间或不同时间给药的单独组合物。
由于用本申请定义的所述化合物治疗的病理类型,组合治疗可能是特别有意义的,这些病理是特别复杂的,因为患者通常表现出症状以及各种损伤或改变的组合。因此,将几种药物组合起来可能是有意义的,每种药物都专门用于预防、减轻或治愈一种或几种特定的症状、损伤或改变,从而得到考虑到疾病或症状所涉及的许多、大部分或全部方面的针对该疾病或症状的全局形式组合治疗。
与本发明的化合物组合的药物可以是用于治疗任何疾病的已获得批准的或者是新开发的药物。
另一方面,本发明涉及式(i),式(ii)或式(iii)的化合物在制备与gpr55受体有关的生物测定中的试剂中的用途。
在本发明中,术语“试剂”是指添加到系统中以引起反应或检查反应是否发生的测试物质。
在本发明中,术语“生物测定”是指用于在活体或体外生物体中定量或定性测量物质的方法。定性测试用于确定物质在该生物体中的生理效应。定量测试用于通过测量该物质产生的生物反应来估计物质的浓度或效力。
本说明书和权利要求书中,术语“包括”及其变体不应理解为排除其他技术特征、添加剂、成分或步骤。对于本领域技术人员而言,本发明的其它目的、优点和特征从说明书部分和从本发明的实践是显而易见的。下面的实施例和附图仅提供作为说明,且并不意图限制本发明。
附图说明
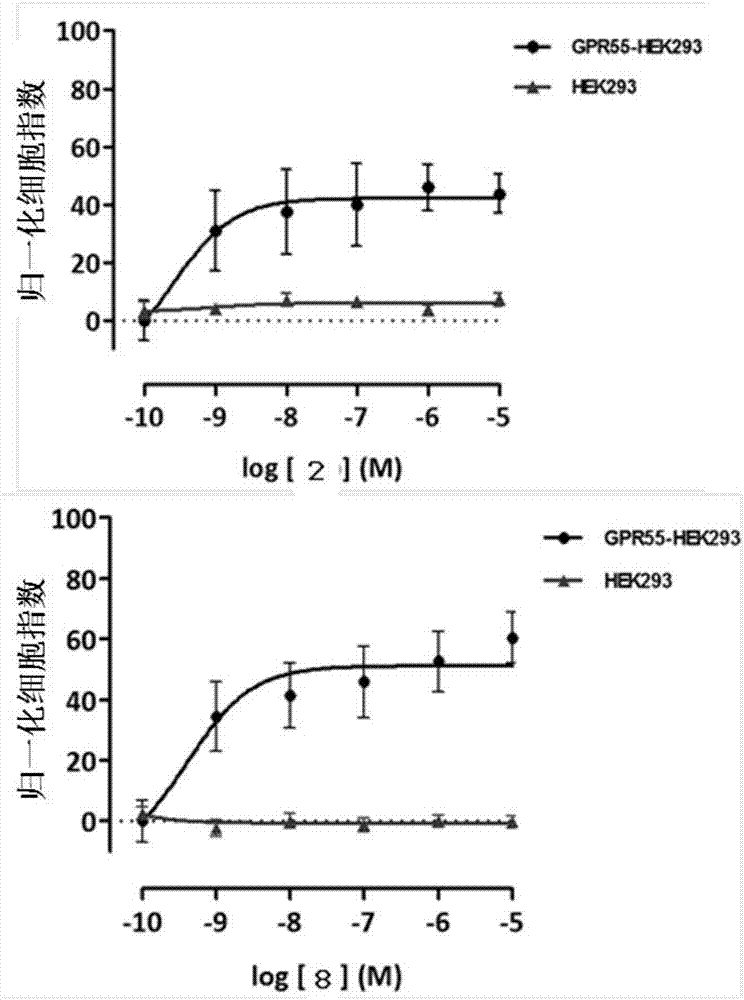
图1.hgpr55-hek293和hek293细胞中的lpi浓度-响应曲线以及实施例2、6和8。数值表示为来自各重复两次的4个独立实验的平均值±sem。所述数值对应于由lpi产生的最大刺激的百分比。
图2.在存在或不存在lpi时的实施例10在hgpr55-hek293细胞中的浓度-响应曲线。数值表示为来自各重复两次的4个独立实验的平均值±sem。所述数值对应于由lpi产生的最大刺激的百分比。
具体实施方式
现在将通过发明人进行的分析来说明本发明,其显示了本发明产品的有效性。
通用方法
反应产物的纯化通过使用硅胶60merck230-400目的柱层析进行。在由2767samplemanager注射器/歧管模块、系统流体组织器分离模块、光电二极管阵列2998(uv-可见光)检测器和质谱仪3100质量检测器整合而成的waters色谱仪上,通过半制备型高效液相色谱进行分离。使用sunfiretmc18反相色谱柱(19mmx150mm)进行分离。所用固定相为:a(mecn+0.1%甲酸)和b(h2o+0.1%甲酸)。70分钟内使用24mlmin的流量执行梯度,并在λ=254nm监测。在具有正电喷雾源的agilenttechnologies6520accurate-massqtoflc/ms光谱仪上记录精确质谱。nmr分析在每种情况下指明的氘代溶剂中进行。在25℃下在mercury400(400和101mhz)或varian500(500和126mhz)光谱仪上记录13c-nmr,异核相关hmbc和hsqc。在mp70mettlertoledo装置上测量熔点。
用于制备本发明式(i)化合物的起始产物是7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑。
为了合成7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑,将2-羟基-4-甲氧基苯乙酮用丙酮环化。用微波辐射使7-甲氧基-2,2-二甲基-2,3-二氢苯并吡喃-4-酮甲酰化得到3-羟基亚甲基苯并吡喃-4-酮。最后,与无水肼缩合,得到7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃并[4,3-c]吡唑。
制备7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑的合成路线总结于以下方案(i)中:
方案(i)
7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑的制备。
将3-(羟基亚甲基)-7-甲氧基-2,2-二甲基苯并二氢吡喃-4-酮(1.46g,6.27mmol)和在etoh中的无水肼(0.58ml,83mmol)的溶液在60℃下搅拌2小时。在真空下蒸发溶剂后,通过硅胶中压色谱(己烷/acoet,1:1)纯化粗品。得到7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃并[4,3-c]吡唑(0.99g,69%),为白色固体。mp:158-160℃。ms(es+,m/z)231[m+h]+。
a.制备式(iii)的1-(2-(4-(2-酮)哌嗪基)乙基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑和式(i)的(2-(4-(2-酮)哌嗪基)乙基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑,其中r1是-c(o)-r3基团。
为了合成本发明的式(iii)的1-(2-(4-(2-酮)哌嗪基)乙基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]和式(iv)的1-(2-(4-(2-酮)哌嗪基)乙基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑,用1,2-二溴乙烷将7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑烷基化。得到2个位置异构体,即1-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑和2-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑,通过色谱分离。最后,与酰基哌嗪反应得到示例性的式(iii)化合物和示例性式(iv)化合物。
下面的方案(ii)总结了这个过程:
方案(ii)
制备1-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑和2-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃并[4,3-c]吡唑。
将nah(28mg,1.19mmol)在无水thf中的悬浮液加入到在thf中的7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑(0.23g,0.99mmol)。将混合物加热回流4小时。真空除去溶剂。用水洗涤溶于acoet中的粗制油状物,用mgso4干燥,并在真空下蒸发溶剂。1-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑和2-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑在硅胶(己烷/acoet,1:1)上进行色谱分离。
1-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑(75mg,20%);1hnmr(400mhz,cdcl3)δ:7.34(d,j=7.9hz,1h),7.22(s,1h),6.50(dd,j=7.9,2.4hz,1h),6.43(d,j=2.4(t,j=6.6hz),3.92(s,3h),1.45(s,6h)ppm;13c-nmr(101mhz,cdcl3)δ:161.7,155.3,144.7,133.4,123.9,121.9,108.5,103.4,101.8,76.7,59.3,55.8,29.6,28.5ppm;ms(es+,m/z)337[m+h]+;hrmsc15h17brn2o2:含量.336.0473,exp.336.0478.
2-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑(0.19g,51%);1hnmr(400mhz,cdcl3)δ:7.68(d,j=8.4hz,1h),7.32(s,1h),6.63(dd,j=8.4,2.5hz,1h),6.58(d,j=2.5hz,1h),4.54(t,j=6.5hz,2h),3.86(s,3h),3.80(t,j=6.5hz,2h),1.66(s,6h)ppm;13c-nmr(101mhz,cdcl3)δ:161.1,154.7,143.8,124.6,123.2,120.9,110.9,108.1,103.2,76.6,55.5,53.8,30.7,29.4ppm;ms(es+,m/z)337[m+h]+;hrmsc15h17brn2o2:含量.336.0473,exp.336.0470.
实施例1-制备1-(2-(4-(2-呋喃甲酰基)哌嗪基)乙基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑
将溶于thf中的1-(2-呋喃甲酰基)哌嗪(12mg,0.06mmol)和k2co3(27mg,0.19mmol)在室温下搅拌10分钟。将1-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑(22mg,0.06mmol)的thf溶液加入到混合物中,并加热回流过夜。真空除去溶剂。用水洗涤溶于etoac中的粗制油状物,用mgso4干燥,过滤后蒸发溶剂。通过中压色谱分离1-(2-(4-(2-呋喃甲酰基)哌嗪基)乙基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑(7mg,25%);1h-nmr(cdcl3)δ:7.57(d,j=8.5hz),7.33-7.28(m,1h),7.11(s,1h),6.96-6.92(m,1h),6.60(dd,j=8.5)1h),6.39-6.36(m,1h),4.22(t,j=6.6hz,2h),3.78(s,3h),3.39-3.21(m,4h),2.83(t,j=6.6hz,2h),2.72-2.64(m,4h),1.52(s,6h)ppm;13c-nmr(101mhz,cdcl3)δ:162.0,155.6,153.1,145.3,142.6,141.8,124.1,123.2,121.3,117.0,112.2,109.2,108.4,103.2,76.1,57.5,55.1,54.1,50.7,49.5,28.9ppm;ms(es+,m/z)437[m+h]+;hrmsc24h28n4o4:含量.436.2110,exp.436.2107。
实施例2-制备2-(2-(4-(2-呋喃甲酰基)哌嗪基)乙基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑。
使用(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑(20mg,0.06mmol)和1-(2-呋喃甲酰基)哌嗪(11mg,0.06mmol)按照实施例1所述的步骤制备期望的化合物。黄色油状(6mg,24%);1hnmr(400mhz,cdcl3)δ:7.61(d,j=8.4hz,1h),7.48-7.45(m,1h),7.18(s,1h),7.00-6.94(m,1h),6.54(dd,j=8.4,2.5hz,1h),6.50(d,j=2.5hz,1h),6.46-6.44(m,1h),4.23(t,j=6.5hz,2h),3.76-3.62(s,7h),2.86(t,j=6.5hz,2h),2.70-2.66(m,4h),1.58(s,6h)ppm;13c-nmr(101mhz,cdcl3)δ:160.9,159.3,154.5,148.0,143.9,142.9,124.2,123.1,121.0,116.7,111.5,111.2,108.0,103.2,76.7,58.0,55.5,53.6,51.3,50.4,29.5ppm;ms(es+,m/z)437[m+h]+;hrmsc24h28n4o4:含量.436.2110,exp.436.2121。
实施例3-制备1-(2-(4-苯甲酰基-哌嗪基)乙基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑。
使用(1-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑(20mg,0.06mmol)和苯甲酰基哌嗪(11mg,0.06mmol)按照实施例1所述的步骤制备想要的化合物。黄色无定形固体(8mg,30%);1h-nmr(cdcl3)δ:7.55(d,j=8.4hz,1h),7.38-7.29(m,5h),7.13(s,1h),6.49(dd,j=8.4,2.5hz,1h),j=6.7hz,2h),3.73(s,3h),3.41-3.26(m,4h),2.81(t,j=6.7hz,2h)),2.59-2.37(m,4h),1.52ppm(s,6h);13c-nmr(101mhz,cdcl3)δ:170.3,165.1,160.7,154.3,130.2,129.7,128.5,127.1,124.4,123.9,122.8,107.9,107.6,103.0,76.4,57.8,55.4,55.3,53.6,50.1,29.2ppm;ms(es+,m/z)447[m+h]+;hrmsc26h30n4o3:含量.446.2317,exp.446.2324。
实施例4-制备2-(2-(4-苯甲酰基-哌嗪基)乙基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑
使用(2-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑(28mg,0.08mmol)和苯甲酰基哌嗪(16mg,0.08mmol)按照实施例1所述的步骤制备想要的化合物。黄色油状(30mg,81%);1h-nmr(400mhz,cdcl3)δ:7.62(d,j=8.4hz,1h),7.46-7.32(m,5h),7.17(s,1h),6.55(dd,j=8.4,2.5hz,j=6.6hz,2h),3.79(s,3h),3.41-3.20(m,4h),2.87(t,j=6.6hz,1h),6.50(d,hz,2h),2.73-2.60(m,4h),1.58ppm(s,6h,oc(ch3)2);(cdcl3)δ:170.4(co),160.8,154.5,142.9,135.8,129.9,128.6,127.1,124.1,123.0,120.9,111.1,107.9,103.1,76.6,57.9,55.4,53.7,50.2,47.9,29.4ppm;ms(es+,m/z)447[m+h]+;hrmsc26h30n4o3:含量.446.2317,exp.446.2311。
实施例5-制备1-(2-(4-(2-噻吩甲酰基)哌嗪基)乙基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑。
使用1-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑(20mg,0.06mmol)和1-(2-噻吩甲酰基)哌嗪三氟乙酸(18mg,0.06mmol)按照实施例1所述的步骤制备想要的化合物。黄色无定形固体(6mg,23%);1h-nmr(400mhz,cdcl3)δ:7.49(d,j=8.8hz,1h),7.44(dd,j=5.0,1.2hz,1h),7.28(s,1h),7.23-7.21(m,6.54(d,j=2.6hz,1h),4.54(t,j=7.1hz,2h),7.03(dd,j=5.0,3.6hz,1h),6.61-6.58(m,1h),6.573.82(s,3h),3.77-3.64(m,4h),2.93-2.87(m,2h),2.67-2.43(m,4h),1.58ppm(s,6h);13c-nmr(101mhz,cdcl3)δ:163.7,161.0,154.6,150.3,137.1,132.8,129.1,128.9,126.9,122.7,121.4,109.1,107.9,104.1,764,57.4,55.6,53.6,51.3,49.5,28.6ppm;ms(es+,m/z)453[m+h]+;hrmsc24h28n4o3s:含量.452.1882,exp.452.1891。
实施例6-制备2-(2-(4-(2-噻吩甲酰基)哌嗪基)乙基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑。
使用2-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑(30mg,0.09mmol)和1-(2-噻吩甲酰基)哌嗪三氟乙酸(28mg,0.09mmol)按照实施例1所述的步骤制备想要的化合物。黄色固体(22mg,55%);mp:163-165℃;1h-nmr(400mhz,cdcl3)δ:7.62(d,j=8.4hz,1h),7.44(dd,j=5.0,1.2hz,1h),7.25-7.23(m,1h),7.20(s,6.55(dd,j=8.4,2.5hz,1h),6.51(d,j=2.5hz,1h),4.27(t,j=6.5),7.03(dd,2h),3.79(s,3h),3.78-3.72(m,4h),3.01-2.91(m,2h),2.63-2.43(m,4h),1.59ppm(s,6h);13c-nmr(101mhz,cdcl3)δ:163.8,161.0,154.6,143.1,137.0,129.1,128.9,126.9,124.3,123.1,121.0,111.1,108.0,103.2,76.7,57.9,55.5,53.5,50.2,46.1,29.5ppm;ms(es+,m/z)453[m+h]+;hrmsc24h28n4o3s:含量.452.1882,exp.452,1889。
实施例7:制备2-(2-(4-苯氧基乙酰基哌嗪基)乙基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑
使用2-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑(30mg,0.09mmol)和苯氧基乙酰基哌嗪(20mg,0.09mmol)按照实施例1所述的步骤制备想要的化合物。橙色固体(16mg,38%);mp:177-179℃;1h-nmr(500mhz,cd3od)δ:7.56(d,j=8.5hz,1h),7.52(s,1h),7.31-7.21(m,2h),7.00-6.90(m,3h),6.56(dd,j=8.5,2.5hz,1h),6.48(d,j=2.5hz,1h),4.76(s,2h),4.26(t,j=6.4hz,2h),3.77(s,3h),3.63-3.50(m,4h),2.84(t,j=6.4hz,2h),2.56-2.46(m,4h),1.56ppm(s,6h);13c-nmr(126mhz,cd3od)δ:167.4,161.1,158.0,154.5,142.5,129.1,125.4,122.3,121.1,120.5,114.3,110.4,107.2,102.8,76.2,66.1,57.2,54.3,52.8,52.3,49.1,44.7,43.7,28.0ppm;ms(es+,m/z)477[m+h]+;hrmsc27h32n4o4:含量.476.2423,exp.476,2427.
实施例8:制备2-(2-(4-(2-四氢呋喃甲酰基)哌嗪基)乙基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑。
使用2-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑(30mg,0.09mmol)和四氢呋喃酰基哌嗪(16mg,0.09mmol)按照实施例1所述的步骤制备想要的化合物。黄色固体(14mg,36%);mp:158-160℃;1h-nmr(500mhz,cd3od)δ:7.46(d,j=8.5hz,1h),7.43(s,1h),6.46(dd,2.5hz,1h),4.67-4.54(m,1h),4.17(t,j=6.5hz,2h),3.83-3.81(m,1h),3.76-3.70(m,1h),3.68(s,3h)2h),2.46-2.33(m,4h),2.12-1.99(m,1h),1.95-1.86(m,1h),2.95(m,1h).1.85-1.75(m,2h),1.47ppm(s,6h);13c-nmr(126mhz,cd3od)δ:171.3,161.1,154.5,142.5,125.4,122.3,120.5,110.4,107.2,102.8,76.2,75.2,68.7,57.2,54.3,52.9,52.3,47.5,44.9,43.7,28.8,28.0,25.1ppm;ms(es+,m/z)441[m+h]+;hrmsc24h32n4o4:含量.440.2423,exp.440.2436.
实施例9:制备2-(2-(4-环己基羰基-哌嗪基)乙基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑
使用2-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑(30mg,0.09mmol)和四氢呋喃酰基哌嗪(17mg,0.09mmol)按照实施例1所述的步骤制备想要的化合物。黄色固体(25mg,62%);mp:151-152℃;1h-nmr(400mhz,cdcl3)δ:7.63(d,j=8.5hz,1h),7.18(s,1h),6.56(dd,j=8.5,2.5hz,1h),6.51(d,j=2.4hz,1h),4.23(t,j=6.6hz,2h),3.79(s,3h),3.66-3.39(m,4h),2.85(t,j=6.6hz,2h),2.54-2.35(m,4h),1.82-1.75(m,1h),1.73-1.61(m,4h),1.59(s,6h),1.57-1.42ppm(m,6h);13c-nmr(101mhz,cdcl3)δ:174.8,160.9,154.6,143.0,124.2,123.1,121.0,111.2,108.0,103.2,76.7,58.0,55.5,53.2,50.3,45.6,41.7,30.6,29.6,26.1ppm;ms(es+,m/z)441[m+h]+;hrmsc26h36n4o3:含量.452.2787,exp.452.2773。
实施例10-制备2-(2-(4-新戊酰基-哌嗪基)乙基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑。
使用2-(2-溴乙基)-7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑(20mg,0.06mmol)和新戊酰基哌嗪(10mg,0.09mmol)按照实施例1所述的步骤制备想要的化合物。黄色无定形固体(8mg,32%);1h-nmr(400mhz,cdcl3)δ:7.62(d,j=8.4hz,1h),7.18(s,1h),6.55(dd,j=8.4,2.5hz,1h),6.51(d,j=j=6.6hz,2h),3.79(s,3h),3.63(t,j=5.0hz,4h),2.84(t,j=(t,j=5.0hz,4h),1.59(s,6h),1.26(s,9h)ppm;13c-nmr(101mhz,cdcl3)δ:176.5,160.9,154.6,142.9,124.2,123.1,121.0,111.2,108.0,103.2,76.7,58.0,55.5,53.6,50.2,45.3,38.8,29.5,28.6ppm.ms(es+,m/z)427[m+h]+;hrmsc24h34n4o3:含量.426.2630,exp.426.2618.
b.制备式(v)的1-(2-(4-芳基哌嗪基)乙酰氨基甲基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑和式(i)的2-(2-(4-芳基哌嗪基)乙酰氨基甲基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑,其中r1是芳基。
对于合成1-(2-(4-芳基哌嗪基)乙酰氨基甲基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑和式(i)的2-(2-4-芳基哌嗪基)乙酰胺基甲基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑,其中r1为芳基,用相应的n-羟甲基-2-(4-苯基哌嗪基)乙酰胺将7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑烷基化。
下面的方案(iii)总结了这个过程:
方案(iii)
通过用苯基哌嗪和相应的2-氯-n-羟甲基乙酰胺进行n-烷基化来制备n-羟甲基-2-(4-苯基哌嗪基)乙酰胺。
下面的方案(iv)总结了这个过程:
方案(iv)
制备n-羟甲基-2-(4-苯基哌嗪基)乙酰胺
将2-氯-n-羟甲基乙酰胺(2当量)的乙腈溶液加入到相应的苯基哌嗪(1当量)与k2co3(1.5当量)在乙腈中的混合物中。将混合物加热回流2-5小时。真空除去溶剂。用水洗涤溶于acoet中的粗制油状物,用mgso4干燥,并在真空下蒸发溶剂。硅胶快速层析(etoac)得到相应的n-羟甲基-2-(4-苯基哌嗪基)乙酰胺。
n-羟甲基-2-(4-苯基哌嗪基)乙酰胺(41%)。mp:112-114℃;1h-nmr(400mhz,cdcl3)δ:8.10-8.02(brs,1h),7.39-7.22(m,2h),7.06-6.85(m,3h),4.82(s,2h),3.28-3.19(m,4h),3.13(s,2h),2.90-2.57ppm(m,4h);13c-nmr(101mhz,cdcl3)δ:173.6,151.5,129.8,129.7,120.5,119.3,116.7,73.1,62.0,54.1,53.7,50.9,49.8ppm;ms(es+,m/z)250[m+h]+;anal.c13h19n3o2:含量.c62.63%,h7.68%,exp.c62.41%,h7.83%.
n-羟甲基-2-(4-(2-甲氧基苯基)哌嗪基)乙酰胺(63%)。mp:134-136℃;1h-nmr(400mhz,cdcl3)δ:8.14-8.11(brs,1h),7.03-6.96(m,2h),6.89-6.78(m,2h),4.79(s,2h),3.94-3.64(m,5h),3.17-2.89(m,4h),2.84-2.66ppm(m,4h);13c-nmr(101mhz,cdcl3)δ:171.4,151.7,140.4,122.6,120.5,117.6and110.8,63.0,61.0,54.8,53.6,53.2,51.0,50.1ppm;ms(es+,m/z)280[m+h]+;anal.c14h21n3o3:含量.c60.20%,h7.58%,found:c60.31%,h7.72%.
n-羟甲基-2-(4-(2,3-二甲基苯基)哌嗪基)乙酰胺(25%)。mp:126-127℃;1hnmr(400mhz,cdcl3)δ:8.19-8.14(brs,1h),7.07(t,j=7.6hz,1h),6.98-6.90(m,2h),5.59-5.57(brs,1h2h),2.94-2.92(m,4h),2.77-2.73(m,4h),2.27(s,3h),2.21(s,3h),2.21(s,2h)ppm;13c-nmr(101mhz,cdcl3)δ:173.8,172.0,151.2,138.0,131.3,125.8,125.1,74.6,67.3,63.7,61.5,54.1,52.2,20.6,13.9ppm;ms(es+,m/z)278[m+h]+;anal.c15h23n3o2:含量.c64.96%,h8.36%,found:c65.09%,h8.03%.
n-羟甲基-2-(4-(4-甲氧基苯基)哌嗪基)乙酰胺(24%)。mp:140-143℃;1h-nmr(400mhz,cdcl3)δ:7.09-6.95(m,2h),6.71-6.54(m,2h),4.83(s,2h),3.78-3.60(m,5h),3.14-3.05,4h),2.77-2.71ppm(m,4h);13c-nmr(101mhz,cdcl3)δ:173.0,152.4,143.6,123.4,122.1,118.6,112.3,65.7,63.2,55.1,54.3,53.8,51.8,51.2ppm;ms(es+,m/z)280[m+h]+;anal.c14h21n3o3:含量.c60.20%,h7.58%,exp.c60.56%,h7.25%.
制备式(v)的1-(2-(4-芳基哌嗪基)乙酰氨基甲基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑和式(iv)的2-(2-(4-芳基哌嗪基)乙酰氨基甲基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑的一般过程。
在0°和氮气氛下将7-甲氧基-4,4-二甲基-1,4-二氢苯并吡喃[4,3-c]吡唑(1当量)的无水thf溶液缓慢加入到nah(3当量)的无水thf悬浮液中。10分钟后,在室温下搅拌的同时加入相应的n-羟甲基-2-(4-苯基哌嗪基)乙酰胺(2当量)。将反应混合物加热回流12-72小时。真空除去溶剂。用水洗涤溶于acoet中的粗制油状物,用mgso4干燥,并在真空下蒸发溶剂。在c18-二氧化硅(ch3cn/h2o)上进行半制备型色谱分离,得到1-(2-(4-芳基哌嗪基)乙酰胺基甲基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑和相应的2-(2-(4-芳基哌嗪基)乙酰氨基甲基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑。
实施例11.制备1-(2-(4-苯基哌嗪基)乙酰氨基甲基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑
根据上述制备的一般方式制备所需的化合物。
白色固体(13%).mp:196-198℃;1h-nmr(500mhz,cdcl3)δ:8.02-7.97(brt,j=6.3hz,1h),7.76(d,j=8.7hz,1h),7.26(s,1h),6.85-6.74,6.55(dd,j=8.6,2.6hz,2h),6.53-6.46(m,2h),6.45(d,j=2.5hz,1h),5.73(d,j=6.3hz,2h),3.71(s,3h),3.13-3.07(m,4h),3.03(s,2h),2.57-2.48(m,4h),1.52(s,6h)ppm;13c-nmr(126mhz,cdcl3)δ:170.2,165.1,161.0,154.3,149.2,133.8,132.5,129.1,123.3,121.4,120.0,116.2,107.8,103.85,76.73,61.3,55.3,54.32,53.4,49.1,28.24ppm;ms(es+,m/z)462[m+h]+;hrmsc26h31n5o3:含量.461.2426,exp.461,2433.
实施例12.制备2-(2-(4-苯基哌嗪基)乙酰氨基甲基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑
根据上述制备的一般方式制备所需的化合物。
无定形固体(5%);1h-nmr(500mhz,cd3od)δ:8.44-8.40(brs,1h),7.51(d,j=8.5,1h),7.44(s,1h),7.15-7.04(m,2h),6.82((d,j=7.4,1.0hz,1h),6.47(dd,j=8.5,2.4hz,1h),6.39(d,j=2.4hz,1h)(m,4h),3.02(s,2h),2.55-2.49(m,4h),1.46(s,6h)ppm;13c-nmr(126mhz,cd3od)δ:173.7,162.7,156.1,152.7,144.6,130.0,126.6,123.9,122.4,121.1,117.5,111.5,108.8,104.2,77.6,62.1,55.8,55.4,54.3,54.2,50.5,50.4,29.3ppm;ms(es+,m/z)462[m+h]+;hrmsc26h31n5o3:含量.461.2426,exp.461,2421.
实施例13.制备1-(2-(4-(2-甲氧基苯基)哌嗪基)乙酰氨基甲基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑。
根据上述制备的一般方式制备所需的化合物。
白色无定形固体(3%);1h-nmr(500mhz,cdcl3)δ:7.35(d,j=8.1hz,1h),7.16(s,1h),6.71-6.59(m,4h),6.42(dd,j=8.1,2.4hz,2h),3.59(s,3h),3.54(s,3h),3.29(s,2h),3.10-3.03(m,4h)),2.98-2.86(m,4h),1.69(s,6h)ppm;13c-nmr(126mhz,cdcl3)δ:175.0,160.4,155.6,155.1,149.5,147.1,130.2,127.5,124.9,118.7,116.9,116.3,113.3,111.4,106.8,104.2,75.8,61.4,55.9,55.1,54.0,53.7,51.3,25.9ppm;ms(es+,m/z)492[m+h]+;hrmsc27h33n5o4:含量.491.2532,exp.491,2528.
实施例14.制备2-(2-(4-(2-甲氧基苯基)哌嗪基)乙酰氨基甲基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑。
根据上述制备的一般方式制备所需的化合物。
黄色油状(8%);1h-nmr(500mhz,cdcl3)δ:7.04(d,j=7.5hz,1h),6.91(s,1h),6.69-6.51(m,5h),6.42(d,j=2.6hz,1h),3.64(s,3h),3.59(s,3h),3.16(s,2h),2.92-2.89(m,4h),2.76-2.70(m,4h),1.54(s,6h)ppm;13c-nmr(126mhz,cdcl3)δ:173.2,163.1,156.7,153.1,148.1,144.9,132.6,126.1,125.6,120.9,118.2,117.5,114.0,110.6,109.4,106.0,75.3,60.2,56.8,56.1,54.6,52.5,50.7,26.4ppm;ms(es+,m/z)492[m+h]+;hrmsc27h33n5o4:含量.491.2532,exp.491,2540.
实施例15:制备1-(2-(4-(2,3-二甲基苯基)哌嗪基)乙酰氨基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑。
根据上述制备的一般方式制备所需的化合物。
黄色油状(2%);1h-nmr(500mhz,cdcl3)δ:8.08-8.02(brt,j=6.4hz,1h),7.76(d,j=8.1hz,1h),7.50(s,1h),6.94(t,j=(d,j=7.7hz,1h),6.61(dd,j=8.1,2.6hz,1h),6.48(d,j=7.5hz,2.6hz,1h),5.61(d,j=6.4hz,2h),3.84(s,3h),3.08(s,2h),2.77-2.69(m,4h),2.64-2.59(m,4h),2.31(s,3h),2.27(s,3h),1.48(s,6h)ppm;13c-nmr(126mhz,cdcl3)δ:169.8,162.4,156.0,151.3,144.2,140.3,132.5,126.1,125.0,123.9,123.1,121.8,117.2,109.8,108.4,104.9,75.7,61.3,56.0,54.7,53.3,51.9,28.8,19.7,14.1ppmms(es+,m/z)490[m+h]+;hrmsc28h35n5o3:含量.489.2739,exp.489.2746.
实施例16.制备2-(2-(4-(2,3-二甲基苯基)哌嗪基)乙酰氨基甲基)-2,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑。
根据上述制备的一般方式制备所需的化合物。
白色固体(4%).mp:199-201℃;1h-nmr(500mhz,cdcl3)δ:8.22-8.17(brt,j=6.9hz,1h),7.62(d,j=8.5hz,1h),7.42(s,1h),7.08(t,j=1h),6.87(d,j=7.7hz,1h),6.57(dd,j=8.5,2.5hz,1h),6.51(d,j=2.5hz,1h),5.54(d,j=6.9hz,2h),3.79(s,3h),3.11(s,2h),2.87(t,j=4.8hz,4h),2.63(t,j=4.8hz,4h),2.25(s,3h),2.18(s,3h),1.58(s,6h)ppm;13c-nmr(126mhz,cdcl3)δ:171.5,161.0,154.6,151.1,143.5,138.0,131.2,125.8,125.2,124.7,122.8,121.5,116.6,110.4,108.0,103.0,76.5,61.4,55.3,54.2,53.9,52.0,29.1,20.6,13.8ppm;ms(es+,m/z)490[m+h]+;hrmsc28h35n5o3:含量.489.2739,exp.489.2750.
实施例17.制备1-(2-(4-(4-甲氧基苯基)哌嗪基)乙酰氨基)-1,4-二氢-7-甲氧基-4,4-二甲基苯并吡喃[4,3-c]吡唑。
根据上述制备的一般方式制备所需的化合物。
黄色油状(14%);1h-nmr(500mhz,cdcl3)δ:7.50-7.48(brt,j=5.1hz,1h),6.81-6.76(m,4h),6.76-6.68(m,2h),6.47(dd,j=5.1hz,2h),3.68(s,3h),3.63(s,3h),3.01(s,2h),2.97-2.94(m,4h),2.55-2.47(m,4h),1.46(s,6h)ppm;13c-nmr(126mhz,cdcl3)δ:172.2,161.2,154.6,154.2,145.2,143.2,125.1,122.4,120.9,118.7,113.8,110.0,107.3,102.7,76.1,60.6,54.4,54.3,53.9,52.950.4,27.8ppm;ms(es+,m/z)492[m+h]+;hrmsc27h33n5o4:含量.491.2532,exp.491.2524.
c.生物测定
在本发明中,通过用实时细胞阻抗测量(xcelligence实验)进行体外测定来评估本发明化合物对gpr55受体的活性。这些测定在稳定形式的过表达重组gpr55受体的hek293人胚胎肾细胞系(hgpr55-hek293)上进行。在用本发明的示例性化合物进行刺激的前一天接种细胞。
gpr55激动剂活性。激动剂化合物对gpr55受体的激活产生了被系统检测到的细胞阻抗,并与溶血磷脂酰肌醇(lpi)(参考gpr55配体)进行比较。将在1μm浓度下测量的lpi效应设定为100%。在加入本发明的实施例化合物5分钟后观察到最大响应。因此,在此时确定了剂量-响应曲线。在添加本发明待评估的本发明化合物之前,将每个孔的细胞阻抗值归一化。为了说明目的,下面(表1)给出本发明的一些示例性化合物的ec50(nm)有效浓度值和相对于lpi活性的最大效应emax(%)的百分比:
表1由xcelligence系统测量的本专利对gpr55的化合物实施例的激动作用。
上述值代表基于各重复两次的4次独立实验所计算的平均数及其95%置信区间。
实施例2、4、6-10和14的化合物是gpr55受体的部分激动剂。
gpr55激动剂活性。已经评估了本专利的示例性化合物抑制lpi介导的gpr55受体刺激的能力。为了说明目的,如下示出了在本发明的某些示例性化合物以1μm浓度存在的情况下的lpiec50(nm)有效浓度值和相对于lpi活性的最大效应emax(%)的百分比(表2)。
表2。由xcelligence系统测量的本专利对gpr55的化合物实施例的激动作用。
上述值代表基于各重复两次的4次独立实验所计算的平均数及其95%置信区间。由于置信区间并未重叠,因此认为相对于lpi值具有显著差异。
实施例7-10的化合物是由lpi产生的gpr55激动剂作用的拮抗剂。
作为对照实验,发现本发明的示例性化合物对不过度表达gpr55受体的hek293细胞没有作用。所述化合物均未显示细胞阻抗。
关于大麻素活性,本发明的示例性化合物均未结合大麻素受体cb1。就所有示例性化合物而言,在涉及cb2受体结合的情况下,仅3个实例具有小于微摩尔量级的值的亲和常数:实施例2(698±107nm)、实施例6(15.4±7.8nm)、实施例9(523±144nm)。
d.药代动力学特性:计算机模拟预测
通过使用maestro(
表3由集成在master(
a水中溶解度预测[-6.5/0.5];b血脑屏障通过预测[-3,0/1,2];chergk+通道(logic50)[>-5];dcaco-2细胞表观渗透性(nm/s)[<25低,>500优良];e人口服胃肠道(gi)吸收度[<25%低]。
- 还没有人留言评论。精彩留言会获得点赞!