一种电子束辐照联合酶法分离纯化高亲和钙的麦胚多肽的方法与流程
本发明涉及功能肽的制备以及农产品精深加工的技术领域,尤其是涉及一种麦胚蛋白源钙螯合肽的方法。
背景技术:
由于我国的饮食结构中植物性食品所占的比例较高,经常产生缺钙现象,尤其是儿童、孕妇以及老人,因此补钙成为国内学者研究中的重要课题。目前,市面上的补钙制剂主要为无机钙、有机钙、氨基酸钙。无机钙(如碳酸钙、磷酸钙、氯化钙等),这类补钙剂在胃肠道中稳定性和溶解性差,吸收利用率低,对胃有刺激作用;有机钙(如乳酸钙、葡萄糖酸钙、柠檬酸钙等),这类补钙剂钙含量低,总体利用率不高;氨基酸钙(如甘氨酸钙、谷氨酸钙等),这类补钙剂钙吸收率显著提高,但易被植酸沉淀,有促进脂肪的氧化的不利影响;肽-钙,作为新一代的补钙产品有明显的优势,钙离子借助小肽的转运、吸收机制以螯合物的形式被小肠吸收,不仅加速钙的转运,而且耗能较少,显著促进钙的利用率。目前,关于肽-钙的研究主要集中于动物蛋白,对植物蛋白的研究较少,但是,动物蛋白成本高,存在潜在的过敏源,所以迫切需要开发植物源的蛋白用于肽-钙的制备。
小麦胚芽是面粉加工业的副产物(蕴藏量达到200~300万吨),含有丰富的淀粉、蛋白质、不饱和脂肪、维生素以及矿物元素,被营养学家誉为“人类天然的营养宝库”,其中蛋白质含量占30%左右,是一种完全蛋白,必需氨基酸配比与WHO/FAO推荐的模式值基本接近,营养价值可与鸡蛋蛋白媲美。麦胚蛋白主要包括清蛋白、球蛋白、谷蛋白以及醇溶蛋白。其中,球蛋白、谷蛋白和醇溶蛋白的溶解性不好,在一定程度上限制了麦胚蛋白的综合利用,造成资源浪费、环境污染。为了节粮减损,增加麦胚的附加值,我们尝试采用电子束辐照处理结合酶法以及分离纯化的方法,制备高亲和钙的麦胚多肽。基于本发明制备的麦胚多肽-钙离子螯合物,不仅补充了钙元素和氨基酸,而且对小麦胚芽进行了精深加工有重要的经济和理论意义。
技术实现要素:
针对现有技术存在的上述问题,本申请人提供了一种电子束辐照联合酶法分离纯化高亲和钙的麦胚多肽的方法。本发明不仅能在较短时间内获得大量的活性肽,促进了麦胚蛋白的综合利用,而且,利用麦胚多肽制备的钙螯合肽能借助小肽的转运、吸收机制被小肠快速大量的吸收,显著提高了钙的利用率。
本发明的技术方案如下:
(一)一种电子束辐照联合酶法分离纯化高亲和钙的麦胚多肽,多肽的氨基酸序列为Phe-Val-Asp-Val-Thr。
(二)一种电子束辐照联合酶法分离纯化高亲和钙的麦胚多肽,包括以下步骤:
(1)以脱脂麦胚为原料,参考碱溶酸沉的方法提取麦胚分离蛋白,提取条件为:脱脂麦胚粉以料液比1:10分散于去离子水中,将分散液的pH调到pH为9.0~9.5,恒温40~45℃搅拌2h,离心获得上清液,将上清液pH调到pH为4.0~4.5来沉淀蛋白,将蛋白离心后调回pH为7.0,获得麦胚分离蛋白并冷冻干燥备用。
(2)麦胚分离蛋白干粉与去离子水按料液比10~40%(w/v)混合均匀,形成悬浊液,添加碱液调成弱碱性(pH为7.5~8.5),将悬浊液密封于透明、耐辐照的密封袋中,悬浊液的厚度控制在1~2cm。
(3)利用电子束辐照技术对上述的蛋白悬浊液进行改性,改性条件为:辐照剂量为1~10kGy,辐照条件为1.5~5.0MeV/20~40mA。
(4)辐照过后的蛋白质经过碱性蛋白酶水解,得到麦胚蛋白酶解产物。水解条件为:蛋白浓度2~5%,酶解pH为8.0~8.5、温度50~60℃、酶与蛋白的重量配比为1:50~1:100。
(5)酶解产物首先利用超滤过程进行分离,截取<1kDa、1~3kDa、>3kDa的组分,分别收集各组分。
(6)收集超滤后的钙螯合率最高的组分,通过DEAE-FF 16/10阴离子交换色谱进行分离,洗脱液为浓度梯度为含有0-0.5M NaCI的Tris-HCl,流速为5mL/min,洗脱峰在214nm下进行测量,透析脱盐。
(7)收集经过阴离子交换色谱分离得到的钙螯合率最高的组分,通过Superdex Peptide 10/300凝胶过滤色谱进行分离,洗脱液为去离子水,流速为0.5mL/min,洗脱峰在214nm下进行测定。
(8)收集经过凝胶过滤色谱分离获得的钙螯合率最高的组分,通过RP-HPLC进行分离,分离条件是用5-30%乙睛溶液作为梯度洗脱液,流速lmL/min,洗脱液自含体积比为5%乙睛和95%水的混合液开始,至体积比为30%乙睛和70%水的混合液结束,进行梯度洗脱。
本发明有益的技术效果在于:当用电子束辐照技术对蛋白质悬浊液进行改性时,电子束会诱导其中的水分子发生裂解,生成自由基、离子、激发分子等大量活性粒子。这些活性粒子往往具有一个或者几个不配对电子,因此化学性质非常不稳定,容易攻击蛋白质等其他生物大分子,促使蛋白分子发生脱氨、脱羧、氨基酸氧化、二硫键的断裂或重建、肽链的降解或交联、疏水集团外露等一系列反应,使得蛋白分子的高级结构及蛋白分子间的聚集方式发生变化。改性后的蛋白质在粘度、溶解度等方面上都会产生很大的变化,这些改变都将在一定程度上有利于生物酶的作用,加快酶的水解,缩短酶解时间,提高蛋白的水解度,进而产生大量的功能肽。这些功能肽进一步分离纯化可以获得螯合率显著提高的亲钙的麦胚多肽。
附图说明
图1为本发明实施例3中DEAE-FF 16/10阴离子交换色谱的分析图谱;
图2为本发明实施例3中Superdex Peptide 10/300凝胶过滤色谱的分析图谱;
图3为本发明实施例3中RP-HPLC的分离图谱。
图4为本发明实施例3中Phe-Val-Asp-Val-Thr的质谱图。
具体实施方式
下面结合附图和实施例,对本发明进行具体描述。
实施例1
(1)麦胚分离蛋白提取:脱脂麦胚粉(购于河南安阳漫天雪有限公司)以料液比1:10(w/v)分散于去离子水中,将分散液的酸碱度恒定在pH9.5,恒温40℃搅拌2h,5000rpm离心10min获得上清液,上清液调到pH4.0沉淀蛋白,蛋白水洗2次并将pH调到中性,冷冻干燥后得麦胚分离蛋白。
(2)麦胚分离蛋白粉与去离子水按料液比40%(w/v)混合,添加碱液,形成弱碱性的悬浊液(pH8.0),悬浊液密封于透明的密封袋中,厚度控制在1~2cm。
(3)蛋白悬浊液置于传送带上,于电子加速器下辐照,辐照剂量1kGy,辐照条件5.0MeV/20mA。
(4)辐照过后的蛋白经过碱性蛋白酶水解,得到麦胚多肽混合物。水解条件为:蛋白浓度5%(w/v),酶解pH8.0,温度50℃,酶与蛋白的重量配比为1:100,水解3h。水解完成后,酶解液于沸水中煮10min,冷却后5000rpm离心10min,收集上清液冷冻干燥备用。
(5)将(4)中酶解产物通过超滤过程分离,超滤过程为:酶解产物重新溶解后制成10mg/ml的多肽溶液,选取1kDa、3kDa的滤膜用PALL超滤系统进行超滤,收集<1kDa、1~3kDa、>3kDa的组分。
(6)将(5)中钙螯合率最高的组分置于DEAE-FF 16/10阴离子交换色谱进行分离,洗脱液为浓度梯度为含有0-0.5M NaCI的20mM Tris-HCl(pH7.5),流速为5mL/min,洗脱峰在214nm处进行测量。
(7)将(6)中钙螯合率最高的组分置于Superdex Peptide 10/300凝胶过滤色谱进行分离,洗脱液为去离子水,流速为0.5mL/min,洗脱峰在214nm处进行测定。
(8)将(7)中钙螯合率最高的组分通过RP-HPLC进行分离,分离条件是用5-30%乙睛溶液作为梯度洗脱液,流速为lmL/min,洗脱液由5%乙睛和95%水的混合液开始,到30%乙睛和70%水的混合液结束,进行梯度洗脱,收集钙螯合率最高的组分,再采用LC/MS液质联用质谱分析仪得出多肽序列。
实施例2
(1)麦胚分离蛋白提取:脱脂麦胚粉(购于河南安阳漫天雪有限公司)以料液比1:10(w/v)分散于去离子水中,将分散液的酸碱度恒定在pH9.5,恒温40℃搅拌2h,5000rpm离心10min获得上清液,上清液调到pH4.0沉淀蛋白,蛋白水洗2次并将pH调到中性,冷冻干燥后得麦胚分离蛋白。
(2)麦胚分离蛋白粉与去离子水按料液比10%(w/v)混合,添加碱液,形成弱碱性的悬浊液(pH8.5),悬浊液密封于透明的密封袋中,厚度控制在1~2cm。
(3)蛋白悬浊液置于传送带上,于电子加速器下辐照,辐照剂量5kGy,辐照条件5.0MeV/20mA。
(4)辐照过后的蛋白经过碱性蛋白酶水解,得到麦胚多肽混合物。水解条件为:蛋白浓度2%(w/v),酶解pH8.5,温度60℃,酶与蛋白的重量配比为1:80,水解3h。水解完成后,酶解液于沸水中煮10min,冷却后5000rpm离心10min,收集上清液冷冻干燥备用。
(5)将(4)中酶解产物通过超滤过程分离,超滤过程为:酶解产物重新溶解后制成10mg/ml的多肽溶液,选取1kDa、3kDa的滤膜用PALL超滤系统进行超滤,收集<1kDa、1~3kDa、>3kDa的组分。
(6)将(5)中钙螯合率最高的组分置于DEAE-FF 16/10阴离子交换色谱进行分离,洗脱液为浓度梯度为含有0-0.5M NaCI的20mM Tris-HCl(pH7.5),流速为5mL/min,洗脱峰在214nm处进行测量。
(7)将(6)中钙螯合率最高的组分置于Superdex Peptide 10/300凝胶过滤色谱进行分离,洗脱液为去离子水,流速为0.5mL/min,洗脱峰在214nm处进行测定。
(8)将(7)中钙螯合率最高的组分通过RP-HPLC进行分离,分离条件是用5-30%乙睛溶液作为梯度洗脱液,流速为lmL/min,洗脱液由5%乙睛和95%水的混合液开始,到30%乙睛和70%水的混合液结束,进行梯度洗脱,收集钙螯合率最高的组分,再采用LC/MS液质联用质谱分析仪得出多肽序列。
实施例3
(1)麦胚分离蛋白提取:脱脂麦胚粉(购于河南安阳漫天雪有限公司)以料液比1:10(w/v)分散于去离子水中,将分散液的酸碱度恒定在pH9.5,恒温40℃搅拌2h,5000rpm离心10min获得上清液,上清液调到pH4.0沉淀蛋白,蛋白水洗2次并将pH调到中性,冷冻干燥后得麦胚分离蛋白。
(2)麦胚分离蛋白粉与去离子水按料液比25%(w/v)混合,添加碱液,形成弱碱性的悬浊液(pH7.5),悬浊液密封于透明的密封袋中,厚度控制在1~2cm。
(3)蛋白悬浊液置于传送带上,于电子加速器下辐照,辐照剂量10kGy,辐照条件5.0MeV/20mA。
(4)辐照过后的蛋白经过碱性蛋白酶水解,得到麦胚多肽混合物。水解条件为:蛋白浓度5%(w/v),酶解pH8.0,温度50℃,酶与蛋白的重量配比为1:50,水解3h。水解完成后,酶解液于沸水中煮10min,冷却后5000rpm离心10min,收集上清液冷冻干燥备用。
(5)将(4)中酶解产物通过超滤过程分离,超滤过程为:酶解产物重新溶解后制成10mg/ml的多肽溶液,选取1kDa、3kDa的滤膜用PALL超滤系统进行超滤,收集<1kDa、1~3kDa、>3kDa的组分。
(6)将(5)中钙螯合率最高的组分置于DEAE-FF 16/10阴离子交换色谱进行分离,洗脱液为浓度梯度为含有0-0.5M NaCI的20mM Tris-HCl(pH7.5),流速为5mL/min,洗脱峰在214nm处进行测量。
(7)将(6)中钙螯合率最高的组分置于Superdex Peptide 10/300凝胶过滤色谱进行分离,洗脱液为去离子水,流速为0.5mL/min,洗脱峰在214nm处进行测定。
(8)将(7)中钙螯合率最高的组分通过RP-HPLC进行分离,分离条件是用5-30%乙睛溶液作为梯度洗脱液,流速为lmL/min,洗脱液由5%乙睛和95%水的混合液开始,到30%乙睛和70%水的混合液结束,进行梯度洗脱,收集钙螯合率最高的组分,再采用LC/MS液质联用质谱分析仪得出多肽序列。
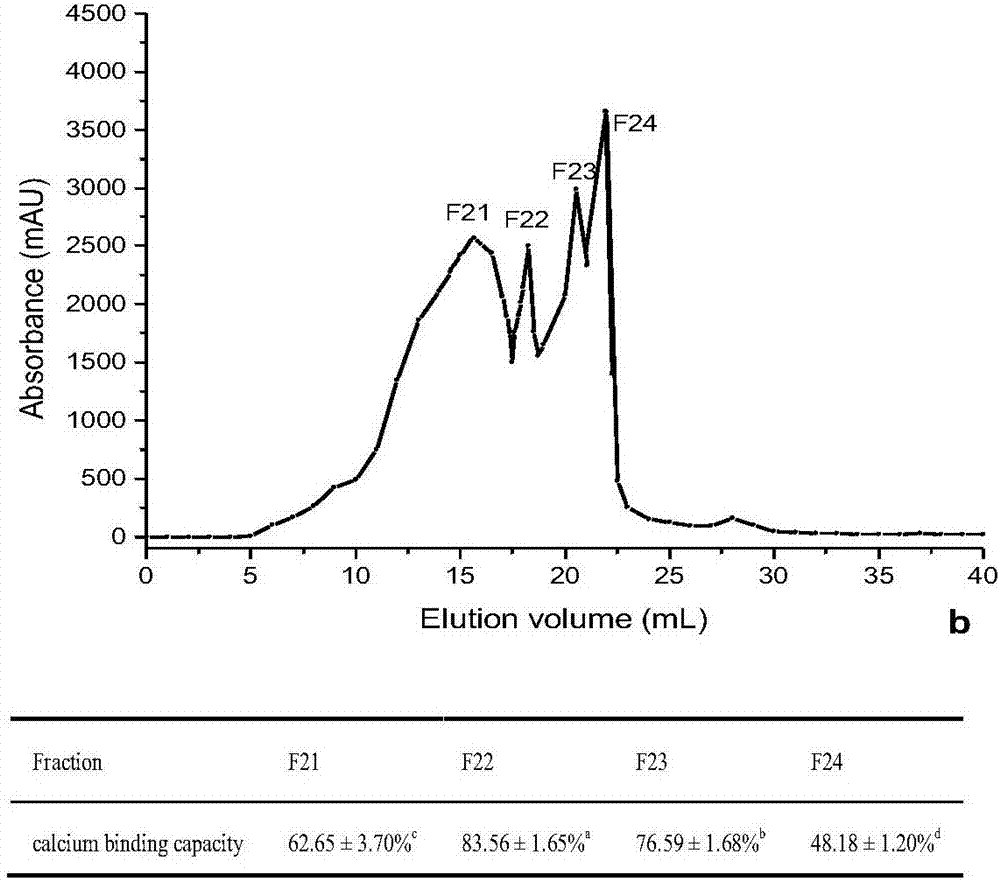
图1为麦胚多肽DEAE-FF阴离子交换色谱图,经阴离子柱纯化得到3个峰,其中峰F2的钙离子螯合性最强,收集该峰用于凝胶柱的分离。图2为麦胚多肽凝胶过滤色谱图,经凝胶柱纯化得到4个峰,其中峰F22的钙离子螯合性最强,收集该峰用于反相高效液相的分离。图3为麦胚多肽反相高效液相色谱图,经反相柱纯化主要得到2个峰,其中峰2的钙离子螯合性最强,收集该峰用于多肽的测序。图4为LC-ESI/MS图,经过LC-ESI/MS的结果,鉴定出多肽的氨基酸序列是Phe-Val-Asp-Val-Thr。各步骤中最高组分钙的螯合率如表1所示。
表1各分离纯化步骤中最高组分钙的螯合率
实施例3中得到的Phe-Val-Asp-Val-Thr比麦胚蛋白水解混合物,钙的螯合率提高了86.37%。
《海洋骨胶原低聚肽钙的分离纯化及结构鉴定》(刘文颖,任玮等食品工业科技,2015年第4期)中,提供了其经反向色谱初步纯化后,钙螯合率为51.38%±0.09%。本发明的螯合率数值要远远大于该技术。
以上所述的仅是本发明的优选实施方式,本发明不限于以上实施例。可以理解,本领域技术人员在不脱离本发明的精神和构思的前提下直接导出或联想到的其他改进和变化,均应认为包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!