包含生物活性微生物和/或生物活性材料的稳定干粉组合物及其制造方法与流程
本申请为国际申请日2010年5月26日、国际申请号pct/us2010/036098于2011年12月29日进入中国国家阶段、申请号201080029392.4、发明名称“包含生物活性微生物和/或生物活性材料的稳定干粉组合物及其制造方法”的分案申请。与相关申请的交叉参考本申请要求分别于2009年5月26日和2009年7月6日在美国专利和商标局(unitedstatespatentandtrademarkoffice)提交的美国临时申请no.61/181,248和61/223,295的优先权,所述申请的内容在此以所有目的引为参考。本发明属于在高的温度和湿度条件中保护生物活性微生物和/或材料的领域。具体来说,本发明涉及将活的微生物和/或生物活性材料包埋在保护性干燥制剂基质中。
背景技术:
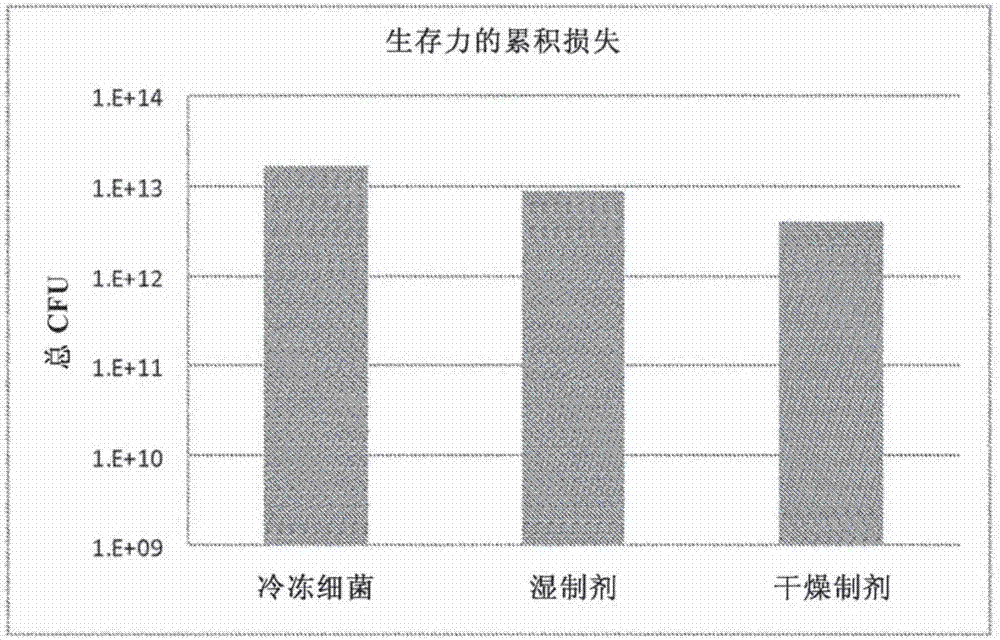
:生物活性微生物例如活的或死的细菌和病毒,或生物活性材料例如蛋白质、维生素、矿物质、激素和细胞,当在高的温度和湿度条件下储存时通常不稳定。例如,许多可商购的益生细菌例如鼠李糖乳杆菌(lactobacillusrhamnosus),当储存在室温(约25℃)和环境气氛下时,可能不到两周就失去一个对数以上的生存力。在从培养容器(例如发酵罐)收获后干燥并保护这些生物活性微生物的常用方法是将活细胞的浓缩液滴在液氮中,然后将冷冻珠储存在-80℃冰箱中,用于以后的冷冻干燥或运输到其他地点。冷冻干燥是用于干燥敏感性生物活性材料的主要方法。其他方法例如喷雾干燥、临界流体干燥和脱水干燥,一般不适合于敏感性生物活性物质例如活的或减毒的细菌和病毒,这是因为在这些方法中使用的高干燥温度会引起对微生物本身的显著伤害。此外,它们不能将材料充分干燥至产品稳定所需的特定残余湿度要求,因此可能需要通过其他手段执行附加的干燥步骤。在冷冻干燥中,通常将生物活性微生物或材料在保护剂溶液或悬液中混合,冷冻,然后通过在完全真空下升华来脱水。冷冻干燥方法的低温减少了生物活性物质的降解反应,使最终干燥形式中活性的丧失降到最低。然而,对低于零度的温度的要求是能量密集性的,并且冷冻材料的表面积与体积比低需要使用长干燥时间(每个批次周期长达数天)。冷冻干燥方法的缓慢干燥也促进冰晶形成,其能够损坏敏感性生物活性物质或使其变性。出于这种原因,生物活性微生物或材料例如病毒、细菌和具有细胞壁或脂质膜的细胞,对冷冻干燥方法提出了重大的挑战。减少冰晶结构形成的一种选择方案是相生物活性物质液添加低温保护剂。这样的保护剂是添加到制剂中用于在冷冻期间保护细胞膜和细胞内蛋白质并在储存期间提高稳定性的高度可溶的化学物质。常用于活的细菌和病毒的稳定剂包括高浓度糖类例如蔗糖、甘油或山梨糖醇以及细胞材料或生物活性物质(morgan等,2006;capela等,2006)。然而,这样的保护剂不能充分穿透到细胞中以保护细胞内容积中的活性组分。因此,对于开发使干燥损失降到最低同时实现干燥材料的足够储存稳定性的最佳干燥方法和制剂,仍是重大的挑战。与冷冻干燥相关的一些问题,已通过在液体状态下组合使用某些制剂和真空干燥得以解决。annear(annear1962)开发了在糖和氨基酸溶液中包含细菌的制剂以及包含沸腾和泡沫形成的真空干燥方法。roser等(美国专利6,964,771)公开了通过泡沫形成进行干燥的类似概念,其包括液体浓缩步骤,然后在真空下将浓缩的溶液(糖浆)进行沸腾和发泡。为了减少在沸腾步骤期间可能发生的氧化和变性损伤,bronshtein(美国专利no.5,766,520、7,153,472)引入了含有糖类和表面活性剂的改进的保护性配方。保护性溶液的干燥还包括在中度真空下浓缩、然后施加强真空以引起剩余水起泡沸腾来形成干燥的稳定泡沫的逐步方法。在消除沸腾步骤的尝试中,busson和schroeder(美国专利no.6,534,087)提出了使用真空烤箱,在不沸腾的情况下,通过施加高于30托的非常温和的真空压力,在液态制剂中对不敏感生物活性物质的干燥方法。在不使材料沸腾的情况下达到一定水平的干燥后,施加高于20℃的热,并且在仅仅几个小时后就收获到干燥的材料。这种其中生物活性溶液在整个干燥过程中维持在液体状态下的干燥方法类型,由于沸腾期间液体的对流和由起泡表面提供的增加的表面积而具有干燥更快的优点。然而,沸腾和起泡需要输入大量的热来提供溶液必需的喷发。这样的干燥方法不是非常适合于干燥敏感性生物物质,例如活病毒、细胞或细菌,这是因为施加的热加速了能够破坏生物材料的活性或生存力的酶过程(例如蛋白水解)和化学过程(例如氧化和自由基攻击)。上面描述的干燥方法在其放大到大规模工业过程的能力方面也受到限制。免除冷冻需要在比常规冷冻干燥或喷雾冷冻干燥方法循环更低的真空水平下(>7托)执行方法。上述方法的最显著缺点是不能控制和限制泡沫在容器、盘或小瓶中的膨胀。不能控制的喷发和往往过量的泡沫形成使得在实践上不可能产生工业规模的方法。沸腾步骤的喷发和起泡性质导致一部分材料被溅射到容器壁上并进入干燥仓室。为了减弱沸腾期间的喷发,bronshtein(美国专利no.6,884,866、6,306,345)提出了特殊的室和受控的温度/压力施加方案,其将过热降低到可接受的水平。包含喷发和过度起泡的另一种方法描述在美国专利申请no.2008/0229609中,其中将生物活性溶液装在覆盖有透气膜的容器或袋子中。同样地,这些方案难以在工业水平下执行,并且它们难以使用不同制剂可靠地重复。对于能够在液体状态下干燥的适合的保护性制剂,以及特别是在高于冷冻的温度下用于干燥生物活性微生物例如活的或死的病毒、细菌和细胞的可工业上放大规模的方法,仍存在着需求。特别是对于也适合于制药工业之外的应用例如食品和农业的具有成本效益的可放大规模的干燥方法,存在着需求。为了提供足够的干燥而不暴露于高温,需要保护性制剂和温和的干燥方法。需要能够保护在高的温度和湿度条件下储存的这些生物物质的组合物。正如下文所描述的,本发明为所有这些挑战提供了解决方法。技术实现要素:本发明包括用于保护储存中的生物活性材料的组合物和方法,所述生物活性材料例如肽、蛋白质、激素、维生素、矿物质、药物、杀微生物剂、杀真菌剂、除草剂、杀虫剂、杀精子剂、核酸、抗体、疫苗和/或生物活性微生物例如细菌(益生的或其他)、病毒和/或细胞悬液。干燥方法提供了包含生物活性微生物或材料、制剂稳定剂和保护剂的制剂的可控膨胀过程。所述制剂通过将所有固体组分在真空或不在真空下分散在溶液中来制备。将溶液冷却至高于其凝固温度的温度并在真空下干燥成干燥组合物,其表现出意想不到的高稳定性。所述方法包括制剂在所需温度和时间段下的初级干燥步骤,以及在最大真空和升高的温度下的加速二级干燥步骤,以达到干燥材料的最终期望的水活度。在一个实施方案中,所述制剂包含足够量的其中包埋有微生物的制剂稳定剂。适合的制剂稳定剂的实例包括但不限于邻苯二甲酸醋酸纤维素(cap)、羧甲基纤维素、果胶、藻酸钠、藻酸盐、羟丙基甲基纤维素(hpmc)、甲基纤维素、角叉菜聚糖、瓜尔胶、阿拉伯胶、黄原胶、刺槐豆胶、脱乙酰壳多糖和脱乙酰壳多糖衍生物、胶原蛋白、聚羟基乙酸、淀粉和改性淀粉、环糊精和寡糖(菊粉、麦芽糖糊精、葡聚糖等);及其组合。在一个具体实施方案中,优选的制剂稳定剂是藻酸钠。优选,以总干物质的重量百分数计,制剂包含0.1-10%、优选1-6%、更优选2-4%的制剂稳定剂。在另一个实施方案中,制剂稳定剂包含藻酸钠和寡糖的混合物,其中藻酸钠/寡糖的重量比为1:1-10、更优选为1:1-5。在本发明的另一个实施方案中,制剂稳定剂与二价金属离子进行交联以形成坚实的水凝胶。在另一个实施方案中,制剂包含相当量的其中包埋有微生物的保护剂。适合的保护剂的实例包括但不限于蛋白质,例如人和牛血清白蛋白、卵清蛋白、明胶、免疫球蛋白、分离的大豆蛋白、小麦蛋白、脱脂奶粉、酪蛋白酸盐、乳清蛋白和任何蛋白水解物;糖类,包括单糖(例如半乳糖、d-甘露糖、山梨糖等)、二糖(例如乳糖、海藻糖、蔗糖等);氨基酸,例如赖氨酸、谷氨酸单钠、甘氨酸、丙氨酸、精氨酸或组氨酸以及疏水氨基酸(色氨酸、酪氨酸、亮氨酸、苯丙氨酸等);甲胺例如甜菜碱;赋形剂盐类例如硫酸镁;多元醇例如三元或更多元糖醇(例如甘油、赤藓糖醇、丙三醇、阿拉伯糖醇、木糖醇、山梨糖醇和甘露糖醇);丙二醇;聚乙二醇;普卢兰尼克(pluronics);表面活性剂;及其组合。在一个优选实施方案中,保护剂包含二糖、蛋白质和蛋白水解物的混合物。在具体实施方案中,优选的保护剂是海藻糖、大豆蛋白分离物或乳清蛋白及其水解物的混合物。优选,以总干物质的重量百分数计,制剂包含10-90%的海藻糖、0.1-30%的大豆蛋白分离物或乳清蛋白以及0.1-30%的大豆或乳清蛋白水解物。优选,20-80%的海藻糖、0.1-20%的大豆蛋白分离物或乳清蛋白以及1-20%的大豆或乳清蛋白水解物,更优选为40-80%的海藻糖、0.1-20%的大豆蛋白分离物或乳清蛋白以及1-20%的大豆或乳清蛋白水解物。本发明的方法典型地包括在或不在真空下,将生物活性微生物(例如活的或死的疫苗、细菌、藻类、病毒和/或细胞悬液)或生物活性材料(例如肽、蛋白质、激素、维生素、矿物质、药物、杀微生物剂、杀真菌剂、除草剂、杀虫剂、杀精子剂、核酸、抗体、疫苗)的浓缩溶液或干粉,与稳定剂和保护剂混合成均匀制剂,将制剂冷却至高于其凝固温度的温度,以及在真空下、在高于20℃的货架温度下进行干燥。根据本发明,干燥方法可以包含在20℃或更高的货架温度下进行初级真空干燥,然后将制剂在最高真空和升高的温度下进行加速二级干燥到足以将干燥制剂的水活度降低至0.3aw或更低的时间。在混合方法的一个实施方案中,生物活性微生物或材料采取干燥的稳定化形式,并与干燥的稳定剂和保护剂进一步干法掺混。然后将该干燥掺混物加到水中,并在适当的真空和搅拌下混合,以提供所需密度的均匀浆液。在混合方法的另一个实施方案中,生物活性微生物或材料采取浓缩的溶液或糊的形式。将溶液与所有其他制剂成分混合,然后加到水中。在混合方法的另一个实施方案中,生物活性微生物或材料采取干粉的形式。将干粉与所有其他制剂成分混合,然后加到水中。在混合方法的另一个实施方案中,将干燥的生物活性微生物或材料与仅仅一部分制剂成分混合,并将该混合物加到预制悬液中,所述悬液由向水添加其余制剂成分来制备。在干燥方法的优选实施方案中,将生物活性微生物在真空下混合在包含制剂稳定剂和保护剂的溶液中。在一个具体实施方案中,生物活性微生物包含活细菌(例如益生细菌)。适合的微生物的实例包括但不限于酵母例如酵母属(saccharomyces)、德巴利酵母属(debaromyces)、假丝酵母属(candida)、毕赤酵母属(pichia)和球拟酵母属(torulopsis),霉菌例如曲霉属(aspergillus)、根霉属(rhizopus)、毛霉属(mucor)、青霉属(penicillium)和球拟酵母属(torulopsis),以及细菌例如双歧杆菌属(bifidobacterium)、梭菌属(clostridium)、梭形杆菌属(fusobacterium)、蜜蜂球菌属(melissococcus)、丙酸杆菌属(propionibacterium)、链球菌属(streptococcus)、肠球菌属(enterococcus)、乳球菌属(lactococcus)、考克氏菌属(kocuria)、葡萄球菌属(staphylococcus)、消化链球菌属(peptostreptococcus)、芽孢杆菌属(bacillus)、片球菌属(pediococcus)、微球菌属(micrococcus)、明串珠菌属(leuconostoc)、魏斯氏菌属(weissella)、气球菌属(aerococcus)、酒球菌属(oenococcus)和乳杆菌属(lactobacillus)。适合的益生微生物的具体实例由下列物种、包括这些物种中的所有培养生物型代表:黑曲霉(aspergillusniger),米曲霉(a.oryzae),凝结芽孢杆菌(bacilluscoagulans),缓慢芽孢杆菌(b.lentus),地衣芽孢杆菌(b.licheniformis),肠膜芽抱杆菌(b.mesentericus),短小芽孢杆菌(b.pumilus),枯草芽孢杆菌(b.subtilis),纳豆芽孢杆菌(b.natto),嗜淀粉拟杆菌(bacteroidesamylophilus),多毛拟杆菌(bac.capillosus),栖瘤胃拟杆菌(bac.ruminicola),猪拟杆菌(bac.suis),青春双歧杆菌(bifidobacteriumadolescentis),动物双歧杆菌(b.animalis),短双歧杆菌(b.breve),两歧双歧杆菌(b.bifidum),婴儿双歧杆菌(b.infantis),乳双歧杆菌(b.lactis),长双歧杆菌(b.longum),假长双歧杆菌(b.pseudolongum),嗜热双歧杆菌(b.thermophilum),candidapintolepesii,丁酸梭菌(clostridiumbutyricum),乳脂肠球菌(enterococcuscremoris),双乙酰乳酸肠球菌(e.diacetylactis),屎肠球菌(e.faecium),中间肠球菌(e.intermedius),乳酸肠球菌(e.lactis),e.muntdi,嗜热肠球菌(e.thermophilus),大肠埃希氏杆菌(escherichiacoli),脆壁克鲁维酵母(kluyveromycesfragilis),嗜酸乳杆菌(lactobacillusacidophilus),消化乳杆菌(l.alimentarius),噬淀粉乳杆菌(l.amylovorus),卷曲乳杆菌(l.crispatus4),短乳杆菌(l.brevis),干酪乳杆菌(l.case4),弯曲乳杆菌(l.curvatus),纤维二糖乳杆菌(l.cellobiosus),德氏乳杆菌保加利亚亚种(l.delbrueckiiss.bulgaricus),香肠乳杆菌(lfarciminis),发酵乳杆菌(l.fermentum),加氏乳杆菌(l.gasseri),瑞士乳杆菌(l.helveticus),乳酸乳杆菌(l.lactis),植物乳杆菌(l.plantarum),约氏乳杆菌(l.johnsonii),罗伊氏乳杆菌(l.reuteri),鼠李糖乳杆菌(l.rhamnosus),清酒乳杆菌(l.sakei),唾液乳杆菌(l.salivarius),肠膜明串珠菌(leuconostocmesenteroides),啤酒(有害)片球菌(p.cereviseae(damnosus)),乳酸片球菌(pediococcusacidilactici),戊糖片球菌(p.pentosaceus),费氏丙酸杆菌(propionibacteriumfreudenreichii),薛氏丙酸杆菌(prop.shermanii),酿酒酵母(saccharomycescereviseae),肉葡萄球菌(staphylococcuscarnosus),木糖葡萄球菌(staph.xylosus),婴儿链球菌(streptococcusinfantarius),唾液链球菌嗜热亚种(strep.salivariusss.thermophilus),嗜热链球菌(strep.thermophilus)和乳酸链球菌(strep.lactis)。在优选方法中,将制剂在真空下在室温(例如从20℃至30℃)混合。在混合至均质后,将制剂冷却至高于制剂的凝固温度的温度。典型地,将制剂冷却至-10℃至+10℃之间,更优选将制剂冷却至-5℃至+5℃之间。在优选实施方案中,然后将冷却的制剂转移到干燥仓室中,在其中施加热(20℃或更高)并同时将初始真空压力控制在维持原始的预冷却温度的水平处。典型地,适宜的真空压力低于7托但是不低于3托。在这些优选条件下,制剂的受控膨胀和随后制剂更快的初级干燥得以实现。为了加速二级干燥,施加最大真空压力,并且供热温度可以进一步升高至30℃至60℃。为了最大化最终产品的稳定性,优选将制剂干燥到足以使制剂的水活度降低至aw=0.3或更低的时间。在本发明的优选实施方案中,二级干燥包含在低于1托的压力下、在特别优选实施方案中在低于0.2托的压力下除去水。湿制剂可以采取0.05至10mm范围的黏稠浆液或水凝胶粒子的形式。干燥制剂可以作为薄片直接使用,或碾磨成平均粒径约10μm至约1000μm的粉末。制剂可以作为浓缩粉剂、作为复溶液体(例如饮料)直接给药于动物、包括人类,或者它可以以薄片或粉末形式掺入到现有的食品或饲料产品中。附图说明图1显示了在40℃和33%相对湿度下进行储存的益生细菌鼠李糖乳杆菌(l.rhamnosus)的稳定性趋势。图2显示了以二级干燥步骤的aw为0.28结束的配制过程的加工温度和累计生存力损失。图3显示了不同制剂稳定剂对储存稳定性的影响。图4显示了藻酸盐粘度对真空下制剂膨胀的影响。图5显示了稳定剂的不同组合对细菌生存力的影响。图6显示了制剂密度对真空下膨胀速率的影响。图7显示了制剂预冷却温度对真空下膨胀的影响。图8显示了初级干燥步骤期间真空压力对制剂温度的影响。图9显示了真空压力对制剂干燥速率的影响。图10显示了使用本发明的制剂和方法干燥的益生细菌嗜酸乳杆菌(l.acidophilus)在37℃和33%相对湿度下储存的稳定性。图11显示了从本发明的水凝胶制剂生产稳定干燥制剂的方法的流程图。具体实施方式定义应该理解,在本文中使用的术语仅仅是出于描述具体实施方案的目的,而不打算是限制性的。当在本说明书和权利要求书中使用时,不带具体数量的指称包括其复数形式,除非内容明确指出不是如此。因此,例如指称“蛋白”包括单一蛋白或两种以上蛋白的组合;指称“酶”、“维生素”、“细菌”等包括单一种或几种的混合物,等等。在本发明的描述和权利要求中,下列术语将按照下面提出的定义使用。“环境”室温或条件是给定环境中任何给定时间的室温或条件。典型地,环境室温是22-25℃,环境气压和环境湿度容易测量,并且随着一年中的时节、天气和气候条件、纬度等而变。“脱气”是指当气体分压高于所施加的压力时,液体中的气体从溶液释放。这不是沸腾,并通常可以在压力高于使溶液沸腾的压力下发生。例如,瓶装碳酸软饮料含有高分压的co2。除去瓶盖使分压降低,饮料剧烈发泡(它脱气,但是没有沸腾)。“沸腾”是指当液体的温度高于其沸点时发生的从液态到气态的快速相变。沸点是液体的蒸汽压等于所施加的压力时的温度。当向已经处于其沸点的液体加热时,沸腾可以特别剧烈。在干燥制剂组合物的情形中,“水活度”或“aw”是指水的可利用度,并代表了系统中水的能量状态。它被定义为样品上方的水蒸汽压除以同样温度下纯水的蒸汽压。纯蒸馏水的水活度恰好为1或aw=1.0。在储存稳定性的情形中,“相对湿度”或“rh”是指给定温度下空气中水蒸气的量。相对湿度通常低于使空气饱和所需的湿度,并用饱和湿度的百分率表示。对于本文描述的方法来说,“初级干燥”是指从开始施加真空的时间至开始二级干燥的时间点所发生的干燥。典型地,初级干燥的主体通过大量蒸发来进行,同时产物温度保持明显低于热源的温度。对于本文描述的方法来说,“二级干燥”是指在温度高于制剂的凝固温度并接近热源的温度时进行的干燥步骤。在典型的制剂干燥方法中,二级干燥步骤将制剂的水活度降低至aw为0.3或更低。“生物活性微生物”或“生物活性微生物或制剂”是指活的或死的微生物制备物,其处于允许微生物的生物活性明确有效的形式下。“作为干粉的活微生物”是指其中至少10%w/w是活细菌的细菌生物质。“作为干粉的死微生物”是指其中至少99.999%是死细菌的细菌生物质。“生物活性材料”、“生物活性组合物”、“生物学活性材料”或“生物活性制剂”是指处于允许生物活性成分的生物活性明确有效的形式下的制备物。这样的生物活性材料包括但不限于肽、蛋白质、激素、维生素、矿物质、药物、杀微生物剂、杀真菌剂、除草剂、杀虫剂、杀精子剂、核酸、抗体和疫苗。“稳定剂”是指添加到制剂中以增加湿制剂的粘度或形成水凝胶的化合物或材料。适合的稳定剂的实例包括但不限于多糖,例如邻苯二甲酸醋酸纤维素(cap)、羧甲基纤维素、果胶、藻酸钠、藻酸盐、羟丙基甲基纤维素(hpmc)、甲基纤维素、角叉菜聚糖、瓜尔胶、阿拉伯胶、黄原胶、刺槐豆胶、脱乙酰壳多糖和脱乙酰壳多糖衍生物、胶原蛋白、聚羟基乙酸、淀粉和改性淀粉、环糊精和寡糖(菊粉、麦芽糖糊精、棉籽糖、葡聚糖等)及其组合。“保护剂”一般是指所添加的用于确保或增加生物活性材料在干燥过程中和之后的稳定性、或用于干粉产品的长期储存稳定性的化合物或材料。适合的保护剂一般容易溶解在溶液中,并且在与水接触后不变稠或不聚合。适合的保护剂在下文中描述,并且包括但不限于蛋白质例如人和牛血清白蛋白、乳清蛋白、大豆蛋白、酪蛋白酸盐、明胶、免疫球蛋白,糖类包括单糖(半乳糖、d-甘露糖、山梨糖等)、二糖(乳糖、海藻糖、蔗糖等),氨基酸例如谷氨酸单钠、赖氨酸、甘氨酸、丙氨酸、精氨酸或组氨酸以及疏水氨基酸(色氨酸、酪氨酸、亮氨酸、苯丙氨酸等);甲胺例如甜菜碱;赋形剂盐例如硫酸镁;多元醇例如三元或更多元糖醇(例如甘油、赤藓糖醇、丙三醇、阿拉伯糖醇、木糖醇、山梨糖醇和甘露糖醇);丙二醇;聚乙二醇;普卢兰尼克;表面活性剂;及其组合。“稳定的”制剂或组合物是其中的生物活性微生物或材料在储存后基本上保持其生存力和/或生物活性的制剂或组合物。稳定性可以在选定温度和湿度条件下测量选定的时间段。预期货架寿命可以在材料被实际储存该时间段之前使用趋势分析来估算。例如,对于活细菌来说,稳定性被定义为在预定的温度、湿度和时间段条件下损失1个对数cfu/g干燥制剂所花费的时间。对于细菌来说,“生存力”是指在适合于细菌生长的营养培养基上形成菌落的能力(cfu或菌落形成单位)。对于病毒来说,生存力是指在适合的宿主细胞中感染和繁殖、导致在宿主细胞层上形成噬斑的能力。本发明的组合物和方法解决了提供成本效率合算并且可工业放大规模的干燥方法、以生产在干燥状态下寿命显著延长的含有生物活性微生物或材料的干燥制剂的问题,所述生物活性微生物或材料例如活的或死的疫苗、细菌、藻类、病毒和/或细胞悬液、肽、蛋白质、激素、维生素、矿物质、药物、杀微生物剂、杀真菌剂、除草剂、杀虫剂、杀精子剂、核酸、抗体、疫苗。本发明提供了在溶液中包含生物活性微生物或材料以及稳定剂和保护剂的制剂,将所述制剂冷却至高于其凝固温度的温度,以及通过在减压方案下同时向组合物供热除去水分以使制剂稳定。微生物在干燥过程期间的大多数生存力丧失可归因于冷冻-融化应激和冰晶形成、高渗和氧化应激、以及气泡空化期间与溶液在低干燥压力和高温下的“沸腾”相关的剪切力和能量释放的组合。本发明提供了使干燥期间的损失降到最低并在其后的严苛储存条件下保护生物活性微生物的制剂和可工业放大规模的干燥方法。本发明的组合物本发明包括生物活性微生物或材料、稳定剂和保护剂在黏稠溶液中的制剂组合物。已发现,本发明的制剂与不使用预冷却进行干燥的非黏稠或浓缩制剂相比,在其物理结构和功能方面具有内在差别。例如,现有技术的制剂最初进行“发泡”以促进有效干燥。发泡步骤通常引起溶液的剧烈沸腾和喷发,这是在液体状态下进行真空干燥不可避免的结果,因此在小瓶或容器中仅能实现非常低的材料装载能力(参见例如美国专利no.6,534.087,其中最终发泡产品的厚度小于2mm)。本发明的组合物和干燥方法仅允许制剂的有限和受控膨胀,因此能够获得高得多的单位干燥面积的材料载量,并因此能够容易地放大规模至生产大量材料。单细胞微生物已经显示出特别受益于本发明的制剂和干燥方法。在一个实施方案中,本发明的生物活性微生物是益生细菌。制剂按照本发明的组成和方法来制备,包括获得浓缩溶液、糊剂、冷冻珠或干粉形式的活益生细菌。在真空下将益生细菌与稳定剂和保护剂混合,将黏稠制剂冷却至高于其凝固温度的温度,施加足够的真空压力以维持该预冷却温度,并供应20℃以上的热源以促进除水。通过将热从制剂传导出去和/或由水蒸发所引起的潜热丧失,可以维持制剂的预冷却温度。为了进一步加速干燥过程,在高达0.1托的更高真空和高达70℃的升高的温度下进行二级干燥步骤,以提供具有aw为0.3或更低的水活度的最终组合物。这样的组合物在40℃和33%rh的储存条件下能够保持稳定60天或以上(参见图1)。已经显示,本发明详细说明的方法导致了细胞出人意料的保持其生存力的能力,其超过了现有的干燥方法。在本发明的整个干燥方法过程中,初始生存力的丧失仅为0.3个对数(参见图2)。用于制备稳定的干粉组合物的制剂与用于制备本发明的干粉组合物的优选微生物或材料混合的组成成分,包括稳定剂和保护剂。这样的组成成分,当与优选的生物活性微生物或材料混合时,可以按照本发明的方法加工,以提供大量用于所述微生物的储存和施用的稳定的干燥组合物。制剂稳定剂可以包括多糖和寡糖的混合物。优选的多糖、特别是用于使活微生物稳定的多糖,是藻酸盐。这是因为意外地发现,在降低敏感性生物物质例如益生物质的干燥损失方面,藻酸盐优于其他多糖例如果胶和阿拉伯胶(图3)。优选使用藻酸盐还因为它在温和温度下与无毒性金属形成水凝胶的特性。还发现藻酸盐通过为制剂提供适合的粘度并允许制剂在特定粘度下受控膨胀,在真空下有效地稳定制剂(图4)。还发现,将寡糖与藻酸盐组合进一步有助于制剂的总体稳定性。图5显示了藻酸盐和寡糖的不同组合对储存稳定性的影响。在对益生细菌的长期储存效果方面,藻酸盐与菊粉的组合是优选组合。在本发明的一个实施方案中,至少一种制剂稳定剂优选为能够通过与金属离子交联形成牢固水凝胶的树胶。本发明的保护剂可以包括各种蛋白质、肽、糖、糖醇和氨基酸。保护剂优选为在凝固温度(例如-20℃)下不使制剂中的生物活性材料结晶和/或去稳定的保护剂。包括两种或以上不同保护剂,对于抑制晶体形成以及使干燥的生物活性材料制剂在储存条件下长时间稳定,可能是有益的。湿制剂可以包含相当量的总固形物(组成成分减去溶剂例如水)。总固形物的主要部分可以由生物活性材料、稳定剂和保护剂构成。例如,生物活性材料存在于制剂中的浓度可以在约2-50重量%、稳定剂约1-20重量%、保护剂约20-80重量%的范围内。在另一个实例中,稳定剂存在于制剂中的浓度可以在约0.5-10重量%、保护剂约10-40重量%的范围内。优选,湿制剂应该具有约5%至80%之间、更优选约30%至60%之间的固形物含量。本发明的制剂的粘度典型地高于1000厘泊(cp),更优选高于10,000cp并低于450,000,最优选高于30,000cp并低于100,000cp。本发明制剂的粘度可以高达450,000cp,只要保护剂完全溶解在溶液中即可。取决于生物活性材料的温度和渗透压敏感性,可以在升高的温度下获得含有大量总固形物的高度黏稠和均匀的悬液。例如,可以将含有30-60%总固形物的活细胞制剂在约35-40℃的升高的温度下混合,并且混合一直进行到所有保护剂完全溶解为止。制备稳定的干燥制剂的方法用于保存生物活性微生物的稳定的干燥制剂的制备方法,包括以浓缩溶液、糊剂、冷冻珠或干粉形式(稳定化的或其他方式)获得特定微生物的活培养物。通过在真空下将生物活性微生物或材料与稳定剂和保护剂在溶液中混合来制备制剂,将制剂冷却至高于其凝固温度不超过10℃的温度,并通过在减压并同时向制剂供热的条件下蒸发水分对制剂进行干燥。例如,在一个实施方案中,将包含生物活性微生物或材料、制剂稳定剂和保护剂的制剂在约10-50托的中度真空下、在溶液中混合至均匀。图6显示了制剂的不同密度对其在真空下的膨胀的影响。在制剂组成成分在溶液中混合期间导入空气,即使在相对高的真空压力下也引起过度并且不可控制的发泡。本发明的真空步骤下的混合,通过取消在制剂溶液中导入空气或气体,从而消除溶液的过度和不可控制的发泡,来解决这个问题。然后将溶液冷却至高于其凝固点(通常在-5℃至+5℃之间)的温度。图7显示了制剂溶液的预冷却对其在真空压力下的膨胀的影响。令人吃惊并且出乎意料地发现,当溶液温度被降低到高于其凝固温度不超过10℃时,即使在相对较高的真空压力下也能有效消除沸腾,并且制剂的膨胀得到更好的控制。正如可以从图7看到的,只要制剂被冷却至+5℃、优选为-3℃,就可以施加3托的真空压力而没有过量发泡。一旦冷却,然后将制剂在足够的真空(例如约3托)下干燥,以维持初级干燥步骤期间的预冷却温度。图8显示了施加的真空压力对制剂溶液的温度的影响。在高于8托的相对高的真空压力下,制剂温度增加至高于6℃,并将继续朝向架子或仓室温度快速升高。同时,溶液将继续发泡并进一步膨胀。该实施方案与上面讨论的现有技术(参见例如美国专利no.6,534,087,其中施加的真空压力在3-7托之间,甚至更高)的区别在于施加了更强的真空压力(<3托),同时控制了制剂的膨胀。该方法产生明显更快的干燥速率(参见图9),并能够获得高的制剂装载容量。在这个实施方案中,甚至在低得多的真空压力下也能消除过量发泡和沸腾,这是因为本发明的方法提供了a)在真空下膨胀受控的特殊组合物,b)方法消除了混合期间将空气引入制剂,c)制剂的显著预冷却。现有技术中的典型方法涉及过量发泡和/或溅射和剧烈沸腾,其能损伤敏感生物物质并对工业规模放大造成困难。此外,对黏稠浆液的完全和有效脱气是困难的,并可能需要长时间。在本发明中,通过首先在温和的真空下实行整个混合过程,以便从一开始就消除夹带的气体导入制剂,来解决这些障碍。然后轻柔地除去可能残留在制剂中的任何少量可溶性气体,允许制剂在低真空下适度膨胀。使制剂达到高于其凝固温度的温度的附加预冷却步骤,提供了对膨胀率的附加控制,从而允许与现有技术所能提供的相比高得多的每单位干燥面积的装载容量。在初级干燥阶段完成后,稳定化的干燥制剂可以保持在升高的二级干燥温度(高达70℃)和低于0.2托的真空压力下,以在非常短的时间内完成制剂干燥。本发明的另一个实施方案提供了用于保存生物活性微生物或材料的水凝胶制剂组合物的制备方法。例如,将含有干粉形式的益生细菌、稳定剂和保护剂的制剂在溶液中混合,通过加入金属离子或二价阳离子交联成水凝胶,然后在如上所述的低真空和温度下进行干燥。制剂的预冷却温度,可以通过将热从制剂传导出去和/或由于水蒸发造成的潜热丧失来维持。例如,在本发明的一个具体实施方案中,制剂在溶液中保包含活益生细菌的浓缩的新鲜或冷冻或干燥培养物,所述溶液包含1至2.5%藻酸钠(优选1.5%藻酸钠)、1%至约5%菊粉(优选2.5%菊粉)、20%至60%海藻糖(优选40%海藻糖)和3%至15%酪蛋白水解物(优选8%酪蛋白水解物)。将制剂在真空下、在略高于室温的温度(典型在25℃-37℃之间)下混合,直至所有组分完全溶解。在本发明的另一个实施方案中,将所有成分在升高的温度下溶解在溶液中,然后将浆液冷却至0℃至-5℃之间的温度,并将活微生物的干粉混合在其中,直至所有组分完全溶解。为了促进活微生物干粉的混合并防止结块,可以向干粉添加少量海藻糖(含有相等部分的干粉和海藻糖的混合物通常就足矣)。将制剂浆液以约200g/sqft的载量铺展在托盘上,并将托盘置于冷冻干燥机中的架子上。将架子温度调整到0至-5℃(优选-2℃),并使浆液冷却至该温度。然后施加1至5托(优选3托)的真空压力,并将架子温度增加到20至45℃(优选30℃)用于传导性传热。在初级蒸发步骤期间,将制剂温度维持在约温度0至-5℃,以防止样品凝固。当产品温度达到约+10℃时,在0.l托的最大真空和40℃的架子温度下开始二级干燥步骤。整个干燥过程进行约4小时,然后收获产品,其水活度为aw-0.3或更低。在本发明的另一个实施方案中,将装载了的托盘在冷室中预冷却至-2℃,然后立即装入真空烤箱干燥机中进行辐射性传热。然后如上所述实施初级和二级干燥步骤,进行传导性传热。制备制剂本发明的制剂可以包含配制在含有制剂稳定剂和保护剂的溶液或悬液中的新鲜、冷冻或干燥的活微生物。在冷却并与生物活性微生物混合之前,可以将制剂稳定剂和/或高浓度保护剂在搅拌下溶解在加热的水性溶液中。微生物、例如培养的病毒或细菌,可以通过离心或过滤进行浓缩并与培养基分离开,然后直接混合在本发明的制剂中,或添加常规的低温保护剂,滴入液氮中,并将小的冷冻珠子储存在-80℃下,直到混合在制剂中之前。或者,可以将冷冻珠冷冻干燥,碾磨成细粉,包装在不透气袋子中,并冷冻储存直到混合到本发明的制剂中之前。在本发明的一个实施方案中,制剂中的全部水提供在浓缩的活生物体的液体中,并将活生物体悬液维持在略高于室温的温度下。将制剂稳定剂和保护剂的干燥组分掺合在一起,然后缓慢添加到活生物体的温悬液中。将制剂悬液在温和真空下在行星式拌和机中轻柔搅拌,直到所有组分完全分散并获得均匀的浆液。在本发明的另一个实施方案中,生物活性微生物处于干粉形式,并与制剂成分干式预混,然后将得到的干燥混合物添加到温度略高于室温的水中。生物活性微生物或材料可以提供任何生物活性,例如酶活性、诱导免疫应答、细胞增殖、感染、抑制细胞生长、刺激细胞生长、治疗效应、药理效应、抗微生物效应和/或其他活性。生物活性微生物或材料可以是可用作疫苗或治疗药剂的递送介质的非活细胞或脂质体。本发明的生物活性微生物可以是活病毒和活的减毒病毒等。制剂稳定剂为制剂提供结构稳定性,和/或为生物活性微生物提供物理和化学保护益处。稳定剂可以为制剂提供增稠的粘度,并对其在真空压力下的膨胀性质提供更好控制,并增加本发明的干燥制剂组合物的结构强度。保护剂可以包括各种蛋白质、蛋白水解物、糖、糖醇和氨基酸。例如,糖例如蔗糖或海藻糖能够物理围绕生物活性材料以促进整个干燥过程中分子结构的保持,并为干燥状态下的无定形基质提供结构刚性。保护剂可以替代干燥过程中水合丧失的水,以防止对细胞膜的损伤和酶的变性。保护剂的其他功能可以包括保护生物活性材料以免暴露于损害性的光、氧气、氧化剂和水分。大多数保护剂可以在约0.1重量%至约60重量%的量下容易地溶解在溶液中。制剂的预冷却在施加干燥方法的真空压力之前,本发明的制剂可以被预冷却,以提供益处例如制剂浆液的进一步增稠、更好地控制制剂在低真空压力下的膨胀、生物活性微生物或材料的稳定化、和/或增强制剂组成成分穿过细胞膜透。冷却可以通过本
技术领域:
已知的任何适合技术来施加。例如,可以通过与冷表面接触和传导、失去潜热等来进行冷却。典型地,将制剂装在容器中或铺展在金属盘上,并将其放置成与控温表面或仓室相接触,在那里它们与受控温度平衡。典型地,本发明的制剂可以预冷却到高于凝固温度的温度(例如-5℃至+5℃之间)。制剂的初级干燥用于保存生物活性微生物例如活的或减毒的生物体的典型方法包括冷冻和真空条件的组合,其能够导致膜损伤和细胞组成成分的变性。现有技术讲授了使用较高真空压力(例如低于100托)、添加特殊低温保护剂、获得稠溶液(浆)的浓缩步骤、和/或较高的初始温度来防止冷冻。本发明的制剂和方法参数的使用克服了这些限制,并允许每单位干燥面积较高的装载量,显著提高了工业产量。本发明的制剂通过蒸发进行干燥。从制剂周围的气态环境中除去溶剂(水分)可以通过冷凝和干燥来驱动。溶剂从制剂的蒸发可以在低真空压力下提供加速的制剂初级干燥。制剂的受控膨胀通过将溶剂快速转移出制剂,加速了制剂的初级干燥。制剂的受控膨胀通过在施加干燥真空时对残留溶解气体进行轻柔脱气(不是沸腾)来实现。因为空化和剪切力与沸腾期间的气泡形成有关,和/或制剂可能从容器溢出或对生物活性微生物具有不利影响,因此希望不使制剂沸腾或过度发泡。随着初级干燥的进行,制剂结构被稳定化。干燥室中供应的热补偿了由溶剂蒸发引起的潜热丧失,并将制剂温度维持在高于其凝固温度10℃之内。在初级干燥过程期间的某些点处,溶剂蒸发速率减慢,并且由于干燥室中热的超量供应,制剂温度开始增加。该点指示了本发明中初级干燥步骤的结束。当从制剂中驱除溶剂时,溶液中的保护剂变得浓缩并且更稠,直到它停止像液体一样流动。无定形和/或玻璃样制剂保存稳定的制剂结构。二级干燥结构稳定的制剂的二级干燥移除剩余的滞留或结合水分,并提供了在环境温度下长时间储存稳定的组合物。二级干燥包括施加数小时至数日的升高的温度和强真空。在优选实施方案中,完成二级干燥步骤所需的时间长度是初级干燥步骤时间的两倍。优选地,在二级干燥步骤结束时,制剂的水活度低于0.3的aw。干燥温度可以在约室温至约70℃的范围内。用于许多生物活性微生物的典型的二级干燥方法包括将温度从约30℃升高至约40℃并保持约30分钟至约24小时(优选为约30分钟至约4小时),以提供水活度低于0.3的aw的稳定的干燥制剂组合物。在二级干燥的一个具体实施方案中,以能够进一步保存活生物物质例如活微生物的活性的速率,将干燥温度从初级干燥条件缓慢升高。在二级干燥过程中可以提供强真空,以加速除水速率,降低残留的水分含量。二级干燥期间的真空可以低于1托,优选低于约0.2托。本发明的干燥方法产生了包裹在无定形玻璃样基质中的生物活性微生物或生物活性材料,由于无定形玻璃样组合物中化合物和其他分子的活动性的极大降低,从而防止蛋白质解折叠并显著减缓了分子的相互作用和交叉反应性。只要无定形固体处于低于其玻璃态转变温度的温度下并且残留水分保持相对低(即低于0.3的aw),不稳定的生物活性微生物就能保持相对稳定。应该指出,获得玻璃态不是长期稳定性的必要条件,因为某些生物活性微生物或材料可能在更晶体性状态下表现得更好。干粉的制备干燥制剂可以整块使用,切成所需形状和大小,或压碎和碾磨成自由流动粉末以提供便利的下游加工例如湿法或干法成团、成粒、制片、压实、球化或任何其他种类的递送方法。用于压碎、碾磨、研磨或粉碎的方法在本
技术领域:
中是公知的。例如,可以使用锤式碾磨机、冲击式碾磨机、喷射式碾磨机、销棒式碾磨机、wiley碾磨机或类似的碾磨装置。优选粒径小于约1000μm,优选小于500μm。本文描述的组合物和方法保存了包裹的生物活性微生物或生物活性材料的生物活性。例如,通过将组合物置于升高的温度(例如40℃)和高湿度(例如33%rh)下并测量制剂的生物活性来测试所述组合物的稳定性。以活益生细菌为例,这些研究的结果证实了配制在这些制剂中的细菌,在至少60天内稳定(参见图1)。稳定性被定义为一个对数cfu/g效力丧失所用的时间。这样的制剂甚至在使用高浓度生物活性材料时也是稳定的。因此,这些制剂的优点在于它们可以在室温或高于室温的温度下长时间运输和储存。实施例提供了下面的实施例对本要求保护的发明进行说明,但不对其构成限制。实施例1干燥预混制剂的制备:按照表1制备了几种制剂预混物。海藻糖从cargillminneapolis,mn获得。大豆蛋白分离物从fearnnaturalfoods,mequon,wi获得。乳清蛋白浓缩物从agri-markinc.,middlebury,vt获得。酪蛋白水解物从marcor,carlstadt,nj获得,藻酸钠从ispcorp.,wayne,nj获得。将所有成分合并在一起并均匀混合(表1)。表1.制剂预混物组成(重量百分比)组成成分大豆预混物乳清预混物蛋白水解物预混物藻酸钠3.03.03.0菊粉5.05.05.0海藻糖75.375.375.3大豆蛋白分离物14--------乳清蛋白浓缩物----14----酪蛋白水解物2.72.716.7实施例2含有益生细菌的稳定干粉:将嗜酸乳杆菌(lactobacillusacidophilus)(来自实验室发酵收获的100g冷冻浓缩物)在37℃下融化。在有夹套的双行星式混合机(dpm,1qt,rossengineering,inc.savannah,ga)中,向益生细菌的融化浆液缓慢加入蛋白水解物预混物(100g,表1)。混合在温和真空(25托)下、在40rpm和37℃下执行10分钟。将均匀浆液以200g/sqft的载量均匀铺展在托盘上,并将托盘置于冷冻干燥机(25src型,virtis,gardiner,ny)中的架子上。将架子温度设置在高于浆液-5℃的凝固温度,以冷却但不凝固浆液。当制剂温度达到约-1℃时施加真空压力(3托)。当真空达到约7托时浆液开始轻柔除气。当真空达到3托时,将架子温度升高至50℃。在初级干燥步骤的前50分钟期间,制剂温度保持在约-1℃至约+5℃。一旦制剂温度升高至+10℃后,就开始二级干燥步骤。施加0.1托的最大真空,同时架子温度仍继续维持在50℃。二级干燥步骤继续进行另外100分钟,这时终止干燥过程,并将干燥制剂从冷冻干燥机中取出。当通过hygropalmaw1仪器(rotonicinstrumentcorp.,huntington,ny.)测量时,该点处干燥制剂的水活度是aw=0.23。配制、制备和干燥过程期间的生存力损失显示在图9中。制剂制备期间的生存力损失是0.26log,干燥过程期间是0.34log,总累计损失为0.6log。图10显示了干燥制剂在37℃和33%rh的加速储存条件下的储存稳定性。在这些储存条件下4周后,在本发明的制剂中稳定化的益生细菌的生存力损失仅为0.8log。实施例3水凝胶制剂的制备:按照实施例2、但是使用表1的乳清蛋白预混物,制备了浓缩的益生菌浆液。向该浆液加入0.5g磷酸氢钙,然后加入0.5g葡萄糖酸内酯。在接下来的2小时内允许浆液在室温下硬化,以形成固体水凝胶。使用可商购切片机/切碎机将坚固凝胶切成细长的丝。以200g/sqft的载量将细丝装载在托盘上,并置于冷冻干燥机中按照实施例2中所述干燥。在建立起0.1托的最大真空后4小时,将干燥的产品从冷冻干燥机取出。制剂的水活度(aw)为0.05(通过hygropalmaw1,rotonichuntington,ny测量)。使用标准的锤式碾磨设备将干燥制剂进一步研磨成细粉,并通过50-250微米筛网筛分。图11显示了从本发明的水凝胶制剂生产稳定干燥制剂的方法的流程图。实施例4益生宠物食品的制备:将可商购的狗的球粒状宠物食品在对流烤箱中干燥至水活度为0.1,然后用按照实施例3中所述制备的稳定的益生菌干燥制剂进行包衣。向干燥球粒喷洒约5%基于脂肪的屏水层(40%鸡脂肪、40%可可脂和20%蜂蜡的混合物),在鼓式拌合机中与干粉制剂(通常为总宠物食品的0.1-0.5%,其提供了108cfu/g)混合,最后喷洒另一部分基于脂肪的屏水层包衣。包衣的总量约为(宠物食品的)15%。包衣时间约为30分钟。实施例5具有几种益生微生物的鱼饲料的制备:使用几种益生菌的混合物制备了本发明的鱼用球粒饲料。按照实施例2中所述制备了含有鼠李糖乳杆菌(l.rhamnosus)、嗜酸乳杆菌(l.acidophilus)和乳双歧杆菌(bifidobacteriumlactis)的混合物的稳定的干燥益生菌制剂。首先将鲑鱼用的可商购起始饲料(zeiglerbros.,gardners,pa)在对流烤箱中干燥至水活度为0.1,然后在鼓式拌合机中用益生菌制剂包衣。首先向球粒(100g)喷洒约5重量%的基于脂肪的屏水层(40%鱼油、40%可可脂和20%蜂蜡的混合物),然后与1g稳定的干燥益生菌制剂混合(以获得107cfu/g饲料的剂量),最后喷洒另一部分基于脂肪的屏水层包衣。包衣的总量约为鱼饲料的10%。实施例6含有本发明的干燥制剂的婴儿配方奶粉:按照实施例2制备含有乳杆菌gg(lactobacillusgg)(valiocorp,芬兰)的稳定的干燥制剂,然后筛分成两种粒径的组(高于50μm和低于150μm)。通过将99gnutramigen(meadjohnson;evansville,il)与0.1g小尺寸粒子(低于50μm)混合,制备了婴儿配方奶粉。最终产品每100g婴儿配方奶粉含约108cfu乳杆菌gg。实施例7含有酶的稳定干粉:通过在温和真空下将60g蛋白水解物制剂预混物(表1)与40gsavinase(novozymes,丹麦)在100g水溶液中混合,制备了含40重量%savinase的水凝胶制剂。将湿制剂在真空烤箱中,在50℃的干燥温度下干燥。为了确定干燥制剂的装载和储存稳定性,将干燥样品精确称重(<100mg)在微量离心管中。加入200μl二甲基亚砜(dmso)。通过涡旋振荡使制剂溶解在dmso缓冲液中。向该样品加入0.8ml含有0.05nnaoh、0.5%sds和0.075m柠檬酸(三钠盐)的溶液。将管在45℃下超声10分钟,然后以5,000rpm短暂离心10分钟。将透明的dmso/naoh/sds/柠檬酸盐溶液的等份加入到微量滴定板的孔中,并使用bradford测定方法分析蛋白质含量。稳定酶制剂的储存稳定性明显高于不含本发明制剂的干酶。实施例8含有维生素a的稳定干粉:通过在25托真空下将50g大豆蛋白制剂预混物(表1)与50g维生素a粉末(basfcorp.,florhampark,nj)在100g水溶液中混合,制备了含有50重量%维生素a的水凝胶制剂。将湿制剂预冷却至-5℃,然后以200g/sqft的载量铺展在托盘上,并在真空烤箱中在3托的初始真空压力和70℃的温度下进行干燥,随后一旦制剂温度达到5℃就执行70℃下0.2托的最大真空步骤。实施例9侵袭性物种诱饵的制备按照本发明制备了含有杀虫剂的特别针对侵袭性物种的球粒状诱饵。向200gm水加入表1的乳清蛋白预混物。向该溶液加入90gm鱼藤酮和0.5gm磷酸氢钙,然后加入0.5gm葡萄糖酸内酯。允许浆液在室温下固化2小时以上。通过切片机/切碎机将坚固凝胶切成细长的丝。将细丝装载在托盘上,并置于真空烤箱干燥机中。在水活度达到0.10后停止干燥。将干燥制剂研磨成对于特定靶向物种来说适合于诱饵尺寸规格的尺寸分布。实施例10制备在水溶性制剂中受保护的杀虫剂:通过本发明的方法制备了杀虫剂的受保护的可溶性颗粒制剂,所述杀虫剂原本在储存期间将被制剂中的其他成分分解。向200g水加入表1的大豆蛋白预混物。向该溶液加入80g敏感的配制过的杀虫剂的干燥制剂。将浆液转移到真空烤箱干燥机,并干燥至水活度为0.1。将干燥制剂研磨至所需尺寸并包装。实施例11在水不溶性制剂中制备受保护的杀虫剂:使用本发明的制剂和方法制备了杀虫剂的受保护的不可溶颗粒制剂,否则所述杀虫剂在储存期间将被制剂中的其他成分分解。向200g水加入表1的大豆蛋白预混物。向该溶液加入90g敏感杀虫剂的干燥制剂和0.5g磷酸氢钙,然后加入0.55g葡萄糖酸内酯。允许浆液在室温下硬化2小时以上,然后通过切片机/切碎机将其切成细长的丝。将细丝装载在托盘上,并在真空烤箱干燥机中干燥至水活度达到0.1。将干燥制剂进一步研磨至所需尺寸分布并包装。实施例12将10克干燥的鼠李糖乳杆菌gg(lactobacillusrhamnosusgg)与100g实施例1的蛋白水解物预混物(表1)混合。在35℃下,在有夹套的双行星式混合机中,向100gm去离子水缓慢加入该干燥混合物,并以40rpm混合10分钟。将均匀浆液以100gm/sqft的载量均匀铺展在托盘上,并将托盘置于冷冻干燥机(25src型,virtis,gardiner,ny)中的架子上。将架子温度设置在5℃以冷却浆液。施加真空以将压力降低至3托,此时将架子温度升高至30℃。2小时后,将压力进一步降低至150毫托,架子温度仍保持在30℃。继续再干燥3小时,这时产品温度已升高至架子温度的2℃范围内。然后从冷冻干燥机中取出干燥产物,通过hygropalmaw1仪器测量该时间点处干燥制剂的水活度。测量并记录配制、制备和干燥过程期间生存力的损失。在32℃和20%rh的加速储存条件下进行干燥制剂的储存稳定性测试。下面显示了在30℃下进行的试验以及在40℃下进行的重复试验的结果。实施例13将20克干燥的鼠李糖乳杆菌gg(lactobacillusrhamnosusgg)与100g实施例1的乳清蛋白预混物混合。在35℃下,在有夹套的双行星式混合机中,向100gm去离子水缓慢加入该干燥混合物,并以40rpm混合10分钟。将均匀浆液以100gm/sqft的载量均匀铺展在托盘上,并将托盘置于冷冻干燥机(25src型,virtis,gardiner,ny)中的架子上。将架子温度设置在5℃以冷却浆液。施加真空以将压力降低至3托,此时将架子温度升高至30℃。2小时后,将压力进一步降低至150毫托,架子温度仍保持在30℃。继续再干燥3小时,这时产品温度已升高至架子温度的2℃范围内。然后从冷冻干燥机中取出干燥产物,通过hygropalmaw1仪器测量该时间点处干燥制剂的水活度。测量并记录配制、制备和干燥过程期间生存力的损失。在32℃和20%rh的加速储存条件下进行干燥制剂的储存稳定性测试。下面显示了在30℃下进行的试验以及在40℃下进行的重复试验的结果:实施例14将10克干燥的嗜酸乳杆菌(lactobacillusacidophilis)与10gm海藻糖混合并暂时放在一边,同时将65.3gm海藻糖、3gm藻酸钠、5gm菊粉和16.7gm乳清水解物作为干粉混合在一起,并缓慢加入到有夹套的双行星式混合机中的100gm35℃去离子水中,并以40rpm混合5分钟。向该浆液加入嗜酸乳杆菌和海藻糖干燥预混物,并在35℃下再继续混合5分钟。将均匀浆液以100gm/sqft的载量均匀铺展在托盘上,并将托盘置于冷冻干燥机(25src型,virtis,gardiner,ny)中的架子上。将架子温度设置在5℃以冷却浆液。施加真空以将压力降低至3托,此时将架子温度升高至30℃。2小时后,将压力进一步降低至150毫托,架子温度仍保持在30℃。继续再干燥3小时,这时产品温度已升高至架子温度的2℃范围内。从冷冻干燥机中取出干燥产物,使用hygropalmaw1仪器测量该时间点处干燥制剂的水活度。测量并记录配制、制备和干燥过程期间生存力的损失。在32℃和20%rh的加速储存条件下进行干燥制剂的储存稳定性测试。下表中显示了干燥机维持在30℃下的试验结果并与干燥机维持在50℃下的结果进行比较。实施例15将10克干燥的嗜酸乳杆菌(lactobacillusacidophilis)与10gm海藻糖混合并暂时放在一边,同时将65.3gm海藻糖、3gm藻酸钠、5gm菊粉和16.7gm乳清水解物作为干粉混合在一起,并缓慢加入到有夹套的双行星式混合机中的100gm50℃去离子水中,并以40rpm混合5分钟。将浆液冷却至4℃。向该冷却浆液加入嗜酸乳杆菌和海藻糖预混物,并在4℃下再继续混合5分钟。将均匀浆液以100gm/sqft的载量均匀铺展在托盘上,并将托盘置于冷冻干燥机(25src型,virtis,gardiner,ny)中的架子上。将架子温度设置在5℃以维持冷却浆液的温度。施加真空以将压力降低至3托,此时将架子温度升高至30℃。2小时后,将压力进一步降低至150毫托,架子温度仍保持在30℃。继续再干燥3小时,这时产品温度已升高至架子温度的2℃范围内。从冷冻干燥机中取出干燥产物。当使用hygropalmaw1仪器测量时,该时间点处干燥制剂的水活度为aw=0.23。配制、制备和干燥过程期间生存力的损失合计为0.6log。实施例16在有夹套的双行星式混合机中,向35℃100gm去离子水缓慢加入100克大豆预混物,并以40rpm混合10分钟。在20rpm混合下缓慢加入10克干燥的乳双歧杆菌(bifidobacteriumlactis)bb-12,并将浆液继续混合5分钟。将均匀浆液以100gm/sqft的载量均匀铺展在托盘上,并将托盘置于冷冻干燥机(25src型,virtis,gardiner,ny)中的架子上。将架子温度设置在5℃以冷却浆液。施加真空以将压力降低至3托,此时将架子温度升高至30℃。2小时后,将压力进一步降低至150毫托,架子温度仍保持在30℃。再继续干燥3小时,这时产品温度已升高至架子温度的2℃范围内。从冷冻干燥机中取出干燥产物,并且当使用hygropalmaw1仪器测量时,该时间点处干燥制剂的水活度为aw=0.26。配制、制备和干燥过程期间生存力的损失合计为0.7log。干燥制剂在32℃和20%rh的加速储存条件下的储存稳定性测试显示,在本发明的制剂中稳定化的益生细菌的生存力损失在4周后仅为0.7log。实施例17在25英寸真空下,除了在ross混合机中进行混合之外,使用与实施例1相同的参数获得了1.2gm/cc的浆液密度。当使用hygropalmaw1仪器测量时,该时间点处干燥制剂的水活度为aw=0.26。配制、制备和干燥过程期间生存力的损失合计为0.5log。干燥制剂在32℃和20%rh的加速储存条件下的储存稳定性测试显示,在本发明的制剂中稳定化的益生细菌的生存力损失在4周后仅为0.7log。实施例18向有夹套的双行星式混合机加入100克lgg细菌(含10%固形物,其余为水)的新鲜液体浓缩物,并加温至35℃。向其缓慢加入100g乳清预混物(表1)。将得到的浆液以40rpm混合10分钟。将均匀浆液以100gm/sqft的载量均匀铺展在托盘上,并将托盘置于冷冻干燥机(25src型,virtis,gardiner,ny)中的架子上。将架子温度设置在5℃以冷却浆液。施加真空以将压力降低至3托,此时将架子温度升高至30℃。2小时后,将压力进一步降低至150毫托,架子温度仍保持在30℃。继续再干燥3小时,这时产品温度已升高至架子温度的2℃范围内。从冷冻干燥机中取出干燥产物。当使用hygropalmaw1仪器测量时,该时间点处干燥制剂的水活度为aw=0.25。配制、制备和干燥过程期间生存力的损失合计为0.5log。干燥制剂在32℃和20%rh的加速储存条件下的储存稳定性测试显示,在本发明的制剂中稳定化的益生细菌的生存力损失在4周后仅为0.4log。实施例19将鼠李糖乳杆菌(lactobacillusrhamnosus)gg(lgg)的100克未融化的冷冻浓缩物与100g蛋白水解物预混物添加到有夹套的双行星式混合机(dpm,1pt,rossengineering,inc.,savannah,ga)中。该过程也可以通过首先融化冷冻浓缩物来进行。混合在40rpm和37℃下进行10分钟。测量均匀浆液的粘度(brookfield粘度计,型号为lvdve115,brookfieldengineeringlaboratories,inc.),然后以100g/sqft的载量均匀铺展在托盘上。高粘度范围的粘度参数是:300g样品在400mlpyrex烧杯中,33-37℃,64号主轴,1.0rpm速度,不使用支腿(guard-leg)操作。然后将托盘装入-4℃冰箱冷却30分钟。在冷却后,使用冷冻干燥机(25src型,virtis,gardiner,ny)开始干燥,在整个过程中将架子温度设定在30℃,使用2800毫托压力至少2.5小时。在至少2.5小时后,将压力降低至100毫托,继续至少2.5小时。使用两个不同批次的lgg发酵物重复该实验,并包括在加入水解物预混物之前将一个批次用3%dmv清洗并使用去离子水重构。中等粘度范围的粘度参数是:300g样品在400mlpyrex烧杯中,33-37℃,64号主轴,5.0rpm速度,不使用支腿操作。实施例20将鼠李糖乳杆菌(lactobacillusrhamnosus)gg(lgg)的100克冷冻浓缩物在37℃下融化,并添加到有夹套的双行星式混合机(dpm,1pt,rossengineering,inc.,savannah,ga)。向其加入100g蛋白水解物预混物。也可以使用未融化的冷冻浓缩物。在40rpm和37℃下混合10分钟,然后将浆液以100g/sqft的载量均匀铺展在托盘上。然后将托盘装入-4℃冰箱冷却30分钟。在冷却后,使用冷冻干燥机(25src型,virtis,gardiner,ny)开始干燥,在整个过程中将架子温度设定在30℃,使用2800毫托压力至少2.5小时。在至少2.5小时后,将压力降低至100毫托继续至少2.5小时。对10g干燥(粉末状)lgg材料实施该同样的过程,将其混合在100g蛋白水解物中。然后将该干燥混合物缓慢添加到有夹套的双行星式混合机中的90g去离子水中。实施例21含有酶的稳定干粉将40克干粉形式的蛋白水解酶(novozymes,丹麦)与60g大豆预混物(表1)混合。将该干燥混合物缓慢加入到有夹套的双行星式混合机中的100gm35℃去离子水中,并以40rpm混合10分钟。将均匀浆液以100gm/sqft的载量均匀铺展在托盘上,并将托盘置于冷冻干燥机(25src型,virtis,gardiner,ny)中的架子上。将架子温度设置在5℃以冷却浆液。施加真空以将压力降低至3托,此时将架子温度升高至60℃。1小时后,将压力进一步降低至150毫托,架子温度仍保持在60℃。再继续干燥1小时,这时产品温度已升高至架子温度的2℃范围内。从冷冻干燥机中取出干燥产物。为了确定干燥制剂的装载和储存稳定性,将干燥样品精确称重(<100mg)在微量离心管中,并加入200μg二甲基亚砜(dmso)。通过涡旋振荡使制剂溶解在dmso缓冲液中。向该样品加入0.8ml含有0.05nnaoh、0.5%sds和0.075m柠檬酸(三钠盐)的溶液。将管在45℃下超声10分钟,然后以5,000rpm短暂离心10分钟。将透明的dmso/naoh/sds/柠檬酸盐溶液等份加入到微量滴定板的孔中,并使用bradford测定方法分析蛋白质含量。稳定酶制剂的储存稳定性明显高于不含本发明制剂的干酶。参考文献本文引用的参考文献的内容在此为所有目的引为参考。6,964,771在干燥的发泡玻璃基质中稳定地掺入物质的方法(methodforstablyincorporatingsubstanceswithindry,foamedglassmatrices)。1997年9月。roser等。5,766,520通过形成制剂来保存(preservationbyformulationformation)。1998年6月。bronshtein6,534,087制备药物组合物的方法(processforpreparingapharmaceuticalcomposition)。2001年6月。busson和schroeder。6,884,866批量干燥和诱导气泡成核作用的效果(bulkdryingandtheeffectsofinducingbubblenucleation)。2005年4月。bronshtein.7,153,472用于在疏水载体中储存和递送的活细胞的保存和配制(preservationandformulationoflivingcellsforstorageanddeliveryinhydrophobiccarriers)。2006年12月。bronshtein20080229609通过汽化进行保存(preservationbyvaporization)。2005年6月.bronshtein6,306,345用于在环境温度下保存敏感性生物材料的工业规模的屏障技术(industrialscalebarriertechnologyforpreservationofsensitivebiologicalmaterialsatambienttemperatures)。2001年10月。bronshtein等。morgan,c.a.,herman,n.,white,p.a.,vesey,g.2006.通过干燥保存微生物:综述(preservationofmicro-organismsbydrying:areview)。j.microbiol.methods.66(2):183-93。capela,p.,hay,t.k.c,&shah,n.p.2006.低温保护剂、益生元和微包囊对酸奶和冷冻干燥酸奶中益生生物体的存活的影响(effectofcryoprotectants,prebioticsandmicroencapsulationonsurvivalofprobioticorganismsinyoghurtandfreeze-driedyoghurt),foodresearchinternational,39(3)203-211。annear,1962.通过从液态干燥来保存钩端螺旋体(thepreservationofleptospiresbydryingfromtheliquidstate),j.gen.microbiol,27:341-343。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1