(N‑1,2,3,4‑四氢异喹啉基)‑阿魏酰胺化合物、制备方法及其应用与流程
本发明属于医药技术领域,具体涉及一种(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺化合物、制备方法及其应用。
背景技术:
阿尔茨海默氏症(Alzheimer's disease,AD,老年痴呆症)是一种以进行性认知障碍和记忆力损害为主的中枢神经系统退行性疾病,随着全球人口的急速老龄化,老年人群的健康问题已经成为当前迫切需要解决的社会重大问题。阿尔茨海默症是老年人中发病率和致死率最高的疾病之一。阿尔茨海默症国际协会(Alzheimer's disease International,ADI)发布的《2015全球阿尔茨海默症报告》指出,2015年全球已有超过4600万人患上痴呆症,据预测,到2050年,全球将有1.315亿人口受到痴呆的困扰,其中中国痴呆症患者的发病率已达到6.61%。随着人均生存年龄的延长,本病已发展为社会和医疗保健系统的主要负担,并且为社会、患者及家属带来了沉重的精神和经济压力。目前已批准用于治疗轻/中度AD的药物有乙酰胆碱酯酶(AChE)抑制剂,以及用于重度AD治疗的N-甲基-D-天冬氨酸(NMDA)受体拮抗剂,但临床使用表明,这些药物可通过提高患者体内乙酰胆碱水平或者抑制兴奋性氨基酸的兴奋毒性来缓解AD症状,但不能有效阻止或逆转病程,而且还会引起幻觉、意识混沌、头晕、头痛、恶心、肝脏毒性、食欲不振以及大便频繁等严重毒副作用,因而长期疗效不甚理想。因此,临床上迫切需要研发具有新型作用机制的AD治疗药物。
近年来,随着对AD致病机理的不断阐明,发现AD的发生和发展具有多机制、多因素作用的特点,不同机制之间又相互关联相互影响,构成了AD发生和发展过程中复杂的网络调控系统。基于上述结果,针对单一确切靶点的药物产生的临床疗效并不适合与AD的复杂本质,研究人员提出“多靶点导向药物”(Multitarget-directed Ligands,MTDLs)策略被认为是研发抗神经退行性疾病药物的一种有效方法。该“多靶点导向药物”是指单一化学实体同时作用于疾病网络中的多个靶点,对各靶点的作用可产生协同效应,使总效应大于各单效应之和,此类药也称为“Multifunctional”或“Multipotential”药物。到目前为止,尽管多靶点的优势是清晰的,但多个靶点功能如何在同一个分子中组合,及最合适治疗靶点的选择仍然是一个关键点。
随着AD的进程的发展,乙酰胆碱酯酶(AChE)水平逐渐减低,而丁酰胆碱酯酶(BuChE)活性增加到了正常值的165%。在AD的中重度阶段,BuChE取代AChE来水解乙酰胆碱(ACh),BuChE的抑制可能在AD治疗中是更有效的。另外,根据β-淀粉样蛋白级联假说,脑内低聚物Aβ的产生和聚集引发了致病的发生,最终导致了神经元丢失和痴呆,Aβ能够进入线粒体诱导氧化应激,同时氧化应激存在于AD患者脑内,并通过自由基的产生促进Aβ毒性,进一步恶化AD进程(Proc. Natl. Acad. Sci. U. S. A. 2005, 102, 17213-17218. J. Med. Chem. 2016, 59, 7683-7689.)。因此,发现具有抑制丁酰胆碱酯酶、Aβ聚集和具有抗氧化活性的神经保护剂可能为AD,尤其是中重度AD带来曙光。
技术实现要素:
有鉴于此,本发明所要解决的技术问题是提供一种(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺化合物,为多靶点治疗阿尔茨海默氏病提供新的思路。
为解决上述技术问题,本发明所采用的技术方案是:
(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺化合物,化学结构如式I所示:
,
式中,Me代表甲基。
本发明还提供了上述(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺化合物的制备方法,包括以下步骤:
,
式中,Me代表甲基,
阿魏酸(1)和1,2,3,4-四氢异喹啉(2)在溶剂与缩合剂存在条件下发生缩合反应,得到化合物(I),
所述溶剂为二氯甲烷、四氢呋喃和甲苯中的一种或多种,
所述缩合剂为EDCI、HOBT、DCC、DMAP和卡特缩合试剂中的一种或多种。
本发明还提供了上述(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺化合物的前药,依据本发明,前药是上述化合物的衍生物,在生理条件下(例如通过代谢、溶剂分解或其它方式)被转化成相应的生物活性形式。药学上可接受的前药是指具有通过溶剂分解或者在生理学条件下能够转换为氨基、羟基、羧基等的基团的化合物。作为形成前药的基团,可以列举公知文献例如Prog.Med.,5,2157-2161(1985)和“医药品的开发”,广川书店 ,1990 年 ,第 7 卷 ,163-198 页记载的基团。
本发明还提供了上述(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺化合物在药学上可接受的水合物。
本发明还提供了上述(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺化合物或其药学上可接受的水合物在制备治疗神经退行性疾病药物中的用途。优选地,所述神经退行性疾病为阿尔茨海默氏病。
本发明还提供了一种药物组合物,包括有效量的上述(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺化合物或其药学上可接受的水合物。
优选地,上述药物组合物的剂型为口腔速崩片、口腔复方制剂、口服缓控释制剂、储库型长效注射剂或透皮给药制剂。
本发明还提供了上述药物组合物在制备治疗神经退行性疾病药物中的用途,特别地,所述神经退行性疾病为阿尔茨海默氏病。
与现有技术相比,本发明的有益效果为:
本发明(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺化合物对丁酰胆碱酯酶具有显著抑制活性,其IC50为3.4μM,较现有广泛使用的抗AD药多奈哌齐对丁酰胆碱酯酶的抑制活性(IC50为4.76μM)高;且对丁酰胆碱酯酶的抑制活性显著高于对乙酰胆碱酯酶的抑制活性,说明本发明化合物对丁酰胆碱酯酶具有选择性抑制作用。
本发明(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺化合物对Aβ1-42自身聚集均具有显著抑制活性,其抑制率为61.1%(25μM),显著高于现有抗AD药多奈哌齐(小于5%)。
本发明(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺化合物的抗氧化活性为Trolox的1.1倍,具有较好的抗氧化活性。
本发明(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺化合物具有显著的神经保护作用。
本发明所提供的(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)体外实验显示良好的丁酰胆碱酯酶抑制活性、显著的抑制Aβ1-42聚集活性,抗氧化活性及对过氧化氢诱导的PC12细胞损伤具有较好的神经保护活性,表明化合物(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)是个多靶点抑制剂。体内实验中展现出较好的治疗阿尔茨海默病的作用,且毒性较低,具备很好的临床应用前景。
附图说明
下面结合附图对本发明做进一步的详细说明:
图1:本发明化合物(I)的PC12细胞毒性测定结果;
图2:本发明化合物(I)对H2O2诱导的PC12细胞损伤的保护作用测定结果;
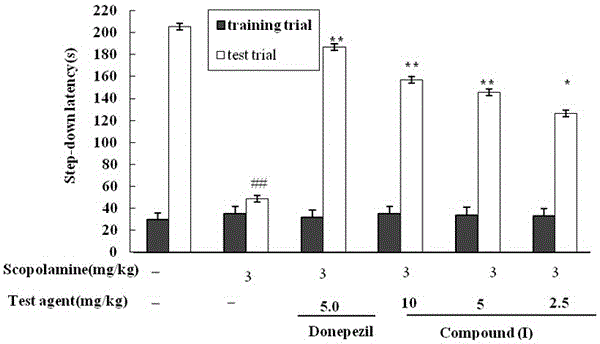
图3:本发明化合物(I)对东莨菪碱所致小鼠记忆再现功能障碍模型评价。
具体实施方式
为了更好地理解本发明,下面结合实施例进一步清楚阐述本发明的内容,但本发明的保护内容不仅仅局限于下面的实施例。在下文的描述中,给出了大量具体的细节以便提供对本发明更为彻底的理解。然而,对于本领域技术人员来说显而易见的是,本发明可以无需一个或多个这些细节而得以实施。
实施例1-10
(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺化合物的制备方法,包括以下步骤:
,
式中,Me代表甲基,
将阿魏酸(1)、缩合剂和溶剂加入反应瓶中,搅拌均匀后加入1,2,3,4-四氢异喹啉(2),加毕,温度T下搅拌反应n小时,TLC监测;反应结束后,减压蒸除溶剂,残余物中加入水,用二氯甲烷萃取,有机层合并后用饱和氯化钠水溶液洗涤,无水硫酸钠干燥,过滤,滤液减压蒸除溶剂,残余物以硅胶柱层析纯化(洗脱剂:石油醚/丙酮=20/1),得目标产物(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)。
(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)为白色固体,熔点为181.6~183.7°C,收率为30%~85%,其化学结构均经1H NMR、13C NMR和ESI-MS确证。
其中,所述溶剂为二氯甲烷、四氢呋喃和甲苯中的一种或多种;所述缩合剂为EDCI、HOBT、DCC、DMAP和卡特缩合试剂中的一种或多种;所述阿魏酸(1):1,2,3,4-四氢异喹啉(2):缩合剂的摩尔投料比为1:1.0~10.0:1.0~10.0;反应温度为0~105℃,反应时间为1~72小时。
本发明中,EDCI:1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,化学式为C8H18ClN3;HOBT:1-羟基苯并三唑,化学式为C6H5N3O;DCC;二环己基碳二亚胺,化学式为C13H22N2;DMAP:4-二甲氨基吡啶,化学式为C7H10N2;卡特缩合试剂:苯并三唑-1-三(三甲氨基)-三氟磷酸酯,化学式为C12H22F6N6OP2。
实施例1-10的具体工艺条件见表1。
表1 本发明工艺条件
。
本发明实施例1所得(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)的1H NMR、13C NMR和ESI-MS检测结果为:
1H NMR (400 MHz,CDCl3) δ 7.66 (d,J = 15.2 Hz,1H,C=CH),7.24-7.12 (m,5H,5 × Ar-H),7.16 (d,J = 1.6 Hz,1H,Ar-H),6.93 (d,J = 8.0 Hz,1H,Ar-H),6.80 (d,J = 15.2 Hz,1H,C=CH),6.04 (s,1H,OH),4.84 (s,2H,phCH2N),3.94 (s,3H,OCH3),3.88 (s,2H,phCH2),3.97-2.91 (m,2H,NCH2),3.80-3.74 (m,4H,2 × NCH2).
13C NMR (100 MHz,CDCl3) 166.24,147.42,146.74,143.06,134.25,133.70,128.97,128.26,127.81,126.76,126.14,121.90,114.79 (2C),110.02,56.02,43.60,29.74.
MS (ESI) m/z: 310.1 [M + H]+.
本发明还提供了一种治疗神经退行性疾病的药物组合物,包括有效量的上述治疗神经退行性疾病药物或其药学上可接受的水合物。所述药物组合物可进一步含有一种或多种药学上可接受的载体或赋形剂。所述“有效量”是指引起研究者或医生所针对的组织、系统或动物的生物或医药反应得药物或药剂的量;所述“组合物”是指通过将一种以上物质或组分混合而成的产品;所述“药学上可接受的载体”是指药学上可接受的物质、组合物或载体,如:液体或固体填充剂、稀释剂、赋形剂、溶剂或包囊物质,它们携带或转运某种化学物质。所述药学上可接受的赋形剂例如可举出:乳糖、葡萄糖、淀粉、蔗糖、微晶纤维素、甘草粉末、甘露糖醇、碳酸氢钠、磷酸钙、硫酸钙。
上述药物组合物进一步可为口腔速崩片、口腔复方制剂、口服缓控释制剂、储库型长效注射剂或透皮给药制剂。
实施例11
(1)乙酰胆碱酯酶和丁酰胆碱酯酶抑制活性
向96孔板中依次加入1.0 mmol/L碘化硫代乙酰胆碱或硫代丁酰胆碱(均购自Sigma公司)30 μL,pH=8.0的PBS缓冲液40 μL,待测化合物溶液20 μL (DMSO含量小于1%)和10 μL乙酰胆碱酯酶(EeAChE)或丁酰胆碱酯酶(equine serum BuChE,eqBuChE)(0.045U,均购自Sigma公司),添加结束混匀后,37°C孵育15 min,向各孔中加入质量分数为0.2%的5,5'-二硫代-双(2-硝基)苯甲酸(DTNB,购自Sigma公司)溶液30μL显色,用酶标仪测定405 nm处各孔的光密度值(OD值),与不加待测样品的空白孔比较,计算化合物对酶的抑制率[酶抑制率=(1-样品组OD值/空白组OD值)×100%];选择化合物的五至六个浓度,测定其酶抑制率,并以该化合物摩尔浓度的负对数与酶的抑制率线性回归,求得50%抑制率时的摩尔浓度即为该化合物的IC50。
实验结果详见表2。
表2 (N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)的胆碱酯酶抑制活性
,
表2结果表明,本发明所提供的(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)对丁酰胆碱酯酶具有显著抑制活性,其IC50为3.4μM;较现有广泛使用的抗AD药多奈哌齐对丁酰胆碱酯酶的抑制活性(IC50为4.76μM)高。并且,(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)对丁酰胆碱酯酶的抑制活性(IC50为3.4μM)显著高于对乙酰胆碱酯酶(IC50为5.6μM)的抑制活性,说明本发明所提供的化合物(I)对丁酰胆碱酯酶具有选择性抑制作用。
(2)对Aβ1-42自身聚集的抑制活性
参照文献(Sang,Z.P. et al. Eur. J. Med. Chem. 2015,94,348-366)所报道的方法进行测定,即:预处理后的Aβ1-42用DMSO配成储备液,使用前用pH7.4的PBS缓冲液稀释至50μM;待测化合物用DMSO配成2.5mM储备液,使用前用pH7.4的PBS缓冲液稀释至相应浓度,取20 μL的Aβ1-42溶液+20 μL的待测化合物溶液、20 μL Aβ1-42溶液+20 μL PBS缓冲液(含2% DMSO)、20 μL PBS缓冲液(含2% DMSO)+20 μL PBS缓冲液(含25% DMSO)于黑色96孔板中,化合物和Aβ1-42的最终浓度均为25 μM。37°C孵育24 h,然后加入160 μL含有5 μM硫黄素T的50 mM的甘氨酸-NaOH缓冲液(pH=8.5),振摇5s后立即用Varioskan Flash Multimode Reader多功能酶标仪在446 nm激发波长和490 nm发射波长下测定荧光值;Aβ1-42+待测化合物的荧光值记录为IFi,Aβ1-42+PBS缓冲液的荧光值记录为IFc,只含有PBS缓冲液的荧光值记录为IF0,由化合物抑制Aβ1-42自身聚集的抑制率计算公式为:100-(IFi-IF0)/(IFc-IF0)×100;每个化合物每个浓度测定两个复孔;以姜黄素为阳性对照。
实验结果详见表3。
表3 (N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)对Aβ1-42自身聚集的抑制活性测试
,
a Inhibition was determined at 25 μM inhibitor concentration,and the mean ± SD of the 3 independent experiments.
表3结果表明化合物(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)具有较好的抑制Aβ1-42聚集活性,抑制率为61.1%;阳性药姜黄素的抑制率为56.8%;广泛使用的抗AD药多奈哌齐在25μM浓度下对Aβ1-42自身聚集的抑制率小于5%。
(3)抗氧化活性测定(ORAC-FL法)
试剂与仪器:6-羟基-2,5,7,8-四甲基色烷-2-羧酸(trolox,购自梯希爱(上海)化成工业发展有限公司)用75mM的PBS缓冲液(pH7.4)配成10-80μmol/L的溶液;荧光素(fluorescein,购自梯希爱(上海)化成工业发展有限公司)用75 mM的PBS缓冲液(pH7.4)配成250 nmol/L的溶液;2,2’-偶氮二异丁基脒二盐酸盐(AAPH,购自韶远化学科技(上海)有限公司)在使用前用75 mM的PBS缓冲液(pH7.4)配成40 mmol/L的溶液;
酶标仪为Varioskan Flash Multimode Reader(Thermo Scientific)。
测定实验方法:向黑色96孔板中加入50或10 μmol/L的化合物溶液20 μL和荧光素溶液120 μL,混匀,37 °C孵育15 min,加入AAPH溶液60 μL,使每孔总体积为200 μL,混匀,立即置于Varioskan Flash Multimode Reader仪器中,在485 nm激发波长和535 nm发射波长下每分钟测定一次荧光值,连续测定90 min,通过仪器自动计算出荧光衰减曲线下面积AUC。其中以1-8 μmol/L的trolox作为标准,以不加待测样品为空白。化合物的抗氧化活性结果表达为trolox的当量,计算公式为:[(AUC Sample-AUC blank)/(AUC Trolox-AUC blank)][(concentration of Trolox/concentration of sample)]。每个化合物每次测定3个复孔,每组实验独立重复三次。
实验结果详见表4。
表4 (N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)的抗氧化活性测定
表4结果表明,本发明所提供的(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)的抗氧化活性为Trolox的1.1倍,具有较好的抗氧化活性。
(4)化合物(I)对PC12细胞的细胞毒性测定
PC12细胞用含10%胎牛血清的DMEM培养液,以密度为4×104个/ml接种于96孔培养板上,接种体积为100 μl/孔,随后放入含5%CO2的37°C恒温培养箱内培养。PC12细胞培养24小时后,给药组中加入不同浓度的化合物(I)(终浓度为100μM, 10μM, 1μM)10 μL/孔,恒温培养24 h后,各组中加入5 mg/mL的3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四氮唑溴盐(MTT)100 μL/孔,进行活细胞染色。待3小时后,各组中加入100%DMSO终止液100 μL/孔,充分溶解混匀。在590 nm的波长下测定各组的OD值。各化合物分别以100 μM、10 μM、1 μM测试3次结果,用Duncan’s test方法统计,以对照组为100%,给药组值以对照组的百分比表示。抑制率=(对照-化合物)/对照*100%。
测定结果详见图1,表明化合物(I)具有较低的细胞毒性,拥有一个安全的治疗范围。
(5)化合物对H2O2诱导的PC12细胞损伤的保护作用筛选
PC12细胞用含10%小牛血清的DMEM培养液,以1×105个/mL密度接种于96孔培养板上,接种体积为100mL/孔,随后放入含5%CO2的37℃恒温培养箱内培养。培养24小时后,给药组中加相应浓度的化合物(终浓度为10μM, 1μM)10mL/孔,预孵育2小时(对照组与损伤组分别加10μL/孔PBS,使其体积保持相等)。PC12细胞孵育2小时后,在给药组与损伤组中分别加入100μΜH2O2损伤剂10μL/孔(对照组加10μL/孔PBS),30分钟后,将各组的培养液均换成无小牛血清的培养液继续放入恒温培养箱内培养24小时,培养液体积认为100μL/孔。继续培养24小时后,各组加入5mg/mL,MTT 100μL/孔,进行活细胞染色。待3小时后,各组中加入100%DMSO终止液100μL/孔,充分溶解混匀。在490 nm的波长下测定各组的OD值,测试结果重复3次,用Duncan’s test 方法统计,各组数值表示为均数±S.E.M.,以对照组为100%,给药组及损伤组值以对照组的百分比表示。
测定结果详见图2,图2表明化合物(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)对H2O2诱导的PC12细胞损伤具有显著的神经保护作用。
(6)化合物(I)的急性毒性试验
试验材料:实验动物为SPF级昆明种小鼠,由四川省中医药科学院提供,生产合格证号SCXK(川) 2008-19。动物饲养于四川省中医药科学院药理毒理研究所SPF屏障系统中。室内温度20~22℃,相对湿度40%-70%左右,照明12小时明亮,12小时黑暗,自由饮水。全营养颗粒饲料由四川省中医药科学院实验动物中心提供。
实验方法:动物随机分组:取SPF级18~22g的小鼠40只,雌雄各半,适应性喂养两天后,按体重随机分为4组。禁食不禁水15h后,分别灌胃化合物(I)1000 mg/kg、500 mg/kg、250 mg/kg、100 mg/kg四个剂量组,取给药体积为0.4 mL/10g ,各组给药一次,连续14天观察并记录各动物的死亡情况,采用Bliss统计软件进行分析。发现各组小鼠未出现毛竖起、行动迟缓、闭眼和呼吸加速以及死亡现象。测定结果表明SPF级昆明种小鼠经(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)处理后,未出现急毒和死亡率,也未出现毛竖起、行动迟缓、闭眼和呼吸加速等现象,表明了化合物是无毒的,且最大耐受量为1000 mg/kg。
(7)动物实验-跳台被动回避实验
试剂与仪器:多奈哌齐购自Eisai China Inc.;东莨菪碱购自J&K Scientific;18-22g的昆明鼠购自四川中医药科学院实验动物中心(合格证号:SCXK-Sichuan 2008-19);动物饲养于四川省中医药科学院药理毒理研究所SPF屏障系统中。饲养环境12 h光照/12 h黑暗交替,环境温度控制于20-22 °C,湿度控制于50-60%。全营养颗粒饲料由四川省中医药科学院实验动物中心提供。小鼠跳台仪(型号ZXC-5Q)由山东省医学科学院设备维修供应站生产
实验方法:60只小鼠,18~22 g,雌雄各半,按体重随机分为6个组,即空白对照组、模型对照组、多奈哌齐组(5.0mg·kg-1)、化合物(I)高剂量组(10.0 mg·kg-1)、化合物(I)中剂量组(5.0mg·kg-1)、化合物(I)低剂量组(2.5mg·kg-1)。每组小鼠按给药剂量分上下午给药,连续给药3次,末次给药后50 min进行造模,除空白对照组以外其他各组腹腔注射东莨菪碱3 mg·kg-1,连续给药24天。造模后20 min进行跳台法训练,将动物放入反应箱内适应3 min,然后立即通以36 V交流电,训练5 min,并记录每次小鼠受到电击的次数(错误次数),并由此作为学习成绩。24 h后进行测试,每只小鼠测定 5 min,记录受到电击的动物数及第一次跳下平台的潜伏期以及5 min内的错误次数,结果进行统计学分析,所有数据均用均值±标准误差(Stand error,S.E.)表示。采用SPSS11.5软件分析,方差齐的选择单因素方差分析(One-way ANOVA)。计量资料比较采用单因素方差分析,各组均数的比较采用t检验,结果分别见图3。
参阅图3,实验结果表明:本发明(N-1,2,3,4-四氢异喹啉基)-阿魏酰胺(I)对东莨菪碱所致小鼠记忆再现功能障碍均具有明显改善作用。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,本领域普通技术人员对本发明的技术方案所做的其他修改或者等同替换,只要不脱离本发明技术方案的精神和范围,均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!