多能性干细胞的非致瘤性增殖的制作方法
本申请是申请号为201210116985.5,申请日为2012年4月19日,发明名称为“多能性干细胞的非致瘤性增殖”的中国专利申请的分案申请。
本发明关于人类多能性干细胞的增殖,尤其是关于人类胚胎干(hes)细胞的非致瘤性增殖。
背景技术:
人类胚胎干(hes)细胞是多能性的,且其具有分化为成人大多数细胞种类的强大能力。因此,该细胞是再生医学的强大保证。该hes细胞令人向往的特殊性质包含不死性、多能性及无限制的未分化生长。传统上,在滋养层(feederlayer)细胞(如小鼠胚胎纤维母细胞(mefs))上培养多能性胚胎干细胞,以将该细胞维持于未分化状态。该滋养层对于维持该等细胞是必要的;且通常在该滋养层上培养hes细胞直到需要分化时为止。不幸地,该小鼠滋养层维持细胞经常与hes细胞接触而受到污染,虽对于小鼠滋养层维持细胞不会造成多大功能上的影响,仍因此使小鼠滋养层细胞中培养的hes细胞不适用于临床。已有报告指出,无滋养层培养的人类多能性干(hps)细胞会很快死亡,或者分化为定型细胞(committedcells)的异源性群体(heterogeneouspopulation)。
许多报告已证实,尝试使用无细胞的成分或是至少避免非人类的成分或细胞,来取代该滋养层或维持细胞。该取代物无法展现长期保证的结果,且这样的尝试已证实不足以维持细胞稳固(robust)且继续增殖(propagation)。再者,该取代方式还展现,于无滋养层细胞的培养中,生长于培养基取代物中的hes细胞的确在hes细胞群落周围形成已分化细胞,这是没有实现最理想情况的标志。
因此,需要开发使用不造成污染及形成畸胎瘤(teratomas)的另一种滋养层细胞源来培养hes细胞的替代方案。
技术实现要素:
一实施方式中,本发明提供一种人类多能性干细胞的增殖方法,共同培养人类多能性干细胞与脐带衍生干细胞。该脐带衍生干细胞于培养基中形成滋养层,用于增殖该人类多能性干细胞,且将该人类多能性干细胞维持于未分化状态。
一实施方式中,该人类多能性干细胞的增殖为非致瘤性增殖,使得该人类多能性干细胞不会形成畸胎瘤。
另一实施方式中,该人类脐带衍生干细胞对于cd10、cd13、cd29、cd44、cd73、cd90、cd166及hla-abc为阳性,但对于cd1q、cd3、cd34、cd45、cd56、cd117及hla-dr为阴性。该人类脐带衍生干细胞具有成骨(osteogenic)或成脂(adipogenic)细胞分化能力。
另一实施方式中,该脐带衍生干细胞为人类脐带间质干细胞(hucmscs),且衍生自人类脐带的华顿氏胶(wharton’sjelly)。
另一实施方式中,该人类多能性干细胞对于碱性磷酸酶(ap)、oct-4、ssea-4、tra-1-60、tra-1-81、nanog、sox2、nf-200、短尾突变型(brachyury)、atbf1或map2为阳性,且表达gdf9、gata4、hand1或tuj-1基因。又,于该人类多能性干细胞中myc被降低调控。
另一实施方式中,该人类多能性干细胞为人类胚胎干(hes)细胞,并形成类胚胎体(embryoidbodies)。
另一实施方式中,本发明提供一种用于增殖人类多能性干细胞的培养基,其中,该培养基包含在培养基中形成滋养层的脐带衍生干细胞。一实施方式中,培养基中的该脐带衍生干细胞为人类脐带间质干细胞(hucmscs)。
另一实施方式中,本发明提供一种用于增殖人类多能性干细胞的试剂盒,其中,该试剂盒包括包含脐带衍生干细胞的培养基,及其使用说明书。在一实施方式中,该试剂盒的培养基中的该脐带衍生干细胞为人类脐带间质干细胞(hucmscs)。
附图说明
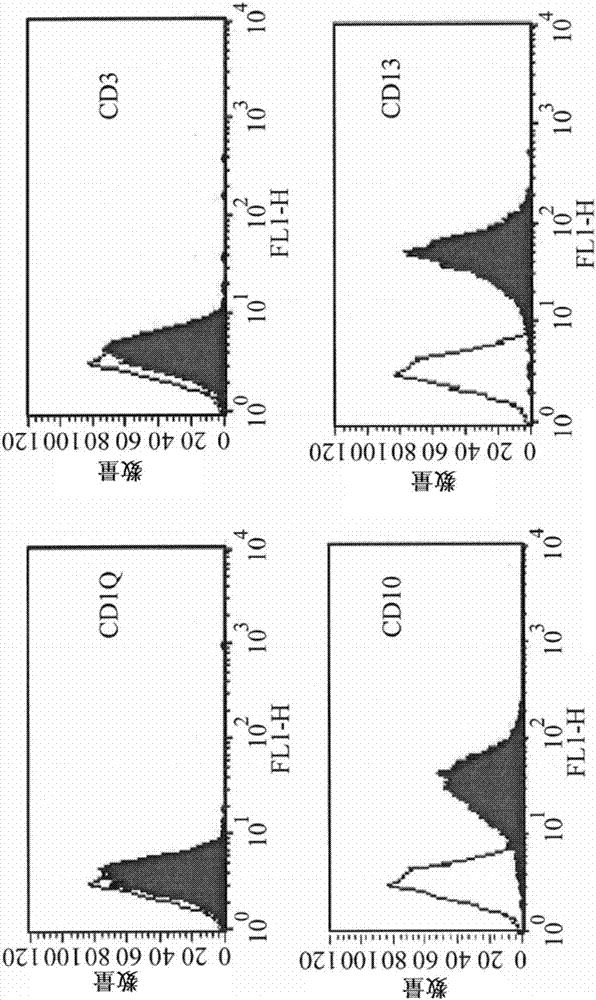
图1显示hucmsc的形态、免疫表型(immunotyping)及体外分化。生长自组织培养物的华顿氏胶细胞为类纤维母细胞,且具有纺锤状型态(图1a)。流式细胞仪快速地区分hucmscs,显示其对于cd1q、cd3、cd34、cd45、cd56、cd117及hla-dr为阴性,而对于cd10、cd13、cd29、cd44、cd73、cd90、cd166及hla-abc为阳性(图1b)。待成脂细胞分化后,该细胞形成中性脂肪空泡,并含有复数对于油红染料为阳性的脂肪小滴(图1c,上)。于成骨细胞培养基中,该细胞延展而形成矿化基质,该矿化基质于三至四周的培养(cultivation)后被茜红染料显著染色(图1c,下)。通过rt-pcr分析(以gapdh作为阳性控制组)显示对于成脂(pparγ)及成骨(骨桥蛋白,osteopontin)细胞分化具有专一性的基因表达(图1d)。图1a左的比例尺表示1000μm,而图1a及图1c右的比例尺表示100μm。
图2显示生长于hucmc及mef滋养层上的未分化人类es细胞群落的形态。生长于hucmc上的hes群落图(图2a)及生长于mef上的hes群落图(图2b)。生长于hucmc上的群落放大图显示典型的hes细胞形态具有高核质比(图2c及图2d)。图2a及图2b的比例尺表示1000μm,而图2c及图2d的比例尺表示100μm。
图3显示生长于hucmc上的人类es细胞表现型(phenotype)。使用专一性抗体的该hes群落的免疫染色(immnostaining)显示碱性磷酸酶(图3a)、oct-4(图3b)、ssea-4(图3c)、tra-1-60(图3d)、及tra-1-81(图3e)的高度表达。于hucmc上持续培养并继代20次后,在es细胞中观察到代表性的正常染色体组型(46,xx)(图3f)。比例尺表示1000μm。
图4显示衍生自hes的类胚胎体(eb)的萤光免疫染色。相位差显微镜下显示的类胚胎体(图4a),及使用nf-200抗体(图4b)、短尾突变型抗体(图4c)、atbf1(图4d)、及map2(图4e)的免疫染色。比例尺表示1000μm。
图5显示不同滋养层上hes细胞的不同分化标记的表达。图5a为通过rt-pcr手段说明对于生殖细胞(gdf9)、内胚层(gata4)、中胚层(hand1)及外胚层(tuj-1)有专一性的基因表达。gapdh作为控制组。图5b说明图5a所显示的基因表达的半定量分析。
图6显示当滋养层细胞由hucmsc变为mef的发展自hes细胞的畸胎瘤。图6a显示待nod-scid小鼠上的滋养层由hucmsc变为mef后,畸胎瘤(箭头指示)快速发展自hes细胞。组织切片显示黑色素细胞(melanocyte)的带状物,其具有似视网膜(retina-like)结构(图6b)、似神经管(neurotube-like)结构(图6c-图6e)、生牙上皮(odontogenicepithelium)(图6f)、神经上皮(图6g)、未成熟的软骨(图6h)及未成熟的鳞状上皮(squamoidepithelium)(图6i)。比例尺表示100μm。
图7显示培养于hucmsc及mef上的hes细胞的多能性基因表达。图7a说明培养于hucmsc(wj)及mef上的hes细胞(es)的oct4、nanog、sox2及myc的rt-pcr分析,并以gapdh作为内部控制组。图7b说明图7a所显示的基因表达的半定量分析。图7c说明通过西方点墨法分析测量c-myc蛋白质。图7d说明通过rt-pcr测量的myc的mrna等级,以该内部控制组的倍数显示。eb表示类胚胎体。
具体实施方式
本文所提供的多种具体细节用以更详细了解本发明。
实施例
该基因与其它分化标记基因的rt-pcr及定量rt-pcr
机械性地移除并以rlt裂解溶液(lysisbuffer)(qiagen)处理培养于hucmscs或mef滋养层上的未分化或已分化的hes细胞。依照制造商说明书使用superscriptiiione-steprt-pcr试剂盒(invitrogen)合成第一条cdna。表1显示每对引物的序列、粘合温度及产物大小。所有的pcr样本通过含有0.5μg/ml溴化乙啶(sigma)的2%琼脂胶电泳分析。关于定量rt-pcr(qrt-pcr),是在abisteponeplus系统(appliedbiosystems)中使用faststartuniversalsybrgreenmaster(rox,roche,usa)基因表达试验,以gapdh作为内部控制组。引物的序列及粘合温度显示于表1。
表1
hucmscs的分离及增殖
将人类脐带样本(长20厘米,重20克)收集于含有hanks’平衡盐溶液(hbss;gibco/brl14185-052)的灭菌盒中。收集及使用人类脐带的实验流程为慈济大学医院人体试验委员会所认可的。同意的书面纪录已自阵痛前的怀孕妇女获得。
以无ca2+及mg2+的磷酸盐缓冲生理盐水(dulbecco’spbs,lifetechnology)清洗收集的人类脐带组织。沿中线机械性切开,且将脐带动脉、静脉及羊膜自华顿氏胶(wj)分离。接着将该胶切成小于0.5立方厘米的片状,以胰蛋白酶/edta(sigma,st.louis,usa)处理,并于37℃,95%空气/5%co2的潮湿环境中培养30分钟。接着将该组织培养物培养于含有10%人类脐带血清(cbs)及抗生素的dulbecco’smodifiedeagle培养基(dmem)中,并静置五至七天以使该细胞自该组织培养物迁移(migrate)。
衍生自人类脐带的hucmscs的特性
通过流式细胞仪分析msc专一性表面标记的特性。将细胞以2mm磷酸盐缓冲生理盐水(pbs)分开,清洗并与已接合萤光素异硫氰酸盐(fluoresceinisothiocyanate,fitc)或藻红蛋白(phycoerythrin,pe)的适当抗体培养。该抗体为cd1q、cd3、cd10、cd13、cd14、cd29、cd31、cd34、cd44、cd45、cd49b、cd49d、cd56、cd73、cd90、cd105、cd117、cd166、hla-abc及hla-dr(bd,pharmingen)。接着,使用bectondickinson流式细胞仪(vantagese,bectondickinson,sanjose,ca)分析细胞。
在wj组织片的第一次培养后,贴附自该组织培养物迁移的带有纺锤状形态的生长细胞(图1a)。该细胞以28小时的倍增时间(doublingtime)快速分裂,且经历多于25次继代(相当于多于40次数量倍增),无自发性的分化。该细胞对于cd1q、cd3、cd34、cd45、cd56、cd117及hla-dr为阴性,且对于cd10、cd13、cd29、cd44、cd73、cd90、cd166及hla-abc为阳性(图1b)。这些观察证实分离自人类脐带的wj的细胞具有与间质干细胞(mscs)相同的表面标记。
hucmsc体外分化至骨细胞及脂肪细胞
为了诱发成骨及成脂细胞分化,将hucmscs转移(transfer)至成骨培养基(补充10%cbs、0.1μmol/l地赛米松(dexamethasone)、10mmol/lβ-甘油磷酸、及50μmol/l抗坏血酸盐的dmem)及成脂培养基(补充10%cbs、1μmol/l地赛米松、5μg/ml胰岛素、0.5mmol/l异丁基甲基黄嘌呤及60μmol/l吲哚美辛(indomethacin)的dmem)三周。通过茜红染料(alizarinreds)(sigma,usa)染色来确认钙化,以评估成骨潜力。为了确认成脂细胞分化,于显微镜下观察细胞内脂肪小滴,且该脂肪小滴通过油红染料(oil-red-o)的染色被区分。
hucmsc的成脂细胞分化在以成脂培养基补充物培养两周后可见。于第二周结束时,细胞形态及中性脂肪空泡(neutrallipidvacuoles)的形成(几乎所有细胞含有许多对油红染料阳性的脂肪小滴)有明显改变(图1c)。同样地,成骨培养基所诱发的细胞分化使得经处理的细胞快速生长且含有被茜红染料强烈染色的钙化基质,显示培养三至四周的钙沉淀(图1c)。rt-pcr分析可见成脂(pparγ)及成骨(骨桥蛋白,osteopontin)基因的表达。
经hucmsc共同培养的hes细胞株的特性
将得自工业研究院生物医学及装置研究实验室的tw1细胞株(p22,即,第22次继代)先培养于mefs,如供应者(即台湾食品工业发展研究(firdi))所指导。将丝裂霉素-c(mitomycin-c)去活化后的mefs或hucmscs作为滋养层细胞,用来培养hes细胞。hes细胞以每孔每9.4平方厘米200,000颗细胞的密度种(plate)于六孔盘。hes细胞培养基包括80%(v/v)knockout(ko)dmem(商品名)、20%(v/v)ko血清取代物、2mml-谷酰胺酸、10mm非必需氨基酸(全来自invitrogen)、50μmb-巯基乙醇(sigma)、及4ng/mlbfgf。
使用对于未分化的hes细胞有专一性的萤光标记抗体,通过免疫细胞化学分类,该抗体为ssea-4、ssea-1、tra-1-60、tra-1-81及oct-4(es细胞分类试剂盒;chemicon)。首先,将hes细胞与滋养层细胞培养于培养盘中的腔式载玻片(chamberslide)(nunc,denmark)或灭菌盖玻片(assisten,germany)。在继代后三至七天的特定时间将hes细胞群落进行免疫萤光染色。简单来说,以4%三聚甲醛固定细胞,接着进行几个流程,包含渗透(permeabilization)(0.1%tritonx-100)、阻断(blocking)(4%正常山羊血清)、一抗处理(1:10-1:50稀释)、清洗三次、萤光标记二抗处理、清洗多于三次、以盖玻片覆盖并封片(mounting)。使用es细胞分类试剂盒(chemicon)进行碱性磷酸酶(ap)染色。
转移至hucmscs滋养层的hes细胞以36小时的倍增时间有效地形成群落并继续增殖。该群落的形态与培养于mefs上的细胞群落的形态有些微不同(图2a及图2b)。然而,培养于hucmscs上及培养于mefs上的单一人类es细胞的形态相同。该细胞维持圆形且小,具有高核质比,且明显存在一至三个核仁(图2c及图2d)。hucmscs滋养层上的tw1hes细胞表达ap、oct-4、ssea-4、tra-1-60及tra-1-81标记(图3a-图3e)。
于第40次继代研究细胞的核型(karyotype)。于继代后第七天,以0.1μg/ml乙酰甲基秋水仙素(colcemid)(gibco)处理hes细胞4小时。清洗细胞后,以0.25%胰蛋白酶处理3-5分钟或以iv型胶原蛋白酶处理8分钟,使用移液管收取细胞。接着将该细胞固定并封片于玻片上。于评鉴合格的细胞遗传实验室使用标准g条纹法(g-banding)分析减数分裂中期(metaphases)。于第40次继代,hucmscs滋养层上的twihes细胞显示正常核型46,xx(图3f)。
经hucmsc共同培养的hes细胞株的体外多能性
分化前,收取hes细胞并将其重新悬浮于无bfgf的hes细胞培养基中。接着,将该hes细胞以悬浮液中的聚集物(aggregates)的形式培养于低贴附六孔盘。五天后,添加胎牛血清(fbs)(最终浓度为5%)。聚集的hes细胞通常于七至十天后形成类胚胎体(eb),随后,自20%至80%的已形成的ebs出现成熟(囊状)ebs。接着,将所得固体或囊状eb种于经琼脂胶处理(gelatin-treated)的细胞培养玻片或35毫米培养盘中,用以进一步分化,随后以相似处理方式处理,以贴附培养直接生长的细胞。固定后,使用对于三胚层有专一性的萤光标记抗体对已分化的hes细胞进行免疫细胞化学研究,该抗体为map2、用于外胚层的nf200(chemicon)、用于中胚层的短尾突变型及用于内胚层的atbf1(santacruz))。
如生长于mefs上的hes细胞,当培养于悬浮液中,与hucmsc滋养层共同培养的hes细胞形成ebs。于该ebs中,观察到已表达三胚层的细胞分化。如免疫细胞化学所指出,该等细胞表达外胚层标记(map-2及nf-200)、中胚层标记(短尾突变型)及内胚层标记(atbf1)(图4)。如rt-pcr指出的,收取自七至十天的ebs细胞表达gdf9(与生殖细胞有关)、gata4(与内胚层有关)、hand1(与中胚层有关)及tuj-1(与外胚层有关)(图5)。
经hucmsc共同培养的hes细胞株的非致瘤性及体内多能性
使用玻璃毛细管机械性分开hes细胞,成块状(pelleted)重新悬浮于含有基质胶(matrigel)(bdbiosciences)的pbs(1:1)中,并注射至非肥胖性糖尿病-重症联合免疫缺陷(nod-scid)小鼠的背部皮下组织(n=17)或肾上腺(n=4)。使用血球计数器(hemecytometer)计数细胞及将细胞悬浮于多种浓度的含有基质胶的pbs(1:1)中。注射前,将hes细胞于冰上放置少于45分钟以维持理想生存率。通过触诊追踪畸胎瘤的形成,将所得肿瘤解剖、固定、包埋于石蜡中及处理,用于组织学研究。
使用异体移植(xenograft)模式于体内调查长期培养于hucmsc滋养层后的细胞发展潜力。在21次不同移植至nod-scid小鼠(n=18)及裸鼠(n=3)两者的密集实验中,于多于三个月的长期追踪期间,并未观察到畸胎瘤生长(表2及表3)。然而,在之后暂时(几天)培养于mef滋养层上清楚观察到畸胎瘤。衍生自hes细胞的畸胎瘤在转移至hucmsc滋养层之前与之后,其组织学并无不同(表2及图6)。
表2tw1人类胚胎干细胞分别培养于作为滋养层的mef及hucmsc上的异体移植实验摘要
表3经hucmsc共同培养的人类干细胞的异体移植试验
*s.c.:皮下
经hucmsc共同培养的hes细胞中myc的降低调控
于裂解缓冲液(150mmnacl、50mmtris-hcl[ph7.4]、1%乙基苯基聚乙二醇-40(nonidetp-40)加上蛋白酶抑制剂混合物(cocktail)(roche,indianapolis,in)中裂解细胞。于10%十二基硫酸钠-聚丙烯酰胺电泳胶(sds-page)进行(electrophorese)蛋白质的电泳,接着转移至硝化纤维素膜(hybond-csuper;amersham,littlechalfont,uk)。将该膜与抗c-myc(2μg/m)或抗α-肌动蛋白(1:10,000;sigma-aldrich)单株抗体培养。使用已接合hrp山羊抗小鼠igg(jacksonimmno-researchlaboratories)作为二抗。使用增强型化学发光试剂(enhancedchemiluminescence)(ecl;amersham)检测已结合的抗体。
进一步检测两种不同滋养层上的hes中关键多能性基因的表达。如rt-pcr所指出,未分化干细胞的标记,如oct-4、nanog、及sox2快速表达(图7a及图7b)。在经hucmsc共同培养的hes细胞中观察到同源盒基因(homeoboxgene)oct4及原致癌基因(proto-oncogene)myc的低表达量(图7a及图7b)。进一步经西方点墨法分析及定量rt-pcr证实此myc的降低调控(图7c及图7d)。
- 还没有人留言评论。精彩留言会获得点赞!