一种基于16SrDNA测序的泡菜发酵剂定向制备方法与流程
本发明涉及蔬菜加工与食品生物技术领域,具体涉及一种基于16srdna测序的泡菜发酵剂定向制备方法。
背景技术:
泡菜是我国传统腌制蔬菜中的一大类别,其历史可追溯到2000多年以前。千百年来,泡菜以其酸鲜纯正、脆嫩芳香、清爽可口,自然本色、醇厚绵长、解腻开胃、促消化增食欲等品位及功效吸引着业内人士和众多中外消费者。但泡菜是我国从简陋的作坊式模式发展起来的发酵蔬菜加工产品,一家一户的自然发酵制作模式代表了它的古老和传统,及成败由天的自然发酵模式又十分现实地表明了其制作过程处在不可控或可控性较差的制作环境之中。纯乳酸菌接种使泡菜工业的传统生产工艺发生了变革,能推动了泡菜工业的发展。在保持传统泡菜优良品质的基础之上,应用直投式乳酸菌进行发酵泡菜具有以下优势:1)所接乳酸菌能快速成为优势菌种,且采用低盐工艺,产品含盐量低,不产生高盐污水;2)ph降低,酸度增加,有利于产品保存;3)缩短了发酵周期,提高了产品的成熟度;4)蔬菜色泽稳定,亮度提高;5)发酵不受气候及季节影响;6)能降低亚硝酸盐等有害物质的含量,确保食品安全;7)可以直接向专业生产厂家购买作为生产发酵剂使用,在发酵生产中省略了发酵剂的制备工序,减少了生产车间的投资和空间,降低了生产成本;8)无杂菌污染防止了菌种的退化;9)生产标准化、规模化,能够实现大规模的批量生产。
泡菜的腌制过程是微生物的发酵过程。正是利用微生物的发酵原理,泡菜在自然发酵过程中,丰富的微生物菌群对泡菜制品的保藏和形成各自独特的风味起到很大的作用。起发酵作用主要的微生物为乳酸菌,包括乳杆菌属、片球菌属、明串株菌属、链球菌属、乳球菌属。但由于一些菌群的不可培养性或较差重复性,导致传统的分离培养方式难以全面、客观地反映泡菜盐渍过程中的菌群结构和变化,因此目前根据传统分离培养所制得的发酵剂生产的泡菜难以真正反映其风味与品质,出现了风味单一、发酵味不醇厚等问题。另外,传统微生物种类鉴定的方法一般采用表型特征鉴定,但此法存在操作步骤繁琐、工作量大、周期长、某些检测结果不稳定等问题。因此,根据不同蔬菜的发酵特性,寻找更为优良、有效的发酵剂制备方法对于传统蔬菜加工方式意义重大。
随着生物技术的飞速发展,传统的微生物鉴定方法常常难以鉴定众多的生长习性复杂的微生物,因而基于基因组序列的分子鉴定受到广泛关注。在细菌基因组中,编码16srrna的rdna基因具有良好的进化保守性,适宜分析的长度(约为1540bp),以及与进化距离相匹配的良好变异性,所以成为细菌分子鉴定的标准标识序列。16srdna序列分析的一个显著特点是能及时鉴定出生长缓慢或生化反应惰性的细菌。
技术实现要素:
本发明针对传统直投发酵剂存在发酵制品风味单一等问题,提出了一种基于16srdna测序的泡菜发酵剂定向制备方法,该方法可定向筛选出主导渍菜盐渍及盐渍风味、品质的不同乳酸菌属,特异性和目标导向性强,准确度高,不必反复纯化。
为实现本发明的发明目的,发明人提供如下技术方案:
一种基于16srdna测序的泡菜发酵剂定向制备方法,至少包括以下步骤:
(1)于泡菜老卤水中取样,样品置于无菌冷冻管中,立即放入液氮中保存,然后置于超低温冰箱中,
(2)提取样品dna并做琼脂糖凝胶电泳检测后做pcr,扩增16srdna,所述的pcr扩增的特异性引物的上游引物515f具有如seqidno.1所示的核苷酸序列(5’-gtgccagcmgccgcgg-3’),特异性引物的下游引物907r具有如seqidno.2所示的核苷酸序列(5’-ccgtcaattcmtttragttt-3’),pcr扩增区域为微生物16srdna的v4-v5可变区域,测序前需对所述pcr产物进行回收纯化,
(3)将步骤(2)获得的pcr产物进行高通量测序并做比对分析,确定优势菌群种类与组成比例,
(4)优势菌株的定向筛选(参考《食品微生物学检验乳酸菌检验(gb4789.35-2010)方法》以及《乳酸细菌分离鉴定及实验方法》实施),将所筛选的菌株分子生物学鉴定(图1),序列同源性须达到99%,
(5)定向筛选菌株的高密度增殖培养,
(6)离心并冷冻干燥,
将步骤(5)经高密度增值培养的菌液经冷冻离心,去除上清培养液,收集试管底部菌体;收集的菌体加入冻干保护剂后做冷冻干燥,其中:菌体与冻干保护剂质量分数配比为1:2-1:4.5,
(7)将步骤(6)得到的各定向筛选和高密度增值培养的菌株冷冻干燥粉按照16srdna测序确定的优势菌群种类与组成比例混合,制得泡菜专用直投式发酵剂。
作为优选方案,根据本发明所述的一种基于16srdna测序的泡菜发酵剂定向制备方法,其中,所述的步骤(4)优势菌株的定向筛选按如下操作:在所述步骤(1)的所取样品中,取1ml液体于生理盐水中进行10倍的梯度稀释,均匀涂布在定向培养基上,然后在35~37℃恒温箱中定向培养36~72h,观察菌落;然后将定向培养的菌株进行生理生化特征鉴定实验;根据鉴定结果,将定向筛选后的菌株进行斜面培养。
作为优选方案,根据本发明所述的一种基于16srdna测序的泡菜发酵剂定向制备方法,其中,所述的步骤(5)定向筛选菌株的高密度增殖培养按如下步骤操作:将上述步骤(4)定向筛选与纯化培养的菌株进行高密度增值培养,高密度增值培养基为乳酸菌培养基,培养条件为35~37℃恒温箱中培养48~72h;所述的乳酸菌培养基配方为:蛋白胨5g,牛肉膏5g,酵母膏5g,吐温80(tween80)0.5ml,糖或醇10g,酵母粉5g,琼脂5~6g,蒸馏水(1000ml);加热溶解后,校正ph=6.2~7.2,121℃高压灭菌15~20分钟。
作为优选方案,根据本发明所述的一种基于16srdna测序的泡菜发酵剂定向制备方法,其中,所述的步骤(6)中将步骤(5)经高密度增值培养的菌液,摇匀后以4000-5000rpm转速于-5~10℃条件下离心25-30分钟。
作为优选方案,根据本发明所述的一种基于16srdna测序的泡菜发酵剂定向制备方法,其中,所述的步骤(6)中冻干保护剂配方为:脱脂乳25-30克、淀粉8-10克,丙三醇5-8克、维生素c5-6.5克、d-山梨醇5-7.2克、l-谷氨酸5-6克和蒸馏水250ml;冻干保护剂加热溶解后,121℃高压灭菌15-20分钟后备用。
作为优选方案,根据本发明所述的一种基于16srdna测序的泡菜发酵剂定向制备方法,其中,所述的步骤(6)中冷冻干燥的主要工艺参数为:-50~-70℃预冻12-24h后,-60~80℃冻干24-72h。
与现有技术相比,本发明的有益效果是:
(1)与采用传统分离培养制备的传统发酵剂相比,本发明通过高通量测序鉴定微生物菌群的16srdna,能准确的获得泡菜自然发酵后详细微生物群落结构与组成比例,并确定主要的乳酸菌菌群,从而准确的判断不同微生物菌群对泡菜自然发酵进程与制品品质的影响。所使用的目标菌种具有多样性、特异性,避免了传统发酵剂菌种单一、菌群良莠不齐、非特异性等缺点。
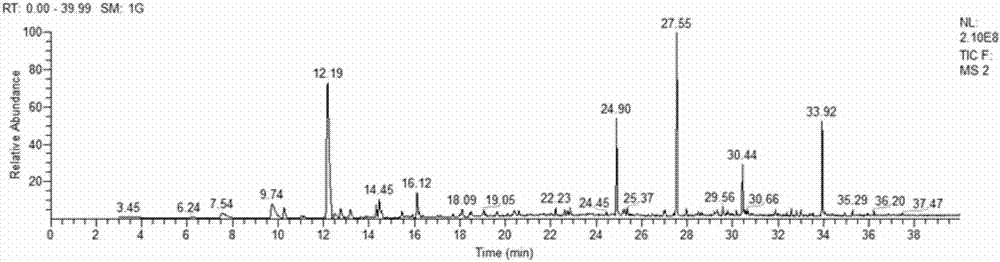
(2)本发明定向制备获得的泡菜专用发酵剂具有特异性与目标导向性特征。根据不同地方泡菜加工的不同工艺及品质、风味需求,通过配比菌种构成提高发酵效率,产物稳定、风味相似(图2和图3),避免了传统发酵剂发酵过程中所导致的发酵风味不纯的缺点。
(3)与传统筛选方法制备的发酵剂相比,一种基于16srdna测序的泡菜发酵剂定向制备方法在发酵剂制备过程中,菌种专一性强、活性高,所制得的发酵剂干粉易于储藏与运输。
附图说明
图1泡菜样品16srrna基因pcr扩增产物琼脂糖凝胶电泳图谱。
图2自然发酵泡菜气相色谱总离子流图。
图3本发明泡菜专用发酵剂气相色谱总离子流图。
具体实施方式
下面结合实施例,更具体地说明本发明的内容。应当理解,本发明的实施并不局限于下面的实施例,对本发明所做的任何形式上的变通和/或改变都将落入本发明保护范围。
在本发明中,若非特指,所有的份、百分比均为重量单位,所有的设备和原料等均可从市场购得或是本行业常用的。若无特别指明,实施例采用的方法为本领域通用技术。
实施例1
一种基于16srdna测序的泡菜发酵剂定向制备方法,按以下步骤进行:
(1)于泡菜坛中取样。采集后混匀,置于15ml的无菌冷冻管中,立即放入液氮中保存,然后置于-70℃超低温冰箱中。
(2)将步骤(1)采集的样品用dna提取试剂盒提取微生物的脱氧核糖核酸(英文缩写dna),所有样品的dna提取步骤均参照dna提取试剂盒说明书。对提取到的样品基因组dna进行3%琼脂糖凝胶电泳检测。
(3)将步骤(2)提取的dna用特异性引物进行pcr,扩增微生物的16srdna,特异性引物的上游引物515f具有如seqidno.1所示的核苷酸序列(5’-gtgccagcmgccgcgg-3’)、下游引物907r具有如seqidno.2所示的核苷酸序列(5’-ccgtcaattcmtttragttt-3’),聚合酶链式反应(即pcr)扩增区域为微生物16srdna的v4-v5可变区域,测序前对所述pcr产物进行回收纯化。
(4)将步骤(3)获得的pcr产物进行高通量测序。筛选测序所得数据并与已有数据库信息进行序列比对,获得菌群的可操作分类单元(otus);且与现有16sv4-v5数据库比对。根据标签序列和reads,泡菜中乳杆菌属(lactobacillus)占有比例为58.7%,分别为:清酒乳杆菌(lactobacillussakei)(核苷酸序列如seqidno.3所示)、戊糖乳杆菌(lactobacilluspentosus)(核苷酸序列如seqidno.4所示)、短乳杆菌(lactobacillusbrevis)(核苷酸序列如seqidno.5所示)、植物乳杆菌(lactobacillusplantarum)(核苷酸序列如seqidno.6所示),比例分别为:31.6%、10.9%、11.8%、4.4%;片球菌属(pediococcus)占有比例为18.1%:主要为戊糖片球菌(pediococcuspentosaceus)(核苷酸序列如seqidno.7所示);魏斯氏菌属(weissellas)占有比例为3.7%:主要为魏斯氏菌(weissellasoli)(核苷酸序列如seqidno.8所示)。
(5)乳杆菌属的定向筛选:
(5.1)清酒乳杆菌(lactobacillussakei)的定向筛选:在上述步骤(1)的所取样品中,取1ml液体于生理盐水中进行10倍的梯度稀释,均匀涂布在mrs培养基,然后在35~37℃恒温箱中培养48~72h,观察菌落。挑选出呈乳白色、圆形光滑的单菌落,进行斜面培养48~72h;接入液体mrs培养基培养48~60h。改良mrs琼脂培养基配方为:蛋白胨5g,牛肉膏5g,酵母膏5g,吐温80(tween80)0.5ml,糖或醇10g,酵母粉5g,k2hpo42g,柠檬酸二铵2g,mgso4·7h2o0.48g,na2co310g,nacl2g,琼脂15~20g,蒸馏水(自来水)1000ml,加入1.6%溴甲酚紫溶液约1.4ml加热溶解后,校正ph为6.2,121℃高压灭菌15~20分钟。
将筛选的菌株进行生理生化鉴定实验,符合以下结果:
(5.2)戊糖乳杆菌(lactobacilluspentosus)的定向筛选:在上述步骤(1)的所取样品中,取1ml液体于生理盐水中进行10倍的梯度稀释,均匀涂布在改良mrs平板上,30℃有氧培养48h。挑取有溶钙圈的单菌落,平板划线反复分离纯化,经革兰氏染色确定为纯化的革兰氏阳性杆菌菌株。改良mrs琼脂培养基配方为:20g/l玉米浆干粉、牛肉膏5.0克、酵母粉4.0克、葡萄糖20.0克、吐温801.0毫升、磷酸氢二钾2.0克、乙酸钠5.0克、柠檬酸三胺2.0克、硫酸镁0.2克;硫酸锰0.05克、琼脂粉15.0克和蒸馏水1升;加热溶解后,校正ph为6.2,121℃高压灭菌15~20分钟。在mrs固体培养基中加入0.75%碳酸钙,灭菌后放入60℃恒温水浴中备用,用前加入0.1%纳他霉素。
将活化后的菌株,按2%接菌量接入乳酸菌培养基中进行培养,30℃有氧培养48h。然后筛选进行生理生化鉴定实验,符合以下结果:
(5.3)植物乳杆菌(lactobacillusplantarum)的定向筛选:在上述步骤(1)的所取样品中,取1ml液体于生理盐水中进行10倍的梯度稀释,均匀涂布在定向mrs培养基上,于35~37℃恒温箱中培养48~72h,观察菌落,挑选出有溶钙圈、呈乳白色、不透明、圆形光滑的单菌落,在mrs平板上划线培养48~72h;斜面培养后,接入液体培养mrs培养48~72h。mrs琼脂培养基配方为:蛋白胨10.0克、牛肉膏5.0克、酵母粉4.0克、葡萄糖20.0克、吐温801.0毫升、磷酸氢二钾2.0克、乙酸钠5.0克、柠檬酸三胺2.0克、硫酸镁0.2克;硫酸锰0.05克、1%碳酸钙、0.05‰的纳他霉素、琼脂粉15.0克和蒸馏水1升;加热溶解后,校正ph为6.2,121℃高压灭菌15~20分钟。
将筛选的菌株进行生理生化实验,符合以下结果:
(5.4)短乳杆菌(lactobacillusbrevis)的定向筛选:在上述步骤(1)的所取样品中,取1ml液体于生理盐水中进行10倍的梯度稀释,均匀涂布在mrs改良培养基,然后在37℃恒温箱中培养48h,观察菌落,挑选出呈乳白色、不透明、圆形光滑的单菌落,在mrs改良培养基平板上划线培养48h。斜面培养后,接入液体mrs改良培养基中培养72h。mrs改良培养基配方为:葡萄糖20g,蛋白胨10g,牛肉膏10g,酵母膏5g,柠檬酸氢二铵2g和蒸馏水1000ml。溶解后,校正ph为6.5,121℃高压灭菌15~20分钟。
将筛选的菌株进行生理生化实验,符合以下结果:
(6)片球菌属的定向筛选:
戊糖片球菌(pediococcuspentosaceus)的定向筛选:
取步骤(1)中1ml液体于生理盐水中进行10倍的梯度稀释,均匀涂布在mrs十0.5%caco3培养基上,挑取菌落四周有明显的透明圈、斜嵌于培养基内的呈菱形、生长在表面的呈规则的圆形、白色扁平的菌落。mrs培养基同(5.2)。菌落经革兰氏染色为阳性,过氧化氢酶实验为阴性,经亚甲蓝单染色后与光学显微镜下观察,细胞球状,四联或成片状排列。
将筛选的菌株进行生理生化实验,符合以下结果:
(7)魏斯氏菌属的定向筛选:
魏斯氏菌(weissellasoli)的定向筛选:
取步骤(1)中1ml液体于生理盐水中进行10倍的梯度稀释,均匀涂布在mrs十0.5%caco3培养基上,挑取有溶钙圈、白色圆形、黏稠、表面光滑,有光泽、边缘整齐的菌落;在mrs平板上反复划线直至观察菌落形态大小一致表明已纯化,纯化后的菌株进行革兰氏染色镜检和过氧化氢接触酶实验,选取革兰氏阳性、过氧化氢接触酶阴性的菌株。
将筛选的菌株进行生理生化实验,符合以下结果:
(8)将步骤(5)-(7)所筛选的菌株进行2%琼脂糖凝胶电泳检测纯化后pcr,序列同源性达到99%,如图1所示。
(9)定向筛选菌株的高密度增殖培养。将步骤(5)、(6)、(7)定向筛选与纯化培养的清酒乳杆菌、戊糖乳杆菌、短乳杆菌、植物乳杆菌、戊糖片球菌、魏斯氏菌进行高密度增值培养,高密度增值培养基为mrs琼脂培养基,培养条件为35~37℃恒温箱中培养48~72h;所述的乳酸菌培养基配方为:蛋白胨5g,牛肉膏5g,酵母膏5g,吐温80(tween80)0.5ml,糖或醇10g,酵母粉5g,琼脂5~6g,蒸馏水(1000ml);加热溶解后,校正ph=6.2~7.2,121℃高压灭菌15~20分钟。
(10)定向筛选菌株的收集:将步骤(9)得到的经高密度增值培养的菌液,加入3.5%经高温灭菌的脱脂奶粉,摇匀后以5000rpm转速于-5℃条件下离心30分钟,去除上清培养液,收集试管底部菌体。
(11)直投式发酵剂的冷冻干燥。将步骤(10)收集的菌体加入冻干保护剂,冻干保护剂配方为:脱脂乳30克、淀粉10克,丙三醇5克、维生素c5克、d-山梨醇5克、l-谷氨酸5克和蒸馏水250ml。冻干保护剂加热溶解后,121℃高压灭菌20分钟。菌体与冻干保护剂质量分数配比为1:4.5。冷冻干燥条件为:-70℃预冻24h后,-80℃冻干24h。
(12)泡菜专用直投式发酵剂的制备。按照16srdna测序结果所确认的乳酸菌的组成,将上述的冻干清酒乳杆菌、戊糖乳杆菌、短乳杆菌、植物乳杆菌、戊糖片球菌、魏斯氏菌按照比例31.6%、10.9%、11.8%、4.4%、18.1%、3.7%混合,制得泡菜专用直投式发酵剂。经检测,活菌含量为1010~1013cfu/g。
将本发明制得的泡菜专用直投式发酵剂用于腌制,与自然发酵的泡菜比较,经固相微萃取-气质联用方法分析其风味,发现其挥发性风味基本一致,结果如图2和图3所示。
实施例2
其他同实施例1,不同之处在于:
步骤(7):将步骤(6)得到的经高密度增值培养的菌液,加入2.7%经高温灭菌的脱脂奶粉,摇匀后以4000rpm转速于10℃条件下离心25分钟,去除上清培养液,收集试管底部菌体。
步骤(8)直投式发酵剂的冷冻干燥。将步骤(7)收集的菌体加入冻干保护剂,冻干保护剂配方为:脱脂乳26克、淀粉8克,丙三醇8克、维生素c6.5克、d-山梨醇7.2克、l-谷氨酸6克和蒸馏水250ml;冻干保护剂加热溶解后,121℃高压灭菌15分钟后备用。菌体与冻干保护剂质量分数配比为1:2.5。冷冻干燥条件为:-50℃预冻12h后,-60℃冻干72h。
经检测,本实施例与实施例1达到同样技术效果,不再赘述。
sequencelisting
<110>浙江省农业科学院
<120>一种基于16srdna测序的泡菜发酵剂定向制备方法
<130>z171136
<160>8
<170>patentinversion3.3
<210>1
<211>16
<212>dna
<213>人工序列
<400>1
gtgccagcmgccgcgg16
<210>2
<211>20
<212>dna
<213>人工序列
<400>2
ccgtcaattcmtttragttt20
<210>3
<211>449
<212>dna
<213>lactobacillussakei
<400>3
tggggaattttggacaatgggcgcaagcctgatccagccatgccgcgtgagtgaagaagg60
ccttcgggttgtaaagctctttcgcaaggaaagaaaacttactcgctaataccgggtgag120
gatgacggtaccttgataagaagcaccggctaactacgtgccagcagccgcggtaatacg180
tagggtgcgagcgttaatcggaattactgggcgtaaagcgagcgcaggcggttttgtaag240
tcagatgtgaaagccccgggctcaacctgggaactgcgtttgaaactgcaaggctagagt300
atgggagaggggggtagaattccacgtgtagcagtgaaatgcgtagagatgtggaggaat360
accaatggcgaaggcagccccctggcctaatactgacgctcatgctcgaaagcgtgggga420
gcaaacaggattagataccctagtagtcc449
<210>4
<211>444
<212>dna
<213>lactobacilluspentosus
<400>4
tgaggaatattggacaatgggcgcaagcctgatccagccatgccgcgtgcaggatgacgg60
tcctatggattgtaaactgcttttatacgagaagaaacactacttcgtgaagtagcttga120
cggtatcgtaagaataaggatcggctaactccgtgccagcagccgcggtaatacggagga180
tccaagcgttatccggaatcattgggtttaaagggtccgtaggcggtttaataagtcagt240
ggtgaaagcccatcgctcaacggtggaacggccattgatactgttagacttgaattatta300
ggaagtaactagaatatgtagtgtagcggtgaaatgcttagagattacatggaataccaa360
ttgcgaaggcaggttactactaattgattgacgctgatggacgaaagcgtgggtagcgaa420
caggattagatacccgtgtagtcc444
<210>5
<211>430
<212>dna
<213>lactobacillusbrevis
<400>5
tagggaatcttccacaatggacgaaagtctgatggagcaatgccgcgtgagtgaagaagg60
gtttcggctcgtaaaactctgttgttaaagaagaacacctttgagagtaactgttcaagg120
gttgacggtatttaaccagaaagccacggctaactacgtgccagcagccgcggtaatacg180
taggtggcaagcgttgtccggatttattgggcgtaaagcgagcgcaggcggttttttaag240
tctgatgtgaaagccttcggcttaaccggagaagtgcatcggaaactgggagacttgagt300
gcagaagaggacagtggaactccatgtgtagcggtggaatgcgtagatatatggaagaac360
accagtggcgaaggcggctgtctagtctgtaactgacgctgaggctcgaaagcatgggta420
gcgaacagga430
<210>6
<211>450
<212>dna
<213>lactobacillusplantarum
<400>6
gtagggaatcttccacaatggacgaaagtctgatggagcaacgccgcgtgagtgaagaag60
gttttcggatcgtaaaactctgttgttggagaagaatgtatctgatagtaactgatcagg120
tagtgacggtatccaaccagaaagccacggctaactacgtgccagcagccgcggtaatac180
gtaggtggcaagcgttgtccggatttattgggcgtaaagcgagcgcaggcggtttcttaa240
gtctgatgtgaaagccttcggctcaaccgaagaagtgcatcggaaactgggaaacttgag300
tgcagaagaggacagtggaactccatgtgtagcggtgaaatgcgtagatatatggaagaa360
caccagtggcgaaggcggctgtctggtctgtaactgacgctgaggctcgaaagcatgggt420
agcaaacaggattagaaaccctagtagtcc450
<210>7
<211>430
<212>dna
<213>pediococcuspentosaceus
<400>7
tagggaatcttccacaatggacgcaagtctgatggagcaacgccgcgtgagtgaagaagg60
gtttcggctcgtaaagctctgttgttaaagaagaacgtgggtaagagtaactgtttaccc120
agtgacggtatttaaccagaaagccacggctaactacgtgccagcagccgcggtaatacg180
taggtggcaagcgttatccggatttattgggcgtaaagcgagcgcaggcggtcttttaag240
tctaatgtgaaagccttcggctcaaccgaagaagtgcattggaaactgggagacttgagt300
gcagaagaggacagtggaactccatgtgtagcggtgaaatgcgtagatatatggaagaac360
accagtggcgaaggcggctgtctggtctgcaactgacgctgaggctcgaaagcatgggta420
gcgaacagga430
<210>8
<211>429
<212>dna
<213>weissellasoli
<400>8
tagggaatcttccacaatgggcgcaagcctgatggagcaacgccgcgtgtgtgatgaagg60
gtttcggctcgtaaagcactgttgtaagagaagaatgtacttgagagtaactgttcaagt120
agtgacggtatcttaccagaaagggacggctaaatacgtgccagcagccgcggtaatacg180
tatgtcccaagcgttatccggatttattgggcgtaaagcgagcgcagacggttatttaag240
tctgaagtgaaagccctcagctcaactgaggaattgctttggaaactggatgacttgagt300
gcagtagaggaaagtggaactccatgtgtagcggtgaaatgcgtagatatatggaagaac360
accagtggcgaaggcggctttctggactgtaactgacgttgaggctcgaaagtgtgggta420
gcaaacagg429
- 还没有人留言评论。精彩留言会获得点赞!