一种提高辣根过氧化物酶保存稳定性的保存稳定剂及其保存方法与流程
本发明属于体外诊断试剂
技术领域:
,具体涉及一种提高辣根过氧化物酶保存稳定性的保存稳定剂。本发明能够显著提高辣根过氧化物酶及其标记的抗原抗体的保存稳定性,在elisa和化学发光体外诊断领域具有极高的应用价值。
背景技术:
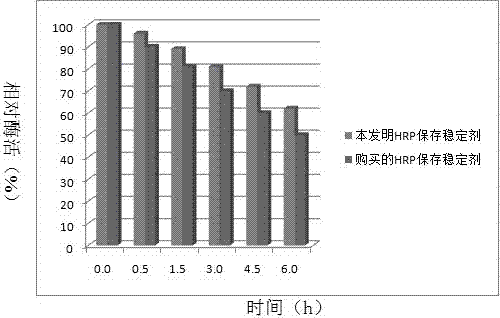
:化学发光免疫分析(chemiluminescenceimmunoassay,clia),是将具有高灵敏度的化学发光测定技术与高特异性的免疫反应相结合,用于各种抗原、半抗原、抗体、激素、酶、脂肪酸、维生素和药物等的检测分析技术。是继放免分析、酶免分析、荧光免疫分析和时间分辨荧光免疫分析之后发展起来的一项最新免疫测定技术。其具有(1)灵敏度高:其灵敏度可达10-16mol/l(ria为10-12mol/l);(2)线性动力学范围宽:发光强度在4~6个量级之间与测定物质浓度呈线性关系;(3)光信号持续时间长:辉光型的clia产生的光信号持续时间可达数小时,简化了实验操作及测量;(4)分析方法简便快速:绝大多数分析测定均为仅需加入一种试剂(或复合试剂)的一步模式;(5)结果稳定、误差小:样品系直接自己发光,不需要任何光源照射,免除了各种可能因素(光源稳定性、光散射、光波选择器等)给分析带来的影响,使分析结果灵敏、稳定、可靠;(6)安全性好使用期长:在上述优点前提下,更免除了使用放射性物质。化学发光按其机理可分为化学发光酶免疫测定、化学发光免疫测定、电化学发光免疫测定,其中化学发光酶免疫测定仍是目前主流测定方法。化学发光酶免疫测定所用的酶主要包括辣根过氧化物酶和碱性磷酸酶等。其中辣根过氧化物酶易于提取,价格相对低廉,与抗原抗体偶联后,活性很少受损失,因此是迄今为止在化学发光和elisa中应用最广泛的标记用酶。辣根过氧化物酶(hrp,horseradishperoxidase)是一种分子量达44000的糖蛋白,由无色的酶蛋白和深棕色的铁卟啉结合而成,中性糖和氨基糖约占18%,主要有甘露糖、木糖、阿拉伯糖和己糖胺等。除fe外每分子中还含有两个ca2+。肽链由308个氨基酸组成,另有8个糖链(占分子质量的18%)分别与13、57、158、186、198、214、255和268位的天冬酰胺残基连接,它们分布在分子表面。肽链n-末端为一个吡咯烷酮羧基所封闭,c-末端为丝氨酸。酶活性中心含有一个正铁血红素卟啉环化合物,每一个辣根过氧化物酶分子中含一个氯化血红素ix作辅基,该辅基在403nm波长处有最大吸收峰,而去辅基的酶蛋白在275nm波长处有最大吸收。辣根过氧化物酶具有高度多态性,功能多做多样,而且互异,根据电泳行为可将辣根过氧化物酶的同工酶分为三种类型:①含糖量高的酸性同工酶。②等电点接近于中性含糖量相对较低的中性同工酶。③含糖量低的碱性(pi>11)同工酶。其中中性同工酶最具有应用价值。酶免疫试验中所使用的辣根过氧化物酶,以pi为8.7~9.0的所谓“c”同工酶为主要组成成分,其他同工酶的活性则很低。“c”同工酶的共价结构由2个密切接近的区域组成,血红素基团则位于其间而成夹心结构,糖链以8个不同的部位结合于多肽。天然的酶所带的纯电荷极少;无游离的氨基,仅有2个可测出的组氨酸,但是其含有6个赖氨酸具有可用于偶联的氨基。辣根过氧化物酶容易受蛋白水解酶、微生物等的作用而发生分解,同时也容易受其它因素的影响而改变分子构象。基于辣根过氧化物酶标记的elisa和化学发光酶免疫分析体外诊断试剂盒的推广与普及与试剂盒本身的质量密不可分。对于体外诊断试剂盒来说,稳定性和有效性是其两大质控指标,其中试剂盒的稳定性主要取决于抗原抗体及标记酶的保存稳定性。在试剂盒保存过程中,大部分情况下,抗原抗体保存稳定性高于标记的辣根过氧化物酶的保存稳定性,即标记的辣根过氧化物酶是整个试剂盒保存过程中比较容易失活的成分,故要想提高试剂盒的保存稳定性,必须要提高标记的辣根过氧化物酶的保存稳定性。然而辣根过氧化物酶的本质是分子量为44000的蛋白质,很多物理、化学或微生物因素均会引起其变性失活,从而使得辣根过氧化物酶生物活性降低甚至丧失,尤其是在辣根过氧化物酶浓度比较低的情况下,其活性丧失速度会成数量级的增加。技术实现要素:为了解决标记的辣根过氧化物酶保存稳定性的问题,本发明提供了一种提高辣根过氧化物酶保存稳定性的保存稳定剂及其保存方法,其能够大大提高辣根过氧化物酶的保存稳定性。本发明解决上述问题所采用的技术方案为:一种提高辣根过氧化物酶保存稳定性的保存方法,步骤一是从内因考虑,利用分子酶工程手段,采用双琥珀酰亚胺修饰辣根过氧化物酶对其进行分子水平的化学改造,使得其保存稳定性提高10倍以上;步骤二是从外因考虑,通过优化其保存缓冲液的配方,提供一种适合辣根过氧化物酶及其标记的抗原抗体稳定保存的保存稳定剂,以提高其保存稳定性。采用内外两个因素考虑大大提高了体外诊断试剂盒的运输、储存过程中的稳定性,延长了试剂盒的货架寿命,具有极高的商业价值。具体地,步骤一的采用双琥珀酰亚胺修饰辣根过氧化物酶的方法如下:(1)将双琥珀酰亚胺溶解于dmso中配成0.1~1.0g/ml,优选浓度为0.5g/ml;(2)用100mm,ph5~8的磷酸氢二钠-磷酸二氢钠缓冲液将辣根过氧化物酶配成1mg/ml,其中磷酸缓冲液优选ph为7.4;(3)将配好的双琥珀酰亚胺溶液加入到1mg/ml的辣根过氧化物酶溶液中,于20±10℃反应0.5~4h,优选反应温度为20℃,优选反应时长为1h,反应过程中不断用磁力搅拌器搅拌;(4)反应结束后,将反应液放入透析袋,4℃下,于磷酸氢二钠-磷酸二氢钠缓冲液中透析48h以上,中途每8h换液1次;(5)透析结束后,小心收集改性后的辣根过氧化物酶,并用磷酸氢二钠-磷酸二氢钠缓冲液将辣根过氧化物酶配成1mg/ml。优选地,双琥珀酰亚胺分子链长应大于10å,包括双琥珀酰亚胺辛二酸酯、乙二醇-双(丁二酸n-羟基琥珀酰亚胺酯)等,其中优选乙二醇-双(丁二酸n-羟基琥珀酰亚胺酯)。具体地,步骤二的保存稳定剂包括以下组分:磷酸缓冲液10mm、ph=7.4,m2+so40.1~300mm/l,peg平均分子量1000~20000、1~100g/l,peo平均分子量10000~100000、1~100g/l,芳基硼酸0.1~1g/l,蔗糖5~50g/l,海藻糖2~100g/l,bsa2~30g/l,tween200.01~0.1%(v/v),proclin3000.02~0.1%(v/v)。保存稳定剂的制备方法为:首先用双蒸水作溶剂配制磷酸缓冲液;其次,加入peg、peo、芳基硼酸、蔗糖、海藻糖、m2+so4,并逐一溶解;接着加入bsa、tween20和proclin300,充分溶解后,调整ph=7.4;最后采用0.22μm滤膜过滤后,密封保存于4℃。进一步地,所述多价阳离子m2+包括mg2+、fe2+、zn2+、cu2+、ca2+离子中的一种或多种混合物。m2+阳离子为mg2+和fe2+的复合阳离子组合,mg2+的含量为150mm/l,fe2+的含量为50mm/l,且二者均与so42-配对,以mgso4和feso4的形式加入使用。进一步地,芳基硼酸包括苯基硼酸、4-溴苯基硼酸、3-乙酰氨基苯基硼酸、3,5-二氯苯基硼酸中的一种或多种混合物。优选芳基硼酸为4-溴苯基硼酸,优选用量为1g/l。进一步地,peo的平均分子量为100000,用量为20~30g/l。再来,蔗糖的优选加入量为10g/l,海藻糖的优选加入量为5g/l;bsa优选加入量为10g/l;tween-20优选加入量为0.02%(v/v)、proclin300的优选加入量为0.05%(v/v)。辣根过氧化物酶容易受蛋白水解酶、微生物等的作用而发生分解,同时也容易受其它因素的影响而改变分子构象。本申请的保存稳定剂中,苯基硼酸可以抑制蛋白水解酶,防止hrp被蛋白水解酶水解。多价阳离子一方面能够维持辣根过氧化物酶的天然构象,多价阳离子能够对hrp的分子片段中的电子云分布进行笼络,从而避免hrp因为双琥珀酰亚胺的改性而发生分子构象的扭曲改变,确保hrp自身的化学结构性质不变。另一方面,能够改变辣根过氧化物酶的表面自由能,在一定条件下使辣根过氧化物酶的结构更加紧密,不容易受外部因素的影响。so42-是hofmeister离子系列中对蛋白质高级结构作用最强的离子之一,其作用可能与加强蛋白质分子与其它分子间作用力的性质(kosmotropiceffect)有关,其对辣根过氧化物酶的保存稳定性也有很大的帮助。与现有技术相比,本发明的优点在于:(1)从内因考虑,利用分子酶工程手段,采用双琥珀酰亚胺类小分子修饰辣根过氧化物酶对其进行分子水平的化学改造,显著提高了其热稳定性和酸碱稳定性。(2)从外因考虑,通过优化其保存缓冲液的配方,提供了一种适合辣根过氧化物酶及其标记的抗原抗体稳定保存的保存稳定剂,此稳定剂可以有效地维持辣根过氧化物酶的分子构象,保护辣根过氧化物酶的化学组成的稳定性,防止辣根过氧化物酶被蛋白酶水解和被微生物分解。(3)以上两种方法双管齐下,优势互补,大大提高了体外诊断试剂盒的运输、储存过程中的稳定性,延长了试剂盒的货架寿命,具有极高的商业价值。附图说明图1为本发明实施例1中乙二醇-双(丁二酸n-羟基琥珀酰亚胺酯)修饰的hrp与未修饰的hrp在50℃下保存不同时间的稳定性对比。图2为本发明实施例2中保存稳定剂与购买的商品化hrp保存稳定剂在50℃下保存不同时间的稳定性对比。具体实施方式以下结合具体实施例对本发明进行说明,所举的实施例仅是对本发明产品或方法作概括性例示,有助于更好地理解本发明,但并不会限制本发明范围。下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述材料,如无特殊说明,均可从商业途径获得。步骤一、辣根过氧化物酶乙二醇-双(丁二酸n-羟基琥珀酰亚胺酯)化学改性(1)称取0.5g乙二醇-双(丁二酸n-羟基琥珀酰亚胺酯)溶解于1mldmso中配成0.5g/ml的溶液;(2)称取20mg辣根过氧化物酶溶解于20ml磷酸氢二钠-磷酸二氢钠缓冲液(100mm,ph7.4)中配成1mg/ml的溶液;(3)将配好的乙二醇-双(丁二酸n-羟基琥珀酰亚胺酯)溶液1ml加入到20ml辣根过氧化物酶溶液中,,于20℃反应1h,反应过程中不断用磁力搅拌器搅拌;(4)反应结束后,将反应液放入透析袋,4℃下,于磷酸氢二钠-磷酸二氢钠缓冲液(100mm,ph7.4)中透析48h,中途每8h换液1次;(5)透析结束后,小心收集改性后的辣根过氧化物酶,并用磷酸氢二钠-磷酸二氢钠缓冲液(100mm,ph7.4)将辣根过氧化物酶配成1mg/ml。步骤二、辣根过氧化物酶及其标记的抗原抗体保存稳定剂的配制,组分如下表保存稳定剂组成成分含量磷酸缓冲液10mm,ph=7.4feso4•7h2o50mm/lmgso4150mm/lpeg(平均分子量~8000)20g/lpeo(平均分子量~100000)20g/l4-溴苯基硼酸1g/l蔗糖10g/l海藻糖5g/lbsa10g/ltween200.02%(v/v)proclin3000.05%(v/v)(1)按上表用量依次称取peg20g、peo20g、4-溴苯基硼酸1g、蔗糖10g、海藻糖5g、feso4•7h2o13.9g、mgso418.0g于2l烧杯中;(2)用双蒸水作溶剂配制磷酸缓冲液(10mm,ph=7.4)1l;(3)量取900ml(2)中配制的磷酸缓冲液加入(1)中烧杯中,磁力搅拌使其中的物质充分溶解;(4)称取bsa10g,移液器移取200μltween20和500μlproclin300,加入(3)中溶液中,磁力搅拌充分溶解后,调整ph=7.4,补加磷酸缓冲液,定容至1l;(5)将(4)中溶液通过0.22μm滤膜过滤,然后密封保存于4℃。步骤三:乙二醇-双(丁二酸n-羟基琥珀酰亚胺酯)修饰对hrp保存稳定性的考察采用gb/t32131-2015《辣根过氧化物酶活性检测方法》对未修饰的hrp和乙二醇-双(丁二酸n-羟基琥珀酰亚胺酯)修饰的hrp的酶活进行检测,考察二者在50℃放置不同时间其酶活的变化,以确定乙二醇-双(丁二酸n-羟基琥珀酰亚胺酯)化学改性对提高hrp的热稳定性是否有帮助,考察结果见图1。步骤四:保存稳定剂对未修饰的hrp保存稳定性的考察采用酶促化学发光法考察hrp的活性,以未修饰的hrp为材料,分别采用本发明实施例2中的保存稳定剂与购买的商品化hrp保存稳定剂对其进行保存,将其置于50℃下保存不同时间后,取5μlhrp酶溶液加入发光底物液中,然后置于化学发光仪上检测其发光强度,其发光强度与hrp的活性成正比,考察结果见图2。通过上述实验对比可知,本发明所涉及的通过酸酐修饰hrp的方法能够大大提高hrp的保存稳定性,与天然hrp酶对比,经乙二醇-双(丁二酸n-羟基琥珀酰亚胺酯)修饰后酶的活性几乎没有变化。在50℃下,修饰的hrp和天然hrp的酶活均随时间的延长而下降,但是天然hrp的酶活丧失速度比修饰的hrp要快很多,0.5h后,天然hrp相对酶活约为70%,而修饰的hrp相对酶活约为99%;3h后,天然hrp相对酶活约为30%,而修饰的hrp相对酶活约为89%;6h后,天然hrp相对酶活约为5%,而修饰的hrp相对酶活约为78%。此外,本发明的hrp保存稳定剂与购买的商品化稳定剂相比,其对hrp的保存稳定效果与商品化hrp保存稳定剂相当,并且略优于商品化hrp保存稳定剂。除上述实施例外,本发明还包括有其他实施方式,凡采用等同变换或者等效替换方式形成的技术方案,均应落入本发明权利要求的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1