用于纯化硫酸软骨素酶ABC的方法与流程
本发明涉及用于纯化硫酸软骨素酶abc(chabc)的方法,尤其涉及从含有chabc的基质纯化chabc的方法。
背景技术:
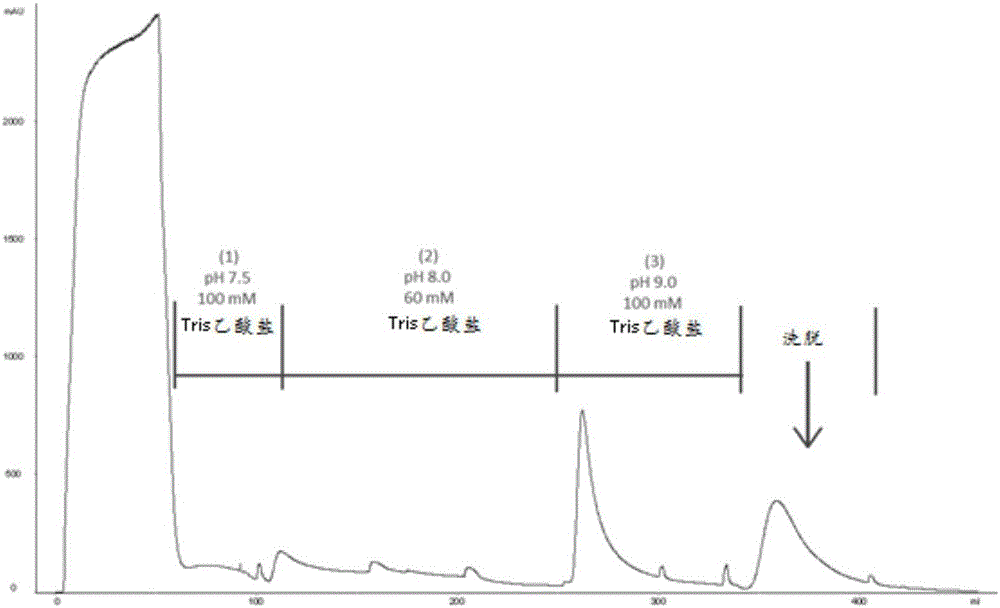
:硫酸软骨素是生物系统中最丰富的糖胺聚糖,由包括硫酸化葡萄糖醛酸、n-乙酰半乳糖胺、艾杜糖醛酸等的多种硫酸化和非硫酸化碳水化合物衍生物组成。该聚合物通常与蛋白质连接,形成硫酸软骨素蛋白多糖(cspg),在生物系统中发挥许多结构和功能作用(例如,使细胞-细胞相互作用的细胞外基质、指导或抑制神经发育、合成软骨以及成为结构成分)。这些分子的生物合成并保持合适的位置对于人的正常功能是至关重要的。事实上,许多疾病与cspg的缺乏、积累和脱位有关,如弥漫性路易体病、粘多糖病ⅳ-a型和粘多糖病ⅶ型、椎间盘突出症等。硫酸软骨素酶是可以有效降解硫酸软骨素的细菌酶。这组酶可以分为具有不同活性和底物特异性的4种类型(硫酸软骨素酶abc,软骨素酶ac,硫酸软骨素酶b和硫酸软骨素酶c)。最近已证明这些酶,特别是硫酸软骨素酶abc是用于治疗许多cspg相关疾病的潜在的新生物药物,例如,mcmachon和同事已经发现chabc可以显著促进受损的脊髓的功能恢复。kubota和naitoh也证明将硫酸软骨素酶注射到瘢痕疙瘩和/或肥厚性瘢痕患者的受影响部分可以大大改善症状。takahashi还开发了使用chabc治疗兔子椎间盘突出症的成功模型。近年的科学研究指出,chabc还有更多有待开发的医学应用,包括治疗弱视、神经和脊髓损伤,后玻璃体脱离和抑制肿瘤转移。chabc能否成功作为生物治疗剂应用,明显取决于生产和纯化高纯度chabc的工艺。chabc的现有上游生产技术均是基于未修饰的普通变形杆菌(proteusvulgaris)或重组表达宿主(如大肠杆菌)的发酵。通过适当优化,这两种表达方法都可以产生大量未经纯化含有chabc的菌液或粗酶液。因为菌液或粗酶液含有大量蛋白质、核酸及内毒素等杂质,开发高效的下游纯化方法对于获得高纯度chabc至为关键。此外,来自不同表达宿主的杂质的份量和性质非常不同,所以为了纯化来自特定表达宿主的chabc将需要单独制定的特定的下游纯化程序,特别是当只使用非特异性相互作用的离子交换(iex)或疏水相互作用(hic)层析时更是如此。事实上,iex/hic层析法的开发和优化非常耗时,需要投入大量人力物力,而通常的结果是需要多个iex/hic层析步骤以获得高纯度的目标蛋白,代价是大幅降低回收率及长时间的纯化流程。相对于iex/hic层析法,在蛋白质纯化中应用亲和层析法具有显著的优点,例如相对快速的优化过程,简单的层析过程,高洗脱液纯度,高回收率等。在亲和层析法中,与靶蛋白的特异性相互作用的分子或分子部分固定在填料上。这种高度选择性相互作用能有效地提取需要的蛋白及去除杂质。此外,利用亲和层析作为chabc的纯化工具从未被探索过,因此开发新的且有效的亲和层析方法对于生产作为生物治疗药物的chabc将具有莫大贡献。然而,设计chabc的亲和层析是不容易的。这是因为可以特异性结合chabc的大多数已知分子是chabc的底物,其在与酶结合时将被降解。换句话说,如果这些底物分子固定在固定相上,那么它们在纯化过程中将被酶分解,从而不能从溶液中捕获chabc。硫酸软骨素酶abc具有比硫酸软骨素酶ac、硫酸软骨素酶b和硫酸软骨素酶c具有更广的底物谱。这使得设计chabc的亲和层析相比于硫酸软骨素酶ac、硫酸软骨素酶b和硫酸软骨素酶c更加困难。在yosizawa等人的研究(1979)中,公开了一种纯化硫酸软骨素酶b及硫酸软骨素酶c的方法,包括使用羟基磷灰石柱从肝素黄杆菌的粗酶提取物中分离粗硫酸软骨素酶c级分和粗硫酸软骨素酶b级分;然后使用磷酸纤维素柱进一步纯化粗硫酸软骨素酶c级分和粗硫酸软骨素酶b级分,最后用硫酸皮肤素包被的结合硫酸皮肤素的ah-sepharose4b柱使硫酸软骨素酶c与透明质酸酶分离,用硫酸皮肤素包被的结合肝素的ah-sepharose4b柱使硫酸软骨素酶b与δ4,5葡萄糖醛酸酶(glycosiduronase)和硫酸酯酶分离。yosizawa的研究强调采用同一种或另一种糖胺聚糖非共价包被糖胺聚糖结合(共价)的ah-sepharose4b对于硫酸软骨素酶的分离纯化是非常重要的。因此,具有简单、高回收率优点的利用亲和层析纯化chabc的技术仍是本领域所需的。技术实现要素:为解决现有技术中存在的问题,发明人发现,肝素不仅能够特异性结合chabc,而且在结合时不会被降解。基于该意想不到的发现,本发明提供了一种从含有chabc的基质纯化chabc的方法,包括使用固定有肝素的亲和柱,通过层析法从含有chabc的基质中获得高度纯化的chabc。根据本发明的一个方面,所述方法包括将含有硫酸软骨素酶abc的基质加载到结合有肝素的亲和柱上。根据本发明的一个方面,本发明的从含有chabc的基质纯化chabc的方法包括如下步骤:用预平衡缓冲液预平衡亲和柱;将样品溶液加载到预平衡后的亲和柱上;用洗涤液洗涤加载后的亲和柱以去除非特异性结合的蛋白质;以及用洗脱液洗脱所述硫酸软骨素酶abc;其中,所述洗涤液为ph8-10的缓冲液,所述洗脱液为ph6-9nacl线性梯度溶液。根据本发明的另一个方面,本发明的从含有chabc的基质纯化chabc的方法还包括在所述洗脱步骤之后通过过滤去除含有chabc的洗脱液中的内毒素。根据本发明的又一个方面,本发明的从含有chabc的基质纯化chabc的方法还包括将所述含有硫酸软骨素酶abc的基质的ph值调节至7.0,和/或将导电率调节到1-5ms/cm范围内。在一个实施方式中,本发明的从含有chabc的基质纯化chabc的方法还包括将导电率调节到1.2、1.6、2、3、4、4.5或4.8ms/cm。根据本发明的又一个方面,所述洗涤液为碳酸盐缓冲液、磷酸盐缓冲液、硼酸盐缓冲液、tris-hcl缓冲液或tris乙酸盐缓冲液。根据本发明的又一个方面,所述基质包括细菌、真菌、昆虫或动物的细胞匀浆、含有表面活性剂的提取物和/或在发酵过程中收集的上清液。根据本发明的又一个方面,所述基质包括来自大肠杆菌(escherichiacoli)、枯草芽孢杆菌(bacillussubtilis)、普通变形杆菌(proteusvulgaris)、巴斯德毕赤酵母(pichiapastoris)、和酿酒酵母(saccharomycescerevisiae)的一种或多种的匀浆或提取物。根据本发明的又一个方面,所述肝素固定在具有羟基、氨基和/或羧基的用于蛋白质纯化的树脂上。进一步地,所述肝素利用共价键结合到所述树脂上。根据本发明的又一个方面,固定有肝素的亲和柱不进一步使用糖胺聚糖包被。根据本发明的又一个方面,所述树脂包括琼脂糖、纤维素、葡聚糖、二氧化硅聚丙烯酰胺和丙烯酸聚合物的一种或多种。根据本发明的又一个方面,所述预平衡缓冲液为ph7.0-7.5缓冲液。本发明的从含有chabc的基质纯化chabc的方法能够获得高纯度的硫酸软骨素酶abc,并且具有简单和高回收率的优点。附图说明图1示出本发明实施例2的层析图。图2示出本发明实施例3的层析图。图3示出本发明实施例3的sds-page图;其中,泳道(1)分子标记,泳道(2)加载到柱上之前的基质,泳道(3)溢流,泳道(4)通过60mmtris-乙酸盐(ph8.0)洗涤的杂质,泳道(5)通过100mmtris-乙酸盐(ph9.2)洗涤的杂质,泳道(6)和(7)洗脱液。图4示出本发明实施例4的层析图。图5示出本发明实施例4的sds-page图;其中,泳道(1)分子标记,泳道(2)加载到柱上之前的基质,泳道(3)溢流,泳道(4)通过100mmtris-乙酸盐(ph9.2)洗涤的杂质,泳道(5)和(6)洗脱液。图6示出本发明实施例5的层析图。图7示出本发明实施例5的sds-page图;其中,泳道(1)分子标记,泳道(2)加载到柱上之前的基质,泳道(3)溢流,泳道(4)通过100mmtris-乙酸盐(ph9.2)洗涤的杂质,泳道(5)和(6)洗脱液。具体实施方式本发明提供了一种新颖且简单的chabc的纯化方法,其可应用于各种含chabc的基质。如本文所用的术语“基质”是指chabc与chabc生产期间来自宿主细胞的细胞外材料或细胞内材料(蛋白质、dna、脂质等)的混合物,包括但不限于细菌、真菌、昆虫或动物的细胞匀浆、含有表面活性剂的提取物、在发酵过程中收集的上清液等。目前chabc的现有上游生产技术均是基于未修饰的普通变形杆菌(proteusvulgaris)或重组表达宿主(如大肠杆菌)的发酵。这两种表达方法都可以产生大量含chabc的基质。在本发明中描述的含chabc的基质可来自野生型普通变形杆菌或重组表达宿主,包括重组大肠杆菌、重组枯草芽孢杆菌、重组巴斯德毕赤氏酵母、重组酿酒酵母等。重组表达宿主可以通过使用重组表达质粒转化宿主细菌来制备。在使用重组表达质粒转化宿主细菌时,需要将编码硫酸软骨素酶的基因连接到含有启动子和shine-dalgarno(sd)序列且能够在宿主细胞中实现高转录水平的表达质粒中。用于大肠杆菌表达系统的载体的启动子可以是t7、t5、lac、trp、arac或它们的任何杂交启动子。用于枯草芽孢杆菌的载体的启动子可以是spac、sacb、xyl、pbad、pgrac或它们的任何杂交启动子。此外,除了使用重组表达质粒转化宿主细菌来制备重组表达系统外,将硫酸软骨素酶基因整合到宿主细菌染色体,也是可行的策略。例如对于枯草芽孢杆菌mg1p使用整合载体pmg1,或对枯草芽孢杆菌1a304(ф105mu331)使用整合载体psg1112。在一个实施方式中,由宿主细胞表达的成熟硫酸软骨素酶如seqidno:1所示。由野生型普通变形杆菌或重组表达宿主获得含chabc的基质的方法是本领域技术人员所熟知的。在使用野生型普通变形杆菌的情况下,例如可以通过流加发酵法将硫酸软骨素加入培养基中来诱导硫酸软骨素酶表达。在使用重组表达宿主的情况下,诱导物是取决于载体和启动子,例如用lac启动子的诱导物为iptg,用于pbad启动子的诱导物为阿拉伯糖。根据发酵的规模,可以通过离心或交叉流微量过滤收集含有硫酸软骨素酶的菌体,可以通过机械破碎,例如超声处理、液体均质化、冻融等,或通过化学破坏,例如引入表面活性剂、溶菌酶或其它溶解酶由收集的菌体获得含chabc的基质。本发明的纯化方法是利用可选择性捕获chabc的亲和柱的层析方法。亲和柱是固定有在层析法下与chabc具有特异性相互作用的特定配体的柱。发明人筛选了大量的不同类型的多糖衍生物,例如糖胺聚糖或其它多糖例如藻酸盐、岩藻依聚糖、聚半乳糖醛酸、戊聚糖多硫酸盐、纤维素磷酸盐等。尽管将选择的多糖固定在树脂上是测试这些配体对chabc亲和层析法的适用性的最直接的方式,但配体和树脂表面之间的固定化学、配体密度、间隔基团等可以显著影响chabc和固定化的多糖之间的相互作用。换句话说,测定溶液相中chabc和多糖之间的结合对于揭示相互作用的强度是更合适和准确的。存在用于定量研究蛋白质-小分子相互作用的若干现有方法,例如差示扫描量热法、石英晶体微量天平法,荧光各向异性等。然而,这些方法需要复杂的设备、昂贵且耗时的蛋白质固定化或蛋白质标记。为了节省时间和降低成本,可以应用半定量评估方法,如酶抑制测定法。在本发明中,通过监测所选择的多糖对chabc的抑制来评价相对结合亲和力。观察到的抑制作用越强,chabc和多糖之间的亲和力越高。更详细的实验设置在实施例1中显示。通过酶抑制测定,当施用等量的底物(硫酸软骨素c)时,发现肝素几乎完全抑制chabc的活性。因此,确定肝素为那些选择的多糖中用于构建亲和柱最合适的配体。在本发明中,肝素可以固定在具有用于配体固定的羟基、氨基、羧基的通常用于蛋白质纯化的不同树脂上。肝素可以利用共价键结合到所述树脂上。对于树脂,本发明没有特别的规定,只要肝素可以共价结合于其上的树脂都可以应用于本发明中,包括琼脂糖、纤维素、葡聚糖、二氧化硅聚丙烯酰胺、丙烯酸聚合物。肝素或树脂可以被各种活化剂活化,活化剂包括但不限于,溴化氰、edc/nhs(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺/正羟基琥珀酰亚胺)、高碘酸钠、表氯醇等。在本发明中,固定有肝素的亲和柱,尤其共价结合有肝素的亲和柱,无需进一步包被,例如可以不进行糖胺聚糖包被,尽管包被也是可行的。在一个实施方式中,本发明的固定有肝素的亲和柱,尤其共价结合有肝素的亲和柱,不使用糖胺聚糖进一步包被。尽管肝素可以结合并且可以显著抑制chabc,但是在层析中固定的肝素和chabc之间的亲和力还是未知的。为了证明chabc仍然对固定化的肝素具有亲和力,将纯化的chabc加载到来自bio-rad的affi肝素凝胶上并用实施例2中描述的各种缓冲液洗涤。事实上,将具有高于chabc的等电点(pi=8.5)的ph值的tris乙酸盐缓冲液(ph9.2)施加到柱上,在这种条件下,当缓冲液的ph值高于pi时,chabc会变成负电荷,chabc和树脂上的负电荷肝素之间应该会有排斥。如果chabc仅具有与肝素的非特异性电荷相互作用,则其将从柱上洗脱下来。然而,从实验结果来看,chabc不仅成功地被树脂捕获,而且没有被ph高于pi的缓冲液洗脱。换句话说,chabc与肝素具有特异性相互作用,而不是纯粹的非特异性电荷相互作用。在本发明中,chabc亲和层析柱与最常用于chabc纯化的阳离子交换层析柱相比具有显著的优点,因为其具有显著较低量的非特异性结合到树脂上的杂质。因此,该层析可以应用于具有不同杂质谱的各种基质,包括但不限于来自大肠杆菌(escherichiacoli)、枯草芽孢杆菌(bacillussubtilis)、普通变形杆菌(proteusvulgaris)、巴斯德毕赤酵母(pichiapastoris)和/或酿酒酵母(saccharomycescerevisiae)的匀浆或提取物,从而获得高度纯化的chabc。然而,由于肝素是带负电荷的多糖,少量的正电荷蛋白仍然可以被肝素固定化树脂非特异性捕获。然而,这些非特异性结合的蛋白质可以通过应用高ph缓冲液(ph8-10)容易地去除,ph8-10缓冲液为碳酸盐缓冲液、磷酸盐缓冲液、硼酸盐缓冲液、tris-hcl缓冲液或tris乙酸盐缓冲液,例如碳酸钠缓冲液、磷酸钠缓冲液、碳酸钾缓冲液、磷酸钾缓冲液、硼酸钠缓冲液、硼酸钾缓冲液。在该ph范围内的缓冲液可以显著降低非特异性蛋白质相互作用,因为这些蛋白质杂质的大多数将变成带负电荷的,因此不再与肝素固定化树脂具有电荷相互作用,而具有特异性相互作用的chabc不会受到高ph缓冲液的影响。去除蛋白质杂质后,用ph6-9的nacl线性梯度洗脱chabc。洗脱液可含有纯度高达98-99%甚至以上且具有低内毒素水平的chabc(实施例3-5)。内毒素可以通过使洗脱液通过内毒素捕获过滤器进一步除去。除了低内毒素和蛋白质杂质之外,该方法的另一个优点是简单性和高回收率。单步层析显著减少了处理时间,从而避免了处理过程中的活性损失。实际上,最终产率在70-80%的范围内(实施例3-5),其显著高于所有现有方法。更重要的是,亲和层析可以应用于由不同宿主细胞产生的不同种类的基质。实施例1在本发明中,鉴定与chabc的底物具有相似结构但对酶促降解呈惰性的分子是本发明的第一个关键部分。为了测试可以实际结合chabc的活性位点的多糖,对所选择的多糖进行相对酶抑制测定:490μl底物溶液在37℃温育至少15分钟,该底物溶液含有0.2%硫酸软骨素c、0.2%所选择的多糖和50mmph8.0trishcl缓冲液。10μl具有约100u/l活性的chabc在37℃下单独温育至少3分钟。温育后,轻轻混合两种溶液。然后混合物在37℃下温育20分钟以进行硫酸软骨素的酶促降解。20分钟后,通过在100℃水浴下2分钟热灭活chabc来终止反应。除了在无20分钟温育的情况下立即热灭活混合物,以相同的方式单独地进行空白对照。然后测量热灭活溶液在232nm处的吸光度并按照式1所示计算表观活性。不存在所选择的多糖的测定也以与参照相同的方式进行。抑制百分比的计算如式2所示:其中abs=吸光度差值=样品管中的od232nm-空白管中的od232nme=来自硫酸软骨素c的不饱和二糖的毫克分子的消光系数=5.5t=反应时间=20分钟vt=测定的总体积=0.5mlvs=使用的酶的体积=0.01mldf=稀释因子1000=将u/ml转换为u/l其中%ra=残余活性百分比a(poly)=存在所选择的多糖时的活性a(ref)=不存在所选择的多糖时测定的吸光度在所有多糖中,藻酸盐和聚半乳糖醛酸对酶活性没有显着影响,而肝素对chabc具有最强的抑制作用。相对酶抑制测定的结果显示在表1中。表1样品参照肝素多聚半乳糖醛酸藻酸盐活性(u/l)1215.1117119%rana4.29798此外,由于单独将chabc与肝素温育后,没有产生任何吸光度的变化(结果未显示),肝素对chabc的酶促降解活性是惰性的。因此,固定肝素作为亲和纯化chabc的配体是所选择的多糖中最合适的选择。实施例2为了测试chabc是否与固定化肝素具有特异性相互作用,使用填充有来自bio-rad的affi肝素凝胶的柱。在将样品装载到柱上之前,用25mmtris-乙酸盐(ph7.3)预平衡该柱。将chabc溶解于25mmtris-乙酸盐(ph7.5)中并装载到柱上。用(1)25mmtris-乙酸盐(ph9.2)、(2)100mmtris-乙酸盐(ph9.2)、(3)60mmtris-乙酸盐(ph8)和(4)100mmtris-乙酸盐(ph7.5)洗涤该柱。这些缓冲液都不能从柱中洗脱出chabc。而当应用0-0.3mnacl线性梯度时,可以从柱上洗脱出chabc。层析图如图1所示。实施例3以普通变形杆菌基因组为模版,利用pcr克隆出编码硫酸软骨素酶abc(seqidno:1)的基因,产物通过t4dna连接酶连接至pet3a质粒上,再通过电穿孔将该重组质粒导入大肠杆菌菌株bl21(de3)。转化后的大肠杆菌接种在含有50μg/ml氨苄青霉素的lb琼脂平板上以选择成功转化的菌落。选择单个菌落,然后接种到含有50μg/ml氨苄青霉素、37℃的lb培养基中培养18小时,并将该培养物以比例1:100加入无菌、含有50μg/ml氨苄青霉素的lb培养基中。该培养基在37℃下进一步温育至od600=0.8。添加1mm的iptg诱导硫酸软骨素酶生产,然后进一步培养4小时。通过离心收获,并储存在-80℃。将10克重组大肠杆菌细胞重悬于25mmtrishcl(ph7.0)中并通过超声波裂解5分钟。通过在17000g下离心1小时从悬浮液中除去细胞碎片。收集上清液,通过加入naoh将ph调节至ph7.0。通过加入双去离子水将上清液的电导率调节至1.2ms/cm。在加载到用ph7.525mmtris-乙酸盐预平衡的肝素固定化柱上之前,对含chabc的上清液进行0.22μm过滤。然后用(1)100mmtris-乙酸盐(ph7.5)、(2)60mmtris-乙酸盐(ph8)、(3)100mmtris-乙酸盐(ph9.2)洗涤该柱,柱上的chabc通过0-0.5mnacl进行线性梯度洗脱。层析图和sds-page显示在图2和图3中。上述方法中的纯化程度示于表2中。表2可以看出,本实施例的方法能够获得纯度>99%的chabc,回收率达到76%及内毒素水平低于0.0002eu/u。实施例4以普通变形杆菌基因组为模版,利用pcr克隆出编码硫酸软骨素酶abc(序列seqidno:1)的基因,产物通过t4dna连接酶连接至pht43质粒上,再通过电穿孔将该重组质粒导入枯草芽孢杆菌菌株168中,转化后的枯草芽孢杆菌接种在含有5μg/ml氯霉素的2×ty琼脂平板上以选择成功转化的菌落。选择单个菌落,然后接种到无菌的含有5μg/ml氯霉素、37℃的2×ty培养基中培养18小时。该培养物以比例1:100加入到无菌、含有5μg/ml氯霉素的lb培养基中。该培养基在37℃下进一步温育至od600=0.8。添加1mm的iptg诱导硫酸软骨素酶生产,然后进一步培养4小时。通过离心收获菌体,并储存在-80℃。将5g重组枯草芽孢杆菌的细胞重悬浮于在30℃与1μg/ml溶菌酶温育20分钟的25mmtris-乙酸盐(ph7.0)中。通过超声处理5分钟将细菌细胞进一步裂解。通过在17000g下离心1小时从悬浮液中除去细胞碎片。收集上清液,通过引入naoh将ph调节至ph7.0。通过引入双去离子水将上清液的电导率调节至1.6ms/cm。在装载到用ph7.525mmtris-乙酸盐预平衡的肝素固定化柱上之前,对含chabc的上清液进行0.22μm过滤。然后用(1)ph7.525mmtris-乙酸盐、(2)ph860mmtris乙酸盐、(3)ph9100mmtris乙酸盐洗涤柱。柱上的chabc通过0-0.5mnacl线性梯度洗脱。层析图如图4和图5所示。纯化程度如表3所示。表3可以看出,本实施例的方法能够获得纯度>99%的chabc,回收率达到74%及内毒素水平低于0.0002eu/u。实施例5将25g普通变形杆菌的细胞糊重悬于在37℃预热30分钟的含有2%tritonx-100的25mmtris-乙酸盐(ph7.0)中。悬浮液在750rpm下连续搅拌并在37℃温育2小时。提取后,悬浮液用4-6℃高纯度水稀释2倍。然后通过以17700g离心速度进行高速离心来立即澄清稀释的悬浮液。通过孔径为0.2μm的微孔过滤进一步澄清上清液。将澄清的上清液的ph调节至ph7.0,电导率调节至4.8ms/cm,然后加载到肝素固定化柱上。肝素固定化柱用ph7.025mmtris-乙酸盐预平衡。将上清液完全装载到柱上后,用(1)ph7.025mmtris-乙酸盐、(2)ph8.060mmtris-乙酸盐和(3)ph10100mmtris-乙酸盐9.2洗涤柱以去除包括不想要的蛋白质、dna、内毒素的杂质。以0-0.5mnacl线性梯度洗脱chabc并测试内毒素水平低于0.0002eu/u。纯化的色谱图如图6和7所示。纯化程度如表4所示。表4可以看出,本实施例的方法能够获得纯度>99%的chabc,回收率达到81%及内毒素水平低于0.0002eu/u。本领域技术人员在以上教导的指导下,可以进行关于本发明的各种改进和变化。因此,可以理解的是,在不脱离本发明权利要求的发明思路的情况下,可以以除了本文具体描述的方式之外的其他方式实施本发明。序列表<110>爱华生物科技有限公司<120>用于纯化硫酸软骨素酶abc的方法<130>p9340cn00<160>1<210>1<211>998<212>prt<213>proteusvulgaris<400>1metalathrserasnproalapheaspprolysasnleumetglnser151015gluiletyrhisphealaglnasnasnproleualaasppheserser202530asplysasnserileleuthrleuserasplysargserilemetgly354045asnglnserleuleutrplystrplysglyglyserserphethrleu505560hislyslysleuilevalprothrasplysglualaserlysalatrp65707580glyargserserthrprovalpheserphetrpleutyrasnglulys859095proileaspglytyrprothrileasppheglyglulysleuileser100105110thrserglualaglnalaglyphelysvallysleuaspphethrgly115120125trpargalavalglyvalserleuasnasnaspleugluasnargglu130135140metthrleuasnalathrasnthrserseraspglythrglnaspser145150155160ileglyargserleuglyalalysvalaspserileargphelysala165170175proserasnvalserglnglygluiletyrileaspargilemetphe180185190servalaspaspalaargtyrglntrpserasptyrglnvallysthr195200205argleusergluprogluileglnphehisasnvallysproglnleu210215220provalthrprogluasnleualaalaileaspleuileargglnarg225230235240leuileasngluphevalglyglyglulysgluthrasnleualaleu245250255glugluasnileserlysleulysserasppheaspalaleuasnile260265270histhrleualaasnglyglythrglnglyarghisleuilethrasp275280285lysglnileileiletyrglnprogluasnleuasnserglnasplys290295300glnleupheaspasntyrvalileleuglyasntyrthrthrleumet305310315320pheasnileserargalatyrvalleuglulysaspprothrglnlys325330335alaglnleulysglnmettyrleuleumetthrlyshisleuleuasp340345350glnglyphevallysglyseralaleuvalthrthrhishistrpgly355360365tyrserserargtrptrptyrileserthrleuleumetseraspala370375380leulysglualaasnleuglnthrglnvaltyraspserleuleutrp385390395400tyrserarggluphelysserserpheaspmetlysvalseralaasp405410415serseraspleuasptyrpheasnthrleuserargglnhisleuala420425430leuleuleuleugluproaspaspglnlysargileasnleuvalasn435440445thrpheserhistyrilethrglyalaleuthrglnvalproprogly450455460glylysaspglyleuargproaspglythralatrparghisglugly465470475480asntyrproglytyrserpheproalaphelysasnalaserglnleu485490495iletyrleuleuargaspthrpropheservalglygluserglytrp500505510asnasnleulyslysalametvalseralatrpiletyrserasnpro515520525gluvalglyleuproleualaglyarghispropheasnserproser530535540leulysservalalaglnglytyrtyrtrpleualametseralalys545550555560serserproasplysthrleualaseriletyrleualaileserasp565570575lysthrglnasngluserthralailepheglygluthrilethrpro580585590alaserleuproglnglyphetyralapheasnglyglyalaphegly595600605ilehisargtrpglnasplysmetvalthrleulysalatyrasnthr610615620asnvaltrpsersergluiletyrasnlysaspasnargtyrglyarg625630635640tyrglnserhisglyvalalaglnilevalserasnglyserglnleu645650655serglnglytyrglnglngluglytrpasptrpasnargmetglngly660665670alathrthrilehisleuproleulysaspleuaspserprolyspro675680685histhrleumetglnargglygluargglypheserglythrserser690695700leugluglyglntyrglymetmetalapheaspleuiletyrproala705710715720asnleugluargpheaspproasnphethralalyslysservalleu725730735alaalaaspasnhisleuilepheileglyserasnileasnserser740745750asplysasnlysasnvalgluthrthrleupheglnhisalailethr755760765prothrleuasnthrleutrpileasnglyglnlysilegluasnmet770775780protyrglnthrthrleuglnglnglyasptrpleuileaspserasn785790795800glyasnglytyrleuilethrglnalaglulysvalasnvalserarg805810815glnhisglnvalseralagluasnlysasnargglnprothrglugly820825830asnpheserseralatrpileasphisserthrargprolysaspala835840845sertyrglutyrmetvalpheleuaspalathrproglulysmetgly850855860glumetalaglnlysphearggluasnasnglyleutyrglnvalleu865870875880arglysasplysaspvalhisileileleuasplysleuserasnval885890895thrglytyralaphetyrglnproalaserilegluasplystrpile900905910lyslysvalasnlysproalailevalmetthrhisargglnlysasp915920925thrleuilevalseralavalthrproaspleuasnmetthrarggln930935940lysalaalathrprovalthrileasnvalthrileasnglylystrp945950955960glnseralaasplysasnsergluvallystyrglnvalserglyasp965970975asnthrgluleuthrphethrsertyrpheglyileproglngluile980985990lysleuserproleupro995当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1