一种低能量激光诱导间充质干细胞血管化的试剂盒的制作方法
本发明属于细胞
技术领域:
,尤其涉及一种低能量激光诱导间充质干细胞血管化的试剂盒。
背景技术:
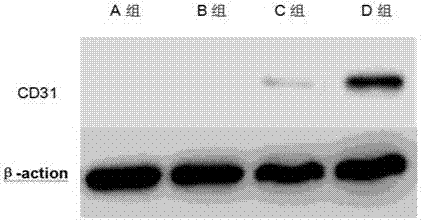
:皮肤作为人体最大的器官,具有感觉、调节体温、分泌与排泄、防止水分蒸发等多种作用,作为人体与外界环境的屏障以维持内环境的稳定,同时也是免疫系统的重要组成部分。外伤导致的皮肤大面积缺损常常导致非常严重的肢体残疾,甚至死亡。血管的生成是皮肤缺损治疗过程中重要的一步,对皮肤创面相关功能的恢复至为关键。多种细胞可经体外诱导分化产生血管内皮细胞,由间充质干细胞定向诱导分化而成的血管内皮细胞已显示出广泛的治疗前景,现有的诱导分化方法一般是采用细胞诱导剂进行诱导分化或将间充质干细胞与bend.3细胞等共同培养,如cn201610160912.4提供了一种毛囊干细胞诱导分化为血管内皮细胞的培养方法,通过分离、培养、纯化、诱导分化等步骤将毛囊干细胞诱导分化为血管内皮细胞。但是该方法诱导分化的效率较低,效果也不够理想,并且不能避免诱导分化过程中出现血管化过度导致产生血管瘤等问题。技术实现要素:为了解决上述技术问题,本发明提供一种低能量激光诱导间充质干细胞血管化的试剂盒,包括盒体、位于盒体内部的基于红光激光的低能量激光康复治疗仪和若干试剂瓶,若干所述试剂瓶内分别盛装有组织分解液、细胞培养液和细胞消化液,所述细胞培养液主要是将α-mem培养基、胎牛血清、青霉素、链霉素、乙基麦芽酚用注射用水溶解而成,每l所述注射用水溶解所述α-mem培养基30-50g、所述胎牛血清3-8g、所述青霉素1-3×105u、所述链霉素0.1-0.3g、所述乙基麦芽酚1-3g。本发明提供的试剂盒可以对间充质干细胞进行分离、培养和诱导分化,使间充质干细胞血管化,培养过程增值效果明显,诱导分化过程安全高效。进一步的,所述细胞培养液还含有羟乙基环糊精、木糖醇和天门冬氨酸,每l所述注射用水溶解所述羟乙基环糊精3-8g、所述木糖醇1-3g、所述天门冬氨酸0.1-0.5g。在细胞培养液中加入羟乙基环糊精、木糖醇和天门冬氨酸可以进一步提高细胞培养液培养脂肪间充质干细胞的增殖速度,减少或改变其中任何一个成分,脂肪间充质干细胞的增殖速度变慢。进一步的,所述细胞培养液还含有麦芽糖醇、丙酸钙、甘氨酸钠,每l所述注射用水溶解所述麦芽糖醇1-3g、所述丙酸钙0.2-0.8g、所述甘氨酸钠0.2-0.5g。在细胞培养液中加入麦芽糖醇、丙酸钙和甘氨酸钠可以提高细胞培养液防止细菌感染的能力,有效抑制细胞培养液中细菌的滋生和繁殖,保障细胞培养液的使用安全。进一步的,所述细胞培养液还含有磷酸淀粉钠、二硫代甘醇酸、海藻酸钠,每l所述注射用水溶解所述磷酸淀粉钠0.5-1.5g、所述二硫代甘醇酸0.5-1.5g、所述海藻酸钠0.05-0.2g。在细胞培养液中增加磷酸淀粉钠、二硫代甘醇酸和海藻酸钠可以有效提高细胞培养液的稳定性,避免细胞培养液沉淀、分层和变色等问题,减少其中一个成分,或变化其中一个成分,细胞培养液的稳定性会减弱。进一步的,所述组织分解液为含1%胶原酶i型的pbs缓冲。进一步的,所述细胞消化液为含0.25%胰酶的pbs缓冲液。进一步的,所述基于红光激光的低能量激光康复治疗仪包括激光组件、壳体以及设在所述壳体内的控制器和电源,所述激光组件包括外壳、设于所述外壳内的激光器和激光头,所述外壳的一端设有供所述激光头伸出的通孔,所述外壳内还设有电机、与所述电机的输出轴相连的齿轮以及中空的伸缩杆,所述外壳外表面设有控制所述电机运动的开关,所述激光头通过设置在所述伸缩杆内的激光线与所述激光器相连,所述伸缩杆的一端与所述激光头连接,所述伸缩杆的底部设有与所述齿轮啮合的齿条。进一步的,所述激光器产生的激光波长为600-800nm。优选的,所述激光组件位于所述壳体内,所述壳体上设有供激光头伸出的通孔。将激光组件设于壳体内,可以进一步简化结构,方便使用。优选的,所述激光器为半导体激光器。半导体激光器又称激光二极管,是用半导体材料作为工作物质的激光器,具有体积小、重量轻、运转可靠、耗电少、效率高等优点。进一步的,所述壳体表面设置有与所述控制器连接的控制面板,所述控制面板上还设置有开关键、时间调节设备、电流调节旋钮、显示屏和报警指示灯,所述开关键用于控制所述激光器的开启和关闭,所述时间调节设备用于调节激光器工作时间的长短,所述电流调节旋钮用于调节电流的大小,所述显示屏用于显示激光器的工作电流,所述报警指示灯用于在所述治疗仪工作状态不正常时发出警报信号。进一步的,所述时间调节设备为时间调节旋钮或时长倍数调节旋钮,所述时间调节旋钮用于调节所述激光器工作的具体时长,所述时长倍数调节旋钮用于在预先设置好所述激光器照射的单位时长的基础上,通过调节所述激光器照射的时长倍数来调节所述激光器的一次照射的总时长。进一步的,所述外壳上套设有两端开口的套筒,所述外壳外表面环设有若干卡槽,所述套筒远离所述激光头一端的内表面至少设有一个凹槽,所述凹槽内设有一端与所述凹槽底部连接的弹簧以及与所述弹簧另一端连接的卡球,所述套筒邻近所述激光头的一端设有至少一对对称排列的吸附装置,所述吸附装置由弹性吸附盘和设置在所述弹性吸附盘顶端并与所述弹性吸附盘相通的弹性吸附球组成。进一步的,所述激光头上设置有遮光罩,所述遮光罩包括环绕所述激光头的筒状罩体和通过螺纹结构与所述筒状罩体连接的敞口罩体,所述敞口罩体由多个环形褶道逐一连接而成。进一步的,所述激光头与所述伸缩杆通过可沿任意角度旋转的连接装置连接,所述治疗仪还包括图像扫描装置以及分别与所述图像扫描装置和所述控制器连接的处理器。进一步的,所述激光器表面设置有防静电层,防止静电对所述激光器造成损伤。进一步的,所述激光组件上设置有固定装置,所述固定装置包括至少两根绑带,所述绑带一端与所述外壳连接,另一端为自由端。在激光组件上设置固定装置可以在使用过程中将激光组件固定在某个物体上或是固定在使用者身体上,避免使用者必须一直手持激光器,方便使用。进一步的,所述固定装置还包括至少三根一端与所述外壳连接的支腿,所述支腿与所述外壳的连接处设置有角度调整装置。增加支腿可以更加方便地对激光器进行固定,在支腿与激光器的连接处设置角度调整装置可以根据使用需要调整支腿的支撑角度,方便使用。进一步的,所述支腿远离所述外壳的一端设置有硅胶头。进一步的,所述支腿为可伸缩结构,可以根据使用需要伸长或缩短支腿。本发明还提供一种诱导间充质干细胞血管化的方法,包括:先将采取的组织放入所述组织分解液中分离获取间充质干细胞;然后将分离得到的间充质干细胞加入所述细胞培养液中进行培养扩增;再将培养所得到的第三代间充质干细胞加入细胞培养液中,采用低能量激光照射间充质干细胞,放入温度为37℃、co2体积分数为5%、饱和湿度的的培养箱中培养2-6天即可完成间充质干细胞的血管化;所述采用低能量激光照射间充质干细胞包括:采用波长为600-800nm、功率密度为40-80mw/cm2的低能量激光照射间充质干细胞1-3次,每次50-100s。本发明提供的诱导间充质干细胞血管化的方法诱导充质干细胞血管化的效果好、效率高,诱导分化过程安全可靠。优选的,所述采用低能量激光照射间充质干细胞包括:采用波长为600-660nm、功率密度为50-60mw/cm2的低能量激光照射间充质干细胞80-100s。采用上述条件进行低能量激光照射可以使间充质干细胞血管化的效果更佳。进一步的,相邻两次低能量激光照射的间隔时间大于12h。适当延长两次低能量激光照射的间隔时间可以避免激光照射过度导致间充质干细胞血管化过度,保证分化过程安全。进一步的,所述分离获取间充质干细胞包括:无菌收集含有间充质干细胞的组织,用pbs缓冲液冲洗1-3min,再用眼科剪剪成1-2mm3大小的组织碎块,将组织碎块加入所述组织分解液中,水浴震荡,37℃、220r/min振荡30-60min,观察到脂肪逐渐变为乳糜状后置入离心机,2000r/min离心5min,弃上层清液,即可获得自体来源的间充质干细胞。进一步的,所述培养扩增包括:加入适量pbs缓冲液重悬分离后得到的间充质干细胞,吹打后接种于所述细胞培养液中,在37℃、5%co2、饱和湿度的条件下进行培养,4h后更换细胞培养液,弃去未贴壁的细胞,每隔3-4d更换细胞培养液,待细胞生长达到80%融合时加入所述细胞消化液将贴壁细胞消化分离3-5min,按1:3比例进行传代接种,每3天更换细胞培养液1次,当贴壁细胞达到融合时再次传代,将传至第三代的间充质干细胞收集,融于0.9%的氯化钠溶液中去,呈悬浊液,保存于4℃环境中。本发明提供的低能量激光诱导间充质干细胞血管化的试剂盒可以从组织中分离间充质干细胞,并进行培养扩增,再通过低能量激光的诱导使间充质干细胞血管化,分离纯度高,培养增殖效果佳,诱导分化效果好、效率高,并有效防止了诱导过程中血管化过度的问题,可以得到丰富的血管内皮细胞用于促进创伤后皮肤早期血管化,从而有利于促进创伤皮肤的修复。附图说明图1为本发明实施例13的治疗仪的结构示意图;图2为本发明实施例13的激光组件的剖视图;图3为本发明实施例13的治疗仪的工作原理结构框图;图4为本发明实施例14的治疗仪的结构示意图;图5为本发明实施例14的外壳与套筒连接位置的剖视图;图6为本发明实施例15的治疗仪的结构示意图;图7为本发明实施例16的治疗仪的工作原理结构框图;图8为各组细胞三天后细胞形态图;图9为各组细胞流式分析图;图10为各组细胞elisa分析结果图;图11为四组细胞培养三天后westernblot分析图。具体实施方式实施例1一种低能量激光诱导间充质干细胞血管化的试剂盒,包括盒体、位于盒体内部的基于红光激光的低能量激光康复治疗仪和若干试剂瓶,若干所述试剂瓶内分别盛装有组织分解液、细胞培养液和细胞消化液,所述细胞培养液主要是将α-mem培养基、胎牛血清、青霉素、链霉素、乙基麦芽酚用注射用水溶解而成,每l所述注射用水溶解所述α-mem培养基30g、所述胎牛血清3g、所述青霉素1×105u、所述链霉素0.1g、所述乙基麦芽酚1g。实施例2一种低能量激光诱导间充质干细胞血管化的试剂盒,包括盒体、位于盒体内部的基于红光激光的低能量激光康复治疗仪和若干试剂瓶,若干所述试剂瓶内分别盛装有组织分解液、细胞培养液和细胞消化液,所述细胞培养液主要是将α-mem培养基、胎牛血清、青霉素、链霉素、乙基麦芽酚用注射用水溶解而成,每l所述注射用水溶解所述α-mem培养基50g、所述胎牛血清8g、所述青霉素3×105u、所述链霉素0.3g、所述乙基麦芽酚3g。实施例3一种低能量激光诱导间充质干细胞血管化的试剂盒,包括盒体、位于盒体内部的基于红光激光的低能量激光康复治疗仪和若干试剂瓶,若干所述试剂瓶内分别盛装有组织分解液、细胞培养液和细胞消化液,所述细胞培养液主要是将α-mem培养基、胎牛血清、青霉素、链霉素、乙基麦芽酚用注射用水溶解而成,每l所述注射用水溶解所述α-mem培养基40g、所述胎牛血清5g、所述青霉素2×105u、所述链霉素0.2g、所述乙基麦芽酚2g。实施例4一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例1不同的是:所述细胞培养液还含有羟乙基环糊精、木糖醇和天门冬氨酸,每l所述注射用水溶解所述羟乙基环糊精3g、所述木糖醇1g、所述天门冬氨酸0.1g。实施例5一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例2不同的是:所述细胞培养液还含有羟乙基环糊精、木糖醇和天门冬氨酸,每l所述注射用水溶解所述羟乙基环糊精8g、所述木糖醇3g、所述天门冬氨酸0.5g。实施例6一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例3不同的是:所述细胞培养液还含有羟乙基环糊精、木糖醇和天门冬氨酸,每l所述注射用水溶解所述羟乙基环糊精5g、所述木糖醇2g、所述天门冬氨酸0.3g。实施例7一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例1不同的是:所述细胞培养液还含有麦芽糖醇、丙酸钙、甘氨酸钠,每l所述注射用水溶解所述麦芽糖醇1g、所述丙酸钙0.2g、所述甘氨酸钠0.2g。实施例8一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例5不同的是:所述细胞培养液还含有麦芽糖醇、丙酸钙、甘氨酸钠,每l所述注射用水溶解所述麦芽糖醇3g、所述丙酸钙0.8g、所述甘氨酸钠0.5g。实施例9一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例3不同的是:所述细胞培养液还含有麦芽糖醇、丙酸钙、甘氨酸钠,每l所述注射用水溶解所述麦芽糖醇2g、所述丙酸钙0.5g、所述甘氨酸钠0.4g。实施例10一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例1不同的是:所述细胞培养液还含有磷酸淀粉钠、二硫代甘醇酸、海藻酸钠,每l所述注射用水溶解所述磷酸淀粉钠0.5g、所述二硫代甘醇酸0.5g、所述海藻酸钠0.05g。实施例11一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例8不同的是:所述细胞培养液还含有磷酸淀粉钠、二硫代甘醇酸、海藻酸钠,每l所述注射用水溶解所述磷酸淀粉钠1.5g、所述二硫代甘醇酸1.5g、所述海藻酸钠0.2g。实施例12一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例3不同的是:所述细胞培养液还含有磷酸淀粉钠、二硫代甘醇酸、海藻酸钠,每l所述注射用水溶解所述磷酸淀粉钠1g、所述二硫代甘醇酸1g、所述海藻酸钠0.1g。实施例13一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例3不同的是,所述基于红光激光的低能量激光康复治疗仪如图1-3所示,包括激光组件、壳体1以及设在所述壳体1内的控制器2和电源3,所述激光组件包括外壳4、设于所述外壳4内的激光器5和激光头6,所述外壳4的一端设有供所述激光头6伸出的通孔,所述外壳4内还设有电机7、与所述电机7的输出轴相连的齿轮8以及中空的伸缩杆9,所述外壳4外表面设有控制所述电机7运动的开关10,所述激光头6通过设置在所述伸缩杆9内的激光线与所述激光器5相连,所述伸缩杆9的一端与所述激光头6连接,所述伸缩杆9的底部设有与所述齿轮8啮合的齿条,所述控制器2分别与所述激光器5和所述电源3连接,用于控制激光器1的工作频率和工作时间。本治疗仪体积小,操作简单,方便患者自己使用。开始使用时,打开开关10启动电机7,齿轮8转动带动伸缩杆9向激光头6方向移动,推动激光头6从外壳4上的通孔处伸出,控制器2控制激光器5发出波长为660nm的激光对创面进行治疗;治疗结束后,控制器2控制激光器5停止发出激光;齿轮8转动带动伸缩杆9向远离激光头6的方向移动,将激光头6缩回外壳4内,方便收纳和携带。本治疗仪中的控制器2和电机7为现有已知结构,控制器2可以选用ametekxg1500系列等型号;电机7可以选用常见的微型电机型号,如portescap16ecp52ultraec、精研6-200w系列。实施例14一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例13不同的是,如图4-5所示,所述外壳4上套设有两端开口的套筒11,所述外壳4外表面环设有若干卡槽12,所述套筒11远离所述激光头6一端的内表面设有一个凹槽13,所述凹槽13内设有一端与所述凹槽13底部连接的弹簧14以及与所述弹簧14另一端连接的卡球15,所述套筒11邻近所述激光头6的一端设有至少一对对称排列的吸附装置,所述吸附装置由弹性吸附盘16和设置在所述弹性吸附盘16顶端并与所述弹性吸附盘16相通的弹性吸附球17组成。本治疗仪上设置的套筒11套设在外壳4上并可在外壳4上移动,通过卡球15卡入不同位置的卡槽12实现固定在外壳4的不同位置上。套筒11可以遮挡激光头发出的激光,使激光仅照射需要照射的创口位置。在套筒11一端设置的吸附装置可以将套筒吸附在创口附近的皮肤上,使使用者不用一直用手握持治疗仪,方便了使用者的操作。实施例15一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例13不同的是,如图6所示,所述激光头6上设置有遮光罩18,所述遮光罩18包括环绕所述激光头6的筒状罩体1801和通过螺纹结构与所述筒状罩体1801连接的敞口罩体1802,所述敞口罩体1802由多个环形褶道逐一连接而成。在本治疗仪中,在激光头上设置遮光罩18可以在激光器使用过程中有效防止激光造成不必要的伤害;环形褶道形成的敞口罩体1802可在压力作用下折叠压缩,节省空间、方便收纳。实施例16一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例13不同的是,如图7所示,所述激光头6与所述伸缩杆9通过可沿任意角度旋转的连接装置连接,所述治疗仪还包括图像扫描装置19以及分别与所述图像扫描装置19和所述控制器2连接的处理器20,所述图像扫描装置19用于扫描伤口形状信息并传输给所述处理器20,所述处理器20用于接收所述伤口形状信息并制定所述激光头6的照射路线,并将所述照射路线信息传输给所述控制器2。本治疗仪中的图像扫描装置19和处理器20为现有已知结构,图像扫描装置19可选用常见的微型摄像机或照相机型号;处理器可选用骁龙820、海思麒麟950等常见处理器型号。实施例17一种诱导间充质干细胞血管化的方法,包括:先将采取的组织放入所述组织分解液中分离获取间充质干细胞;然后将分离得到的间充质干细胞加入所述细胞培养液中进行培养扩增;再将培养所得到的第三代间充质干细胞加入细胞培养液中,采用低能量激光照射间充质干细胞,放入温度为37℃、co2体积分数为5%、饱和湿度的的培养箱中培养2-6天即可完成间充质干细胞的血管化;所述采用低能量激光照射间充质干细胞包括:采用波长为800nm、功率密度为80mw/cm2的低能量激光照射间充质干细胞2次,每次50s。实施例18一种诱导间充质干细胞血管化的方法,与实施例18不同的是,所述采用低能量激光照射间充质干细胞包括:采用波长为620nm、功率密度为60mw/cm2的低能量激光照射间充质干细胞100s。实施例19一种诱导间充质干细胞血管化的方法,与实施例18不同的是,所述采用低能量激光照射间充质干细胞包括:采用波长为700nm、功率密度为40mw/cm2的低能量激光照射间充质干细胞3次,每次60s,相邻两次低能量激光照射的间隔时间为24h。对照例1一种低能量激光诱导间充质干细胞血管化的试剂盒,包括盒体、位于盒体内部的基于红光激光的低能量激光康复治疗仪和若干试剂瓶,若干所述试剂瓶内分别盛装有组织分解液、细胞培养液和细胞消化液,所述细胞培养液主要是将α-mem培养基、胎牛血清、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述α-mem培养基40g、所述胎牛血清5g、所述青霉素2×105u、所述链霉素0.2g。对照例2一种低能量激光诱导间充质干细胞血管化的试剂盒,包括盒体、位于盒体内部的基于红光激光的低能量激光康复治疗仪和若干试剂瓶,若干所述试剂瓶内分别盛装有组织分解液、细胞培养液和细胞消化液,所述细胞培养液主要是将α-mem培养基、胎牛血清、青霉素、链霉素、乳聚糖用注射用水溶解而成,每l所述注射用水溶解所述α-mem培养基40g、所述胎牛血清5g、所述青霉素2×105u、所述链霉素0.2g、所述乳聚糖2g。对照例3一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例3不同的是:所述细胞培养液还含有羟乙基环糊精和天门冬氨酸,每l所述注射用水溶解所述羟乙基环糊精5g、所述天门冬氨酸0.3g。对照例4一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例3不同的是:所述细胞培养液还含有甲壳糖、木糖醇和天门冬氨酸,每l所述注射用水溶解所述甲壳糖5g、所述木糖醇2g、所述天门冬氨酸0.3g。对照例5一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例3不同的是:所述细胞培养液还含有麦芽糖醇、丙酸钙,每l所述注射用水溶解所述麦芽糖醇2g、所述丙酸钙0.5g。对照例6一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例3不同的是:所述细胞培养液还含有麦芽糖醇、苯甲酸钾、甘氨酸钠,每l所述注射用水溶解所述麦芽糖醇2g、所述苯甲酸钾0.5g、所述甘氨酸钠0.4g。对照例7一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例3不同的是:所述细胞培养液还含有二硫代甘醇酸和海藻酸钠,每l所述注射用水溶解所述二硫代甘醇酸1g、所述海藻酸钠0.1g。对照例8一种低能量激光诱导间充质干细胞血管化的试剂盒,与实施例3不同的是:所述细胞培养液还含有磷酸淀粉钠、酒石酸钾钠、海藻酸钠,每l所述注射用水溶解所述磷酸淀粉钠1g、所述酒石酸钾钠1g、所述海藻酸钠0.1g。对照例9一种诱导间充质干细胞血管化的方法,包括:先将采取的组织放入所述组织分解液中分离获取间充质干细胞;然后将分离得到的间充质干细胞加入所述细胞培养液中进行培养扩增;再将培养所得到的第三代间充质干细胞加入细胞诱导液中,在温度为37℃、co2体积分数为5%、饱和湿度的条件下诱导培养14天即可完成间充质干细胞的血管化;所述细胞诱导液主要是将α-mem培养基、胎牛血清、青霉素、链霉素、vegf、氢化可的松溶液用注射用水溶解而成,每l所述注射用水溶解所述α-mem培养基30-50g、所述胎牛血清3-8g、所述青霉素1-3×105u、所述链霉素0.1-0.3g、所述vegf10-30μg、所述氢化可的松溶液5-10ml;所述氢化可的松溶液是将氢化可的松用无水乙醇溶解而成,每l所述无水乙醇溶解所述氢化可的松5-10mg。对照例10一种诱导间充质干细胞血管化的方法,与实施例18不同的是,所述采用低能量激光照射间充质干细胞包括:采用波长为900nm、功率密度为90mw/cm2的低能量激光照射间充质干细胞2次,每次30s,两次低能量激光照射的间隔时间为6h。细胞培养液增殖效果评价采取脂肪组织,分离获取脂肪间充质干细胞,分别采用实施例3、实施例6、对照例1-4的试剂盒中的细胞培养液对脂肪间充质干细胞进行培养,采用台盼蓝经典染色法对细胞进行计数,分别统计原代和第3代活脂肪间充质干细胞的数量,计算脂肪间充质干细胞的培养扩增倍数,结果见表1。表1脂肪间充质干细胞培养扩增效果评价由上述结果可以得出,采用本发明提供的试剂盒中的细胞培养液培养脂肪间充质干细胞的增殖效果明显优于对照例1和对照例2的细胞培养液,说明本发明提供的试剂盒中的细胞培养液有利于提高脂肪间充质干细胞的增殖速度。采用实施例6提供的试剂盒中的细胞培养液培养脂肪间充质干细胞的增殖效果明显优于实施例3、对照例3和对照例4的细胞培养液,说明在细胞培养液中加入羟乙基环糊精、木糖醇和天门冬氨酸可以进一步提高细胞培养液培养脂肪间充质干细胞的增殖速度,减少或改变其中任何一个成分,脂肪间充质干细胞的增殖速度变慢。细胞培养液安全性评价分别采取实施例3、实施例9、对照例5和对照例6的试剂盒中的细胞培养液,均在温度为25℃±2℃,相对湿度为60%±10%的条件下密闭保存12个月,检测细胞培养液中的细菌总数。表2细胞培养液中细菌总数统计实施例3实施例9对照例5对照例6细菌总数(cfu/ml)81674638561由上述结果可知,在细胞培养液中加入麦芽糖醇、丙酸钙和甘氨酸钠可以提高细胞培养液防止细菌感染的能力,有效抑制细胞培养液中细菌的滋生和繁殖,保障细胞培养液的使用安全。细胞培养液稳定性评价取实施例3、实施例12、对照例7、对照例8的试剂盒中的细胞培养液,将上述细胞培养液均在温度-4℃±2℃下,相对湿度为60%±5%的条件下放置6个月后,检测细胞培养液的性状和色泽,实施例12的细胞培养液的形状和色泽未发生明显变化,而实施例3、对照例7、对照例8的细胞培养液均出现了颜色变深和少量沉淀的现象。由上述试验结果可知,在细胞培养液中增加磷酸淀粉钠、二硫代甘醇酸和海藻酸钠可以有效提高细胞培养液的稳定性,避免细胞培养液沉淀、分层和变色等问题,减少其中一个成分,或变化其中一个成分,细胞培养液的稳定性会减弱。间充质干细胞血管化效果评价1.诱导间充质干细胞血管化的不同方法的效果比较采取脂肪组织,分别采用实施例18、实施例19、对照例9和对照例10的方法进行分离、培养和诱导分化,然后分别检测血管内皮细胞标记物cd31、cd34、kdr的阳性率,结果见表3。表3cd31、cd34、kdr阳性率评价组别cd31(%)cd34(%)kdr(%)实施例1945.2±2.338.6±1.953.0±2.5实施例2029.8±3.527.1±2.142.7±4.0对照例918.3±3.014.1±2.817.5±2.9对照例1014.2±1.719.4±3.526.5±4.1由上述结果可知,采用本发明提供的诱导间充质干细胞血管化的方法与对照例9和对照例10的方法对比,其血管内皮细胞标记物cd31、cd34、kdr的阳性率均明显较高,说明采用本发明提供的诱导间充质干细胞血管化的方法可使充质干细胞血管化的效果更好。采用实施例18的方法对脂肪间充质干细胞进行诱导分化后其血管内皮细胞标记物cd31、cd34、kdr的阳性率明显高于实施例19的方法,说明采用波长为600-660nm、功率密度为50-60mw/cm2的低能量激光照射间充质干细胞80-100s使充质干细胞血管化的效果更佳。2.不同诱导间充质干细胞血管化的方法导致血管瘤倾向的评价采取脂肪组织,分别采用实施例18、实施例19、对照例9和对照例10的方法进行分离、培养和诱导分化,然后分别检测血管内皮祖细胞标记物cd133的阳性率,结果见表4。表4cd133阳性率评价组别cd133(%)实施例191.3±0.7实施例202.0±0.5对照例99.1±1.7对照例1022.4±1.2由上述结果可知,采用本发明提供的诱导间充质干细胞血管化的方法与对照例9和对照例10的方法对比,其血管内皮祖细胞标记物cd133的阳性率明显偏低,说明采用本发明提供的方法诱导间充质干细胞血管化的过程中形成血管瘤的倾向较低,诱导分化过程安全。3.低能量激光诱导血管化试剂盒的结果3.1材料和方法(一)主要试剂和仪器(二)实验方法1、脂肪源性间充质干细胞的复苏:参见现有技术。2、实验分组a组为adscs普通培养组,空白对照:复苏3代细胞按照7.5×104/cm2密度接种于普通24孔板(组织处理培养板)上,然后置于37℃、体积分数为5%的二氧化碳培养箱中培养三天;b组为adscs悬浮培养组:取第3代细胞按照7.5×104/cm2的密度接种于极低吸附24孔培养板上,然后置于37℃、体积分数为5%的二氧化碳培养箱中培养三天;c组为lll+adscs普通培养组:取第3代细胞按照7.5×104/cm2的密度接种于普通24孔培养板上,采用660nm,功率密度为60mw/cm2的低能量密度激光照射细胞,能量密度为6j/cm2,照射距离为10cm,照射时间为100s,然后置于37℃、体积分数为5%的二氧化碳培养箱中培养三天;d组为lll+adscs悬浮培养组:取第3代细胞按照7.5×104/cm2的密度接种于极低吸附24孔培养板上(该培养板上含有实施例3的细胞培养液),采用660nm,功率密度为60mw/cm2的低能量密度激光照射细胞,能量密度为6j/cm2,照射距离为10cm,照射时间为100s,然后置于37℃、体积分数为5%的二氧化碳培养箱中培养三天。3、观察细胞生长形态采用倒置显微镜(leica)观察培养三天后各组细胞的形态。4、免疫表型分析:分别提取各组实验细胞,0.25%胰酶消化,pbs液洗涤离心,加人抗光谱角蛋白多克隆抗体(浓度1:20),4℃孵育0.5h。pbs液重写3次,加异硫氰酸荧光素标记的人抗兔二抗(浓度1:200),4℃孵育0.5h。pbs液冲洗3次后,标记cd29、cd31、cd34、cd90、cd105流式分析。igg做阴性对照。5、血管再生相关分子的检测(elisa分析):使用人vegf和fgf定量elisa试剂盒定量检测各组细胞vegf和fgf的分泌量。严格按照elisa试剂盒操作说明进行操作,详细如下:(1)标本收集:分别收集细胞培养液室温下1000g离心20分钟,取上清液进行检测。(2)配液:用蒸馏水将20倍浓缩洗涤液稀释成原倍的洗涤液。(3)加标准品和待测样本:取足够数量的酶标包被板固定于框架上,分别设置标准品孔、待测样本孔和空白对照孔,记录各孔位置,在标准品孔加入标准品50μl;待测样本孔中先加入待测样本10μl,再加样本稀释液40μl(即样本稀释5倍);空白对照孔不加。(4)温育:37℃水浴锅或恒温箱温育30min。(5)洗板:弃去液体,吸水纸上拍干,没孔加满洗涤液,静置1min,甩去洗涤液,吸水纸上拍干,如此重复洗板4次。(6)加酶标工作液:每孔加入酶标工作液50μl,空白对照孔不加。(7)温育:重复4的操作。(8)洗板:重复5的操作。(9)显色:每孔先加入显色剂a液50μl,再加入显色剂b液50μl,37℃避光显色15min。(10)终止:取出酶标板,每孔加终止液50μl,终止反应。(11)测定:以空白孔调零,在终止后15min内,用450nm波长测量各孔的吸光值(od值)。(12)计算:根据标准品的浓度及对应的od值,计算出标准曲线的直线回归方程,再根据样本的od值,在回归方程上计算出对应的样品浓度,也可以使用各种应用软件来计算。最终浓度为实际测定浓度乘以稀释倍数。6、westernblot检测:(1)实验前准备:根据实验所需制备分离胶和浓缩胶。(2)样本提取:分别将不同组的细胞及培养液转移至15ml离心管中,2500rpm离心5min,弃上清,pbs液吹打洗涤,继续2500rpm离心5min,弃上清后,pbs液重复洗涤一次;吸干上清后,加100μl裂解液(含pmsf)冰上裂解30min;然后4℃、12000rpm离心5min,取上清分装于0.5ml离心管中-20℃保存。(3)上样:拿出配好的胶,小心移去梳子,整理梳孔,固定电泳装置,电泳槽内加入电泳缓冲液200ml(要没过低的玻璃板),按预定顺序上样。(4)电泳:分离胶时80v,浓缩胶120v。待样本到达分离胶的底部时,关闭电源。卸下玻璃板,取下凝胶转到去离子水中略为漂洗一下备用。蒸馏水淋洗电泳槽擦干。(5)转膜:根据裁胶的大小,剪切大小约8.3cm*6cm(和胶板大小一致)左右的pvdf膜,pvdf膜用前要经过甲醇15min浸泡,然后与滤纸一起放置于转膜液(转膜液提前在4℃冰箱静置防止转膜时蛋白降解)中浸泡。安装电转移装置,注意确保各层精确对齐并避免出现气泡(由上往下依次是滤纸、胶、pvdf膜、滤纸),紧扣支持物,连接电源。转膜电压220转膜的时间、转膜完成后,断开电源,拆卸电转装置,逐一拆去各层,取出pvdf膜,标注正反,剪切右上角为正面。(6)封闭:用5%脱脂牛奶—tbst封闭液室温(建议放在37℃恒温摇床上)震荡2小时。(每过半小时将杂交袋翻个面,向杂交袋中加入牛奶时,不要直接打在膜上,以免对膜上蛋白造成损失)(7)一抗封闭:相应一抗与5%bsa—tbst封闭液按比例稀释后取适量放入杂交袋中,放入4℃冰箱,摇床慢摇过夜。(8)洗膜:将膜转到干净平皿中,加入tbst室温摇晃3×15min(控制摇床速度,慢摇)。(9)二抗标记:将洗完的膜,重新放回杂交袋中,加入tbst封闭液,按比例加入二抗,室温(建议放在37℃恒温摇床上)摇晃1小时(每过0.5小时将杂交袋翻个面)。(10)洗膜:弃去二抗封闭buffer液,将膜转到干净平皿中(转移膜时,一定要小心,不要用镊子夹膜的中部,以免造成一抗、二抗或靶蛋白损失),加入tbst室温震荡3次,第一次15min(控制摇床速度,慢摇),最后两次均为5min。(11)显影成像:利用scionimage图像分析软件进行分析。(三)统计学方法spss17.0软件分析。记录数据,组间比较,采用方差分析和snk检验进行统计学分析表处理。p≤0.05表明差异具有统计学意义。3.2结果(一)光镜特征如图8所示为四组细胞培养三天后,倒置光学显微镜下观察细胞形态:a组细胞广泛贴壁,呈长梭形,可见螺旋样生长;b组细胞散在悬浮生长,聚集形成小细胞团块;c组细胞广泛贴壁,鱼群样分布明显;d组细胞悬浮聚集形成大细胞团块及少量小细胞团块。(二)免疫表型鉴定如图9所示,各组细胞进行流式细胞学分析,其中d组cd31、cd34表达阳性,而a、b、c组cd29、cd90、cd105表达阳性,cd31、cd34表达阴性。(三)血管再生相关分子的检测结果(elisa分析)如图10所示,elisa结果分析显示d组vegf和fgf的分泌量显著多于a、b、c组,差异有统计学意义(p<0.05),而c组多于a、b两组,差异有统计学意义(p<0.05),b组多于a组有统计学意义(p<0.05)。(四)westernblot检测结果如图11所示,westernblot结果分析显示d组cd31高表达,而c组cd31低表达,多于a、b两组,a组、b组cd31均不表达3.3结论由此可以得出,本发明提供的试剂盒可对间充质干细胞进行培养扩增,再通过低能量激光的诱导使间充质干细胞血管化,培养增殖效果佳,诱导分化效果好、效率高。最后应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1