一种检测食源性致病菌生物芯片的制备方法与流程
本发明涉及食源致病性微生物检测技术,尤其涉及一一种检测食源性致病菌生物芯片制备方法。
背景技术:
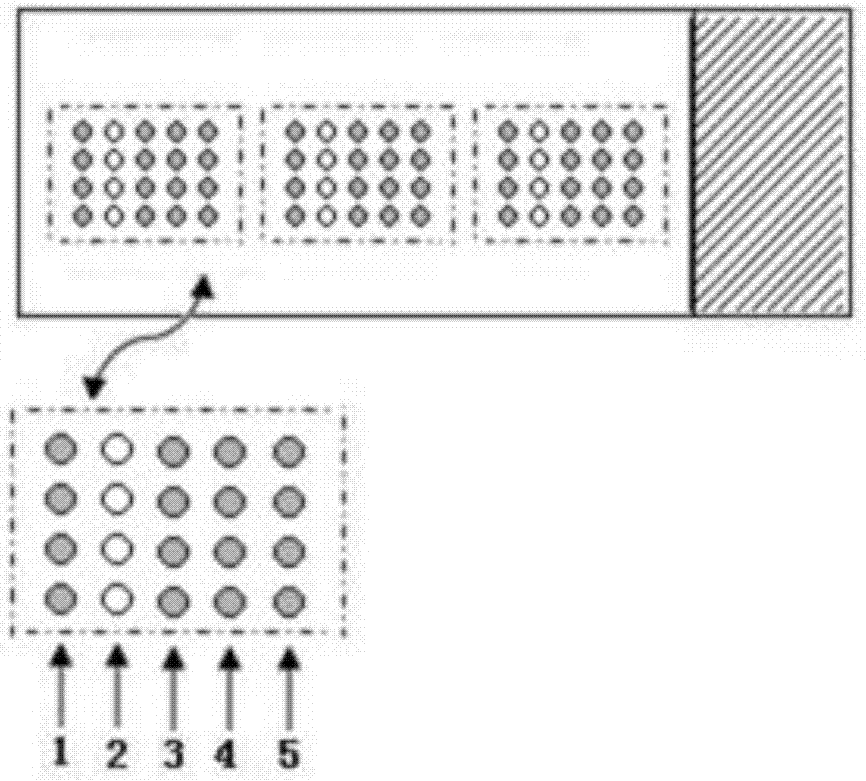
:常见的食源性病原体主要有:沙门氏菌、副溶血性弧菌、金黄色葡萄球菌、肉毒梭菌、大肠杆菌o157、产气荚膜梭菌(魏氏梭菌)、猪囊尾坳、旋毛虫、黄曲霉等。食源性病原体的种类仍在增加,对食品安全以及人类自身健康已构成了不容忽视的威胁。根据世界卫生组织的估计,全球每年发生食源性疾病数十亿人,发达国家发生食源性疾病的概率也相当高,平均每年有三分之一的人群感染食源性疾病,其中食源性微生物引起的食源性疾病占37.1%。传统的检测方法包括增菌培养筛选及后续计数检测、生化反应鉴定或血清学鉴定等环节,这些传统方法技术成熟、准确性高、所需设备简单,仍然是目前食品卫生监管机构的主流检测方法。然而随着检验要求的提升和检验规模的扩大,传统方法的缺点也日益凸显,如检测周期长,准备和收尾工作繁重、特异性不足、灵敏度低,而且需要专业操作人员等。再加上实际检测中,大部分食品微生物检测的结果为阴性,因此需要一种简单、灵敏、准确、快速检测方法对大量样木进行筛查,通过去除大部分阴性结果,剩余少许疑似阳性样品再用传统的培养鉴定方法进行确认,从而大大提高食品微生物检验的执行效率。技术实现要素:本发明要解决的技术问题在于提供一种针对常见的食源致病性微生物的生物芯片检测方法,以食源性致病菌独有的蛋白基因序列设计其特异性的捕获探针cp、检测探针dp和滚环探针rcp。cp和dp含有与待检细菌基因组gdna特异性序列互补的序列,rcp不含任何待检细菌基因组dna序列;cp经5′-氨基修饰点样固定在醛基修饰的芯片表面,制备成捕获探针微阵列,在片cp和dp与待检细菌基因组dna退火并连接,进行在片滚环扩增(rca)并引入biotin-dutp,经扩增、洗涤后,加入链亲和素(streptavidin-800cw)与固相rca扩增产物结合,在一定的条件下洗脱。如果“靶”微生物存在,cp和dp可通过t4dna连接酶连接,在片滚环扩增(rca)可以进行,则有荧光信号产生,如果“靶”微生物不存在,则无荧光信号产生。用近红外荧光成像仪扫描芯片,获得检测结果。该方法能同时检测多种食源致病性微生物。具有高灵敏性、高通量、高特异性、不依赖抗体等优点。为解决上述技术问题,本发明提供了具体包括如下步骤的一种检测食源致病性微生物芯片的制备方法:第1步、将硅烷化处理的玻片用5%的戊二醛处理,用丙酮、乙醇、去离子蒸馏水彻底清洗,干燥,得到醛基修饰的玻片;第2步、设计食源性致病微生物特异性的捕获探针cp、检测探针(dp,detectprobe)、滚环探针(rcp,rollingcircleprobe)、靶标探针(targetprobe,tp)、阴性对照探针(negativecontrol,nc)和阳性对照探针(positivecontrol,pc);第3步、经5′-氨基修饰的cp、pc和nc点样在第1步制备的芯片表面,cp微阵列经水化和naio4还原处理后,制备成cp微阵列;第4步、dp、rcp和待检细菌基因组gdna混合变性后加入微阵列上退火并连接;第5步、对第4步退火的微阵列经洗脱后,在芯片表面的基因结构中加入滚环扩增(rca,rollingcircleamplification)反应体系物,进行在片滚环扩增(rca)并引入biotin-dutp,经扩增和洗涤后,加入链亲和素(streptavidin-800cw)与rca扩增产物结合,在一定的条件下洗脱,用近红外荧光成像仪扫描芯片,获得检测结果。制备核酸探针是一种检测食源致病性微生物芯片的制备方法的第一步,也是很重要的一步。为实现本技术检测的食源致病性微生物功用,核酸探针的设计和合成应满足下列条件:[1]cp和dp-a序列是根据待检细菌特有蛋白基因序列设计,cp和dp-a序列与待检细菌特有蛋白基因序列互补且具有高度特异性,高度特异性是指其他细菌不含有该序列或相似度低于10%;[2]捕获探针cp的5′端含有7-10个与待检细菌基因序列无关序列。[3]滚环引物dp-c、dp-b和滚环探针rcp不含任何待检细菌基因组dna序列,彼此之间序列相似度低于10%。本发明的有益效果在于:(1)本发明将生物芯片技术和rca技术优势相结合建立一种基于近红外荧光固相rca在片(nirf-srca)检测食源致病性微生物新技术方法,该方法具有高灵敏性、高通量、高特异性、不依赖抗体等优点,可用于同步检测多种食源致病性微生物检测。(2)本发明中rca的核酸扩增能力和信号放大能力比其他技术高出很多倍,线性rca对模板的扩增能力高达100000倍,指数rca可达高于10的9次方倍的扩增效率,如此高的灵敏性使其能够实现检测到单分子水平。(3)本发明中设计的捕获探针cp和检测探针与靶标微生物特异性互补,检测靶标微生物时,只有当捕获探针cp和检测探针与靶标微生物核酸序列特异性互补配对,才能进行连接反应,形成在片检测信号,同时,当出现一个碱基错配时,连接反应就无法进行,不能形成在片检测信号,也就无法完成rca反应,因此确保了食源致病性微生物检测中的特异性。(4)本发明中设计rca扩增的通用引物序列和通用锁式探针序列,不仅大大降低了合成探针的成本,而且可高效降进行等效率的扩增,并且不会相互干扰对靶标微生物的检测,避免了传统液相扩增反应中引物和产物相互影响的现象。因此,在同一检测体系中可以实现同时对多个靶目标分子的高通量检测。此优势在芯片检测扩增中优势更为明显。(5)本发明中基于rca是一种等温核酸扩增技术,不必再使用昂贵的热循环仪便可以完成扩增,为商业化应用和推广提供了广阔的市场前景。附图说明图1为本发明所述的一种检测食源性致病菌生物芯片的制备方法原理示意图;其中,1—连接反应,2—cp的5′端和醛基修饰的玻片基质的连接区,3—醛基修饰的玻片基质。图2是pc、cp和nc微阵列点样布阵示意图;其中,1—pc,2—nc,3、4和5—cp。图3是微阵列芯片检测靶标探针(tp)效果图。图4是是微阵列检测金黄色葡萄球菌效果图。具体实施方式以下通过实施例对本发明的上述内容做进一步详细说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。此处仅以制备检测金黄色葡萄球菌生物芯片的制备方法为例,说明本发明技术的具体实施方式。本发明实施例中所用标准金黄色葡萄球菌(staphylococcusaureussubsp.aureuscmcc26003,冻干粉)菌株,购自中国医学细菌保藏管理中心(cmcc)。一种检测食源致病性微生物芯片的制备方法,具体步骤如下:(1):将硅烷化处理的玻片置于含5%的戊二醛(50%水溶液,amresco)磷酸缓冲液(0.1mph7.4)中浸泡2小时,用丙酮、乙醇、去离子蒸馏水彻底清洗各两次,氮气吹干,4℃保存备用;(2):设计并合成探针:tp:5′-gcctttacagatagcatgccatacagtcatttcacgc-3′cp:5′-nh2-tttttttgcgtgaaatgactgtatgg-3′dp:5′-catgctatctgtaaaggctttcgtttcacgacgaaataacgggatacaggac-3′rcp:5′-cgttatttcgtctattctactgtattctgtatgtctccgtatcgctgtcacctgtgtatctttgattcgtcagtcctgtatcc-3′pc:5′-nh2-tttttttttttgcatatgagcgtctcgacttt-biotin-3′nc:5′-nh2-tttttttttttcgttactagtacatgcttcggttt-3′(3):使用te缓冲液将cp、pc和nc配置为100μm的贮存液,保存于-20℃。点样前,使用te缓冲液将100μmcp、pc和nc稀释为20μm,再用50%点样液稀释至2μm,瞬时离心混匀,然后取至少35μl至384微孔板中,将384微孔板置于点样仪中的吸样位置准备点样。(4)将点样完毕的玻片置于密闭的湿盒中,湿盒中铺有pbs溶液浸湿的滤纸,37℃水浴过夜(大于12h),去离子水洗涤2min、0.2%sds洗涤5min、去离子水洗涤2min、0.15%~0.3%硼氢化钠溶液处理5min、去离子水洗涤3遍,2min/遍、玻片离心机离心甩干,储存于4℃备用。(5)将gdna、dp(终浓度0.05μm)与rcp(5μl)加入ep管中杂交液,加热95℃,变性5min,将ep管中的25μl杂交反应体系迅速转移到贴于醛基基片的25μlgeneframe中,盖好盖玻片,置于杂交炉中开始杂交反应,50℃杂交4h。(6)杂交反应结束后,去离子水洗涤1min,吹干。按照如下连接反应体系,进行连接,将连接反应体系25μl贴于基因结构(geneframe)中。组分反应1t4dna连接酶(14u/μl)1μl10×t4缓冲液2.5μl灭菌水21.5μl总体积25μl(7)连接反应条件37℃30min,之后去离子水洗涤1min,吹干。(8)醛基基片的固相rca体系,反应体系如下:将ep管中的25μlrca扩增反应体系转移到上述geneframe中,将玻片置于30℃杂交炉的密闭湿盒中,扩增2h。(9)rca反应结束后,揭掉geneframe,去离子水洗涤玻片2min。(10)瞬时离心玻片,加入1×封闭液浸没玻片,室温,摇床慢速摇动,封闭30min。(11)按照链亲和素(streptavidin-irdye800):pbs=1:15000的比例,配置streptavidin-irdye800的pbs溶液,浸没玻片,室温,摇床慢速摇动,结合30min。(12)去离子水洗涤玻片10min,瞬时离心玻片,使用odyssey800nm激光通道扫描信号。实施例2:验证微阵列芯片检测方法的可行性和特异性:(1)将pc、nc和cp使用点样仪点样至醛基基片上,探针浓度2μm。(2)探针固定过程与实施例1中(1)—(4)相同。(3)(3)将tp、dp(终浓度0.05μm)与rcp(5μl)加入ep管中杂交液,加热95℃,变性5min,将ep管中的25μl杂交反应体系迅速转移到贴于醛基基片的25μlgeneframe中,盖好盖玻片,置于杂交炉中开始杂交反应,50℃杂交4h。(4)连接、rca、洗涤和扫描,步骤与实例1的(6)—(12)相同。以tp为检测对象,将tp直接加入杂交反应体系,进行微阵列芯片滚环扩增检测,结果如图3所示。pc荧光信号说明在cp、pc和nc的点样、固定是可行的,同时streptavidin-irdye800和biotin能在片高效结合,并可取得微阵列芯片检测结果;nc无信号说明nc不能与tp结合,也不能进行延伸扩增反应,不能进行滚环扩增,具有较高的特异性;cp的荧光信号说明dp和cp能够连接,也成功实现滚环扩增,检测到了靶标,说明本发明检测方法是可行的。实施例3:金黄色葡萄球菌的检测效果培养金黄色葡萄球菌(cmcc26003),提取金黄色葡萄球菌gdna。点样步骤与实例1的(1)—(12)相同。培养金黄色葡萄球菌(cmcc26003),提取其gdna,制备2μm的cp、pc和nc、阵列,进行srca反应,检测结果如图4所示,pc和cp均有荧光信号,nc无荧光信号,表明本发明方法能够特异性地检测到金黄色葡萄球菌gdna,说明该检测方法具有较高的特异性。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1