胡黄连素二聚体类似物JJA-D0的衍生物或其药学上可接受的盐、制法与用途的制作方法
本发明属于医药领域,具体涉及胡黄连素二聚体类似物jja-d0的衍生物或其药学上可接受的盐、制备方法与用途。
背景技术
胡黄连素是常用中药胡黄连中的主要活性成分,最初是从夹竹科植物加拿大麻(apocynumcannabinuml.)中分离得到的,其结构如下所示。胡黄连为玄参科植物西藏胡黄连和胡黄连的根茎,是常用的中药材,具有清热凉血、治疳疾等作用。胡黄连主要分布于喜马拉雅山区,西藏胡黄连主要分布于四川、云南、西藏。
胡黄连素的分子结构
胡黄连在印度民间用于利胆、抗疟、健脾、尿路感染及肝炎等的治疗。随着对其化学成分及药理作用的研究深入,发现胡黄连素为胡黄连的主要药理成分之一,具有抗氧化、抗炎作用。体内nadph氧化酶是调控ros水平的主要途径之一,在病理情况下,nadph氧化酶激活,ros表达量增加,破坏组织蛋白结构和功能,造成疾病部位组织损伤,引发炎症等。有报道胡黄连素能够特异性抑制nadph氧化酶活性,可以选择性抑制多形核中性白细胞产生ros,起到抗氧化的作用。也有报道,胡黄连素可改善一些炎症性损伤,具有一定的抗炎作用。但所报道的胡黄连素的抗氧化与抗炎作用往往不够理想,有一些研究者进行了胡黄连素的结构修饰,以期获得效果更好的候选化合物。
apocynin-lipoicacidconjugatesandusesthereof(公开号us2014/0315989a1)公开了胡黄连素硫辛酸衍生物在sd大鼠脑中风缺血再灌注模型中,对脑组织梗死损伤的改善以及其对抗氧化应激、凋亡等方面的作用。kanegaemp等人对胡黄连素进行了构效关系的研究,对分子结构上的乙酰基分别用不同的吸电子基团和供电子基团替换,得到一系列衍生物,研究发现,吸电子取代基衍生物抑制nadph氧化酶的活性较供电子取代基衍生物强(kanegaemp,dafonsecalm,brunettiil,silvaso,ximenesvf.thereactivityofortho-methoxy-substitutedcatecholradicalswithsulfhydrylgroups:contributionforthecomprehensionofthemechanismofinhibitionofnadphoxidasebyapocynin.biochemicalpharmacology2007,74(3):457-464.)。macías-pérezme等人将胡黄连素的酚羟基以不同长度碳链的羧酸加以修饰,结果显示,所合成的胡黄连素衍生物与nadph氧化酶的p47phox有较好的亲和力,从而抑制nox的活性(macías-pérezme,martínez-ramosf,padilla-martinezii,correa-basurtoj,kispertl,mendieta-wejebeje,rosales-hernándezmc.ethersandestersderivedfromapocyninavoidtheinteractionbetweenp47phoxandp22phoxsubunitsofnadphoxidase:evaluationinvitroandinsilico.biosciencereports.2013,33(4):605-616.)。
本领域研究人员前期针对胡黄连素的结构修饰公开了专利“胡黄连素的衍生物及其制备方法和应用(zl200610037302.1)”与“胡黄连素衍生物及其制备与应用(zl201010185981.3)”。这两个专利主要公开了胡黄连素硝基化、氨基化、酰胺化衍生物,胡黄连素与硫辛酸、硝酮等抗氧化基团结合的衍生物以及胡黄连素二聚体类似物jja-d0的制备方法,以及这些化合物在制备治疗免疫系统疾病药物和在制备抗氧化药物方面的用途。
随着对胡黄连素药理学研究的深入,有报道胡黄连素是一种前药,实际发挥作用的是其体内代谢物胡黄连素二聚体。胡黄连素在体内通过髓过氧化酶(mpo)的氧化转化为二聚体,二聚体作用于nadph氧化酶,抑制其活化。针对胡黄连素二聚体活性代谢物进行结构修饰,有望获得药理活性更佳的化合物,但目前报道胡黄连素结构修饰的专利与文献主要是上述对胡黄连素单体的修饰,而对胡黄连素二聚体的修饰报道甚少。
在前期工作中,现有技术中已合成出胡黄连素二聚体并准备对其进行结构修饰,但此母体化合物可修饰的位点比较单一。为此,将两个胡黄连素分子用-ch2-nh-相连,合成了胡黄连二聚体类似物jja-d0。与胡黄连素二聚体相比,jja-d0具有更多的可修饰结构位点。胡黄连素二聚体及其类似物jja-d0的结构如下式所示:
胡黄连素二聚体(a)与胡黄连素二聚体类似物jja-d0(b)的分子结构式
前期本领域研究人员初步评价了jja-d0的药理活性,发现其对lps诱导的raw264.7细胞损伤的保护作用明显优于母体化合物胡黄连素(lux,wans,jiangj,jiangx,yangw,yup,xul,zhangz,zhangg,shanl,wangy.synthesisandbiologicalevaluationsofnovelapocyninanalogues.europeanjournalofmedicinalchemistry.2011,46(7):2691-2698.)。另用lps处理雄性sd大鼠造成急性肺损伤模型,采用胡黄连素及其衍生物进行处理,结果显示,jja-d0在降低炎症因子tnf-α水平、改善肺部病理变化以及降低nadph氧化酶的p47phox与gp91phox蛋白表达等方面都优于胡黄连素(xul,liy,wans,wangy,yup.protectiveeffectsofapocyninnitroneonacutelunginjuryinducedbylipopolysaccharideinrats.internationalimmunopharmacology.2014,20(2):377-382.)。可见,jja-d0是一个有潜力的模型化合物。
二十世纪80年代中期,一氧化氮(no)作为机体第一个气体信号分子被发现,其体内合成主要由一氧化氮合酶催化产生。一氧化氮合酶广泛存在于机体各组织器官,所产生的no在体内也具有多种生物活性,它起着信号分子的作用。no对于神经系统、免疫系统和心血管系统的功能维持与疾病发生发展中发挥着重要的作用。no作为中枢与外周神经系统的信使物质,可能与脑细胞的发育、学习和记忆过程、后脑垂体激素分泌、在脑缺血等情况下调节脑供血保护脑组织等过程有关,也存在于气道神经中与胃肠道系统的肠肌反射中,参与气道与胃肠道平滑肌舒张调节。在病原体入侵以及癌症发生过程中,所产生的炎症与肿瘤相关细胞因子如γ-干扰素、白介素-1β、肿瘤坏死因子可诱导inos大量表达,从而产生大量的no,可作为免疫功能分子起到阻止病毒复制、清除病原体、杀伤肿瘤细胞的作用。no广泛参与血管平滑肌调节、血压调控、血小板凝集、血栓形成、血管内膜新生和血管重建等过程,因而在多种心血管疾病如动脉粥样硬化、高血压、心力衰竭、血管成形术后再狭窄等的发生与发展中发挥着重要的作用。no广泛参与多种生理功能的调节,也与多种疾病的发生发展存在密切的关系,因此与no合成释放调节和外源性供给相关的药物研究深受重视。
高浓度的h2s对人体有巨大的危害,容易导致中枢神经系统、心血管系统等多方面的毒性,300年来一直被认为是一种有毒的废气。继no与co气体在复杂生命活动中发挥的重要调节作用被逐步发现之后,在二十世纪90年代中期,kimura发现半胱氨酸的代谢产物h2s气体对神经系统具有作用,近年来,h2s被誉为第三个气体信号分子,其多种生理功能得到了广泛的研究。内源性h2s在哺乳动物机体含硫氨基酸代谢通路中生成,主要在胱硫醚-β合成酶、胱硫醚-γ裂解酶和β-巯基丙酮酸转硫酶作用下产生。h2s对细胞增殖和凋亡、炎症反应、血管新生、缺血再灌注损伤、神经传递等方面都发挥着重要的作用。h2s在不同情况下对炎症可分别表现为促进与抑制的双向作用。在心血管系统,h2s可介导血管平滑肌舒张;抑制低氧时肺动脉高压的形成,调节肺血管结构的重建;可降低原发性高血压大鼠的血压;抑制心肌缺血再灌注损伤。在呼吸系统,h2s对气道平滑肌有舒张作用,能够减轻哮喘的炎症反应,起到保护作用。在神经系统,h2s可通过抗氧化应激、抗炎作用和抗代谢抑制等机制减轻氧化应激对神经元的损伤作用,拮抗神经毒素诱导的神经退行性病变;脑组织h2s水平降低与阿尔茨海默症患者认知能力减退有关。此外,h2s还对多个系统如消化系统、内分泌系统、生殖系统等的疾病都有影响。鉴于h2s信号分子在生理与病理上的重要意义,使得它成为药物研发的关注点之一。
很多严重疾病如心脑血管疾病、代谢性疾病、免疫性疾病、神经系统疾病等的发病机制或病程发展与自由基所致氧化应激损伤、炎症损伤息息相关。与no、h2s和nadph氧化酶相关的很多疾病在氧化应激损伤和炎症发生发展方面具有相互关联,因此将这三个靶点结合起来进行药物设计,是一种寻找治疗这些疾病新药物的重要方法。
技术实现要素:
为解决现有技术的缺点和不足之处,本发明的首要目的在于提供一种胡黄连素二聚体类似物jja-d0的衍生物或其药学上可接受的盐。其中,本发明将no、h2s供体基团引入胡黄连素二聚体类似物jja-d0的结构修饰中,设计公开了一系列jja-d0衍生物,以期获得在发挥胡黄连素二聚体抑制nadph氧化酶活性的同时发挥no、h2s药理作用的新化合物结构类型。
本发明的另一目的在于提供上述胡黄连素二聚体类似物jja-d0的衍生物或其药学上可接受的盐的制备方法。
本发明的再一目的在于提供上述胡黄连素二聚体类似物jja-d0的衍生物或其药学上可接受的盐的用途。本发明公开的以胡黄连素二聚体类似物jja-d0为母体化合物设计合成的一系列衍生物,大多数具有较强的抗炎抗氧化作用,可用于与nadph氧化酶相关的疾病,与自由基相关的疾病,与炎症相关的疾病,与no相关的疾病、与h2s相关的疾病的保健品或药物的制备。
本发明目的通过以下技术方案实现:
一种胡黄连素二聚体类似物jja-d0的衍生物或其药学上可接受的盐,具有通式(i)的结构:
其中,r1、r2、r3相同或不相同,分别选自:氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至10个碳原子的烃基碳链(优选的碳原子数为1-8,更优选为1-4),取代或未取代的单环芳基、杂芳基,烷氧羰酰烷基,硫辛酸基,取代或未取代的半胱氨酰基、硝酸酯基、酰基、磺酸酯基。
优选的,r1为取代或未取代的半胱氨酰基,亦即所述化合物具有通式(ii)的结构:
其中,r2,r3相同或不相同,分别为氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至10个碳原子的烃基碳链(优选的碳原子数为1-8,更优选为1-4),取代或未取代的单环芳基、杂芳基;r4为氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至6个碳原子的烃基碳链,取代或未取代的单环芳基、杂芳基。
优选的,r2与r3至少有一个为no供体基团硝酸酯基,亦即所述化合物具有通式(iii)、(iv)、(v)之一的结构:
其中通式(iii)结构中,r1、r3相同或不相同,为氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至10个碳原子的烃基碳链(优选的碳原子数为1-8,更优选为1-4),取代或未取代的单环芳基、杂芳基;z1为连接硝酸酯基的直链或带有分支的碳链,其中z1上可以取代有杂原子、烃基、芳基或杂芳基,并且z1包含的碳原子数为1-6;
其中通式(iv)结构中,r1、r2相同或不相同,为氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至10个碳原子的烃基碳链(优选的碳原子数为1-8,更优选为1-4),取代或未取代的单环芳基、杂芳基;z2为连接硝酸酯基的直链或带有分支的碳链,其中z2上可以取代有杂原子、烃基、芳基或杂芳基,并且z2包含的碳原子数为1-6;
其中通式(v)结构中,r1为氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至10个碳原子的烃基碳链(优选的碳原子数为1-8,更优选为1-4),取代或未取代的单环芳基、杂芳基;z3和z4相同或不相同,分别为连接硝酸酯基的直链或带有分支的碳链,其中z3和z4上各自可以取代有杂原子、烃基、芳基或杂芳基,并且z3和z4各自包含的碳原子数为1-6。
优选的,r1为取代或未取代的酰基,亦即所述化合物具有通式(vi)的结构:
其中,r2,r3相同或不相同,分别为氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至10个碳原子的烃基碳链(优选的碳原子数为1-8,更优选为1-4),取代或未取代的单环芳基、杂芳基;r5为氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至10个碳原子的烃基碳链(优选的碳原子数为1-5),取代或未取代的单环芳基、杂芳基。
优选的,所述r2与r3至少有一个为取代或未取代的磺酸酯基,亦即所述化合物具有通式(vii)、(viii)、(ix)之一的结构:
其中通式(vii)结构中,r1,r3相同或不相同,分别为氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至10个碳原子的烃基碳链(优选的碳原子数为1-8,更优选为1-4),取代或未取代的单环芳基、杂芳基;r6为氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至10个碳原子的烃基碳链(优选的碳原子数为1-4),取代或未取代的单环芳基、杂芳基;
其中通式(viii)结构中,r1,r2相同或不相同,分别为氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至10个碳原子的烃基碳链(优选的碳原子数为1-8,更优选为1-4),取代或未取代的单环芳基、杂芳基;r7为氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至10个碳原子的烃基碳链(优选的碳原子数为1-4),取代或未取代的单环芳基、杂芳基;
其中通式(ix)结构中,r1选自:氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至10个碳原子的烃基碳链(优选的碳原子数为1-8,更优选为1-4),以及取代或未取代的单环芳基、杂芳基;r8和r9相同或不相同,分别选自:氢,取代或未取代、有杂原子或无杂原子的直链、支链或环状的多至10个碳原子的烃基碳链(优选的碳原子数为1-4),以及取代或未取代的单环芳基、杂芳基。
优选的,所述胡黄连素二聚体类似物jja-d0的衍生物或其药学上可接受的盐选自但不限于如下化合物之一:
所述的胡黄连素二聚体类似物jja-d0的衍生物或其药学上可接受的盐的制备方法,包括以下步骤:
以胡黄连素为原料,由reimer-tiemann反应得到中间体apo-cho,由硝基化与还原反应得到中间体apo-nh2,两者通过形成schiff’s碱的反应将两部分结构缩合后氢化还原而制得jja-d0;
其中jja-d0的烃基化、芳基化、杂芳基化、烷氧羰酰烷基化、硝酸酯基化、磺酸酯基化衍生物分别以烃基、芳基、杂芳基、烷氧羰酰烷基、硝酸酯基、磺酸酯基通过醚键、酯键结合在apo-cho与apo-nh2的酚羟基上,制得取代的apo-cho与apo-nh2中间体,再以取代的或未取代的apo-cho与取代的或未取代的apo-nh2为原料,通过形成schiff’s碱的反应将两部分结构缩合后氢化还原而制得;其中烃基化、芳基化、杂芳基化、烷氧羰酰烷基化apo-cho与/或apo-nh2中间体分别通过卤代烃、卤代芳香烃、卤代杂芳烃、卤代羧酸酯与apo-cho与/或apo-nh2的酚羟基醚化形成;硝酸酯基化apo-cho与/或apo-nh2中间体通过双卤代烃与apo-cho与/或apo-nh2的酚羟基醚化后,再与硝酸银酯化形成;磺酸酯化apo-cho与/或apo-nh2中间体通过磺酰氯与apo-cho与/或apo-nh2的酚羟基酯化形成;
其中jja-d0的硫辛酸基化衍生物通过两个酚羟基均保护的jja-d0,即jja-d0-tbdms,或未保护的jja-d0与硫辛酸反应而制得;jja-d0的酰胺化衍生物通过两个酚羟基均保护的jja-d0-tbdms与酰氯反应制得;jja-d0的半胱氨酸酰胺化衍生物通过先制得酚羟基保护的apo-nh2,即apo-nh2-tbdms,apo-nh2-tbdms再与apo-cho反应制得单个酚羟基保护的jja-d0(apo-nh2-tbdms),再将此中间产物jja-d0(apo-nh2-tbdms)与取代或未取代的半胱氨酸通过酰胺化反应而制得半胱氨酸酰胺化衍生物。
所述胡黄连素二聚体类似物jja-d0的衍生物或其药学上可接受的盐的制备方法,优选包括以下步骤:
(1)取胡黄连素,加入三乙胺与无水乙醇,滴加氢氧化钠水溶液,往反应液中滴加氯仿,70~80℃下反应1~4h;冷至室温,并用盐酸酸化,水洗萃取,硅胶柱分离,得到apo-cho;(2)取胡黄连素,加入冰乙酸溶解底物,冰浴下加入浓硝酸,反应15~60min,移走冰水,常温反应1.5~5h,加入冰水,抽滤,冰水洗,重结晶得apo-no2;取apo-no2溶于乙醇中,加入10%pd/c(指pd与c的质量比为pb:c=1:9),通入h2反应7~14h,水洗萃取,硅胶柱分离,得到apo-nh2;(3)取化合物apo-cho溶解于dmf中,加卤代烃、卤代芳烃、卤代杂芳烃、卤代羧酸酯或磺酰氯中的一种,与碳酸钾或三乙胺,加热30~60℃或冰浴反应1.5~5h,放至室温,水洗萃取,硅胶柱分离,得到酚羟基取代apo-cho;(4)取化合物apo-nh2溶于无水二氯甲烷,加入二碳酸二叔丁酯((boc)2o)和三乙胺,反应7~14h,反应液水洗萃取,硅胶柱分离,得到化合物apo-nh-boc;(5)取化合物apo-nh-boc,丙酮或dmf溶解,加入卤代烃、卤代芳烃、卤代杂芳烃或磺酰氯中的一种,与三乙胺,室温或冰浴反应1~4h,水洗萃取,硅胶柱分离,得到化合物酚羟基取代apo-nh-boc;(6)取酚羟基取代apo-nh-boc,溶解于二氯甲烷中,滴加三氟乙酸,反应0.5~4h,反应结束后直接水洗萃取或用nahco3饱和水溶液中和反应液后萃取,硅胶柱分离,得到酚羟基取代apo-nh2;(7)取化合物酚羟基取代apo-cho,甲醇溶解,加入化合物apo-nh2,反应0.5~3h,加入氰基硼氢化钠和冰乙酸,常温反应1~4h,水洗萃取,硅胶柱分离,得到化合物jja-d14,jja-d15,jja-d16,jja-d17,jja-d23,jja-d25,jja-d26,jja-d33和jja-d34;(8)取化合物apo-cho用甲醇溶解,加入酚羟基取代apo-nh2,反应0.5~3h,加入适量的氰基硼氢化钠,滴加冰乙酸,常温反应1~4h,水洗萃取,硅胶柱分离,得到固体化合物jja-d18,jja-d19,jja-d20,jja-d21,jja-d24,jja-d27和jja-d28;(9)取化合物酚羟基取代apo-cho用甲醇溶解,加入化合物酚羟基取代apo-nh2,反应0.5~3h,加入氰基硼氢化钠,冰乙酸,常温反应1~4h,水洗萃取,硅胶柱分离,得到化合物jja-d22,jja-d29,jja-d30,jja-d31,jja-d32,jja-d38,jja-d39和jja-d40。
所述胡黄连素二聚体类似物jja-d0的衍生物或其药学上可接受的盐的制备方法,优选包括以下步骤:
(1)取apo-nh2与apo-cho,用甲醇溶解,常温反应1~5h,加入氰基硼氢化钠和冰乙酸,常温反应1~4h,水洗萃取,得到化合物jja-d0;(2)将jja-d0加入无水二氯甲烷、叔丁基二甲基硅氯(tbdms-cl)和咪唑,常温反应3~7h,水洗,硅胶柱分离,得到两个酚羟基均保护的化合物jja-d0-tbdms;(3)取硫辛酸用二氯甲烷溶解,在冰浴下加入1-羟基苯并三唑(hobt)和1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edci),反应15~60min后,加入jja-d0-tbdms和无水三乙胺,室温反应5~10h,水洗萃取,再向有机层中加入四丁基氟化铵(tbaf),室温反应0.5~3h后,硅胶柱分离,得到化合物jja-d5;(4)取化合物jja-d0-tbdms,二氯甲烷溶解,氮气保护,加入三乙胺和酰氯,冰浴下反应1~4h,撤去冰浴,水洗萃取,有机层浓缩;残留物用无水二氯甲烷溶解,滴加tbaf,反应1~4h,水洗萃取,硅胶柱分离,得到化合物jja-d11或jja-d12或jja-d13;(5)取硫辛酸用二氯甲烷溶解,在冰浴下加入hobt和edci,反应15~60min,移去冰浴,加入jja-d0和n,n-二异丙基乙胺(dipea),室温反应5~10h后,
水洗萃取,硅胶柱分离,得到化合物jja-d6与jja-d7。
所述胡黄连素二聚体类似物jja-d0的衍生物或其药学上可接受的盐的制备方法,优选包括以下步骤:
(1)取l-半胱氨酸溶解在预冷的nh3·h2o溶液中,冰浴条件下滴加卤代烃,反应1.5~5h后,冰浴条件滴加稀盐酸调ph,析出固体,抽滤,重结晶,得到化合物巯基氢被烃基取代的l-半胱氨酸(cys-a);(2)将cys-a、水、丙酮、三乙胺和(boc)2o,于冰浴下反应2~6h;撤去冰浴,减压蒸去丙酮,萃取,合并水层,将水层用稀盐酸调ph,萃取,有机层水洗蒸干,得到油状化合物,冷冻成固体,得到化合物cys-b,即氨基被boc保护的cys-a;(3)取apo-nh2,二氯甲烷溶解,加入咪唑和tbdms-cl,反应7~14h,水洗,硅胶柱分离,得到酚羟基被保护的化合物apo-nh2-tbdms;(4)取apo-cho,甲醇溶解,加入apo-nh2-tbdms,反应0.5~3h,加入氰基硼氢化钠和冰乙酸,常温反应1~4h,水洗萃取,有机层浓缩,得到单个酚羟基保护的化合物jja-d0(apo-nh2-tbdms);(5)取化合物jja-d0(apo-nh2-tbdms),二氯甲烷溶解,加入cys-b、hobt和edci,反应7~14h;水洗萃取,硅胶柱分离,得到化合物被cys-b酰胺化的jja-d0(apo-nh2-tbdms);(6)取化合物被cys-b酰胺化的jja-d0(apo-nh2-tbdms),二氯甲烷溶解,滴加四丁基氟化铵(tbaf),反应0.5~4h,水洗萃取,有机层浓缩,残留物用无水二氯甲烷溶解,滴加三氟乙酸,反应1~4h,水洗萃取,硅胶柱分离,得到化合物jja-d8或jja-d9或jja-d10。
所述胡黄连素二聚体类似物jja-d0的衍生物或其药学上可接受的盐的制备方法,优选包括以下步骤:
(1)取apo-cho,加入dmf,二卤代烃、二卤代芳烃或二卤代杂芳烃中的一种,与k2co3,60~90℃反应7~14h,水洗萃取,硅胶柱分离,分别得到卤代烃基化、卤代芳烃基化或卤代杂芳烃基化的apo-cho;(2)用乙腈溶解卤代烃基化、卤代芳烃基化或卤代杂芳烃基化的apo-cho,加入硝酸银,避光条件下60~90℃反应6~12h,反应液用硅胶柱分离,分别得到硝酸酯烃基化、硝酸酯芳烃基化或硝酸酯杂芳烃基化的apo-cho;(3)将apo-nh-boc用dmf溶解,加入二卤代烃、二卤代芳烃或二卤代杂芳烃中的一种,与dipea,常温反应6~12h,水洗萃取,用硅胶柱分离,分别得到卤代烃基化、卤代芳烃基化或卤代杂芳烃基化的apo-nh-boc;(4)用乙腈溶解卤代烃基化、卤代芳烃基化或卤代杂芳烃基化的apo-nh-boc后,加入硝酸银,避光下60~90℃反应6~12h,反应结束后用硅胶柱分离,分别得到硝酸酯烃基化、硝酸酯芳烃基化或硝酸酯杂芳烃基化的apo-nh-boc;(5)用二氯甲烷溶解硝酸酯烃基化、硝酸酯芳烃基化或硝酸酯杂芳烃基化的apo-nh-boc,加入三氟乙酸,反应0.5~3h后,用nahco3饱和水溶液中和反应液,萃取,有机层减压浓缩,分别得到硝酸酯烃基化、硝酸酯芳烃基化或硝酸酯杂芳烃基化的apo-nh2;(6)将所得的硝酸酯烃基化、硝酸酯芳烃基化或硝酸酯杂芳烃基化的apo-cho与apo-nh2用甲醇溶解,反应0.5~3h,加入氰基硼氢化钠和冰乙酸,反应1~4h,反应液用硅胶柱分离,得到化合物jja-d1或jja-d2。(7)用甲醇溶解硝酸酯烃基化、硝酸酯芳烃基化或硝酸酯杂芳烃基化的apo-nh2,加入apo-cho,反应0.5~3h,加入氰基硼氢化钠和冰乙酸,反应1.5~5h,硅胶柱分离,得化合物jja-d3或jja-d4;(8)将所得的硝酸酯烃基化、硝酸酯芳烃基化或硝酸酯杂芳烃基化的apo-cho与硝酸酯烃基化、硝酸酯芳烃基化或硝酸酯杂芳烃基化的apo-nh2用甲醇溶解,反应0.5~3h,加入氰基硼氢化钠和冰乙酸,反应1.5~5h,反应液用硅胶柱分离,得到化合物jja-d35或jja-d36或jja-d37。
本发明提供的这些化合物具有多重作用,能够抑制nadph氧化酶,清除自由基、抗炎、释放no、释放h2s,因此,上述胡黄连素二聚体类似物jja-d0的衍生物或其药学上可接受的盐可用于制备预防或治疗与nadph氧化酶相关的疾病,与自由基相关的疾病,与炎症相关的疾病,与no相关的疾病,或是与h2s相关的疾病的保健品或药物。
所述与nadph氧化酶相关的疾病选自高血压、动脉粥样硬化、心肌肥厚与心力衰竭、冠心病、心律失常、心肌梗死、缺血再灌注损伤、肺炎症性损伤、急性肺损伤、慢性阻塞性肺疾病、肺气肿、慢性支气管炎、急性呼吸窘迫综合征、肺动脉高压、哮喘、特发性肺纤维化、脑卒中、阿尔茨海默症、肾结石、慢性肾病、关节炎、糖尿病及其并发症、肿瘤等。所述与自由基相关的疾病选自高血压、克山病、心力衰蝎、动脉粥样硬化、心肌梗死、冠心病、急性肺损伤、肺炎、慢性阻塞性肺疾病、哮喘、肺纤维化、缺血再灌注损伤、脑创伤、脑卒中、阿尔茨海默症、过敏反应、桥本氏病、红斑狼疮、皮肌炎、自身免疫性脉管炎等、肌萎缩性脊髓侧索硬化症、关节炎、白内障、青光眼、晶体后的纤维化、视网膜氧化损伤、视神经炎、放射病、疱疹样皮炎、水浸性皮炎、日光性皮炎、肾小球肾炎、肝炎、肝硬化、肥胖症、糖尿病及其并发症、肿瘤。所述与炎症相关的疾病选自急性肺损伤、肺炎、慢性阻塞性肺疾病、哮喘、肺纤维化、关节炎、高血压、动脉粥样硬化、病毒性心肌炎、非特异性溃疡性结肠炎、克罗恩病、慢性炎性肠病、新生儿坏死性小肠结肠炎、儿童炎症性肠病、先天性巨结肠合并小肠结肠炎、急性肝损伤、非酒精性脂肪性肝、胰腺炎、糖尿病及其并发症、银屑病、特应性皮炎、荨麻疹、大疱性类天疱疮、前列腺炎、白塞病、阿尔茨海默症、肥胖症、肿瘤。所述与no相关的疾病选自慢性阻塞性肺疾病、肺气肿、慢性支气管炎、关节炎、急性肺损伤、急性呼吸窘迫综合征、哮喘、脑缺血、脑卒中、脑创伤、癫痫、阿尔茨海默病、肌萎缩性侧索硬化症、偏头痛、高血压、动脉粥硬化、心绞痛、心肌梗死、缺血性心脏病、冠心病、血管栓塞、缺血再灌注损伤、心力衰竭、牙周病、口腔黏膜病、唾液腺疾病、口腔癌及颞下颌关节紊乱、川崎病、食管炎、胰腺炎、糖尿病及其并发症、高胆固醇血症、肿瘤。所述与h2s相关的疾病选自高血压、动脉粥样硬化、低氧性肺动脉高压、高肺血流性肺动脉高压、心肌缺血性损伤、阿霉素心肌病、心肌肥厚、心力衰竭、动脉粥样硬化、心绞痛、心肌梗死、冠心病、外伤性脑损伤、高热惊厥、阿尔茨海默症、亨廷顿舞蹈病、肌萎缩性侧索硬化症、脑卒中、脑缺血再灌注、急性肺损伤、肺纤维化、肺缺血再灌注损伤、哮喘、慢性阻塞性肺病、肺炎、肝硬化、应激性溃疡、炎症性肠病、急性胃黏膜损伤、结肠癌、先天性巨结肠、溃疡性结肠炎、牙周炎、口腔癌、银屑病、肾移植、尿毒症、肥胖症、糖尿病及其并发症、肿瘤。
本发明中涉及的新化合物包括前述通式(i)至(ix)的结构。新化合物在jja-d0结构上至少再含有烃基、芳基、杂芳基、烷氧羰酰烷基、硫辛酸基,半胱氨酰基、硝酸酯基、酰基、磺酸酯基中的1种取代基团。以下定义用以阐明和界定该发明中所用到的各种术语的含义以及范围。
本文所用的术语“烃基”是指未被取代的或被取代的直链、支链或环状的多至10个碳原子的烃基碳链,或在链上含有至少一个杂原子(例如氮、氧或硫)的烃基。直链烃基的非限定性例子包括如甲基、乙基、正丙基、正丁基、正戊基、正己基、正庚基和正辛基等饱和烃基,也包括含有烯键、炔键、羰基、氰基等取代基的不饱和烃基,还包括含杂原子的烃基如-ch2ch2och3、-ch2ch2n(ch3)2和-ch2ch2sch3等。不含或含杂原子的支链烃基的非限定性例子包括如异丙基、仲丁基、异丁基、叔丁基、新戊基、-ch2ch(och3)ch3、-ch2ch(n(ch3)2)ch3和-ch2ch(sch3)ch3。不含或含杂原子的环状烃基(“环烃基”)的非限定性例子包括如环丙基、环丁基、环戊基和环己基等,含o、n、s的六元环如-ch(ch2ch2)2o、-ch(ch2ch2)2nch3和-ch(ch2ch2)2s等及相应的五元杂环等。烃基可被一个或多个取代基取代,上述取代基的非限定性例子包括n(ch3)2、f、cl、br、i、-och3、-co2ch3、-cn、-oh、芳基和杂芳基。
本文所用的术语“芳基”是指未被取代的或取代的芳香化合物、碳环基团和杂芳基。芳基或者是单环或者是多环稠合化合物。芳基可以被一个或多个取代基取代,取代基的非限制性的例子包括-n(ch3)2、f、cl、br、i、-och3、-co2ch3、-cn、-oh、芳基和杂芳基。
杂芳基涉及到取代的或非取代的单环或多环的基团,环内至少包括一个杂原子,如氮、氧以及硫。举例来说,典型的杂环基团包括一个或多个氮原子譬如四唑基、吡咯基、吡啶基(如4-吡啶基,3-吡啶基,2-吡啶基等)、哒嗪基、吲哚基、喹啉基(如2-喹啉基,3-喹啉基等)、咪唑基、异喹啉基,吡唑基、吡嗪基、嘧啶基、吡啶酮基;典型的含一个氧原子的杂环基团包括2-呋喃基,3-呋喃基或苯并呋喃基;典型的硫杂原子基团包括噻吩基、苯并噻吩基;典型的混合杂原子基团包括呋吖基、噁唑基、异噁唑基、噻唑基和吩噻噁基。杂环基团能被一个或多个取代基取代,这些取代基包括-o-烷基、-nh-烷基、-n-(烷基)2、-nhc(o)-烷基、f、cl、br、i、-oh、-ocf3、-co2-烷基、-cn以及芳基和多芳基。
本文使用的术语“药学上可接受的”指的是在化合物如盐或赋形剂中不具有不能接受的毒性。药学上可接受的盐包括无机阴离子,例如氯离子、溴离子、碘离子、硫酸根、亚硫酸根、硝酸根、亚硝酸根、磷酸根、磷酸氢根等。有机阴离子包括乙酸根、丙酸根、肉桂酸根、苯甲磺酸根、柠檬酸根、乳酸根、葡萄糖酸根、富马酸根、酒石酸根、琥珀酸根等。本发明涉及胡黄连素二聚体类似物jja-d0的烃基、芳基、杂芳基、烷氧羰酰烷基、硫辛酸基、半胱氨酰基、硝酸酯基、酰基、磺酸酯基衍生物,可以一种药学可接受的盐或药物复合物的形式对病人给药。某个复合物可与适当载体或赋形剂混合形成药物组合物从而保证达到有效治疗剂。“有效治疗剂量”是指该种类化合物及其衍生物达到治疗效果所需的剂量。
本发明所述的常温跟室温都是指15~25℃。
与现有技术相比,本发明具有以下优点及有益效果:
(1)本发明以活性较好、结构修饰位点较胡黄连素二聚体多的母体化合物胡黄连素二聚体类似物jja-d0为基本结构,对其进行系统的结构修饰,设计提供了一类结构新颖的化合物。并将no、h2s供体基团引入jja-d0的结构修饰中,获得在发挥胡黄连素二聚体抑制nadph氧化酶活性的同时发挥no、h2s药理作用的新化合物结构类型。这类化合物具有抗炎与抗氧化双重药理作用机制,可抑制nadph氧化酶,提供no、h2s供体等多种功能。这类化合物可用于预防或治疗与nadph氧化酶相关的疾病,与自由基相关的疾病,与炎症相关的疾病,与no相关的疾病、与h2s相关的疾病的保健品或药物的制备。
(2)jja-d0制备工艺简单,原料易得,成本较低,经济有效。jja-d0与胡黄连素二聚体一样具有较胡黄连素更好的药理活性,而且jja-d0在结构上较胡黄连素二聚体具有更多的结构修饰位点,有利于获得更丰富的成药性较好的全新化合物。
附图说明
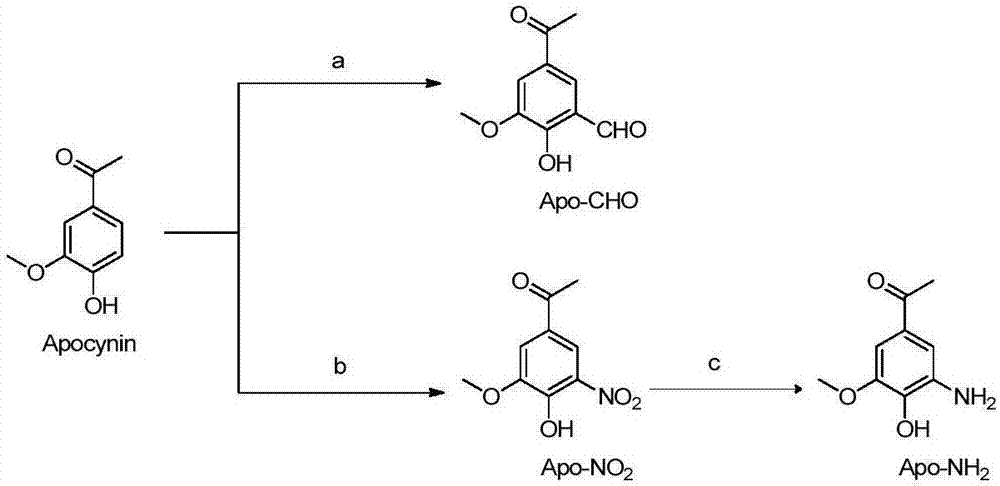
图1描述化合物apo-cho和apo-nh2的合成。其中:(a)50%氢氧化钠水溶液,乙醇,氯仿,回流,稀盐酸;(b)67%硝酸,冰乙酸,冰浴至室温;(c)氢气,10%钯碳,乙醇。
图2描述化合物jja-d1的合成。其中:(a)1,2-二溴乙烷/二甲基甲酰胺/碳酸钾,80℃;(b)硝酸银/乙腈,80℃;(c)氰基硼氢化钠/甲醇,冰乙酸,室温。
图3描述化合物jja-d2的合成。其中:(a)1,4-二溴丁烷/二甲基甲酰胺/碳酸钾,80℃;(b)硝酸银/乙腈,80℃;(c)氰基硼氢化钠/甲醇,冰乙酸,室温。
图4描述化合物jja-d3的合成。其中:(a)二碳酸二叔丁酯/三乙胺,室温;(b)1,2-二溴乙烷/n,n-二异丙基乙胺,室温.;(c)硝酸银/乙腈,80℃;(d)二氯甲烷/三氟乙酸;(e)氰基硼氢化钠/甲醇,冰乙酸,室温。
图5描述化合物jja-d4的合成。其中:(a)二碳酸二叔丁酯/三乙胺,室温;(b)1,4-二溴丁烷/二甲基甲酰胺,室温;(c)硝酸银/乙腈,80℃;(d)二氯甲烷/三氟乙酸;(e)氰基硼氢化钠/甲醇,冰乙酸,室温。
图6描述化合物jja-d5的合成。其中:(a)氰基硼氢化钠/甲醇,冰乙酸,室温;(b)二氯甲烷/叔丁基二甲基氯硅烷/咪唑,室温;(c)硫辛酸,二氯甲烷/1-羟基苯并三唑/碳化二亚胺/三乙胺,室温;(d)四丁基氟化铵/二氯甲烷,室温。
图7描述化合物jja-d6和jja-d7的合成。其中:(a)氰基硼氢化钠/甲醇,冰乙酸,室温;(b)硫辛酸,二氯甲烷/1-羟基苯并三唑/碳化二亚胺/n,n-二异丙基乙胺,室温。
图8描述化合物jja-d8,jja-d9和jja-d10的合成。其中:(a)溴乙烷/烯丙基溴/炔丙基溴,氨水,0℃;(b)丙酮/水/二碳酸二叔丁酯/三乙胺;(c)二氯甲烷,叔丁基二甲基氯硅烷/咪唑,室温;(d)氰基硼氢化钠/甲醇,冰乙酸,室温;(e)sec-boc/sac-boc/sprc-boc,1-羟基苯并三唑/碳化二亚胺,二氯甲烷,0℃;(f)四丁基氟化铵/二氯甲烷;三氟乙酸/二氯甲烷,室温。
图9描述化合物jja-d11,jja-d12和jja-d13的合成。其中:(a)二氯甲烷/叔丁基二甲基氯硅烷/咪唑,室温;(b)二氯甲烷/不同的酰氯/三乙胺,0℃;(c)四丁基氟化铵/二氯甲烷,室温。
图10描述化合物jja-d14,jja-d15,jja-d16,jja-d17,jja-d23,jja-d25和jja-d26的合成。其中:(a)不同的卤代烃或磺酰氯,碳酸钾或三乙胺,二甲基甲酰胺,40℃或冰浴;(b)氰基硼氢化钠/甲醇,冰乙酸,室温。
图11描述化合物jja-d18,jja-d19,jja-d20,jja-d21,jja-d24,jja-d27和jja-d28的合成。其中:(a)二碳酸二叔丁酯,三乙胺,二氯甲烷,室温;(b)不同的卤代烃或磺酰氯,三乙胺,丙酮或二甲基甲酰胺;(c)三氟乙酸,二氯甲烷,室温;(d)氰基硼氢化钠/甲醇,冰乙酸,室温。
图12描述化合物jja-d22的合成。其中:(a)苄基氯,碳酸钾,二甲基甲酰胺,40℃,3h;(b)二碳酸二叔丁酯,三乙胺,二氯甲烷,室温;(c)苄基氯,三乙胺,丙酮;(d)三氟乙酸,二氯甲烷,室温;(e)氰基硼氢化钠/甲醇,冰乙酸,室温。
图13描述实施例54中jja-d0的安全性评价结果。图中*表示与对照组相比有显著差异(**,p<0.01;***,p<0.001)。
图14描述实施例55中胡黄连素、jja-d0及14个jja-d0衍生物对lps诱导的raw264.7细胞损伤的保护作用(#,与空白对照组相比具有显著性差异,###p<0.001;*,与模型组相比具有显著性差异,*p<0.05,**p<0.01)。
图15描述实施例56中胡黄连素、jja-d0及14个jja-d0衍生物对lps诱导的raw264.7细胞内的ros水平的影响(#,与空白对照组相比具有显著性差异,###p<0.001;*,与模型组相比具有显著性差异,*p<0.05,**p<0.01)。
图16描述实施例57中胡黄连素、jja-d0、jja-d26对lps诱导的raw264.7细胞中tnf-α表达的下调作用(#,与空白对照组相比具有显著性差异,##p<0.01;*,与模型组相比具有显著性差异,*p<0.05)。
图17描述实施例58中胡黄连素、jja-d0、jja-d26对lps诱导的raw264.7细胞中nadph氧化酶亚基p47phox、gp91phox表达的下调作用(#,与空白对照组相比具有显著性差异,###p<0.001;*,与模型组相比具有显著性差异,*p<0.05,**p<0.01)。
具体实施方式
下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1:化合物apo-no2的合成
取胡黄连素(1.66g,10mmol),加入10ml冰乙酸溶解,冰浴搅拌下缓慢加入67wt%的浓硝酸1.5ml,反应30min,移走冰水,常温反应3h,反应结束后向体系中加入冰水,抽滤得黄色固体,冰水洗,95%(v/v)乙醇中重结晶得黄色针状晶体(1.65g,产率78%)。此化合物为已知化合物,经质谱、核磁图谱显示与文献中记载的图谱一致。
实施例2:化合物apo-nh2的合成
取apo-no2(2.11g,10mmol)溶于30ml乙醇中,加入质量比为10%pd/c(950mg),反应混合物通入h2反应过夜,反应结束后水洗,取有机层减压浓缩后,硅胶柱分离(乙酸乙酯:石油醚=1:2),得到浅白色的固体apo-nh2(1.32g,产率73%)。此化合物为已知化合物,经质谱、核磁图谱显示与文献中记载的图谱一致。
实施例3:化合物apo-cho的合成
取胡黄连素(1.66g,10mmol)置于烧瓶中,加入3ml三乙胺与20ml无水乙醇的混合溶液后,向体系中滴入50wt%的氢氧化钠水溶液30ml,搅拌混均。往反应液中滴加氯仿(5.95g,50mmol),70–80℃下反应2h。将反应液冷却至室温,并用盐酸酸化至ph=1。收集有机层,水层用二氯甲烷萃取,合并有机层并用水洗,经无水硫酸钠干燥后浓缩,硅胶柱分离(乙酸乙酯:石油醚=2:3),得到淡黄色粉末apo-cho(0.69g,产率36%)。此化合物为已知化合物,经质谱、核磁图谱显示与文献中记载的图谱一致。
实施例4:化合物jja-d0的合成
取apo-nh2(1.81g,10mmol)、apo-cho(1.94g,10mmol)置于烧瓶中,加入适量的甲醇溶解,常温反应3h,待不再产生沉淀后,加入适量的氰基硼氢化钠,滴加催化量的冰乙酸,常温反应2h,然后加水萃取,取有机层减压浓缩,得到化合物jja-d0(2.08g,58%)棕黄色固体,此化合物为已知化合物,经质谱、核磁图谱显示与文献中记载的图谱一致。
实施例5:化合物jja-d1的合成
取化合物apo-cho(1.94g,10mmol),置于烧瓶中,加入dmf10ml、1,2-二溴乙烷(2.23g,12mmol)、k2co3(2.76g,20mmol),80℃反应过夜,反应结束后加入二氯甲烷60ml,水洗,减压浓缩,硅胶柱分离(乙酸乙酯:石油醚=1:6),得到化合物apo-cho-(ch2)2br。用适量的乙腈溶解apo-cho-(ch2)2br(3.0g,10mmol),加入硝酸银(3.38g,20mmol),避光条件下80℃反应8h。反应结束后,反应液用硅胶柱分离(乙酸乙酯:石油醚=1:5),分离得到化合物apo-cho-(ch2)2no3(1.5g,产率53%)。将apo-cho-(ch2)2o-no2(2.83g,10mmol)与apo-nh2(1.81g,10mmol)置于烧瓶中,加入适量的甲醇溶解,待不再出现沉淀后,加入适量的氰基硼氢化钠以及少许冰乙酸,反应2h,反应液用硅胶柱分离(乙酸乙酯:石油醚=1:4),得到白色固体化合物jja-d1(2.55g,产率57%)。m.p.:161~163℃。esi-ms:m/z[m+h]+449,[m-h]+447.1h-nmr(300mhz,cdcl3)δ:9.46(s,1h),7.66(d,1h),7.50(d,1h),7.12(d,1h),7.07(d,1h),5.52(s,1h),4.79~4.82(m,2h),4.51(s,2h),4.45~4.48(m,2h),3.93(s,3h),3.91(s,3h),2.56(s,3h),2.52(s,3h).13c-nmr(75mhz,cdcl3)δ:198.69,198.40,153.59,150.79,147.08,138.43,137.09,134.79,133.99,131.11,124.00,112.26,107.57,102.96,73.40,70.25,57.68,57.36,44.50,27.82,27.64.
实施例6:化合物jja-d2的合成
取化合物apo-cho(1.94g,10mmol),置于烧瓶中,加入dmf10ml,1,4-二溴丁烷(2.57g,12mmol)、k2co3(2.76g,20mmol),80℃反应过夜,反应结束后加入二氯甲烷60ml,水洗,减压蒸干,硅胶柱分离(乙酸乙酯:石油醚=1:8),得到化合物apo-cho-(ch2)4br。apo-cho-(ch2)4br(3.28g,10mmol)用适量乙腈溶解后,加入硝酸银(3.38g,20mmol),避光条件下80℃反应8h。反应结束后,反应液用硅胶柱分离(乙酸乙酯:石油醚=1:6),得到化合物apo-cho-(ch2)4o-no2(2.66g,产率86%)。将apo-cho-(ch2)4no3(3.11g,10mmol)与apo-nh2(1.81g,10mmol)置于烧瓶中,加入适量的甲醇,待不再出现沉淀后,加入适量的氰基硼氢化钠及少许冰乙酸,反应2h,反应液用硅胶柱分离(乙酸乙酯:石油醚=1:5),得到化合物浅黄色固体jja-d2(2.81g,产率59%)。m.p.:151~152℃.esi-ms:m/z[m+h]+477.4,[m-h]+475.4.1h-nmr(300mhz,cdcl3)δ:9.46(s,1h),7.61(d,1h),7.47(d,1h),7.05(d,1h),7.00(d,1h),5.52(s,1h),4.48(t,2h),4.43(s,2h),4.14(t,2h),3.88(s,3h),3.85(s,3h),2.52(s,3h),2.50(s,3h),1.87~1.94(m,4h).13c-nmr(75mhz,cdcl3)δ:197.37,197.22,152.49,150.42,145.73,137.22,135.45,132.85,132.11,129.48,122.84,110.84,106.18,101.94,73.00,72.24,56.20,55.85,43.47,26.52,26.42,26.25,23.53.
实施例7:化合物apo-nh-boc的合成
取化合物apo-nh2(1.81g,10mmol),溶于适量的无水二氯甲烷中,依次加入二碳酸二叔丁酯((boc)2o,4.36g,20mmol)、三乙胺(1.01g,10mmol),反应过夜。反应结束后水洗,合并有机层,无水硫酸钠干燥,减压浓缩后用硅胶柱分离(乙酸乙酯:石油醚=1:8),得到化合物apo-nh-boc(2.24g,产率80%)。esi-ms:m/z[m+h]+282,[m-h]+280.1h-nmr(300mhz,dmso-d6)δ:10.02(s,1h),8.06(d,1h),7.89(s,1h),7.26(d,1h),3.87(s,3h),2.50(s,3h),1.47(s,9h).
实施例8:化合物jja-d3的合成
按实施例7方法制备化合物apo-nh-boc,将apo-nh-boc(2.82g,10mmol)用适量dmf溶解,再加入1,2-二溴乙烷(2.23g,12mmol)、n,n-二异丙基乙胺(dipea,2.58g,20mmol),常温反应8h,反应结束后加入二氯甲烷60ml,水洗,减压蒸干,用硅胶柱分离(乙酸乙酯:石油醚=1:8),得到化合物apo-nh-boc-(ch2)2br,用适量的乙腈溶解apo-nh-boc-(ch2)2br(3.87g,10mmol),加入硝酸银(3.38g,20mmol),避光条件下反应8h。反应结束后用硅胶柱分离(乙酸乙酯:石油醚=1:6),得到化合物apo-nh-boc-(ch2)2o-no2(1.10g,产率30%)。用二氯甲烷溶解所得到的全部apo-nh-boc-(ch2)2o-no2,加入三氟乙酸,反应1h后,用nahco3饱和水溶液中和反应液,二氯甲烷萃取,减压浓缩有机层得到化合物apo-nh2-(ch2)2o-no2。用甲醇溶解apo-nh2-(ch2)2o-no2(2.70g,10mmol),加入apo-cho(1.94g,10mmol),待不再出现沉淀后加入氰基硼氢化钠适量及少许冰乙酸,反应3h,反应液用硅胶柱分离(乙酸乙酯:石油醚=1:2),得到棕黄色固体化合物jja-d3(2.15g,产率48%)m.p.:138~139℃。esi-ms:m/z[m+h]+449.4,[m-h]+447.5.1h-nmr(300mhz,cdcl3)δ:9.87(s,1h),7.59(d,1h),7.44(d,1h),7.05(d,1h),6.96(d,1h),5.95(s,1h),4.72~4.75(m,2h),4.46(s,2h),4.33~4.36(m,2h),3.92(s,3h),3.87(s,3h),2.53(s,3h),2.51(s,3h).13c-nmr(75mhz,cdcl3)δ:197.61,196.91,151.89,148.62,146.68,141.35,137.51,133.67,129.49,123.72,123.55,109.01,106.02,101.88,71.96,68.20,56.23,55.88,43.00,26.48,26.18.
实施例9:化合物jja-d4的合成
按实施例7方法制备化合物apo-nh-boc,用适量的dmf溶解apo-nh-boc(2.81g,10mmol),再加入1,4-二溴丁烷(2.57g,12mmol)、k2co3(2.76g,20mmol),常温反应8h,反应结束后加入二氯甲烷60ml,水洗,减压蒸干,硅胶柱分离(乙酸乙酯:石油醚=1:10),得到化合物apo-nh-boc-(ch4)4br,用适量的乙腈溶解apo-nh-boc-(ch4)4br(4.15g,10mmol),加入硝酸银(3.38g,20mmol),避光条件下反应8h。反应结束后用硅胶柱分离(乙酸乙酯:石油醚=1:8),得到纯化合物apo-nh-boc-(ch2)4o-no2(1.52g,产率38%)。用二氯甲烷溶解所得到的全部apo-nh-boc-(ch2)4o-no2,加入三氟乙酸,反应1h后,用nahco3饱和水溶液中和反应液,二氯甲烷萃取后,减压浓缩有机层得到化合物apo-nh2-(ch4)4-ono2。用甲醇溶解apo-nh2-(ch4)4-ono2(2.98g,10mmol),加入apo-cho(1.94g,10mmol),待出现沉淀后加入氰基硼氢化钠适量,反应3h,反应液用硅胶柱分离(乙酸乙酯:石油醚=1:3),得到白色固体化合物jja-d4(2.09g,产率44%)。m.p.:160~162℃。esi-ms:m/z[m+h]+477.6,[m-h]+475.6.1h-nmr(300mhz,cdcl3)δ:9.87(s,1h),7.60(d,1h),7.45(d,1h),7.08(d,1h),7.00(d,1h),5.95(s,1h),4.53(t,2h),4.48(s,2h),4.07(t,2h),3.93(s,3h3),3.87(s,3h),2.53(s,3h),2.52(s,3h),1.85~1.97(m,4h).13c-nmr(75mhz,cdcl3)δ:197.58,196.78,151.96,148.60,146.66,141.05,138.97,133.13,129.48,123.63,123.59,109.10,106.25,102.58,72.96,71.49,56.22,55.86,43.53,26.46,26.20,23.61;
实施例10:化合物jja-d0-tbdms的合成
取化合物apo-nh2(1.81g,10mmol)、apo-cho(1.94g,10mmol)按实施例4方法制备jja-d0。将jja-d0加入50ml无水二氯甲烷、叔丁基二甲基硅氯(tbdms-cl,6g,40mmol)、咪唑(4.1g,60mmol),常温反应5h,反应完成后水洗,减压浓缩反应液,硅胶柱分离(乙酸乙酯:石油醚=1:5),得到白色固体化合物jja-d0-tbdms(4.1g,产率70%)。esi-ms:m/z[m+h]+588,[m-h]+586.1h-nmr(300mhz,dmso-d6)δ:7.60(s,1h),7.44(s,1h),6.96(s,1h),6.82(s,1h),4.90(s,1h),4.39(d,2h),3.87(d,3h),3.80(s,3h),2.46(s,3h),2.45(s,3h),0.95(s,9h),0.92(s,9h),0.23(d,6h),0.16(s,6h).
实施例11:化合物jja-d5的合成
取化合物apo-nh2(1.81g,10mmol)、apo-cho(1.94g,10mmol)按实施例10方法反应处理制备化合物jja-d0-tbdms。另取硫辛酸(2.08g,10mmol)用无水的二氯甲烷溶解,在冰浴下加入1-羟基苯并三唑(hobt,2.02g,15mmol)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edci,2.87g,15mmol),反应30min后,移去冰浴,加入jja-d0-tbdms(5.87g,10mmol)、无水三乙胺(3.03g,30mmol),室温反应8h,反应结束后水洗,再向有机层中加入四丁基氟化铵(tbaf),室温反应1h后,硅胶柱分离(乙酸乙酯:石油醚=1:1),得到浅白色固体化合物jja-d5(3.06g,产率56%)。m.p.:112~114℃。esi-ms:m/z[m+h]+548,[m-h]+546.1h-nmr(300mhz,dmso-d6)δ:10.11(s,2h),7.50(d,1h),7.43(d,1h),7.35(d,1h),7.27(d,1h),4.43~5.12(dd,2h),3.88(s,3h),3.82(s,3h),3.47~3.58(m,1h),3.03~3.18(m,2h),2.46(s,3h),2.39(s,3h),2.00~2.17(m,2h),1.74~1.85(m,1h),1.40~1.58(m,4h),1.17~1.32(m,3h).13c-nmr(75mhz,cdcl3)δ:197.92,197.53,174.85,151.16,150.15,149.57,149.10,130.72,129.80,129.66,125.48,125.43,125.27,112.01,111.56,57.99,57.89,57.79,47.88,39.94,35.96,34.62,34.56,30.05,28.07,27.96,26.38.
实施例12:化合物jja-d6和jja-d7的合成
取硫辛酸(6.24g,30mmol)用无水的二氯甲烷溶解,在冰浴下加入hobt(6.06g,45mmol)、edci(8.61g,45mmol),反应30min,移去冰浴,加入jja-d0(3.59g,10mmol)、dipea(11.6g,90mmol),室温反应8h后,水洗,有机层减压浓缩,硅胶柱分离,得到白色固体化合物jja-d6(3.16g,产率43%)与白色固体化合物jja-d7(3.69g,产率40%)。
化合物jja-d6:m.p.:150~152℃。esi-ms:m/z[m+h]+736,[m-h]+734.1h-nmr(300mhz,dmso-d6)δ:7.58(d,1h),7.45(d,1h),7.38(d,1h),7.37(d,1h),5.95(s,1h),4.41~5.07(dd,2h),3.86(s,3h),3.83(s,3h),3.52~3.68(m,2h),3.07~3.25(m,4h),2.50(s,3h),2.46(s,3h),2.08~2.43(m,4h),1.14~1.96(m,16h).13c-nmr(75mhz,cdcl3)δ:197.67,196.98,176.76,171.15,154.15,151.63,149.90,141.95,137.01,136.47,130.25,127.00,123.27,123.05,113.15,112.25,57.91,57.68,57.64,57.53,50.30,41.62,41.53,39.89,39.82,35.86,34.78,34.74,34.71,29.98,29.85,27.78,27.48,26.02,25.88.
化合物jja-d7:m.p.:200~203℃。esi-ms:m/z[m+h]+924,[m-h]+922.1h-nmr(dmso-d6,300mhz)δ:7.58(d,1h),7.50(d,1h),7.32(d,1h),7.27(d,1h),4.30~5.18(dd,2h),3.86(s,3h),3.82(s,3h),3.48~3.68(m,3h),3.04~3.25(m,6h),2.50~2.56(m,2h),2.48(s,3h),2.46(s,3h),2.02~2.43(m,4h),1.15~1.95(m,24h).13c-nmr(cdcl3,300mhz)δ:198.06,197.51,173.56,172.40,171.84,153.90,153.07,144.41,142.67,136.47,136.40,135.91,131.96,126.22,125.45,112.08,112.01,57.90,57.81,57.78,57.69,46.53,41.68,41.61,39.92,39.85,36.09,36.02,35.97,35.12,34.99,34.90,30.17,30.01,29.97,27.82,27.72,26.25,26.07,25.84.
实施例13:化合物s-ethylcysteine(sec)的合成
取l-半胱氨酸(1.21g,10mmol)于烧瓶中,溶解在预冷的20mlnh3·h2o溶液中,冰浴条件下滴加溴乙烷(2.17g,20mmol)。反应3h后,在冰浴条件下慢慢滴加稀盐酸,调ph至2~3之间,析出大量白色固体,抽滤,用水/无水乙醇重结晶,得到白色针状晶体sec(1.3g,产率87%)。esi-ms:m/z[m+h]+150,[m-h]+148.1h-nmr(300mhz,dmso-d6)δ:11.00(s,1h),4.14(s,1h),3.01(d,2h),2.72(t,2h),2.27(s,2h),1.22~1.01(m,3h).
实施例14:化合物sec-boc的合成
在烧瓶中依次加入化合物sec(1.5g,10mmol),水10ml,丙酮20ml,搅拌下加入三乙胺(4g,40mmol),(boc)2o(4.36g,20mmol),冰浴下继续搅拌4h。反应结束后撤去冰浴,减压蒸去丙酮,用石油醚、乙酸乙酯对水层萃取,合并水层,将水层用稀盐酸调ph至2~3,乙酸乙酯萃取,合并有机层,然后用饱和氯化钠溶液洗,无水硫酸钠干燥,过滤减压蒸干,得到油状化合物,冷冻成固体,得到化合物白色固体化合物sec-boc(2.3g,产率92%)。esi-ms:m/z[m+h]+250,[m-h]+248.1h-nmr(300mhz,dmso-d6)δ:11.00(s,1h),7.10(d,1h),4.04(d,1h),3.20~3.00(m,1h),2.86(dd,j=4.7hz,1h),2.70(dd,j=9.2hz,1h),2.55(d,1h),1.37(d,9h),1.16(dd,3h).
实施例15:化合物s-allylcysteine(sac)的合成
取l-半胱氨酸(1.21g,10mmol)与烯丙基溴(2.38g,20mmol),按实施例13的方法反应处理,得到白色固体化合物sac(1.5g,产率93%)。esi-ms:m/z[m+h]+162,[m-h]+160.1h-nmr(300mhz,d2o)δ:11.00(s,1h),5.83~5.64(m,1h),5.17~5.06(m,2h),3.80(dd,1h),3.11(d,2h),2.97(dd,2h),2.86(dd,2h).
实施例16:化合物sac-boc的合成
按照实施例14中sec-boc的制备方法,取化合物sac(1.61g,10mmol)代替化合物sec,与(boc)2o(4.36g,20mmol)反应制得白色固体化合物sac-boc(2.5g,产率96%)。esi-ms:m/z[m+h]+262,[m-h]+260.1h-nmr(300mhz,acetone-d6)δ:11.00(s,1h),6.16(d,1h),5.81(d,1h),5.14(ddd,j=1.2hz,2h),4.36(s,1h),3.22(d,2h),2.98(d,1h),2.84(dd,1h),1.43(s,9h).
实施例17:化合物s-(prop-2-yn-1-yl)cysteine(sprc)的合成
取l-半胱氨酸(1.21g,10mmol)与溴丙炔(2.36g,20mmol),按实施例13的方法反应处理,得到白色固体化合物sprc(1.5g,产率94%)。esi-ms:m/z[m+h]+160,[m-h]+158.1h-nmr(300mhz,d2o)δ:11.00(s,1h),3.91(dd,2h),3.30(dd,1h),3.22(dd,2h),3.08(dd,2h),2.60(t,3h).
实施例18:化合物sprc-boc的合成
按照实施例14中sec-boc的制备方法,取sprc(1.59g,10mmol)代替化合物sec,与(boc)2o(4.36g,20mmol)反应制得白色固体化合物sprc-boc(2.5g,产率97%)。esi-ms:m/z[m+h]+260,[m-h]+258.1h-nmr(300mhz,dmso-d6)δ:11.00(s,1h),7.07(dd,1h),5.09(t,1h),4.01(d,1h),3.24~2.93(m,2h),2.92~2.69(m,1h),2.65(d,1h),1.37(s,9h).
实施例19:化合物8a的合成
称取化合物apo-nh2(1.81g,10mmol),用40ml无水二氯甲烷溶解于烧瓶中,搅拌下依次加入咪唑(1.33g,20mmol)、tbdms-cl(3g,20mmol),反应过夜。反应结束后水洗,合并有机层减压蒸干,硅胶柱分离(乙酸乙酯:石油醚=1:8),得到白色的固体化合物8a(2.50g,85%)。esi-ms:m/z[m+h]+296,[m-h]+294.1h-nmr(300mhz,dmso-d6)δ:7.03(t,1h),6.86(d,1h),4.72(s,2h),3.79(d,3h),2.47(s,3h),0.97(s,9h),0.15(s,6h).
实施例20:化合物8b的合成
取化合物apo-cho(1.94g,10mmol),用甲醇溶解于烧瓶中,搅拌下加入化合物8a(3.24g,11mmol),反应1h,产生黄色沉淀,加入适量的氰基硼氢化钠,滴加催化量的冰乙酸,常温反应2h,加水萃取,取有机层减压蒸干,得到白色固体化合物8b。esi-ms:m/z[m+h]+474,[m-h]+472.1h-nmr(300mhz,cdcl3)δ:9.87(s,1h),7.61(d,1h),7.48(d,1h),7.08(d,1h),7.02(d,1h),5.95(s,1h),4.50(s,2h),3.95(s,3h),3.84(s,3h),2.53(s,3h),2.51(s,3h),0.99(s,9h),0.23(s,6h).
实施例21:化合物8c的合成
取化合物8b(4.73g,10mmol),用适量无水二氯甲烷溶解,搅拌下依次加入sec-boc(4.98g,20mmol)、hobt(2.7g,20mmol)、edci(3.8g,20mmol),反应过夜。反应结束后水洗,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(乙酸乙酯:石油醚=1:8),得到白色固体化合物8c(4.22g,产率60%)。esi-ms:m/z[m+h]+705,[m-h]+703.1h-nmr(300mhz,dmso-d6)δ:9.49(s,1h),7.67(d,1h),7.60(s,1h),7.52(s,1h),6.92(s,1h),6.75(s,2h),5.15(s,1h),4.37(s,1h),3.85(s,3h),3.79(s,3h),3.07(d,2h),3.02~2.82(m,2h),2.60(d,3h),2.41(s,3h),1.37(d,9h),1.17(d,3h),0.97(s,9h),0.20(s,6h).
实施例22:化合物jja-d8的合成
取化合物8c(3.52g,5mmol),溶解于20ml二氯甲烷中,滴加4mltbaf,反应2~3h。反应结束后水洗,二氯甲烷萃取,合并有机层,无水硫酸钠干燥,减压浓缩,浓缩液用20ml无水二氯甲烷溶解,搅拌条件下滴加5ml三氟乙酸,反应2~3h。反应结束后水洗,二氯甲烷萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(二氯甲烷:甲醇=100:1),得到黄色固体化合物jja-d8(1.85g,产率76%)。m.p.:80.2~82.1℃。esi-ms:m/z[m+h]+491,[m-h]+489.1h-nmr(300mhz,dmso-d6)δ:8.51(s,2h),7.77(s,1h),7.67(s,1h),7.19(s,1h),7.11(s,1h),7.01(s,1h),6.92(d,1h),4.71(s,2h),4.22(s,1h),3.80(s,3h),3.74(s,3h),3.17(s,1h),2.71(d,1h),2.52(s,3h),2.49(s,3h),2.45(s,2h),1.24(dd,3h).13c-nmr(75mhz,dmso-d6):196.69,195.23,164.72,150.80,150.11,149.58,147.68,128.99,128.35,124.73,124.19,123.64,123.10,110.26,109.45,56.19,51.31,48.00,27.10,26.27,26.19,25.63,25.14,14.96.
实施例23:化合物9c的合成
取化合物8b(4.73g,10mmol)、sac-boc(5.22g,20mmol),按实施例21的方法反应处理,得到白色固体化合物9c(4.43g,产率62%)。esi-ms:m/z[m+h]+717,[m-h]+715.1h-nmr(300mhz,dmso-d6)δ:9.55~9.12(m,1h),7.70(d,1h),7.59(s,1h),7.52(s,1h),6.92(s,1h),6.73(s,1h),5.85~5.69(m,1h),5.18(s,1h),5.12(s,1h),5.09(s,1h),4.36(s,2h),3.85(d,3h),3.79(s,3h),3.24(d,2h),3.01(d,2h),2.91~2.74(m,3h),2.40(d,3h),1.35(s,9h),0.94(d,9h),0.20(s,6h).
实施例24:化合物jja-d9的合成
取化合物9c(3.58g,5mmol),按实施例22的方法依次脱去酚羟基和氨基保护基团并进行相应的处理,得到黄色固体化合物jja-d9(1.95g,产率78%)。m.p.:81.6-82.9℃.esi-ms:m/z[m+h]+503,[m-h]+501.1h-nmr(300mhz,d6-dmso)δ:9.85(s,1h),9.48(s,1h),7.60(d,j=1.8hz,1h),7.38(d,j=1.8hz,1h),6.92(d,j=1.7hz,1h),6.86(d,j=1.8hz,1h),5.75(dd,j=17.0,9.9hz,1h),5.27~4.92(m,2h),4.35(s,2h),4.23(s,1h),3.87(s,3h),3.82(s,3h),3.17(d,j=2.9hz,1h),3.15(d,j=2.8hz,1h),2.98(dd,j=13.9,3.5hz,2h),2.74(dd,j=13.9,3.9hz,2h),2.44(s,3h),2.42(s,3h).13c-nmr(75mhz,d6-dmso)δ:197.06,197.65,167.01,149.51,147.41,146.65,137.99,137.66,134.97,128.76,128.40,126.48,122.93,117.83,110.10,105.05,102.18,56.40,56.38,55.07,41.89,34.83,26.71,26.66.
实施例25:化合物10c的合成
取化合物8b(4.73g,10mmol)、sprc-boc(5.18g,20mmol)反应,按实施例21的方法反应处理,得到白色固体化合物10c(4.28g,产率60%)。esi-ms:m/z[m+h]+715,[m-h]+713.1h-nmr(300mhz,dmso-d6)δ:9.72(d,1h),7.73(d,1h),7.58(s,1h),7.52(s,1h),6.92(d,1h),6.71(d,1h),4.58~4.44(m,1h),4.37(s,2h),3.86(d,3h),3.78(s,3h),3.48(t,2h),3.32(s,2h),3.04(dd,j=9.8hz,1h),2.5~2.43(m,3h),2.40(d,3h),1.34(s,9h),0.97(s,9h),0.20(s,6h).
实施例26:化合物jja-d10的合成
取化合物10c(3.57g,5mmol),按实施例22的方法依次脱去酚羟基和氨基保护基团并进行相应的处理,得到黄色固体化合物jja-d10(1.95g,产率78%)。m.p.:82.0-83.5℃。esi-ms:m/z[m+h]+501,[m-h]+499.1h-nmr(300mhz,dmso-d6)δ:9.86(s,1h),9.46(s,1h),7.60(d,1h),7.37(d,1h),6.92(d,1h),6.86(d,1h),5.49(s,1h),4.35(s,2h),3.87(s,3h),3.82(d,3h),2.44(s,3h),2.42(s,3h),2.40(s,2h),1.63(dd,j=6.6hz,2h),1.37(dd,1h),1.23(s,2h).13c-nmr(75mhz,dmso-d6)δ:196.70,195.75,165.0,149.90,149.34,148.92,148.06,136.35,128.98,128.27,127.48,125.23,123.21,121.71,110.45,79.49,71.60,56.25,56.30,50.93,49.20,44.10,36.75,26.20,26.10.
实施例27:化合物jja-d11的合成
取apo-nh2(1.81g,10mmol)、apo-cho(1.94g,10mmol),按实施例10的方法反应处理,制备化合物jja-d0-tbdms。取化合物jja-d0-tbdms(5.87g,10mmol),用适量无水二氯甲烷溶解,氮气保护抽真空后,加入三乙胺(2.02g,20mmol)、乙酰氯(1.57g,20mmol),冰浴下反应2h,反应结束后,撤去冰浴,水洗反应液,二氯甲烷萃取,合并有机层,无水硫酸钠干燥,减压蒸干。残留物用无水二氯甲烷溶解,搅拌下滴加tbaf,反应2h,水洗,二氯甲烷萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(二氯甲烷:甲醇=100:1)。得到黄色固体化合物jja-d11(2.48g,产率62%)。m.p.:187.2-188.9℃。esi-ms:m/z[m+h]+402,[m-h]+400.1h-nmr(300mhz,dmso-d6)δ:10.36(s,1h),9.75(s,1h),7.50(d,1h),7.41(d,1h),7.34(d,1h),7.31(d,1h),4.49(d,2h),3.88(s,3h),3.81(s,3h),2.46(s,3h),2.40(s,3h),1.81(s,3h).13c-nmr(75mhz,dmso-d6)δ:196.67,195.81,173.82,150.55,148.66,147.87,146.49,129.46,128.67,127.51,125.24,123.19,122.20,110.90,109.91,56.52,56.14,48.81,26.11,26.15,21.49.
实施例28:化合物jja-d12的合成
取化合物jja-d0-tbdms(5.87g,10mmol),用适量无水二氯甲烷溶解,氮气保护抽真空后,加入三乙胺(2.02g,20mmol)、丙酰氯(1.85g,20mmol),冰浴下反应2h,反应结束后,撤去冰浴,水洗反应液,二氯甲烷萃取,合并有机层,无水硫酸钠干燥,减压蒸干。残留物用无水二氯甲烷溶解,搅拌下滴加tbaf,反应2h,水洗,二氯甲烷萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(二氯甲烷:甲醇=100:1)。得到白色固体化合物jja-d12(2.37g,产率57%)。m.p.:184.2-185.5℃。esi-ms:m/z[m+h]+416,[m-h]+414.1h-nmr(300mhz,dmso-d6)δ:10.29(s,1h),9.74(s,1h),7.48(d,j=1.8hz,1h),7.41(d,j=1.8hz,1h),7.34(d,j=1.8hz,1h),7.28(d,j=1.8hz,1h),5.08(d,j=15.2hz,1h),4.45(d,j=15.3hz,1h),3.88(s,2h),3.81(s,1h),2.45(s,2h),2.39(s,1h),2.03(dt,j=15.9,7.0hz,1h),1.18(t,j=7.1hz,1h),0.95(dd,j=9.6,5.2hz,1h).13cnmr(75mhz,cdcl3)δ:196.55,195.70,176.93,150.65,148.72,147.70,146.35,129.62,128.66,127.03,125.23,123.47,122.32,110.99,109.81,56.55,56.16,49.03,26.96,26.09,9.21,1.03.
实施例29:化合物jja-d13的合成
取化合物jja-d0-tbdms(5.87g,10mmol),用适量无水二氯甲烷溶解,氮气保护抽真空后,加入三乙胺(2.02g,20mmol)、异丁酰氯(2.12g,20mmol),冰浴下反应2h,反应结束后,撤去冰浴,水洗反应液,二氯甲烷萃取,合并有机层,无水硫酸钠干燥,减压蒸干。残留物用无水二氯甲烷溶解,搅拌下滴加tbaf,反应2h,水洗,二氯甲烷萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(二氯甲烷:甲醇=100:1)。得到白色固体化合物jja-d13(1.97g,产率46%)。m.p.:187.3-188.9℃。esi-ms:m/z[m+h]+430,[m-h]+428.1hnmr(300mhz,dmso-d6)δ:10.34(s,1h),9.79(s,1h),7.47(d,j=1.8hz,1h),7.43(d,j=1.8hz,1h),7.35(d,j=1.9hz,1h),7.26(d,j=1.9hz,1h),5.07(d,j=15.4hz,1h),4.40(d,j=15.3hz,1h),3.88(d,j=3.4hz,3h),3.82(s,3h),2.73(s,1h),2.45(s,3h),2.40(s,3h),1.15~0.90(m,6h).13cnmr(75mhz,cdcl3)δ:196.56,195.71,180.60,150.77,148.72,147.65,146.36,129.51,128.57,127.05,125.26,123.39,122.21,110.98,109.85,56.54,56.15,49.15,31.69,26.10,19.85,19.3.
实施例30:化合物14a的合成
取化合物apo-cho(1.94g,10mmol)溶解于dmf中,加碘甲烷(2.84g,20mmol)、碳酸钾(2.76g,20mmol),加热40℃反应3h。反应结束后,冷却,水洗,二氯甲烷萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(乙酸乙酯:石油醚=1:8),得到白色固体化合物14a(1.64g,产率79%)。esi-ms:m/z[m+h]+209,[m-h]+207.1h-nmr(300mhz,dmso-d6)δ:10.33(s,1h),7.88(d,1h),7.79(d,1h),4.00(s,3h),3.96(s,3h),2.62(s,3h).
实施例31:化合物jja-d14的合成
取化合物14a(2.08g,10mmol),用甲醇溶解,搅拌下加入化合物apo-nh2(1.99g,11mmol),反应1h,至不再产生黄色沉淀,搅拌下加入适量的氰基硼氢化钠,滴加催化量的冰乙酸,常温反应2h,水洗,乙酸乙酯萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(乙酸乙酯:石油醚=1:4),得到白色固体化合物jja-d14(2.42g,产率65%)。m.p.:182.2-183.9℃。esi-ms:m/z[m+h]+374,[m-h]+372.1h-nmr(300mhz,dmso-d6)δ:9.46(s,1h),7.61(d,j=1.9hz,1h),7.44(d,j=1.9hz,1h),6.93(d,j=1.8hz,1h),6.83(d,j=1.8hz,1h),5.52(s,1h),4.39(s,1h),3.89(s,3h),3.82(s,2h),2.49(s,1h),2.41(s,2h).13c-nmr(75mhz,cdcl3)δ:197.42,197.25,152.60,151.51,145.73,137.28,135.57,132.84,132.26,129.49,122.69,110.88,105.70,101.64,61.00,56.25,55.93,43.21,26.44,26.31.
实施例32:化合物jja-d15的合成
称化合物apo-cho(1.94g,10mmol)溶解于dmf中,加溴乙烷(2.18g,20mmol)、碳酸钾(2.76g,20mmol),加热40℃反应3h。反应结束后,冷却,水洗,二氯甲烷萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(乙酸乙酯:石油醚=1:8),得到化合物15a(1.52g,68%)。取化合物15a(2.22g,10mmol),用甲醇溶解,搅拌条件下加入化合物apo-nh2(1.99g,11mmol),反应1h,至不再产生黄色沉淀,搅拌下加入适量的氰基硼氢化钠,滴加催化量的冰乙酸,常温反应2h,水洗,乙酸乙酯萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(乙酸乙酯:石油醚=1:4),得到棕黄色固体化合物jja-d15(2.39g,产率62%)。m.p.:184.2-185.4℃.esi-ms:m/z[m+h]+388,[m-h]+386.1h-nmr(300mhz,dmso-d6)δ:9.45(s,1h),7.62(d,j=2.0hz,1h),7.43(d,j=1.9hz,1h),6.93(d,j=1.8hz,1h),6.84(d,j=1.8hz,1h),5.53(s,1h),4.40(s,2h),4.15(d,j=7.0hz,2h),3.87(s,3h),3.82(s,3h),2.49(s,3h),2.41(s,3h),1.34(t,j=7.0hz,3h).13c-nmr(75mhz,dmso-d6)δ:197.24,197.00,152.51,150.20,146.70,138.03,137.53,134.03,132.68,128.79,121.79,111.34,104.91,102.34,68.90,56.38,56.30,41.95,40.49,40.21,39.93,39.66,39.38,26.91,26.66,16.10.
实施例33:化合物jja-d16的合成
参照实施例32的方法反应处理,将溴乙烷换成溴异丙烷(2.44g,20mmol),得到棕黄色固体化合物jja-d16(2.12g,产率53%)。m.p.:185.2-187.9℃。esi-ms:m/z[m+h]+402,[m-h]+400.1hnmr(300mhz,dmso-d6)δ:9.46(s,1h),7.61(d,j=2.0hz,1h),7.42(d,j=2.0hz,1h),6.99(d,j=2.0hz,2h),6.79(d,j=1.8hz,1h),5.60(s,1h),4.70(dt,j=12.2,6.1hz,2h),4.38(s,3h),3.83(m,3h),2.48(m,6h),1.28(d,j=6.1hz,6h).13cnmr(75mhz,cdcl3)δ:197.47,197.28,152.58,149.35,145.69,137.09,132.89,132.43,129.57,122.47,110.47,106.35,101.27,75.11,56.21,55.85,43.31,26.32,22.71.
实施例34:化合物jja-d17的合成
参照实施例32的方法反应处理,将溴乙烷换成溴丙烷(2.44g,20mmol),得到棕黄色固体化合物jja-d17(2.72g,产率68%)。m.p.:185.5-187.3℃。esi-ms:m/z[m+h]+402,[m-h]+400.1hnmr(300mhz,dmso-d6)δ:9.46(s,1h),7.61(d,j=1.7hz,1h),7.43(d,j=1.8hz,1h),6.93(d,j=1.6hz,1h),6.83(s,1h),5.54(s,1h),4.40(s,2h),4.04(t,j=6.6hz,2h),3.87(s,3h),3.82(s,3h),2.49(s,3h),2.41(s,3h),1.76(d,j=7.2hz,2h),1.01(s,3h).13cnmr(75mhz,dmso-d6)δ:197.23,196.97,152.46,150.40,146.67,138.05,137.52,133.87,132.64,128.77,121.78,111.40,104.85,102.37,74.76,56.36,56.29,41.89,26.90,26.63,23.67,10.90.
实施例35:化合物18b的合成
取化合物apo-nh-boc(2.81g,10mmol),用适量丙酮溶解,密封条件下依次加碘甲烷(2.84g,20mmol)、三乙胺(2.02g,20mmol),反应2h。反应结束后,减压蒸去丙酮,水洗反应液,二氯甲烷萃取合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(乙酸乙酯:石油醚=1:10),得到白色固体化合物18b(2.41g,产率82%)。esi-ms:m/z[m+h]+296,[m-h]+294.1h-nmr(300mhz,cdcl3)δ:8.36(s,1h),7.21(d,1h),7.18(s,1h),3.88(s,3h),3.85(s,3h,),2.55(s,3h),1.49(s,9h).
实施例36:化合物18c的合成
取化合物18b(2.95g,10mmol),溶解于20ml二氯甲烷中,搅拌下滴加5ml三氟乙酸,反应2~3h。反应结束后水洗,二氯甲烷萃取合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(二氯甲烷:甲醇=100:1),得到白色固体化合物18c(1.52g,产率78%)。esi-ms:m/z[m+h]+196,[m-h]+194.1h-nmr(300mhz,dmso-d6)δ:6.99(d,1h,arh),6.80(d,1h,arh),5.13(s,2h),3.80(s,3h),3.69(s,3h),2.47(s,3h).
实施例37:jja-d18的合成
取化合物apo-cho(1.94g,10mmol),用甲醇溶解,搅拌下加入化合物18c(2.15g,11mmol),反应1h,至不再产生黄色沉淀,搅拌下加入适量的氰基硼氢化钠,滴加催化量的冰乙酸,常温反应2h,水洗,乙酸乙酯萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(用乙酸乙酯:石油醚=1:4),得到棕黄色固体化合物jja-d18(2.05g,产率55%)。m.p.:181.2-182.8℃。esi-ms:m/z[m+h]+374,[m-h]+372.1hnmr(300mhz,dmso-d6)δ:9.87(s,1h),7.60(d,j=2.0hz,1h),7.37(d,j=1.9hz,1h),6.85(s,2h),5.95(s,1h),4.36(d,j=6.7hz,2h),3.87(s,3h),3.81(s,3h),3.75(s,3h),2.44(d,j=2.9hz,6h).13cnmr(75mhz,cdcl3)δ:197.75,196.89,152.05,148.64,146.72,141.59,140.14,134.08,129.44,124.01,123.54,108.98,105.70,102.26,60.14,56.22,55.92,43.00,26.44,26.17.
实施例38:化合物jja-d19的合成
参照实施例35、36、37的方法反应处理,将碘甲烷换成溴乙烷(2.16g,20mmol),分别合成化合物19b、19c,最后得到棕黄色固体化合物jja-d19(1.70g,产率44%)。m.p.:182.4-184.5℃。esi-ms:m/z[m+h]+388,[m-h]+386.1hnmr(300mhz,dmso-d6)δ:9.89(s,1h),7.59(d,j=1.8hz,1h),7.37(d,j=1.9hz,1h),6.85(d,j=2.4hz,2h),5.85(s,1h),4.37(d,j=4.0hz,2h),4.00(d,j=7.0hz,2h),3.87(s,3h),3.80(s,3h),2.45(s,3h),2.43(s,3h),1.31(s,3h).13cnmr(75mhz,dmso-d6)δ:197.70,196.55,152.32,149.55,147.46,142.54,138.16,133.07,128.45,126.31,122.80,110.10,104.89,101.60,67.99,56.40,56.12,41.52,26.97,26.56,15.95.
实施例39:化合物jja-d20的合成
参照实施例35、36、37的方法反应处理,将碘甲烷换成溴异丙烷(2.46g,20mmol),分别合成化合物20b、20c,最后得到棕黄色固体化合物jja-d20(1.76g,产率44%)。m.p.:186.2-187.5℃。esi-ms:m/z[m+h]+402,[m-h]+400.1hnmr(300mhz,dmso-d6)δ:9.88(s,1h),7.59(d,j=1.7hz,1h),7.37(d,j=1.8hz,1h),6.93~6.79(m,2h),5.73(t,j=6.6hz,1h),4.55(dt,j=12.2,6.0hz,1h),4.36(d,j=6.4hz,2h),3.87(s,3h),3.79(s,3h),2.45(s,3h),2.42(s,3h),1.25(s,3h),1.23(s,3h).13cnmr(75mhz,cdcl3)δ:197.71,196.85,152.08,148.62,146.74,142.36,137.82,132.76,129.39,124.07,123.27,108.85,105.71,102.32,75.00,56.18,55.84,43.10,26.39,26.14,22.69.
实施例40:jja-d21的合成
参照实施例35、36、37的方法反应处理,将碘甲烷换成溴丙烷(2.46g,20mmol),分别合成化合物21b、21c,最后得到棕黄色固体化合物jja-d21(2.08g,产率52%)。m.p.:185.2-187.4℃。esi-ms:m/z[m+h]+402,[m-h]+400.1hnmr(300mhz,dmso-d6)δ:9.88(s,1h),7.60(d,j=1.8hz,1h),7.38(d,j=1.9hz,1h),6.87(s,2h),5.71(s,1h),4.38(d,j=6.4hz,2h),3.87(s,3h),3.90(t,j=5.2hz,2h),3.80(s,3h),2.45(s,3h),2.44(s,3h),1.73(dd,j=14.4,7.1hz,2h),0.96(t,j=7.4hz,3h).13cnmr(75mhz,dmso-d6)δ:197.72,196.57,152.20,149.57,147.47,142.32,138.47,132.99,128.42,126.24,122.87,110.11,104.97,101.75,74.07,56.40,56.15,41.62,26.99,26.56,23.44,10.79.
实施例41:化合物22a的合成
取化合物apo-cho(1.94g,10mmol)溶解于dmf中,加苯甲基氯(2.52g,20mmol)、碳酸钾(2.76g,20mmol),加热40℃反应3h。反应结束后,冷却,水洗,二氯甲烷萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(乙酸乙酯:石油醚=1:8),得到白色固体化合物22a(2.24g,产率79%)。esi-ms:m/z[m+h]+285,[m-h]+283.1hnmr(300mhz,dmso-d6)δ:7.68(s,1h),7.52~7.27(m,7h),5.16(s,2h),3.83(s,3h),2.50(s,3h).
实施例42:化合物22b的合成
取化合物apo-nh-boc(2.81g,10mmol),用适量丙酮溶解,密封条件下依次加苯甲基氯(2.52g,20mmol)、三乙胺(2.02g,20mmol),反应2h。反应结束后,减压蒸去丙酮,水洗反应液,二氯甲烷萃取合并有机层,无水硫酸钠干燥,减压浓缩有机层,硅胶柱分离(乙酸乙酯:石油醚=1:10),得到白色固体化合物22b(3.04g,产率82%)。esi-ms:m/z[m+h]+372,[m-h]+370.1hnmr(300mhz,dmso-d6)δ:8.05(s,1h),7.96(d,j=1.3hz,1h),7.55~7.26(m,6h),5.09(s,2h),3.92(s,3h),2.53(d,j=5.8hz,3h),1.44(s,9h).
实施例43:化合物22c的合成
取化合物22b(3.71g,10mmol),溶解在20ml二氯甲烷中,搅拌下滴加5ml三氟乙酸,反应2~3h。反应结束后水洗,二氯甲烷萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(二氯甲烷:甲醇=100:1),得到白色固体化合物22c(2.17g,产率80%)。esi-ms:m/z[m+h]+272,[m-h]+270.1hnmr(300mhz,dmso-d6)δ:7.50(d,j=6.7hz,1h),7.42~7.28(m,4h),7.01(d,j=1.7hz,1h),6.84(d,j=1.6hz,1h),5.05(s,2h),4.96(s,2h),3.83(s,3h),2.49(d,j=7.5hz,3h).
实施例44:化合物jja-d22的合成
取化合物22a(2.83g,10mmol),用甲醇溶解,搅拌下加入化合物22c(2.98g,11mmol),反应1h,至不再产生黄色沉淀,搅拌下加入适量的氰基硼氢化钠,滴加催化量的冰乙酸,常温反应2h,水洗,乙酸乙酯萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(乙酸乙酯:石油醚=1:4),得到浅黄色固体化合物jja-d22(2.42g,产率45%)。esi-ms:m/z[m+h]+540,[m-h]+538.1hnmr(300mhz,dmso-d6)δ:7.53~7.27(m,12h),6.82(s,1h),6.78(s,1h),5.16(s,4h),5.01(s,1h),4.45(s,2h),3.83(s,6h),2.50(s,6h).13cnmr(300mhz,dmso-d6)δ:198.44,152.79,152.41,150.94,144.89,137.56,136.96,135.94,134.37,130.50,129.01,128.19,128.16,122.92,114.41,109.75,108.74,74.02,56.83,42.84,27.81.
实施例45:化合物jja-d23的合成
取化合物22a(2.83g,10mmol),用甲醇溶解,搅拌下加入化合物apo-nh2(1.99g,11mmol),反应1h,至不再产生黄色沉淀,搅拌下加入适量的氰基硼氢化钠,滴加催化量的冰乙酸,常温反应2h,水洗,乙酸乙酯萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(乙酸乙酯:石油醚=1:4),得到浅黄色固体化合物jja-d23(2.51g,产率56%)。m.p.:135.5-136.4℃。esi-ms:m/z[m+h]+450,[m-h]+448.1hnmr(300mhz,dmso-d6)δ:9.44(s,1h),7.60(d,j=1.9hz,1h),7.49(dd,j=7.9,1.6hz,3h),7.43~7.29(m,3h),6.93(d,j=1.8hz,1h),6.80(d,j=1.8hz,1h),5.50(s,1h),5.15(s,2h),4.30(s,2h),3.94(s,3h),3.82(s,3h),2.50(s,3h),2.37(s,3h).13cnmr(75mhz,,cdcl3)δ:197.45,197.30,152.68,150.65,145.62,137.10,136.95,135.60,133.04,132.90,129.58,128.53,128.47,128.34,122.51,110.65,106.36,101.23,75.07,56.25,55.98,43.14,26.49,26.35。
实施例46:化合物jja-d24的合成
取化合物apo-cho(1.94g,10mmol),用甲醇溶解,搅拌下加入化合物22c(2.98g,11mmol),反应1h,至不再产生黄色沉淀,搅拌下加入适量的氰基硼氢化钠,滴加催化量的冰乙酸,常温反应2h,然后加水洗,乙酸乙酯萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(乙酸乙酯:石油醚=1:4),得到黄色固体化合物jja-d24(2.47g,产率55%)。m.p.:119.4-120.4℃。esi-ms:m/z[m+h]+450,[m-h]+448.1hnmr(300mhz,dmso-d6)δ:9.91(s,1h),7.68~7.55(m,1h),7.50(dd,j=6.2,1.8hz,2h),7.43~7.27(m,4h),6.87(d,j=3.4hz,2h),5.73(s,1h),4.93(t,j=27.8hz,2h),4.28(d,j=41.2hz,2h),3.92~3.71(m,6h),2.67~2.14(m,6h).13cnmr(75mhz,dmso-d6)δ:197.73,196.61,152.29,149.53,147.47,142.40,137.99,137.80,133.27,128.83,128.67,128.45,126.21,122.95,110.17,105.05,101.58,73.84,56.44,56.23,41.70,27.03,26.65。
实施例47:化合物25a的合成
取化合物apo-cho(1.94g,10mmol)溶解于dmf中,加甲基磺酰氯(2.28g,20mmol)、三乙胺(2.02g,20mmol),冰浴反应3h。反应结束后,水洗,二氯甲烷萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(乙酸乙酯:石油醚=1:8),得到白色固体化合物25a(1.45g,产率53%)。esi-ms:m/z[m+h]+273,[m-h]+271.1hnmr(300mhz,dmso-d6)δ:10.18(d,j=5.0hz,1h),8.04~7.84(m,2h),4.01(s,3h),2.75~2.60(m,3h),1.59~1.36(m,3h).
实施例48:化合物jja-d25的合成
取化合物25a(2.72g,10mmol),用甲醇溶解,搅拌下加入化合物apo-nh2(2.17g,12mmol),反应1h,至不再产生黄色沉淀,搅拌下加入适量的氰基硼氢化钠,滴加催化量的冰乙酸,常温反应2h,水洗,乙酸乙酯萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(乙酸乙酯:石油醚=1:4),得到棕黄色固体化合物jja-d25(2.79g,产率64%)。m.p.:172.4-173.6℃。esi-ms:m/z[m+h]+438,[m-h]+436.1hnmr(300mhz,dmso-d6)δ:9.54(s,1h),7.62(s,1h),7.55(s,1h),6.94(d,j=1.0hz,1h),6.70(s,1h),5.82(s,1h),4.49(d,j=4.8hz,2h),3.96(s,3h),3.83(s,3h),3.59(s,3h),2.53(s,3h),2.37(s,3h).13cnmr(75mhz,dmso-d6)δ:197.44,196.91,152.10,146.77,140.30,138.08,137.12,136.41,136.12,128.77,120.51,111.66,104.74,102.35,56.76,56.37,41.98,27.19,26.64.
实施例49:化合物jja-d26的合成
取化合物apo-cho(1.94g,10mmol)溶解于dmf中,加乙基磺酰氯(2.56g,20mmol)、三乙胺(2.76g,20mmol),参照实施例47、48方法反应处理,先得到化合物26a,再得到棕黄色固体化合物jja-d26(3.06g,产率68%)。m.p.:174.2-176.5℃。esi-ms:m/z[m+h]+452,[m-h]+450.1h-nmr(300mhz,dmso-d6)δ:9.53(s,1h),7.62(d,j=1.9hz,1h),7.53(d,j=1.9hz,1h),6.93(d,j=1.8hz,1h),6.69(d,j=1.7hz,1h),5.83(s,1h),4.48(d,j=5.8hz,2h),3.94(s,3h),3.83(d,j=4.7hz,3h),3.71(q,j=7.3hz,2h),2.53(s,3h),2.37(s,3h),1.48(t,j=7.3hz,3h).13cnmr(75mhz,cdcl3)δ:197.72,197.03,152.05,145.74,140.45,136.93,136.17,135.75,135.13,129.69,121.62,110.42,106.66,101.25,56.25,47.76,43.06,26.60,26.36,8.39.
实施例50:化合物27c的合成
取apo-nh2(1.81g,10mmol),按实施例7制得apo-nh-boc,将apo-nh-boc(2.81g,10mmol)用适量的dmf溶解,加入甲基磺酰氯(1.36g,12mmol)、三乙胺(2.02g,20mmol),冰浴反应2h,反应结束后加入二氯甲烷60ml,水洗,减压蒸干,硅胶柱分离(乙酸乙酯:石油醚=1:10),得到白色固体化合物27b。esi-ms:m/z[m+h]+360.5.1hnmr(300mhz,dmso-d6)δ:8.67(s,1h),7.80(d,j=1.7hz,1h),7.41(d,j=1.9hz,1h),3.91(s,3h),3.59(s,1h),2.59(s,3h),1.78~1.15(m,9h)。用二氯甲烷溶解化合物27b(3.59g,10mmol),加入三氟乙酸,反应1h,用nahco3饱和水溶液中和反应液,二氯甲烷萃取,减压浓缩有机层,得到白色固体化合物27c(1.76g,68%)。esi-ms:m/z[m+h]+260.4,[m-h]+258.5.1hnmr(300mhz,dmso-d6)δ:7.07(d,j=2.0hz,1h),6.84(d,j=2.0hz,1h),5.39(s,2h),3.84(s,3h),3.41(d,j=26.4hz,3h),2.61–2.29(m,3h).
实施例51:化合物jja-d27的合成
取化合物27c(2.8g,11mmol),用甲醇溶解,加入apo-cho(1.94g,10mmol),反应1h,待不再出现沉淀后,搅拌下加入适量的氰基硼氢化钠,滴加催化量的冰乙酸,常温反应2h,水洗,乙酸乙酯萃取,合并有机层,无水硫酸钠干燥,减压浓缩,硅胶柱分离(乙酸乙酯:石油醚=1:3),得到棕黄色固体化合物jja-d27(2.57g,产率59%)。m.p.:179.2-181.4℃。esi-ms:m/z[m+h]+438,[m-h]+436.1hnmr(300mhz,dmso-d6)δ:9.95(s,1h),7.64(s,1h),7.38(s,1h),6.90(s,2h),5.95(s,1h),4.41(t,j=10.0hz,2h),3.87(d,j=6.8hz,6h),3.52(s,3h),2.50(s,3h),2.44(s,3h).13cnmr(75mhz,dmso-d6)δ:197.86,196.64,152.79,149.48,147.54,142.63,136.31,129.05,128.57,125.53,122.95,109.78,105.21,100.72,56.48,56.38,41.13,27.19,26.59.
实施例52:化合物28c的合成
取apo-nh2(1.81g,10mmol),按实施例7制得apo-nh-boc,将apo-nh-boc(2.81g,10mmol)用适量的dmf溶解,加入乙基磺酰氯(1.53g,12mmol)、三乙胺(2.02g,20mmol),冰浴反应2h,反应结束后加入二氯甲烷60ml,水洗,减压蒸干,硅胶柱分离(乙酸乙酯:石油醚=1:10),得到白色固体化合物28b(3.02g,产率81%)。esi-ms:[m+h]+374.3,[m-h]+372.3.1h-nmr(300mhz,dmso-d6)δ:8.67(s,1h),7.80(d,j=1.7hz,1h),7.41(d,j=1.9hz,1h),3.91(s,3h),3.58(q,j=7.3hz,2h),2.59(s,3h),1.54~1.35(m,12h).用二氯甲烷溶解化合物28b(3.73g,10mmol),加入三氟乙酸,反应1h,用nahco3饱和水溶液中和反应液,二氯甲烷萃取,减压浓缩有机层得到化合物28c(1.77g,65%)。esi-ms:m/z[m+h]+274.3,[m+nh4]+291.2.1hnmr(300mhz,dmso-d6)δ:7.07(d,j=1.9hz,1h),6.84(d,j=1.8hz,1h),5.34(s,2h),3.83(s,3h),3.61(q,j=7.3hz,2h),2.52(s,3h),1.41(t,j=7.3hz,3h).
实施例53:化合物jja-d28的合成
取化合物28c(2.99g,11mmol),用甲醇溶解,加入apo-cho(1.94g,10mmol),待不再出现沉淀后,加入氰基硼氢化钠适量,滴加催化量的冰乙酸,反应3h,反应液用硅胶柱分离(乙酸乙酯:石油醚=1:3),得到棕黄色固体化合物jja-d28(2.84g,产率63%)。m.p.:177.2-180.1℃。esi-ms:m/z[m+h]+452,[m-h]+450.1hnmr(300mhz,dmso-d6)δ:9.96(s,1h),7.66(s,1h),7.38(d,j=1.3hz,1h),6.91(s,2h),5.85(t,j=6.0hz,1h),4.42(d,j=5.9hz,2h),3.88(s,3h),3.85(s,3h),3.66(q,j=7.3hz,2h),2.50(s,3h),2.44(s,3h),1.26(dd,j=15.3,5.5hz,3h).13cnmr(75mhz,dmso-d6)δ:197.84,196.63,152.66,149.49,147.55,142.79,136.26,129.01,128.56,125.48,123.02,109.77,105.26,100.75,56.48,56.38,47.66,41.23,27.20,26.58,8.65.
实施例54:jja-d0的安全性评价
本实施例使用胡黄连素衍生物jja-d0,取对数生长的raw264.7细胞,以1.0×104/ml浓度接种于96孔板,以浓度分别为12.5μm,25μm,50μm,100μm,200μm与400μm的jja-d0处理,在24h、36h、48h与72h之后,弃其上清液,加入含0.5mg/mlmtt的培养液,置于co2培养箱中37℃培养4h后,移弃培养液,加入100μldmso,震荡10min后,在波长570nm处检测其吸光值,计算细胞存活率。其目的是为了检测化合物jja-d0对raw264.7细胞的细胞毒性。实验数据显示(图13),jja-d0化合物在24h时,没有出现任何细胞毒性;在36h时,只在400μm下,表现出较小的毒性,相当于空白对照组(control,ctrl)的细胞存活率是88.66%;在48h时,在200μm下其细胞存活率相当于空白对照组的91.73%,在400μm下其细胞存活率相当于空白对照组的75.96%;在72h时,在200μm下其细胞存活率相当于空白对照组的83.91%,在400μm下其细胞存活率相当于空白对照组的50.73%。从结果可知,jja-d0在长时间处理细胞48h与72h,且在超过200μm时才表现出细胞毒性,安全性好。
实施例55:mtt法测apo、jja-d0以及14个jja-d0衍生物对lps诱导raw264.7细胞损伤的保护作用
取对数生长的raw264.7细胞,以1.0×104/ml浓度接种于96孔板,生长24h后,分别加入不同浓度apo(50,100,200μm)、jja-d0(50,100,200μm)和上述实施例中的14个jja-d0衍生物(50,100,200μm),空白对照组和模型组(model)加入等量空白培养液,预处理1h后,吸去上清液。除空白对照组加入等量空白培养液外,其余每组加入含100μg/mllps的培养液。置于co2培养箱中37℃培养24h后,弃去上清液,加入含0.5mg/mlmtt的培养液,置于co2培养箱中37℃培养4h后,移弃培养液,加入100μldmso,震荡10min后,在波长570nm处检测其吸光值,计算细胞存活率。实验结果(图14)显示,所测定的jja-d0衍生物对lps诱导的raw264.7细胞损伤都有一定的保护作用,其中以jja-d26在200μm时细胞存活率最高。
实施例56:apo、jja-d0、14个jja-d0衍生物对lps诱导的raw264.7细胞内ros水平的影响
本实施例考察胡黄连素、jja-d0及上述实施例中的14个jja-d0衍生物对lps诱导的raw264.7细胞内活性氧ros水平的影响。将对数生长期的raw264.7细胞接种于黑色底透的96孔板,以密度为1×104个/100μl,生长24h后,除空白对照组和模型组加入等量空白培养液外,实验组分别用不同浓度的不同化合物预处理1h后,吸去上清液。除空白对照组加入等量空白培养液外,其余每组加入含100μg/mllps的培养液诱导24h。弃去上清液,用pbs清洗2遍,采用对活性氧敏感的荧光探针dcfh-da(终浓度为20μm)标记细胞,37℃孵育30min,弃去上清,用pbs清洗2遍。立即采用酶标仪检测lps诱导的raw264.7细胞中的ros荧光强度,激发波长为488nm,发射光波长为525nm。结果(图15)显示,所测定的jja-d0衍生物对lps诱导的raw264.7细胞中ros水平均具有一定的降低作用,且大部分衍生物效果优于单体化合物胡黄连素,在所测浓度对细胞内ros水平的降低作用与模型组相比具有显著性差异。
实施例57:jja-d26对炎症因子tnf-α表达的下调作用
本实施例采用westernblot实验,检测胡黄连素,jja-d0、jja-d26对lps诱导的raw264.7细胞中的tnf-α表达的影响。参照实施例55相同的方法,以5×105/ml将raw264.7细胞接种于6孔板上,培养24h后,细胞用胡黄连素(200μm),jja-d0(100μm)和jja-d26(200μm)预处理1h后,加入lps(100μg/ml)刺激24h。制备细胞质提取物,进行sds-丙烯酰胺凝胶电泳,然后转移到pvdf膜上。将膜在tbst中封闭,并与tnf-α抗体(cellsignalingtechnology,1:1000)和β-actin抗体(cellsignalingtechnology,1:1000)在4℃孵育过夜。之后膜与羊抗鼠igg辣根过氧化物酶联抗体(santacruz,1:2000)在室温孵育1h,用tbst洗膜,用ecl溶液a与b(1:1)配制成的工作液(0.1ml工作液/cm2)曝光显影。结果(图16)显示,与空白对照组相比,细胞内tnf-α蛋白表达量在模型组细胞中上调了2.58倍(p<0.001),在胡黄连素组(200μm)处理后的细胞中上调了1.99倍,在jja-d0组(100μm)处理后的细胞中上调了1.65倍,在jja-d26(200μm)处理后的细胞中上调了1.48倍。与模型组相比,jja-d0、jja-d26组对细胞内tnf-α蛋白表达量的下调作用均具有显著性差异,p<0.05。
实施例58:jja-d26对nadph氧化酶亚基p47phox、gp91phox表达的下调作用
本实施例采用westernblot实验,检测胡黄连素,jja-d0、jja-d26对lps诱导的raw264.7细胞中的nadph氧化酶亚基p47phox、gp91phox表达的影响。参照实施例55相同的方法,以5×105/ml将raw264.7细胞接种于6孔板上,培养24h后,细胞用胡黄连素(200μm),jja-d0(100μm)和jja-d26(200μm)预处理1h后,加入lps(100μg/ml)刺激24h。制备细胞质提取物,进行sds-丙烯酰胺凝胶电泳,然后转移到pvdf膜上。将膜在tbst中封闭,并与p47phox抗体(cellsignalingtechnology,1:1000),gp91phox抗体(cellsignalingtechnology,1:1000)和β-actin抗体(cellsignalingtechnology,1:1000)在4℃孵育过夜。之后膜与羊抗鼠igg辣根过氧化物酶联抗体(santacruz,1:2000)在室温孵育1h,用tbst洗膜,用ecl溶液a与b(1:1)配制成的工作液(0.1ml工作液/cm2)曝光显影。实验结果(图17)显示,胡黄连素、jja-d0、jja-d26对lps诱导的raw264.7细胞中的nadph氧化酶亚基p47phox、gp91phox表达均具有显著的下调作用,且胡黄连素作用最弱,jja-d26作用最强。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!