杂环苦参碱衍生物及其制备方法和应用与流程
本发明涉及化合物及其分离制备技术领域,更具体地,涉及一种杂环苦参碱衍生物及其制备方法和应用。
背景技术:
长期以来,恶性肿瘤已成为严重危害人类生命和生活质量的主要疾病之一,成为人类首要死因,而且,随着经济的发展以及人们对环境保护的不力,恶性肿瘤的致死率还在不断增长。世界卫生组织预测,到2020年,将有2000万新发恶性肿瘤病例,其中死亡人数达1200万,且绝大部分将发生在发展中国家。对于恶性肿瘤的治疗,天然产物及其衍生物药物发挥着重要作用。据报道,1981年到2008年间,天然产物来源的抗肿瘤药物占上市抗肿瘤药物的60%以上,而且,新型天然产物及其衍生物作为新的抗肿瘤药物所占数量还在不断增加。
苦参碱是于1958年首次被植物学家从苦参植物中分离和确认,是属于一类独特的生物碱,学名为喹里西啶生物碱,目前,国内外许多学者对苦参碱类化合物的化学成分、药理作用以及临床应用均已进行了较为详细的研究,发现苦参碱类化合物具有显著的抗肿瘤、抗炎、镇痛、抗病毒等多种生物活性。苦参碱因具有独特的分子结构和丰富的生物活性,使其成为开发新药物的重要先导化合物。结构修饰可以对天然活性化合物的原始结构进行修饰或改造,改善缺点,提高活性,解决原有结构存在的影响药效问题。苦参碱的d环13,14-位是重要的可修饰键位,对其修饰,能够获取一系列具抗肿瘤、抗炎、抗菌、镇痛等活性的衍生物。
植物源农药属于绿色农药的一大类,具有作用靶标多样性,无环境残留,对人畜安全等优点。分析植物化学成分,探寻具有农用生物活性的天然化合物,创制新型绿色农药成为当前农药开发的主流之一。苦参碱也是一种传统生物农药,它对棉铃虫(heliothisarmigera)、褐飞虱(nilaparvatalugens)、菜青虫(pierisrapaelinne)、小菜蛾(plutellaxylostella)等20多种害虫具有毒杀作用,对多种植物致病菌也有较好的抑制作用;苦参碱单剂或与其他农药混配的杀虫效果比部分化学农药高,且混配能显著提高苦参碱的药效和杀虫谱。目前苦参碱农用方面的基础研究仅局限于药效试验和形态层面的毒理分析;应用开发主要集中于从各种植物中提取和分离苦参碱类化合物,再以粗提物形式应用于农业生产,或以其与其它农药混配发展商品化的农药品种,这些应用均比较粗放,未能充分体现苦参碱作为重要植物源农药的价值,因此,开发高效的新型苦参碱类农药是当前的重要任务。近年,随着计算机辅助技术引入农药分子设计,加快了新型农药的开发步伐,取得了显著成果。运用这些技术以植物活性成分为先导化合物,以其活性机理为理论依据,对先导化合物进行结构修饰和改造,已开发出一系列高效的环保型农药,如拟除虫菊类、烟碱类、阿维菌素等。苦参碱是创制新型环保农药的优良先导化合物,然而目前针对农业害虫,以苦参碱为先导化合物,结构修饰、筛选新活性衍生物的研究尚未开展。
技术实现要素:
本发明要解决的技术问题是针对现有以苦参碱为先导化合物经结构修饰获得新的活性衍生物的技术不足,提供一种杂环苦参碱衍生物。
本发明要解决的另一技术问题是提供所述杂环苦参碱衍生物的制备方法。
本发明还一要解决的另一技术问题是提供所述杂环苦参碱衍生物的应用。
本发明的目的通过以下技术方案予以实现:
提供一种杂环苦参碱衍生物,其结构如式(ⅰ)所示:
其中,所述杂环基团为吲哚
本发明同时提供了所述苦参碱衍生物的制备方法,苦参碱d环含有内酰胺结构,13,14位均为饱和键,性能稳定,引入基团的难度相对较大,本发明创造性地以13、14位带不饱和双键的苦参碱衍生物槐果碱为原料,在其13位分别成功引入吲哚和环己胺两个杂环基团,修饰合成两个杂环基苦参碱衍生物,经过重结晶获得晶体,再进行单晶衍射和结构分析,确定其分别为吲哚基苦参碱(衍生物ⅱind-mat)和环己胺基苦参碱(衍生物ⅲcyc-mat)。结构式分别如式(ⅱ)或式(ⅲ)所示:
本发明提供所述吲哚基苦参碱(ind-mat)制备方法包括以下步骤:
s01.粗产品制备:通n2条件下,加入槐果碱、吲哚、氟化铯和石油醚,加热保持恒温,滴加四甲氧基硅烷,反应;反应结束后,稍冷却,加入二氯甲烷,搅拌后过滤,滤液蒸去溶剂后得粗产品。
优选地,所述吲哚基苦参碱(ind-mat)经过以下纯化结晶操作步骤可以获得所述衍生物晶体:
s02.分离纯化:采用硅胶柱层析法,用200~300目硅胶作为固定相,流动相为乙酸乙酯和乙醇混合物,湿法装柱完成后,反复用流动相过柱活化;封口,流动相浸泡静置过夜;
进样与洗脱:使用少量洗脱剂溶解试样后上样,样品完全渗入硅胶柱后,加入洗脱剂开始洗脱。每流出5ml馏分收集一次,蒸去大部分溶剂后用于检测;
检测:tlc薄层色谱跟踪检测分析分离液中目标产物的开始流出时间和洗脱剂体积,目标物洗脱完毕时间和洗脱溶剂体积,合并目标产物开始流出和洗脱完毕时间点之间的所有洗脱样品,浓缩;
s03.重结晶:
将步骤s02所得浓缩的产品用重结晶溶剂溶解,挥发得油状物,吸出油状物,加入溶剂,超声溶解后继续挥发,重复2~3次,得到目标衍生物(ⅱ)。
进一步优选地,步骤s02所述流动相为乙酸乙酯:乙醇按照体积比为10:1的混合物。
进一步优选地,步骤s03所述所述重结晶溶剂是正己烷和无水乙醇按照体积比为6:1的混合物。
本发明同时提供所述环己胺基苦参碱(cyc-mat)制备方法,包括以下步骤:
s11.粗产品制备:按比例将槐果碱、环己胺和水混合后在磁力搅拌下恒温油浴加热反应,反应结束后,稍冷却,加入二氯甲烷,搅拌后过滤,滤液蒸去溶剂后得粗产品。
优选地,所述环己胺基苦参碱(cyc-mat)经过以下纯化结晶操作步骤可以获得所述衍生物晶体:
s12.分离纯化:采用硅胶柱层析法,用200~300目硅胶作为固定相,流动相为乙酸乙酯和乙醇混合物,湿法装柱完成后,反复用流动相过柱活化;封口,流动相浸泡静置过夜;
进样与洗脱:使用少量洗脱剂溶解试样后上样,样品完全渗入硅胶柱后,加入洗脱剂开始洗脱,每流出5ml馏分收集一次,蒸去大部分溶剂后用于检测;
检测:tlc薄层色谱跟踪检测分析分离液中目标产物的开始流出时间和洗脱剂体积,目标物洗脱完毕时间和洗脱溶剂体积,合并目标产物开始流出和洗脱完毕时间点之间的所有洗脱样品,浓缩;
s13.将步骤s12所得浓缩的样品,用溶剂溶解,常温挥发掉溶剂得到晶体,获得目标衍生物ⅲ。
进一步优选地,步骤s12所述流动相为乙酸乙酯:乙醇按照体积比为1:8的混合物。
进一步优选地,步骤s13所述溶剂为石油醚。
本发明还提供了所述杂环苦参碱衍生物的应用,具体是在制备具有抗肿瘤活性药物或者农药方面的应用。
抗肿瘤活性应用尤其是在应用于制备抗人宫颈癌细胞株的药物方面具有良好的效果。进一步地,衍生物ind-mat在0.32~0.64mmol/l剂量浓度条件下对肿瘤细胞具有显著的抑制作用,并表现出明显时效性,在相同浓度下cyc-mat对细胞的抑制作用随时间的增大而增强,在相同作用时间内随浓度的增加而增强。衍生物cyc-mat在0.8~1.6mmol/l剂量浓度条件下对肿瘤细胞具有显著的抑制作用,并表现出明显时效性,在相同浓度下cyc-mat对细胞的抑制作用随时间的增大而增强,在相同作用时间内随浓度的增加而增强,。
优选地,所述制备农药方面的应用主要是制备应用于防治农业害虫的环保型农药的候选化合物。所述害虫包括但不限于棉铃虫(heliothisarmigera)、褐飞虱(nilaparvatalugens)、菜青虫(pierisrapaelinne)、小菜蛾(plutellaxylostella)、草地贪夜蛾(s.frugperda)等
进一步地,应用于抑制草地贪夜蛾(s.frugperda)sf9细胞系方面。衍生物ind-mat在2.5mm的浓度能够明显诱导所述细胞凋亡,3mm浓度对细胞增殖生长抑制率超过80%。1.2mmcyc-mat对sf9细胞抑制率超过60%。在苦参碱13键位上引入吲哚和环己胺两个种杂环,能够显著提高其昆虫细胞抑制活性。
本发明的有益效果:
本发明公开了两种新的杂环基苦参碱衍生物,所述衍生物具有良好的抗肿瘤和杀虫活性,所获得两种苦参碱衍生物对肿瘤细胞或昆虫细胞具有明显的抑制作用,填补了本领域技术不足,可用于抗肿瘤药物或杀虫剂研究开发,因此本发明为开发新的抗肿瘤或杀虫活性苦参碱衍生物提供了候选化合物,对全面开发苦参碱的医用活性和农用活性具有重要的意义。
实验证明,0.32~0.64mmol/l的衍生物ind-mat对肿瘤细胞有良好的抑制作用,并表现出明显时效性,在相同浓度下cyc-mat对细胞的抑制作用随时间的增大而增强;在相同作用时间内随浓度的增加而增强。0.8~1.6mmol/l的衍生物cyc-mat对肿瘤细胞具有良好的抑制作用,并表现出明显时效性,在相同浓度下cyc-mat对细胞的抑制作用随时间的增大而增强;在相同作用时间内随浓度的增加而增强。
所述衍生物具有抑制以草地贪夜蛾(s.frugperda)sf9细胞系为典型代表的农用活性方面。衍生物ind-mat在2.5mm的浓度能够明显诱导所述细胞凋亡,3mm浓度对细胞增殖生长抑制率超过80%。1.2mmcyc-mat对sf9细胞抑制率超过60%。在苦参碱13键位上引入吲哚和环己胺两个种杂环,能够显著提高其昆虫细胞抑制活性。
本发明进一步提供了所述两种衍生物的制备方法,是在先导化合物苦参碱13键位上引入吲哚或环己胺杂环,显著提高苦参碱的生物活性,制备方法条件温和,简单易行。
附图说明
图1衍生物吲哚基苦参碱(ind-mat)的晶体形态图。
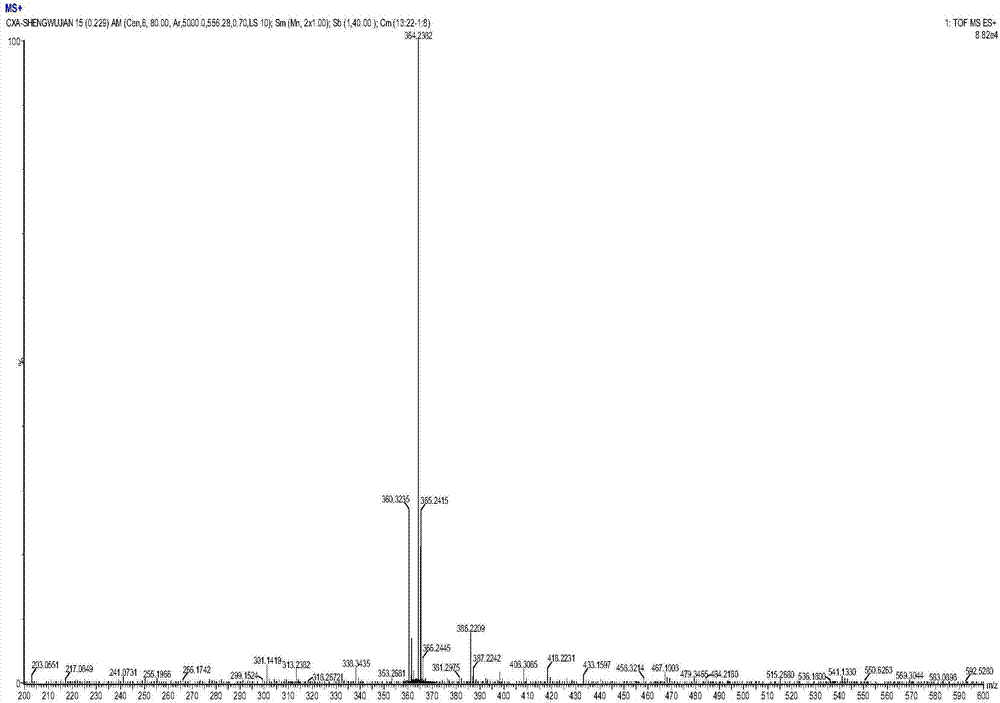
图2衍生物吲哚基苦参碱(ind-mat)的ms分析结果。
图3衍生物吲哚基苦参碱(ind-mat)的单晶衍生结果。
图4衍生物环己胺基苦参碱(cyc-mat)的单晶衍生结果。
图5环己胺基苦参碱(cyc-mat)的晶体形态图。
图6衍生物对hela229细胞显微形态影响。
图7衍生物对sf9细胞显微形态影响。
具体实施方式
下面结合具体实施例进一步说明本发明。下述实施例仅用于示例性说明,不能理解为对本发明的限制。除非特别说明,下述实施例中使用的试剂为常规市购或商业途径获得的试剂,除非特别说明,下述实施例中使用的方法和设备为本领域常规使用的方法和设备。
实施例1吲哚基苦参碱(ind-mat)制备
s01.制备粗产品
100ml三口烧瓶,通入n25min后,加入槐果碱1.23g,吲哚0.585g,氟化铯0.76g与石油醚12ml。调整n2流速,5min后开始甘油油浴加热,保持恒温80℃,滴加0.5ml四甲氧基硅烷;反应6h后停止加热。反应过程中溶剂量保持在4~5ml不足时可补充2~3ml。反应结束后,稍冷却,加入10ml二氯甲烷,搅拌后过滤,滤液蒸去溶剂后得粗产品。
s02.分离纯化和结构表征
将步骤s01所得粗产品采用硅胶柱层析法分离纯化。
(1)分离条件
固定相:200~300目硅胶230ml;
筛选洗脱体系:tlc法筛选洗脱溶剂体系,最后确定柱色谱分离流动相为乙酸乙酯:乙醇=10:1。
装柱与活化:湿法装柱完成后,反复用流动相过柱活化;封口,流动相浸泡静置过夜。
进样与洗脱:使用少量洗脱剂溶解试样后上样,样品完全渗入硅胶柱后,加入洗脱剂开始洗脱。每流出5ml馏分收集一次,蒸去大部分溶剂后用于检测。检测:tlc薄层色谱跟踪检测分析分离液中目标产物的开始流出时间和洗脱剂体积,目标物洗脱完毕时间和洗脱溶剂体积。合并目标产物开始流出和洗脱完毕时间点之间的所有洗脱样品,浓缩。
(2)重结晶和结构表征
结晶溶剂体系:正己烷:无水乙醇=6:1。
把浓缩样品,用1.5~2ml重结晶溶剂溶解,转入玻璃样品瓶,用滤纸封瓶口,在通风橱下敞开挥发。放置过夜后瓶底出现结晶及黄色油状物(瓶内需留有一定量液体,不可挥干),用毛细管吸出油状物,加入溶剂,超声溶解后继续挥发,重复2~3次该过程可得到形态较好的晶体。tlc薄层色谱进一步检测确认所获的样品为合成产物纯品,取部分晶体样品进行质谱(lc-ms)分析和单晶衍生分析。表征结果确认吲哚基团已引入苦参碱13键位,并获得目标衍生物(ⅱ)。目标衍生物(ⅱ)的晶体形态见附图1所示,ms分析结果见图2所示,单晶衍生结果见表1和图3所示。
表1数据收集与处理
实施例2环己胺基苦参碱(cyc-mat)制备
s11.制备粗产品
50ml单口烧瓶,加入槐果碱0.62g,环己胺0.55ml,水4ml,磁力搅拌下恒温60℃油浴加热6小时。反应结束后,稍冷却,加入10ml二氯甲烷,搅拌后过滤,滤液蒸去溶剂后得粗产品。
s12.分离纯化和结构表征
将步骤s11所得粗产品采用硅胶柱层析法。
(1)分离条件
固定相:200~300目硅胶230ml;
筛选洗脱体系:tlc法筛选洗脱溶剂体系,最后确定柱色谱分离流动相为乙酸乙酯:乙醇=1:8。
装柱与活化:湿法装柱完成后,反复用流动相过柱活化;封口,流动相浸泡静置过夜。
进样与洗脱:使用少量洗脱剂溶解试样后上样,样品完全渗入硅胶柱后,加入洗脱剂开始洗脱。每流出5ml馏分收集一次,蒸去大部分溶剂后用于检测。
检测:tlc薄层色谱跟踪检测分析分离液中目标产物的开始流出时间和洗脱剂体积,目标物洗脱完毕时间和洗脱溶剂体积。合并目标产物开始流出和洗脱完毕时间点之间的所有洗脱样品,浓缩。
(2)重结晶和结构表征
结晶溶剂体系:石油醚
把浓缩样品,用1.5~2ml石油醚溶解,转入玻璃样品瓶,用滤纸封瓶口,在通风橱中常温挥发掉溶剂得到晶体。tlc薄层色谱进一步检测确认所获的样品为合成产物纯品,取部分晶体样品进行lc-ms分析和单晶衍生分析。确认吲哚基团已引入苦参碱13键位,并获得目标衍生物ⅲ。衍生物ⅲ的晶体形态见图5所示,单晶衍生结果见表2和图4所示。
表2:数据收集与处理
实施例3本发明两个衍生物生物活性分析
1.两个衍生物对肿瘤hela229细胞抑制活性实验
(1)实验方案:
试验化合物:修饰前的先导化合物苦参碱(mat);合成实验原料,苦参碱衍生物槐果碱(sop);本发明两种新的苦参碱衍生物吲哚基苦参碱(衍生物ⅱind-mat)和环己胺基苦参碱(衍生物ⅲcyc-mat)。
细胞培养:供试的人宫颈癌细胞hela229,以mem基础培养基加10%胎牛血清,在5%二氧化碳,37℃及适当湿度的细胞培养箱常规培养。
mtt检测细胞活力:选择状态良好的细胞,调整细胞悬液密度至8×104~1×105个/ml,以每孔100μl接种到96孔板中,mat等药物对细胞增殖的影响,则接种24h后,实验分两组:对照组和加药处理组,设置24、48、72h三个时间点,每组每个时间点各浓度四个重复,到时间点后,向对应的孔,以每孔10μl加入mtt溶液,期间注意避光,于培养箱培养4h后弃去培养液,以每孔150μl加dmso,室温下轻轻震荡是蓝紫色结晶甲瓒完全溶解,约15min;将96孔放到酶标仪中,设定波长为429mm,测定并记录对应孔的吸光度(od值)。细胞抑制率(%)=(1-od实验组/od对照组)×100%。
倒置相差显微镜(ipcm)形态观察:选择形态良好的细胞,调整细胞密度至8×104~1×105个/ml,向6孔板中以每孔1ml加入稀释后的细胞悬液,24h后按照实验设计,加药处理,分别在0、24、48、72h进行ipcm定点观察,拍下照片记录细胞形态。
(2)结果与分析
由ipcm显微特征观察可知,对照组细胞形态呈梭行,折光性好,24、48h均处于旺盛的增殖状态(图6-a,b)。分别以终浓度1.6、0.64、1.6mmol/l的mat、ind-mat和cyc-mat诱导细胞24和48h,与对照组比较,三处理细胞形态发生不同程度变化,其中ind-mat和cyc-mat处理组,细胞形态变化尤为显著,细胞数量逐渐变少,贴壁细胞形态变小,最后解体消失(图6-e,f,g,h)。mat处理组细胞形态有一定的影响,但变化程度没有ind-mat和cyc-mat处理组显著,细胞仍能继续增殖生长(图6-c,d)。mtt细胞活力分析表明0.32~0.64mmol/lind-mat对肿瘤细胞有不同程度的抑制作用,并表现出明显时效性,在相同浓度下cyc-mat对细胞的抑制作用随时间的增大而增强;在相同作用时间内随浓度的增加而增强,0.64mmol/l,处理72h抑制率可达83.83%,比0.8mmol/l浓度mat和sop处理组的7.91%和14.46%大幅度增加(见表3、4、5所示)。0.8~1.6mmol/lcyc-mat对肿瘤细胞也有不同程度的抑制作用,并表现出明显时效性,在相同浓度下cyc-mat对细胞的抑制作用随时间的增大而增强;在相同作用时间内随浓度的增加而增强,0.8mmol/l,处理72h抑制率可达66.32%,比相同浓度sop、mat处理组的7.91%和14.46%大幅度增加(表3、4、6),可见在苦参碱13键位上引入吲哚和环己胺两个杂环,能够显著提高其抗肿瘤活性。图6中,a-b:ck,24h和48h;c-d:2.5mmol/lmatrine处理24h和48h;e-f:2.5mmol/lind-mat处理24h和48h;g-h:1.2mmol/lcyc-mat处理24h和48h。
表3不同浓度mat对肿瘤细胞生长影响
表4不同浓度的sop对肿瘤细胞生长影响
表5不同浓度的ind-mat对肿瘤细胞生长影响
表6不同浓度的cyc-mat对肿瘤细胞生长影响
实施例4本发明两个衍生物对昆虫细胞sf9抑制活性
(1)实验方案:
本发明两个衍生物多种昆虫细胞具有很好的抑制活性。为免赘述,以下以草地贪夜蛾(s.frugperda)为例进行说明。
试验化合物:修饰前的先导化合物苦参碱(mat);合成实验原料,苦参碱衍生物槐果碱(sop);本发明两种新的苦参碱衍生物吲哚基苦参碱(衍生物ⅱind-mat)和环己胺基苦参碱(衍生物ⅲcyc-mat)。
细胞培养:供试昆虫细胞为草地贪夜蛾(s.frugperda)sf9细胞系,用含10%胎牛血清的昆虫培养基置于细胞培养箱27℃恒温常规贴壁培养。细胞培养基主要成分包括grace’s昆虫干粉培养基(gibco公司)、活胎牛血清,酵母提取物、蛋白胨,水解乳蛋白,细胞传代培养。
mtt检测细胞活力:选择状态良好的细胞,调整细胞悬液密度至8×104~1×105个/ml,以每孔100μl接种到96孔板中,mat等药物对细胞增殖的影响,则接种24h后,实验分两组:对照组和加药处理组,设置24、48、72h三个时间点,每组每个时间点各浓度四个重复,到时间点后,向对应的孔,以每孔10μl加入mtt溶液,期间注意避光,于培养箱培养4h后弃去培养液,以每孔150μl加dmso,室温下轻轻震荡是蓝紫色结晶甲瓒完全溶解,约15min;将96孔放到酶标仪中,设定波长为429mm,测定并记录对应孔的吸光度(od值)。细胞抑制率(%)=(1-od实验组/od对照组)×100%。
倒置相差显微镜(ipcm)形态观察:选择形态良好的细胞,调整细胞密度至8×104~1×105个/ml,向6孔板中以每孔1ml加入稀释后的细胞悬液,24h后按照实验设计,加药处理,分别在0、24、48、72h进行ipcm定点观察,拍下照片记录细胞形态。
(2)结果与分析
由ipcm显微形态观察(图7,a-h)和细胞活性测定(表7~10)结果可知,对照组细胞形态呈圆形,折光性好,24、48h均处于旺盛的增殖状态(图7,a,b),浓度3mm以下mat和sop对sf9细胞生长有一定促进作用,细胞状态良好(图7,c,d),3~4.5mm对细胞表现一定增殖抑制作用,抑制率低于20%。而13键位引入吲哚基修饰后的ind-mat在2.5mm的浓度能够明显诱导细胞凋亡,诱导24h,细胞出现漂浮,周围产生大量凋亡小体,表现出显著凋亡特征,48h后,绝大部分细胞已漂浮、解体死亡(图7-e,f),3mm浓度对细胞增殖生长抑制率超过80%。1.2mmcyc-mat对sf9细胞抑制率超过60%,显微形态观察发现cyc-mat诱导sf9细胞24h大部分仍细胞贴壁,但出现空泡化,48h后,大部分细胞贴壁原位解体死亡,但细胞周围未大量出现凋亡小体(图7-g,h),cyc-mat诱导sf9细胞发生自噬死亡。可见在苦参碱13键位上引入吲哚和环己胺两个种杂环,能够显著提高其昆虫细胞抑制活性。图7中,a-b:ck,24h和48h;c-d:2.5mmol/lmatrine处理24h和48h;e-f:2.5mmol/lind-mat处理24h和48h;g-h:1.2mmol/lcyc-mat处理24h和48h。
表7不同浓度的mat对昆虫细胞的生长影响
表8不同浓度的sop对昆虫细胞的生长影响
表9ind-mat对昆虫细胞的生长影响
表10不同浓度的cyc-mat对昆虫细胞的生长影响
- 还没有人留言评论。精彩留言会获得点赞!
- 苯并双(噻二唑)衍生物、包含其的油墨、以及使用了其的有机电子装置的制造方法
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 一种苯并噻咯类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并二氮杂*衍生物的2-萘磺酸盐及晶型和它们的制备方法与制造工艺
- 靛红杂合喹唑啉类化合物合成的靛红衍生物及其在制备抗肿瘤药物中的应用的制造方法与工艺
- 一种杂环衍生物及使用该杂环衍生物的有机发光器件的制造方法与工艺
- 一种二氰基甲烯基苯并四氢呋喃衍生物及其制备方法与制造工艺
- 一种含氮杂环衍生物及使用该含氮杂环衍生物的有机发光器件的制造方法与工艺