一种含偶氮苯碱基元素的化合物及其制备方法和应用与流程
本发明涉及生物医药领域,具体地涉及一种含偶氮苯碱基元素的化合物及其制备方法和应用。
背景技术
核酸分子是遗传信息的载体,同时具有特异性识别与自组装功能特点的核酸也是智能材料。固相合成技术使得短链的核酸可通过固相合成仪实现自动化、高效化学合成。这一技术极大地推进了核酸在生物、医药与纳米技术等领域的应用。
作为生物大分子,核酸的结构无法通过元素周期表里的化学元素符号来表达,而是应用核酸里碱基符号a、t、c、g与u来准确表达其确切结构。随着人工核酸研究的深入,越来越多的人工碱基被开发出来,相应的核酸在生物医药领域得到广泛应用。为更好表达包含天然碱基与人工碱基核酸大分子的结构,我们提出将a、t、c、g、u与人工碱基通称为“碱基元素”,即构建核酸分子的“元素”。
核酸可通过碱基对a-t、c-g之间的氢键作用实现自组装、形成双链结构,这一性能使得核酸作为智能材料在生物、医药与纳米技术等领域具有独特的应用价值。例如发明专利pct/ca2010/001292所揭示的核酸适配体(aptamer)即是人工合成的单链寡聚核酸通过分子内碱基特异性配对的氢键作用,折叠形成特定结构的三维大分子配体,用于检测与治疗等方面。
可控地切断a-t、c-g,使得自组装可逆地进行,将使得作为智能材料的核酸得到更广阔的应用。日本的研究人员通过在核酸中引入偶氮苯基团,实现了可控地开、关核酸的自组装(asanuma,h.etal.angew.chem.int.ed.,40:2671-2673(2001);liang,x.etal.tetrahedronlett.,42:6723-6725(2001);asanuma,h.etal.chembiochem,2:39-44(2001);liang,x.etal.j.am.chem.soc,124:1877-1883(2002);asanuma,h.etal.nucleicacidssyinp.ser.,49:35-36(2005);liang,x.etal.chembiochem,9:702-705(2008))。这种控制核酸自组装的方法进而可控制dna水凝胶的形成,用于药物释放(pct/us2010/045314)。然而,这一方法存在明显缺陷:偶氮苯是作为核酸中的额外器件,并不参与自组装过程,它的引入破坏了核酸结构的规整性(该类型核酸分子通用结构见图1a)。其次,这种开关控制自组装的效果不佳,偶氮苯基团在光照下发生顺反异构,稳定态的反式偶氮苯是共平面的共轭п电子平面结构,可稳定dna双链,而顺式偶氮苯是折叠的非平面结构(见图1b);通过这种偶氮苯顺反异构变化来扰动dna双链的碱基п电子平面的叠加稳定性,实现控制dna双链开、关的效果有限。
因此,开发结构更优、效果更佳的光响应核酸具有重要应用价值。
技术实现要素:
本发明的目的在于提供一种式i所示含偶氮苯碱基元素的化合物及其制备方法和应用。
本发明的第一方面,提供了一种含偶氮苯碱基元素的化合物,所述化合物具有式i所示结构:
其中,z选自下组:无、取代或未取代的核糖基、取代或未取代的脱氧核糖基、卤素、ora、nrarb;所述取代指被选自下组的基团取代:-o-p(nrdre)-o-(取代或未取代的c1-c6亚烷基)-cn、-(c1-c6亚烷基)-o-c(rfrgrh);其中,在-o-p(nrdre)-o-(取代或未取代的c1-c6亚烷基)-cn中,rd和re可相同或不同,分别独立地选自下组:c1-c6烷基、c1-c6烷氧基;且在所述取代或未取代的c1-c6亚烷基中,所述取代指被如下基团取代:c1-c6烷基、c1-c6烷氧基、卤素;在-(c1-c6亚烷基)-o-c(rfrgrh)中,rf、rg、rh可相同或不同,分别独立地选自下组:取代或未取代的苯基,所述取代指被选自下组的取代基取代:c1-c6烷基、c1-c6烷氧基;
ra和rb可相同或不同,分别独立地选自下组:h、取代或未取代的c1-c6烷基、取代或未取代的c1-c6烷氧基、取代或未取代的c3-c6环烷基、取代或未取代的c2-c12烯基、取代或未取代的c2-c12炔基、取代或未取代的含1-3个选自n、o、s的杂原子的c1-c6杂环烷基、-(c=o)苯基;rc选自下组:无、卤素、取代或未取代的c1-c6烷基、取代或未取代的c1-c6烷氧基、取代或未取代的c3-c6环烷基、取代或未取代的含1-3个选自n、o、s的杂原子的c1-c6杂环烷基;其中,所述取代指被选自下组的取代基取代:卤素。
在另一优选例中,z具有如下结构:-r1-o-p(nrdre)-o-(取代或未取代的c1-c6亚烷基)-cn,其中,
r1选自下组:取代或未取代的含1-3个选自n、o、s的杂原子的c1-c6杂环烷基、取代或未取代的c3-c6环烷基、取代或未取代的c1-c6亚烷基、取代或未取代的c2-c12亚烯基、取代或未取代的c2-c12亚炔基、取代或未取代的c6-c10芳基、取代或未取代的含1-3个选自n、o、s的杂原子的c5-c10杂芳基;所述取代指被选自下组的取代基取代:-(c1-c6亚烷基)-o-c(rfrgrh),其中,rf、rg、rh可相同或不同,分别独立地选自下组:取代或未取代的苯基,所述取代指被选自下组的取代基取代:c1-c6烷基、c1-c6烷氧基;
rd和re可相同或不同,分别独立地选自下组:取代或未取代的c1-c6烷基、取代或未取代的c1-c6烷氧基;
且在所述取代或未取代的c1-c6亚烷基中,所述取代指被如下基团取代:c1-c6烷基、c1-c6烷氧基、卤素。
在另一优选例中,r1为取代的含1个杂原子o的c3-c6杂环烷基,所述取代指被如下基团取代:-(c1-c6亚烷基)-o-(4,4'-双甲氧基三苯甲基);和/或
rd和re相同,且为异丙基。
在另一优选例中,ra和rb可相同或不同,分别独立地选自下组:h、-(c=o)苯基、c1-c3烷基、c1-c3卤代烷基。
在另一优选例中,所述卤素选自下组:f、cl、br、i、或其组合。
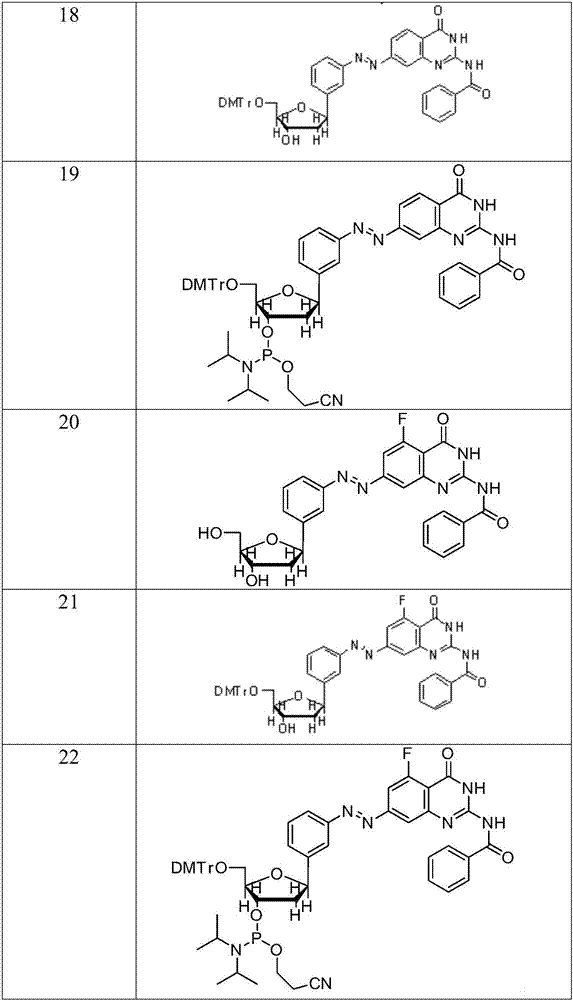
在另一优选例中,所述化合物选自下组:化合物6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21和22,
本发明的第二方面,提供了一种本发明第一方面所述化合物的制备方法,包括如下步骤:
1)将
且在步骤1)之后还任选地包括步骤:
2)将步骤1)所得产物与4,4'-双甲氧基三苯甲基氯反应,制得本发明第一方面所述化合物;
且在步骤2)之后还任选地包括步骤:
3)将步骤2)所得产物与氯代亚膦酰胺反应,获到本发明第一方面所述化合物,
其中,
本发明的第三方面,提供了一种本发明第一方面所述化合物的用途,用于制备含所述化合物的dna双链或rna双链的组合物。
在另一优选例中,当所述dna双链或rna双链处于关闭状态时,可通过uv照射实现对所述dna双链或所述rna双链的打开;和/或
当所述dna双链或rna双链处于打开状态时,所述控制通过可见光照射以实现对所述dna双链或所述rna双链的关闭。
本发明的第四方面,提供了一种非诊断性、非治疗性调节dna双链开关的方法,所述dna双链包含本发明第一方面所述化合物,通过光照刺激实现对所述dna双链的可逆开关的控制。
在另一优选例中,当所述dna双链处于关闭状态时,所述控制通过uv照射实现对所述dna双链的打开。
在另一优选例中,当所述dna双链处于打开状态时,所述控制通过可见光照射以实现对所述dna双链的关闭。
本发明的第五方面,提供了一种大分子材料,所述大分子材料包含本发明第一方面所述化合物或由本发明第一方面所述化合物构建而成。
在另一优选例中,所述大分子材料选自下组:核酸、多肽、聚合物。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1是常规含偶氮苯的核酸的示意图(图1a)和偶氮苯的顺反式转变(图1b)。
图2是天然碱基元素的结构示意图。
图3是偶氮苯碱基元素的结构示意图。
图4是偶氮苯的异构化控制碱基对之间的氢键配对。
图5是偶氮苯碱基元素主导分子内、分子间核酸双链的分离和闭合的示意图。
图6是含偶氮苯碱基元素的核酸azodnaiii在添加cdna或uv光照射前后荧光强度对比。
图7为含偶氮苯碱基元素的核酸在uv光、可见光多次循环照射下双链打开、闭合示意图。
具体实施方式
本发明人经过长期而深入的研究,通过调节含偶氮苯碱基元素的化合物的结构意外地制备得到一种结构更优、控制dna双链开关效果更佳的式i所示化合物及其制备方法和应用。在此基础上,发明人完成了本发明。
术语
如本文所用,“卤素”指f、cl、br、和i。
如本文所用,“c1-c6烷基”是指包括1-6个碳原子的直链或支链的烷基,例如甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、或类似基团。
如本文所用,“c1-c6烷氧基”包括1-6个碳原子的直链或支链的烷氧基。例如甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、异丁氧基、叔丁氧基、或类似基团。
在本发明中,术语“烷基”包括饱和或不饱和、直链、支链、环状的1-10个碳原子的全碳烷基或其中的1-3个碳原子被氧、氮、硫等杂原子取代的烷基,以及通过1个或1个以上碳原子连接的芳烷基。此外,所述的烷基是未取代的或取代的。
如本文所用,术语“芳基”包括稠合或非稠合的芳基,通常含有6-30个碳原子,代表性的芳基包括苯基、萘基,或含氧、氮、硫等杂原子的芳香基团。
在本发明中,“dmtr”指4,4'-双甲氧基三苯甲基。
式i化合物
本发明人经过广泛调研,发现现有技术未能有效控制核酸自组装的开关、并保持核酸结构的规整性。因此经过深入地研究,开发出了系列含偶氮苯碱基元素的化合物,完成了本发明。本发明首次将偶氮苯作为分子开关,与具有形成氢键、实现自组装功能的嘧啶环进行串联,设计出系列偶氮苯碱基元素azoa、azot、azoc、azog(见图3)。该新型碱基元素可通过有机合成,转换为相应化合物,合成具有光响应的功能性核酸、多肽以及聚合物。本发明揭示一类含偶氮苯碱基元素的dna合成试剂,使用这类化合物可在固相合成仪自动化合成相应的核酸;偶氮苯的顺反异构将直接开、关嘧啶环上的官能团参与形成的氢键,从而直接控制核酸双链的打开或闭合(见图4)。
具体地,本发明提供了一种含偶氮苯碱基元素的化合物,所述化合物具有式i所示结构:
其中,z选自下组:无、取代或未取代的核糖基、取代或未取代的脱氧核糖基、卤素、ora、nrarb;所述取代指被选自下组的基团取代:-o-p(nrdre)-o-(取代或未取代的c1-c6亚烷基)-cn、-(c1-c6亚烷基)-o-c(rfrgrh);其中,在-o-p(nrdre)-o-(取代或未取代的c1-c6亚烷基)-cn中,rd和re可相同或不同,分别独立地选自下组:c1-c6烷基、c1-c6烷氧基;且在所述取代或未取代的c1-c6亚烷基中,所述取代指被如下基团取代:c1-c6烷基、c1-c6烷氧基、卤素;在-(c1-c6亚烷基)-o-c(rfrgrh)中,rf、rg、rh可相同或不同,分别独立地选自下组:取代或未取代的苯基,所述取代指被选自下组的取代基取代:c1-c6烷基、c1-c6烷氧基;
ra和rb可相同或不同,分别独立地选自下组:h、取代或未取代的c1-c6烷基、取代或未取代的c1-c6烷氧基、取代或未取代的c3-c6环烷基、取代或未取代的c2-c12烯基、取代或未取代的c2-c12炔基、取代或未取代的含1-3个选自n、o、s的杂原子的c1-c6杂环烷基、-(c=o)苯基;rc选自下组:无、卤素、取代或未取代的c1-c6烷基、取代或未取代的c1-c6烷氧基、取代或未取代的c3-c6环烷基、取代或未取代的含1-3个选自n、o、s的杂原子的c1-c6杂环烷基;其中,所述取代指被选自下组的取代基取代:卤素。
在另一优选例中,所述化合物中,r1、r2、ra、rb、rc、rd、re、rf、rg、rh中任一个分别为实施例中所述具体化合物中所对应的基团。
在另一优选例中,所述化合物优选为实施例中所制备的化合物6-22。
在本发明中,所述化合物可用作固相合成试剂,合成得到含有偶氮苯碱基元素的寡聚核酸。
制备方法
下面更具体地描述本发明式i结构化合物的制备方法,但这些具体方法不对本发明构成任何限制。本发明化合物还可以任选将在本说明书中描述的或本领域已知的各种合成方法组合起来而方便地制得,这样的组合可由本发明所属领域的技术人员容易地进行。
典型地,本发明化合物的制备工艺流程如下,其中所用原料和试剂如无特殊说明,均可通过商业途径购买。
本发明还提供了一种所述化合物的制备方法,包括如下步骤:
1)将
且在步骤1)之后还任选地包括步骤:
2)将步骤1)所得产物与4,4'-双甲氧基三苯甲基氯反应,制得所述化合物;
且在步骤2)之后还任选地包括步骤:
3)将步骤2)所得产物与氯代亚膦酰胺反应,获到所述化合物,
其中,
应用
本发明还提供了一种所述化合物的用途,用于制备含所述化合物的dna双链或rna双链的组合物。
本发明还提供了一种非诊断性、非治疗性调节dna双链开关的方法,所述dna双链包含所述化合物,通过光照刺激实现对所述dna双链的可逆开关的控制。
本发明还提供了一种大分子材料,所述大分子材料包含所述化合物或由所述化合物构建而成。
在另一优选例中,所述大分子材料包括(但并不限于):核酸、多肽、聚合物。
与现有技术相比,本发明具有以下主要优点:
(1)所述化合物结构更优、控制dna双链开关效果更佳;
(2)所述化合物具有光响应特性,可用于构建光响应核酸的含偶氮苯碱基元素的化合物。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
实施例1化合物7的合成
化合物1的合成:
化合物s2(1,3-双(4-甲基苯甲酰基)-7-硝基喹唑啉-2,4(1h,3h)-二酮)的合成:
在化合物s1(2.07g,10.0mmol)与三乙胺(et3n,5ml)的无水dmf(80ml)0℃溶液中滴加入4-甲基苯甲酰氯(3.56g,23.0mmol)。添加完毕反应液回复到室温并继续搅拌30分钟。然后反应液在50℃下搅拌8小时,移除有机溶剂并将残余物溶解于二氯甲烷中,食盐水洗并干燥。移除有机相并将残渣用硅胶柱层析纯化得到白色固体化合物s2(5.50g,产率63%)
1hnmr(300mhz,cdcl3)δ8.45(d,j=8.4hz,1h),8.13(dd,j=8.4hz,j=2.1hz,1h),7.84-7.95(m,4h),7.29-7.36(m,4h),2.45(s,3h),2.43(s,3h);13cnmr(100mhz,cdcl3)δ168.18,166.70,159.68,152.30,148.14,147.79,147.39,139.49,131.25,131.12,130.91,130.60,130.29,128.83,128.56,119.38,118.87,111.10,22.25,22.17;ms(esi)m/z444.11[m+h]+.
化合物1(1,3-双(4-甲基苯甲酰基)-7-亚硝基喹唑啉-2,4(1h,3h)-二酮)的合成:
在化合物s2(4.40g,10mmol)与nh4cl(1.60g)的丙酮/水(9:1,45ml)溶液中分批缓慢加入锌粉(1.40g,21mmol)。反应通过薄层析板跟踪,反应完成后滤除固体,减压旋蒸除去溶剂,残渣重新溶解于二氯甲烷中。该二氯甲烷溶液用饱和nahco3水溶液与饱和食盐水洗,无水na2so4干燥。移除溶剂得到的s3作为粗产物直接用于下步反应:将该粗产物溶于乙醇中(6ml)并将该溶液滴加入到fecl3(9.6g)的水溶液(120ml)中。添加完毕后反应液在室温搅拌半小时,然后用乙酸乙酯(3x50ml)萃取,合并有机层并用饱和nahco3水溶液与饱和食盐水洗、无水na2so4干燥。移除溶剂,残渣经硅胶柱层析分离得到绿色固体化合物1(1.94g,两步的产率为45%)。
1hnmr(300mhz,cdcl3)δ8.52(d,j=8.4hz,1h),7.40(d,j=8.1hz,2h),7.87(d,j=8.4hz,2h),7.67-7.71(m,2h),7.27-7.36(m,4h),2.45(s,3h),2.43(s,3h);13cnmr(100mhz,cdcl3)δ168.52,167.02,163.37,160.39,148.05,148.03,147.36,140.31,131.72,131.19,130.96,130.62,130.32,129.05,128.70,118.81,114.60,109.62,22.25,22.18;ms(esi)m/z400.09[m+h]+.
化合物7的合成:
化合物3的合成:
将钯催化剂pd(oac)2(22mg,0.1mmol)与配体asph3(61mg,0.2mmol)的无水chcl3(20ml)溶液在氮气保护下搅拌30分钟。然后将化合物2(710mg,2.0mmol)与化合物s4(520mg,2.0mmol)的chcl3(20ml)溶液与et3n(2.0ml)加入到钯催化剂的溶液中。反应溶液在氮气保护下加热回流搅拌过夜,然后冷却到室温、滤除固体,滤液在减压蒸馏处理得到的固体经柱层析纯化得到油状化合物3(650mg,产率55%)。
1hnmr(300mhz,cdcl3)δ7.73-7.81(m,4h),7.33-7.53(m,9h),7.09-7.16(m,2h),6.76(d,j=7.5hz,1h),5.49-5.51(m,1h),4.72-4.74(m,1h),4.33-4.34(m,1h),3.83(m,2h),2.11(s,3h),1.08(s,9h);13cnmr(101mhz,cdcl3)δ168.52,150.92,143.19,138.24,136.09,135.59,131.64,130.44,130.27,129.24,128.14,128.01,123.30,119.96,118.94,103.11,84.80,83.62,62.89,26.63,24.70,19.47;ms(esi)m/z510.22[m+na]+.
化合物4的合成:
往化合物3(970mg,2.0mmol)的thf(40ml)溶液加入醋酸(1.2ml)和tbaf(1m,溶剂为thf,2.9ml)。反应混合物在0℃下搅拌1小时。然后用减压蒸馏移除溶剂,得到油状粗产品。该粗产品溶解于乙腈(20ml)和醋酸(10ml)的混合溶剂中并冷却到0℃。加入na(aco)3bh(650mg,3.0mmol)到该溶液,然后继续搅拌2小时。加入丙酮淬灭反应、然后移除溶剂。剩余的残渣经柱层析分离得到白色固体化合物4(410mg,两步的产率为82%)。
1hnmr(300mhz,cd3od)δ7.51(s,1h),7.45(d,j=8.1hz,1h),7.25(t,j=8.1hz,1h),7.10(d,j=8.1hz,1h),5.08(dd,j=10.5hz,5.4hz,1h),4.30(dt,j=6.0,1.8hz,1h),3.91-3.95(m,1h),3.61-3.66(m,2h),2.15-2.21(m,1h),2.09(s,3h),1.87-1.94(m,1h);13cnmr(101mhz,cd3od)δ170.44,142.93,138.67,128.57,121.65,119.11,117.58,87.98,80.19,73.21,62.92,43.63,22.67;ms(esi)m/z274.12[m+na]+.
化合物5的合成:
将化合物4(376mg,1.5mmol)用3m盐酸甲醇溶液溶解,并将该反应液回流反应1小时。然后慢慢加入nahco3以中和反应。然后移除溶解、残渣柱层析得到白色固体化合物5(292mg,产率93%)。
1hnmr(300mhz,cd3od)δ7.02(t,j=7.8hz,1h),6.57-6.74(m,3h),4.98(dd,j=10.5hz,5.1hz,1h),4.26(dt,j=6.0,1.8hz,1h),3.88-3.91(m,1h),3.58-3.63(m,2h),2.08-2.14(m,1h),1.83-1.93(m,1h);13cnmr(101mhz,cd3od)δ147.41,142.82,128.88,115.95,114.78,113.08,87.84,80.53,73.22,62.92,43.50;ms(esi)m/z232.11[m+na]+.
化合物6的合成:
将化合物5(210mg,1.0mmol)与化合物1(430mg,1mmol)溶解于无水干燥的醋酸(10ml)中,然后移除有机溶剂、残渣剩余物经柱层析纯化得到红色固体化合物6(464mg,产率75%)。
1hnmr(300mhz,cd3od)δ8.29(d,j=8.4hz,1h),7.69-7.99(m,7h)7.31-7.55(m,7h),5.14(dd,j=10.5hz,5.1hz,1h),4.27(dt,j=5.7,1.5hz,1h),3.91-3.95(m,1h),3.63-3.65(m,2h),2.39(s,3h),2.37(s,3h),2.17-2.23(m,1h),1.87-1.94(m,1h);13cnmr(101mhz,cdcl3)δ168.81,167.75,160.98,156.77,152.47,148.47,147.81,147.15,143.96,139.72,130.95,130.67,130.21,130.15,129.93,129.91,129.23,129.20,129.08,122.25,120.89,118.24,116.44,109.21,88.18,79.71,73.14,62.80,43.70,20.76,20.70;ms(esi)m/z641.21[m+na]+.
化合物s5的合成:
在化合物6(309mg,0.5mmol)的吡啶溶液中加入4,4'-双甲氧基三苯甲基氯(dmtrcl,186mg,0.55mmol),然后将反应液搅拌过夜。减压蒸馏除去吡啶,剩余固体柱层析分离得到化合物s5(360mg,产率79%)。
1hnmr(300mhz,丙酮-d6)δ8.28(d,j=8.4hz,1h),7.85-7.99(m,5h),7.81(d,j=8.1hz,1h),7.63(d,j=8.4hz,1h),7.18-7.55(m,16h),6.80(d,j=8.1hz,4h),5.22-5.28(m,1h),4.40-4.43(m,1h),4.06-4.12(m,1h),3.88(s,6h),3.26-3.32(m,2h),2.39(s,3h),2.37(s,3h),2.22-2.228(m,1h),2.01-2.10(m,1h);13cnmr(101mhz,cdcl3)δ168.88,167.57,160.85,158.65,156.99,152.55,148.23,147.55,147.00,145.00,143.78,139.64,136.20,136.17,131.11,130.94,130.46,130.28,130.21,129.47,129.36,129.00,128.36,128.05,126.99,122.91,121.15,118.21,116.02,113.33,110.56,86.78,86.49,79.70,74.86,64.64,55.43,44.23,22.25,22.19;ms(esi)m/z943.33[m+na]+.
化合物7的合成:
将化合物s5(276mg,0.30mmol)溶解于无水二氯甲烷(3ml)中,在该0℃溶液中相继加入二异丙基乙基胺、氯代亚膦酰胺(78mg,0.33mmol)。添加完毕反应液升到室温继续反应1小时,然后加入20ml二氯甲烷。溶液分别用饱和nahco3溶液与食盐水洗并用na2so4干燥,移除溶剂得到的固体进一步柱层析纯化得到红色泡沫状固体7(285mg,产率85%)。
1hnmr(300mhz,cdcl3)δ8.30(d,j=8.4hz,1h),8.03(s,1h),7.60-7.95(m,5h),7.36-7.62(m,6h),7.15-7.55(m,11h),6.78(d,j=8.1hz,4h),5.22-5.27(m,1h),4.50-4.52(m,1h),4.21-4.26(m,1h),3.88(s,6h),3.56-3.83(m,4h),3.20-3.40(m,2h),2.52-2.58(m,1h),2.40-2.51(m,8h),2.02-2.22(m,1h),1.01-1.21(m,12h);31pnmr(cdcl3)δ:149.01,149.13.
实施例2化合物10的合成
化合物8的合成:
将化合物5(210mg,1.0mmol)与化合物s6(442mg,1mmol)溶解于无水干燥的醋酸(10ml)中,然后移除有机溶剂、残渣剩余物经柱层析纯化得到红色固体化合物8(473mg,产率78%)。
1hnmr(300mhz,cd3od)δ8.46(d,j=8.6hz,1h),7.91-7.99(m,6h)7.41-7.75(m,7h),5.14(dd,j=10.5hz,5.1hz,1h),4.27(dt,j=5.7,1.5hz,1h),3.91-3.95(m,1h),3.63-3.65(m,2h),2.48(s,3h),2.39(s,3h),2.37(s,3h),2.17-2.23(m,1h),1.87-1.94(m,1h);13cnmr(101mhz,cdcl3)δ168.81,167.75,160.98,156.77,152.47,148.47,147.81,147.15,143.96,139.72,130.95,130.67,130.21,130.15,129.93,129.91,129.23,129.20,129.08,122.25,120.89,118.24,116.44,109.21,88.18,79.71,73.14,62.80,43.70,20.76,20.70;ms(esi)m/z633.23[m+h]+.
化合物9的合成:
在化合物8(315mg,0.5mmol)的吡啶溶液中加入dmtrcl(186mg,0.55mmol),然后将反应液搅拌过夜。减压蒸馏除去吡啶,剩余固体柱层析分离得到化合物9(359mg,产率75%)。
1hnmr(300mhz,丙酮-d6)δ8.46(d,j=8.6hz,1h),7.91-7.99(m,4h),7.81(d,j=8.1hz,1h),7.63(d,j=8.4hz,1h),7.18-7.55(m,16h),6.80(d,j=8.1hz,4h),5.22-5.28(m,1h),4.40-4.43(m,1h),4.06-4.12(m,1h),3.88(s,6h),3.26-3.32(m,2h),2.48(s,3h),2.39(s,3h),2.37(s,3h),2.22-2.228(m,1h),2.01-2.10(m,1h);13cnmr(101mhz,cdcl3)δ168.88,167.57,160.85,158.65,156.99,152.55,148.23,147.55,147.00,145.00,143.78,139.64,136.20,136.17,131.11,130.94,130.46,130.28,130.21,129.47,129.36,129.00,128.36,128.05,126.99,122.91,121.15,118.21,116.02,113.33,110.56,86.78,86.49,79.70,74.86,64.64,55.43,44.23,22.25,22.19;ms(esi)m/z935.35[m+h]+.
化合物10的合成:
将化合物9(279mg,0.30mmol)溶解于无水二氯甲烷(3ml)中,在该0℃溶液中相继加入二异丙基乙基胺、氯代亚膦酰胺(78mg,0.33mmol)。添加完毕反应液升到室温继续反应1小时,然后加入20ml二氯甲烷。溶液分别用饱和nahco3溶液与食盐水洗并用na2so4干燥,移除溶剂得到的固体进一步柱层析纯化得到红色泡沫状固体10(281mg,产率83%)。
1hnmr(300mhz,cdcl3)δ8.46(d,j=8.6hz,1h),8.03(s,1h),7.64-7.98(m,4h),7.36-7.62(m,6h),7.15-7.55(m,11h),6.78(d,j=8.1hz,4h),5.22-5.27(m,1h),4.50-4.52(m,1h),4.21-4.26(m,1h),3.88(s,6h),3.56-3.83(m,4h),3.20-3.40(m,2h),2.52-2.58(m,1h),2.48(s,3h),2.30-2.41(m,8h),2.02-2.22(m,1h),1.01-1.21(m,12h);31pnmr(cdcl3)δ:149.01,149.13.
实施例3化合物13的合成
化合物11的合成:
将化合物5(420mg,2.0mmol)与化合物s7(556mg,2mmol)溶解于无水干燥的醋酸(20ml)中,然后移除有机溶剂、残渣剩余物经柱层析纯化得到红色固体化合物11(760mg,产率81%)。
1hnmr(300mhz,cd3od)δ8.68(d,j=8.8hz,1h),8.49(d,j=8.6hz,1h),8.03-8.25(m,4h)7.56-7.99(m,7h),5.14(dd,j=10.5hz,5.1hz,1h),4.27(dt,j=5.7,1.5hz,1h),3.81-3.85(m,1h),3.53-3.55(m,2h),2.47-2.43(m,1h),2.01-2.08(m,1h);13cnmr(101mhz,cdcl3)δ169.89,164.75,157.88,156.37,152.57,150.27,139.41,134.15,132.16,130.32,128.87,128.85,128.81,127.55,127.53,123.61,123.13,120.80,120.48,120.25,118.49,88.44,83.54,71.91,61.65,61.63,43.8;ms(esi)m/z420.19[m+h]+.
化合物12的合成:
在化合物11(470mg,1.0mmol)的吡啶溶液中加入dmtrcl(380mg,1.10mmol),然后将反应液搅拌过夜。减压蒸馏除去吡啶,剩余固体柱层析分离得到化合物12(632mg,产率82%)。
1hnmr(300mhz,丙酮-d6)δ8.69(d,j=8.8hz,1h),8.49(d,j=8.6hz,1h),8.03-8.25(m,4h),7.56-7.99(m,7h),6.92-7.38(m,13h),5.14(dd,j=10.5hz,5.1hz,1h),4.27(dt,j=5.7,1.5hz,1h),3.91-3.95(m,1h),3.83(s,6h),3.53-3.55(m,2h),2.47-2.43(m,1h),2.01-2.08(m,1h);13cnmr(101mhz,cdcl3)δ169.89,164.75,158.16,158.16,157.88,156.37,152.57,150.27,143.92,139.41,136.20,136.20,134.15,132.16,130.32,129.26,129.26,128.87,128.85,128.81,127.55,127.53,127.50,127.50,127.50,127.50,127.50,127.50,126.21,123.61,123.13,120.80,120.48,120.25,118.49,114.80,114.80,114.80,114.80,88.44,83.54,71.91,61.65,61.63,55.81,55.81,43.8;ms(esi)m/z794.31[m+na]+.
化合物13的合成:
将化合物12(386mg,0.50mmol)溶解于无水二氯甲烷(6ml)中,在该0℃溶液中相继加入二异丙基乙基胺、氯代亚膦酰胺(128mg,0.53mmol)。添加完毕反应液升到室温继续反应1小时,然后加入20ml二氯甲烷。溶液分别用饱和nahco3溶液与食盐水洗并用na2so4干燥,移除溶剂得到的固体进一步柱层析纯化得到红色泡沫状固体13(402mg,产率83%)。
1hnmr(300mhz,cdcl3)δ8.69(d,j=8.8hz,1h),8.49(d,j=8.6hz,1h),8.03-8.25(m,4h),7.56-7.99(m,7h),6.92-7.38(m,13h),5.14(dd,j=10.5hz,5.1hz,1h),4.27(dt,j=5.7,1.5hz,1h),3.91-3.95(m,1h),3.83(s,6h),3.90-3.98(m,4h),3.53-3.55(m,2h),2.91-2.99(m,2h),2.47-2.43(m,1h),2.01-2.08(m,1h),1.01-1.21(m,12h);31pnmr(cdcl3)δ:149.03,149.14.
实施例4化合物16的合成
化合物14的合成:
将化合物5(210mg,1.0mmol)与化合物s8(294mg,1mmol)溶解于无水干燥的醋酸(10ml)中,然后移除有机溶剂、残渣剩余物经柱层析纯化得到红色固体化合物14(383mg,产率79%)。
1hnmr(300mhz,cd3od)δ8.55(d,j=8.4hz,1h),7.99-8.03(m,4h)7.56-7.99(m,7h),5.14(dd,j=10.5hz,5.1hz,1h),4.27(dt,j=5.7,1.5hz,1h),3.81-3.85(m,1h),3.53-3.55(m,2h),2.47-2.43(m,1h),2.01-2.08(m,1h);13cnmr(101mhz,cdcl3)δ169.29,161.75,154.88,152.37,151.57,150.27,139.41,134.15,132.16,130.32,128.87,128.85,128.81,127.55,127.53,123.61,123.13,120.80,120.48,120.25,118.49,88.44,83.54,71.91,61.65,61.63,43.8;ms(esi)m/z508.21[m+na]+.
化合物15的合成:
在化合物14(243mg,0.5mmol)的吡啶溶液中加入dmtrcl(186mg,0.55mmol),然后将反应液搅拌过夜。减压蒸馏除去吡啶,剩余固体柱层析分离得到化合物15(322mg,产率82%)。
1hnmr(300mhz,丙酮-d6)δ8.55(d,j=8.4hz,1h),7.99-8.03(m,4h),7.56-7.99(m,7h),6.92-7.38(m,13h),5.14(dd,j=10.5hz,5.1hz,1h),4.27(dt,j=5.7,1.5hz,1h),3.91-3.95(m,1h),3.83(s,6h),3.53-3.55(m,2h),2.47-2.43(m,1h),2.01-2.08(m,1h);13cnmr(101mhz,cdcl3)δ169.29,161.75,158.16,158.16,156.88,154.37,152.37,150.27,143.92,139.41,136.20,136.20,134.15,132.16,130.32,129.26,129.26,128.87,128.85,128.81,127.55,127.53,127.50,127.50,127.50,127.50,127.50,127.50,126.21,123.61,123.13,120.80,120.48,120.25,118.49,114.80,114.80,114.80,114.80,88.44,83.54,71.91,61.65,61.63,55.81,55.81,43.8;ms(esi)m/z810.30[m+na]+.
化合物16的合成:
将化合物15(393mg,0.50mmol)溶解于无水二氯甲烷(5ml)中,在该0℃溶液中相继加入二异丙基乙基胺、氯代亚膦酰胺(128mg,0.53mmol)。添加完毕反应液升到室温继续反应1小时,然后加入20ml二氯甲烷。溶液分别用饱和nahco3溶液与食盐水洗并用na2so4干燥,移除溶剂得到的固体进一步柱层析纯化得到红色泡沫状固体16(410mg,产率82%)。
1hnmr(300mhz,cdcl3)δ8.55(d,j=8.4hz,1h),7.99-8.03(m,4h),7.56-7.99(m,7h),6.92-7.38(m,13h),5.14(dd,j=10.5hz,5.1hz,1h),4.27(dt,j=5.7,1.5hz,1h),3.91-3.95(m,1h),3.83(s,6h),3.90-3.98(m,4h),3.53-3.55(m,2h),2.91-2.99(m,2h),2.47-2.43(m,1h),2.01-2.08(m,1h),1.01-1.21(m,12h);31pnmr(cdcl3)δ:149.01,149.13.
实施例5化合物19的合成
化合物17的合成:
将化合物5(210mg,1.0mmol)与化合物s9(294mg,1mmol)溶解于无水干燥的醋酸(10ml)中,然后移除有机溶剂、残渣剩余物经柱层析纯化得到红色固体化合物17(364mg,产率75%)。
1hnmr(300mhz,cd3od)δ7.99-8.03(m,4h),7.91(d,j=8.2hz,1h),7.56-7.90(m,7h),5.14(dd,j=10.5hz,5.1hz,1h),4.27(dt,j=5.7,1.5hz,1h),3.81-3.85(m,1h),3.53-3.55(m,2h),2.47-2.43(m,1h),2.01-2.08(m,1h);13cnmr(101mhz,cdcl3)δ167.89,161.75,156.88,156.37,152.57,150.27,139.41,134.15,132.16,130.32,128.87,128.85,128.81,127.55,127.53,123.61,123.13,120.80,120.48,120.25,118.49,88.44,83.54,71.91,61.65,61.63,43.8;ms(esi)m/z508.17[m+na]+.
化合物18的合成:
在化合物17(243mg,0.5mmol)的吡啶溶液中加入dmtrcl(186mg,0.55mmol),然后将反应液搅拌过夜。减压蒸馏除去吡啶,剩余固体柱层析分离得到化合物18(314mg,产率80%)。
1hnmr(300mhz,丙酮-d6)δ7.99-8.03(m,4h),7.91(d,j=8.2hz,1h),7.56-7.90(m,7h),6.92-7.38(m,13h),5.14(dd,j=10.5hz,5.1hz,1h),4.27(dt,j=5.7,1.5hz,1h),3.91-3.95(m,1h),3.83(s,6h),3.53-3.55(m,2h),2.47-2.43(m,1h),2.01-2.08(m,1h);13cnmr(101mhz,cdcl3)δ167.29,161.75,158.16,158.16,156.88,154.37,152.37,150.27,143.92,139.41,136.20,136.20,134.15,132.16,130.32,129.26,129.26,128.87,128.85,128.81,127.55,127.53,127.50,127.50,127.50,127.50,127.50,127.50,126.21,123.61,123.13,120.80,120.48,120.25,118.49,114.80,114.80,114.80,114.80,88.44,83.54,71.91,61.65,61.63,55.81,55.81,43.8;ms(esi)m/z800.30[m+na]+.
化合物19的合成:
将化合物18(236mg,0.30mmol)溶解于无水二氯甲烷(6ml)中,在该0℃溶液中相继加入二异丙基乙基胺、氯代亚膦酰胺(78mg,0.33mmol)。添加完毕反应液升到室温继续反应1小时,然后加入20ml二氯甲烷。溶液分别用饱和nahco3溶液与食盐水洗并用na2so4干燥,移除溶剂得到的固体进一步柱层析纯化得到红色泡沫状固体19(260mg,产率88%)。
1hnmr(300mhz,cdcl3)δ7.99-8.03(m,4h),7.91(d,j=8.2hz,1h),7.56-7.90(m,7h),6.92-7.38(m,13h),5.14(dd,j=10.5hz,5.1hz,1h),4.27(dt,j=5.7,1.5hz,1h),3.91-3.95(m,1h),3.83(s,6h),3.90-3.98(m,4h),3.53-3.55(m,2h),2.91-2.99(m,2h),2.47-2.43(m,1h),2.01-2.08(m,1h),1.01-1.21(m,12h);31pnmr(cdcl3)δ:149.01,149.13.
实施例6化合物22的合成
化合物20的合成:
将化合物5(210mg,1.0mmol)与化合物s10(442mg,1mmol)溶解于无水干燥的醋酸(10ml)中,然后移除有机溶剂、残渣剩余物经柱层析纯化得到化合物20(365mg,产率72%)。
1hnmr(300mhz,cd3od)δ7.99-8.03(m,4h),7.91(d,j=8.2hz,1h),7.56-7.90(m,6h),5.14(dd,j=10.5hz,5.1hz,1h),4.27(dt,j=5.7,1.5hz,1h),3.81-3.85(m,1h),3.53-3.55(m,2h),2.47-2.43(m,1h),2.01-2.08(m,1h);13cnmr(101mhz,cdcl3)δ167.89,161.75,156.88,156.37,152.57,150.27,139.41,134.15,132.16,130.32,128.80,128.80,128.80,127.55,127.53,123.61,123.13,120.80,120.48,120.25,118.49,88.44,83.54,71.91,61.65,61.63,43.8;ms(esi)m/z526.16[m+na]+.
化合物21的合成:
在化合物20(252mg,0.5mmol)的吡啶溶液中加入dmtrcl(186mg,0.55mmol),然后将反应液搅拌过夜。减压蒸馏除去吡啶,剩余固体柱层析分离得到化合物21(360mg,产率79%)。
1hnmr(300mhz,丙酮-d6)δ7.99-8.03(m,4h),7.91(d,j=8.2hz,1h),7.56-7.90(m,6h),6.92-7.38(m,13h),5.14(dd,j=10.5hz,5.1hz,1h),4.27(dt,j=5.7,1.5hz,1h),3.91-3.95(m,1h),3.83(s,6h),3.53-3.55(m,2h),2.47-2.43(m,1h),2.01-2.08(m,1h);13cnmr(101mhz,cdcl3)δ167.29,161.75,158.16,158.16,156.88,154.37,152.37,150.27,143.92,139.41,136.20,136.20,134.15,132.16,130.32,129.26,129.26,128.87,128.85,128.81,127.55,127.53,127.50,127.50,127.50,127.50,127.50,127.50,126.21,123.61,123.13,120.80,120.48,120.25,118.49,114.80,114.80,114.80,114.80,88.44,83.54,71.91,61.65,61.63,55.81,55.81,43.8;ms(esi)m/z828.29[m+na]+.
化合物22的合成:
将化合物21(245mg,0.30mmol)溶解于无水二氯甲烷(5ml)中,在该0℃溶液中相继加入二异丙基乙基胺、氯代亚膦酰胺(78mg,0.33mmol)。添加完毕反应液升到室温继续反应1小时,然后加入20ml二氯甲烷。溶液分别用饱和nahco3溶液与食盐水洗并用na2so4干燥,移除溶剂得到的固体进一步柱层析纯化得到红色泡沫状固体化合物22(258mg,产率86%)。
1hnmr(300mhz,cdcl3)δ7.99-8.03(m,4h),7.91(d,j=8.2hz,1h),7.56-7.90(m,6h),6.92-7.38(m,13h),5.14(dd,j=10.5hz,5.1hz,1h),4.27(dt,j=5.7,1.5hz,1h),3.91-3.95(m,1h),3.83(s,6h),3.90-3.98(m,4h),3.53-3.55(m,2h),2.91-2.99(m,2h),2.47-2.43(m,1h),2.01-2.08(m,1h),1.01-1.21(m,12h);31pnmr(cdcl3)δ:149.01,149.13.
实施例7含偶氮苯碱基元素的核酸的合成、表征
为很好地说明偶氮苯碱基元素的性质,为这类新材料的使用提供参考依据,必要的表征很重要。我们设计并合成了系列含偶氮苯碱基元素的核酸,它们可能形成分子内双链或分子间双链结构,这种双链的形成与打开,可通过偶氮苯的异构化进行控制。
仪器信息:核酸的合成是应用abi394dna/rna合成仪,熔点的测试是由装有sybrgreen探头的实时pcr仪(7500,appliedbiosystems)与cary100uv-vis分光光度计完成,荧光试验是通过rf-5301-pc荧光分光光度计(shimadzu,japan)完成的,用于偶氮苯碱基元素光响应异构试验的光源为便携式6wuv灯以及白炽灯。
相关核酸的序列如表1所示:
表1
表1中,azog代表从化合物19合成得到的相应偶氮苯碱基元素;azot代表从化合物7合成得到的相应偶氮苯碱基元素;azoa代表从化合物13合成得到的相应偶氮苯碱基元素;azoc代表从化合物16合成得到的相应偶氮苯碱基元素。fam是一种荧光基团,dabcyl是荧光淬灭基团,当该二者距离接近,核酸分子的荧光信号弱,当距离变远,荧光信号增强。因此,应用相应的荧光信号变化可直观表征双链的打开与闭合。
上述核酸是用固相合成仪合成的、后处理脱保护、hplc纯化处理,即得到相应的核酸产品。
相关核酸的热力学稳定性试验结果如表2所示:
表2dna双链的熔点温度(tm)a
a条件:2μmdna,100mmnacl,10mmmgcl2,10mmpipes,ph7.0;
dna双链的熔点温度是指在溶液中双链分开变成单链的临界温度。上述试验结果证明,含偶氮苯碱基元素azog的化合物可与天然碱基c形成碱基对(azog-c,条目1,2,3)、含偶氮苯碱基元素azot的化合物可与天然碱基a形成碱基对(azot-a,条目8,9,10)、含偶氮苯碱基元素azoa的化合物可与天然碱基t形成碱基对(azoa-t,条目12)含偶氮苯碱基元素azog的化合物可与天然碱基c形成碱基对(azoc-g,条目13),并进而形成双链结构。与天然的碱基比较(条目6,7),这种偶氮苯碱基具有更大的共轭平面,因此从熔点判断,这种双链更稳定。
序列表里的odn13可通过偶氮苯碱基元素azog与天然碱基c形成碱基对,因此形成分子内双链----类似发夹的纳米结构。这一结构也通过荧光试验得到证实:加入与该发夹结构序列互补的cdna的前后(azodnaiii与azodnaiii+cdna,参见图6),荧光吸收发生显著变化,这证明了分子内azog-c配对的双链结构。
此外,从图5可以看出:偶氮苯碱基配对的双链不仅可以通过加热的方式、链置换的方式(加入cdna)打开,它也可以通过光照的方式控制双链的开、合。
通过进行光照试验,我们发现azog-c配对的双链结构可用光控打开(azodnaiii-uv),参见图6。我们进一步的试验发现,这种通过光控方式打开、闭合双链可以实现多次循环式控制,是可逆的过程(参见图7)。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!