人胚胎干细胞的悬浮培养物的制作方法
其它专利申请
本申请要求2005年6月22日提交的ussn60/693,266的优先权。
背景
再生医学益于关于各种类型祖细胞的分离、培养和使用的最新研究进展。本
技术实现要素:
进一步提高了人多能干细胞和其衍生物的商业开发水平。
胚胎干细胞有两种非常特殊的特性:第一,与其它正常的哺乳动物细胞类型不同,它们可以无限地培养增殖,供应量基本不受限制。第二,可用它们产生各种感兴趣的组织类型,从而用作组织治疗或用于药物筛选所用的替代细胞和组织的来源。
thomson等(美国专利5,843,780;proc.natl.acad.sci.usa92:7844,1995)首先成功分离并增殖了灵长动物的多能干细胞。他们随后由人胚泡产生了人胚胎干(hes)细胞系(science282:114,1998)。gearhart和同事们由胎儿性腺组织产生人胚胎生殖(heg)细胞系(shamblott等,proc.natl.acad.sci.usa95:13726,1998;和美国专利6,090,622)。hes和heg细胞都具有多能干细胞的长期寻求的特征:它们可无限培养而不分化,它们具有正常的核型,它们能够产生许多种重要的细胞类型。
将多能干细胞用于治疗的主要挑战是通常将它们培养在一层饲养细胞上以防止分化(美国专利5,843,780;美国专利6,090,622)。按照thomson等(science282:114,1998),在没有饲养细胞的情况下培养的hps细胞很快死亡,或分化成定型细胞的异源群体。白血病抑制因子(lif)能抑制小鼠es细胞的分化,但它不会代替饲养细胞在防止人es细胞分化中的作用。
美国专利6,800,480(杰龙公司(geroncorp.))发明名称为“用于培养灵长动物衍生的原代干细胞的方法和材料”(methodsandmaterialsforthegrowthofprimate-derivedprimordialstemcells)。国际专利公开wo01/51616(杰龙公司)发明名称为“培养和分化人多能干细胞的技术”(techniquesforgrowthanddifferentiationofhumanpluripotentcells)。xu等的文章(naturebiotechnology19:971,2001)题为“不用饲养细胞来培养未分化的人胚胎干细胞”(feeder-freegrowthofundifferentiatedhumanembryostemcells)。lebkowski等的文章(cancerj.7增刊2:s83,2001)题为“人胚胎干细胞:培养、分化和遗传修饰以用于再生医学应用”(humanembryonicstemcells:culture,differentiation,andgeneticmodificationforregenerativemedicineapplications)。国际专利公开wo03/020920发明名称为“用于快速扩增人胚胎干细胞的培养系统”(culturesystemforrapidexpansionofhumanembryonicstemcells)。li等的文章(biotechnologyandbioengineering,在线公开日期:2005年6月21日)题为“人胚胎干细胞的扩增”(expansionofhumanembryonicstemcells)。这些出版物报道了用于以未分化状态增殖胚胎干细胞的示范性培养试剂和技术,以及它们在制备用于人类治疗的细胞中的应用。
以下章节提供的信息进一步发展了hes细胞培养的内容,将有助于培养和操作未分化的多能干细胞,并且帮助实现胚胎细胞治疗的全部商业潜能。
发明概述
本发明提供了用于培养和增殖灵长动物多能干(hes)细胞的改进系统。本发明的悬浮培养系统使得使用者能够以快速和体积-有效(volume-efficient)的方式产生用于治疗和药物发现的高质量胚胎干细胞。
本发明一方面是悬浮培养人胚胎干(hes)细胞,其中hes细胞基本未分化。该培养物可含有以下一种或多种物质:高浓度的成纤维细胞生长因子,其它培养基添加剂如tgfβ、干细胞因子(scf)或flt3配体(flt3l),一种或多种可溶性或悬浮性胞外基质组分如层粘连蛋白和/或纤连蛋白,或者任选为多孔性或被胞外基质包被的各种类型的固体微粒。
本发明另一方面是培养hes细胞的方法,所述方法包括:将所述细胞悬浮于营养培养基中;用上述系统培养时维持所述细胞为悬浮状态;定期更换培养基;任选地,不时将培养物分瓶培养,以降低细胞密度;最后收获培养物中的细胞。
本发明另一方面是悬浮培养hes细胞的系统或试剂盒,其包括已经提到或以下描述的一种或多种组分。
通过以下说明可以明白本发明的这些和其它方面。
附图
图1显示了用补充有生长因子的非条件培养基在固体表面上传代六次之后的hes细胞集落。(a)mef条件es培养基(对照)+bfgf(8ng/ml);(b)x-vivotm10+bfgf(40ng/ml);(c)x-vivotm10+bfgf(40ng/ml)+干细胞因子(scf,青灰因子)(15ng/ml);(d)x-vivotm10+bfgf(40ng/ml)+flt3配体(75ng/ml);(e)qbsftm-60+bfgf(40ng/ml)。可采用所有三种基础培养基(es培养基、x-vivotm10和qbsftm-60)以无饲养细胞的培养方式扩增hes细胞。在这种情况下,用(c)所示组合条件培养的细胞每代扩增8.2倍,而用条件培养基培养的细胞扩增2.2倍。
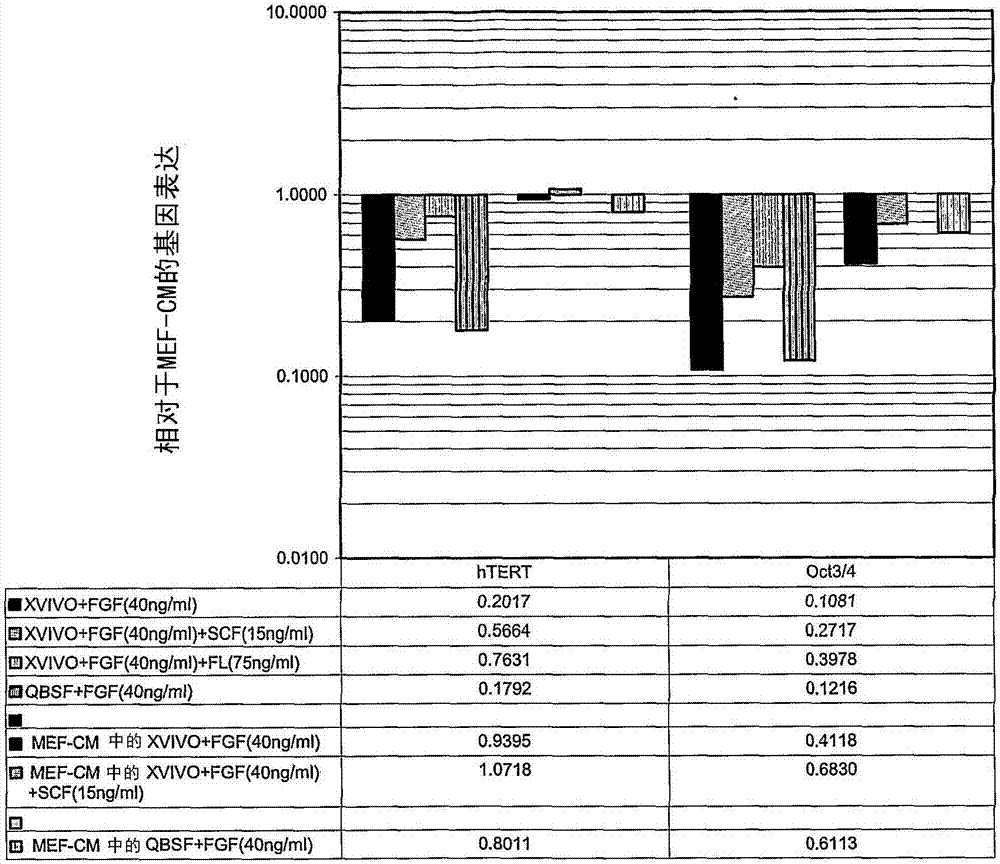
图2显示了经实时rt-pcr测定的htert和oct3/4的基因表达概况,如实施例1所述。
图3证明,用非条件培养基培养的细胞保持了它们的多能性。用mef条件培养基或含有bfgf和scf的非条件x-vivotm10培养基将hes细胞传代7次。然后,使细胞分化成胚状体,平板培养,用免疫细胞化学方法分析分别代表三个胚层的表型标记物。对细胞中的甲胎蛋白(代表内胚层);肌动蛋白(代表中胚层)和β-微管蛋白iii(代表外胚层)进行染色。
图4显示了在旋转培养瓶中悬浮培养的hes细胞的细胞计数(实施例3)。建立培养物后,细胞继续以相同密度生长(上图)。重新接种到标准表面进行培养时,它们恢复为未分化表型的典型形态:即具有经典hes细胞形态的独立细胞集落(下图)。
图5获自以下实验:使悬浮培养的细胞(图4)分化成胚状体、平板培养,然后通过免疫细胞化学分析具体的细胞类型(上面一列)。也显示了完全通过标准表面培养方法维持的细胞(下面一列)。悬浮培养的细胞保持了全部多能性,这证明悬浮培养系统在维持未分化hes细胞的重要特性方面的有效性。
图6显示了用旋转培养瓶培养的另一悬浮培养物的细胞计数。
图7显示了在振荡装置上悬浮培养的不同hes细胞系的细胞。4周后,将细胞重新接种到固体表面上,显示出经典的未分化hes细胞形态,如图所示。继续以此方式进行培养3个月以上,显示悬浮培养的细胞大量增殖。
详述
培养灵长动物多能干(hes)细胞的现有技术包括在固体表面:即成纤维细胞饲养细胞(美国专利6,200,806)或胞外基质(美国专利6,800,480)上培养。可优化无饲养细胞的技术,以便快速扩增(wo03/020920),大大降低为商业目的生产hes细胞的成本。
下述信息提供了进一步发展了hes细胞培养技术的新型系统。具体说,这种培养的生产能力不再受培养表面的二维大小的限制,能够更充分地利用整个培养容器的三维空间。已经确定了能够将hes细胞悬浮培养三个月以上(实施例4)的培养条件。悬浮培养的hes细胞维持了未分化细胞的表型特征,并且维持了分化成代表三种胚层中任意一种的组织类型的全部潜能(实施例3)。
在三维空间中培养hes细胞的能力使得hes细胞的累积(bulkingup)成为一种更加节省成本的工艺,并且提供了更多的优化hes细胞培养物的生产能力和生长速率的机会。采用悬浮培养物也有助于将hes细胞培养方法适应于封闭系统,其中以无菌方式将细胞和培养基引入该系统并从该系统中回收,但该系统也可在稍宽松的环境下运行。
从以下章节应能理解本发明的其它优点。
定义
原型“灵长动物多能干细胞”(pps细胞)是衍生自受精后任何时间的胚前、胚胎或胎儿组织的多能细胞,它们具有能够在正确条件下产生几种不同细胞类型的后代的特征。按照标准技术-接受的监测,pps细胞能够产生作为三个胚层(内胚层、中胚层和外胚层)各自的衍生物的后代,如能够在合适宿主中形成畸胎瘤,或能够分化成具有所培养的所有三个胚层的组织类型的标记物的细胞。
pps细胞的定义包括各种类型的胚胎细胞如hes细胞(定义如下);来自其它灵长动物的胚胎干细胞如猕猴或狨干细胞(thomson等,proc.natl.acad.sci.usa92:7844,1995;developmentalbiology38:133,1998);和人胚胎生殖(heg)细胞(shamblott等,proc.natl.acad.sci.usa95:13726,1998)。该术语也包括其它类型的多能细胞。也包括能够产生作为所有三个胚层的衍生物的后代的灵长动物来源的任何细胞。宜采用核型正常并且不是恶性肿瘤来源的pps细胞。
“人胚胎干细胞”(hes细胞),除非另有明确说明,该术语包括具有hes细胞表型特征的已建立的谱系,以及该谱系仍然能够产生三个胚层各自后代的衍生物。
当群体中大部分干细胞和其衍生物显示出未分化细胞的形态学特征、能够将它们与胚胎或成年人来源的分化细胞明确区分开时,将hes细胞培养物称为“未分化”。本领域技术人员不难辨识未分化的hes细胞,在二维的显微镜视野下,这种细胞一般呈现出高核/质比和明显的核仁。应理解,群体中未分化细胞的集落周围常常环绕着已分化的邻近细胞。然而,在合适条件下培养或传代时未分化的集落持续存在,细胞群体中的大部分是单个未分化细胞。以发展的观点看,基本未分化的培养物含有至少20%未分化的hes细胞,并可含有至少40%、60%或80%以提高优选性(以未分化的基因型相同的细胞的百分数计)。
本文中称培养物或细胞群体为“未分化”地增殖时,指增殖后,按照上述定义其组成为基本未分化。以与起始培养物相同的汇合度评价时,增殖至少四代(翻~20倍)而未分化的群体含有基本相同比例的未分化细胞(或者可能是更高比例的未分化细胞)。
“营养培养基”是含有促进增殖的营养物的细胞培养介质。营养培养基一般含有等渗盐水、缓冲液、蛋白质来源(一种或多种添加的蛋白质或氨基酸的形式)和(可能)其它外部添加的营养物和生长因子。
通过在培养基中培养第一细胞群体、然后收获该培养基制备“条件培养基”。然后,可利用条件培养基(以及细胞分泌到培养基中的任何物质)支持第二细胞群体的生长。描述已将某具体成分或因子加入培养基时,指已通过有意操作将该因子(或经工程改造能分泌该因子的细胞或颗粒)混入培养基中。
“新鲜培养基”是用于最终设计用来支持的细胞类型之前未与不同细胞类型一起培养而未被有目的地条件化的培养基。另外,不应对制备、储存或使用方式进行任何限制。将其新鲜加入(通过交换或输注)最终培养物,在培养物中该培养基被存在的细胞类型消耗或加工。
普通技术
分子遗传学和遗传工程中的普通方法参见当前版本的《分子克隆:实验室手册》(molecularcloning:alaboratorymanual)(sambrook等,冷泉港(coldspringharbor));《哺乳动物细胞的基因转移载体》(genetransfervectorsformammaliancells)(miller和calos编);和《新编分子生物学实验指南》(currentprotocolsinmolecularbiology)(f.m.ausubel等编,威利公司(wiley&sons))。细胞生物学、蛋白质化学和抗体技术可参见《新编蛋白质科学实验指南》(currentprotocolsinproteinscience)(j.e.colligan等编,威利公司);《新编细胞生物学实验指南》(currentprotocolsincellbiology)(j.s.bonifacino等,威利公司)和《新编免疫学实验指南》(currentprotocolsinimmunology)(j.e.colligan等编,威利公司)。本发明中提到的用于遗传操作的试剂、克隆载体和试剂盒可购自生产商如伯乐公司(biorad)、司查塔基公司(stratagene)、英杰公司(invitrogen)、克隆泰克公司(clontech)和西格马-奥德里奇公司(sigma-aldrichco.)。
细胞培养方法通常参见当前版本的《动物细胞培养:基本技术手册》(cultureofanimalcells:amanualofbasictechnique)(r.i.freshney编,威利公司);《普通细胞培养技术》(generaltechniquesofcellculture)(m.a.harrison和i.f.rae,剑桥大学出版社(cambridgeuniv.press))和《胚胎干细胞:方法和实验方案》(embryonicstemcells:methodsandprotocols)(k.turksen编,休曼出版社(humanapress))。其它感兴趣的参考文献包括《我们做培养》(cultureisourbusiness)(m.mcluhan,巴拉汀书局(ballantinebooks),1970);和《理解培养基》(understandingmedia)(m.mcluhan,signet,1970)。组织培养用品和试剂可购自生产商如吉布科/brl(gibco/brl)、纳耳-囊克国际公司(nalgene-nuncinternational)、西格马化学品公司(sigmachemicalco.)和icn生物医药公司(icnbiomedicals)。
干细胞来源
实施例部分的内容是用hes细胞产生的。然而,除非另有要求,可采用满足灵长动物多能干细胞定义的其它细胞实施本发明。
实施本发明决不需要分解人胚泡以产生用于实施本发明的hes或胚胎干细胞。hes细胞可由可获自公共保藏单位(例如美国威斯康星州麦迪逊的wicell研究所(wicellresearchinstitute)或美国弗吉尼亚州马纳萨斯的美国典型培养物保藏中心)的已建立谱系获得。可由原始生殖细胞制备人胚胎生殖(heg)细胞,如shamblott等,proc.natl.acad.sci.u.s.a.95:13726,1998和美国专利6,090,622所述。美国专利公开2003/0113910a1报道了不用胚胎或胎儿组织获得的多能干细胞。也可采用诱导多能表型的因子使其它祖细胞再程序化为hes细胞(chambers等,cell113:643,2003;mitsui等,cell113:631,2003)。在适当条件下,具有合适的增殖和分化能力的任何细胞均可用于产生用于本发明的分化组织。
hes细胞的增殖
最初,本领域的大多数科学家偏爱在一层饲养细胞上培养hes细胞,以防止分化,如thomson(美国专利5,843,780;美国专利6,090,622)所述。
早期,杰龙公司的科学家发现了可以另一种形式提供饲养细胞所产生的促进未分化表型增殖的成分的培养系统。美国专利6,800,480、wo01/51616(杰龙公司)和xu等(naturebiotechnology19:971,2001)描述了能支持在不分化的情况下增殖的无饲养细胞培养环境。
无饲养细胞培养法一方面是通过在胞外基质上培养支持hes细胞。可通过预培养和裂解基质-形成细胞系(美国专利6,800,480),如sto小鼠成纤维细胞系(atcc登录号crl-1503)或人胎盘成纤维细胞沉积基质。也可将基质直接包被到含有分离基质组分的培养容器中。
无饲养细胞培养系统的另一方面是营养培养基。该培养基通常含有能提高细胞存活率的普通组分,包括等渗缓冲液(即调节至工作浓度时等渗的缓冲液)、必需矿物质和血清或某种血清替代物。
直接引入hes支持因子的方式是用原代小鼠胚胎成纤维细胞(mef)预调节培养基,所述原代小鼠胚胎成纤维细胞可按照美国专利6,200,806或wo01/51616所述的方法制备。适合用作饲养细胞的还有端粒化细胞系,以及获自正在分化的es细胞(美国专利6,642,048)或其它原始细胞类型的人细胞系。可通过培养饲养细胞(一般通过辐射或其它方式灭活)调节hes细胞培养基。通过37℃培养1-2小时调节的培养基含有能支持hes细胞培养物约1-2天的浓度的因子。然而,可上调或下调调节时间,凭经验确定足够的调节时间。
作为条件培养基的替代方法,用含有引发未分化细胞中合适信号转导通路的添加因子的新鲜(非条件)培养基培养hes细胞。可凭经验鉴定无需调节即可使用的合适的基本培养基。该培养基一般含有等渗溶液形式的中性缓冲液(如磷酸盐和/或高浓度碳酸氢盐);蛋白质营养物(如血清如fbs、血清替代物、白蛋白或必需和非必需氨基酸如谷胺酰胺)。它一般还含有脂质(脂肪酸、胆固醇、血清的hdl或ldl提取物)和大多数此类培养基母液中发现的其它成分(如胰岛素或转铁蛋白、核苷或核苷酸、丙酮酸、糖源如葡萄糖、任何离子化形式或盐形式的硒、糖皮质激素如氢化可的松和/或还原剂如β-巯基乙醇)。
已经开发了许多适用于培养增殖性细胞类型如造血细胞的市售基础培养基。例如x-vivotm10扩增培养基(拜惠特克公司(biowhittaker))和qbsftm-60(质量生物公司(qualitybiologicalinc.))(实施例1)。也参见wo98/30679(生命技术公司(lifetechnologiesinc.))和美国专利5,405,772(阿姆基公司(amgen))。x-vivotm10配方含有药物级人白蛋白、重组人胰岛素和巴氏杀菌的人转铁蛋白。x-vivotm10培养基中不包含外源性生长因子、细胞增殖的人工刺激物或不确定的补充物。它们也不含任何蛋白激酶c刺激物。qbsftm-60是含有重组或巴氏杀菌的人蛋白质的无血清配方。其它可能的替代物是jrh生物科学公司(jrhbiosciences)生产的ex-cellvprotm培养基和海克隆公司(hyclone)生产的hyqcdm4tm。
基础培养基补充有能促进未分化表型增殖并且抑制分化的添加剂。高浓度的成纤维细胞生长因子能特别有效地促进hes细胞在不分化的情况下增殖。例如碱性fgf(fgf-2)、和fgf-4,但也可采用该家族的其它成员。等同形式是种类同源物、人工类似物、各fgf受体的抗体和其它受体活化分子。已由基因表达分析证明,未分化的hes细胞表达酸性fgf(fgf-1)的受体。在高浓度下,单独fgf就足以促进hes细胞以未分化状态生长(实施例1和2)。能有效促进未分化的hes细胞生长的fgf浓度的下限通常约为20、30或40ng/ml,实际的下限约为200、500或1000ng/ml。至少为60、80或100ng/mlbfgf的浓度既可靠又节省成本。可通过将培养物中的bfgf换成拟定的替代物,并按照下述标记物系统监测该培养物的分化情况,从而凭经验确定fgf的其它形式和类似物的等同浓度。
悬浮培养hes细胞
现在发现,可悬浮培养hes细胞,而不一定要让所述细胞生长在固体基片上。
将用另一种培养方法扩增(或获自原代来源)的hes细胞接种到适合保持该细胞呈悬浮状态的容器中。该容器壁一般对未分化hes细胞的粘附是惰性或有抗性。也有防止细胞沉淀下来的装置,例如,搅拌机械装置如磁力或机械驱动的搅拌板或搅拌桨、振荡机械装置(一般连接于该容器的外侧)或倒转机械装置(即旋转该容器以改变重力作用于细胞的方向的装置)。
工艺开发中适用于悬浮培养的容器包括普通范围的市售旋转培养瓶或振荡培养瓶。适用于商业生产的发酵罐是celligenplustm(新布伦兹维克科学公司(newbrunswickscientificco.))和stirred-tankreactortm(艾普利康公司(applikoninc.))。这些生物反应器可连续灌注培养基或以批量给料模式运行,大小可以不同。
按需更换帮助维持未分化表型和支持生长的营养培养基(例如,使细胞沉淀、更换培养基、然后重悬细胞)。监测生长情况,需要为进一步生长腾出空间时将培养物分瓶。合适的培养时间后,收获细胞,并用于所需目的。
设计用于在固体表面上没有饲养细胞的情况下培养hes细胞的培养基和其它组分也可用于悬浮培养。可采用条件培养基或新鲜培养基(实施例4)。然而,悬浮培养的动力学为使用者提供了另一个优化培养系统各个组分的机会。不受限于理论,本发明假设:如果允许hes细胞形成可能被部分分化成基质细胞的细胞围绕的小的未分化细胞簇(固体表面上未分化集落的三维等同物)—或者如果分散了hes细胞,但避免了可能引起分化的动态流体力,则会增加悬浮培养物。
可通过经验式检测优化悬浮培养系统。将来自之前的表面或悬浮培养物的未分化细胞传代至测试条件下,培养1周或更长时间。可采用(例如)下一章节所述和实施例1说明的标记物系统定期检测细胞的hes细胞特征。也可将细胞传代回已很好建立的培养系统中,评价未分化细胞的经典形态学特征(实施例3)。如果想要使hes细胞最终分化为具体组织类型,那么最终测试目标可能不是未分化培养物的标记物概况,而是细胞按需分化的能力。可通过采样细胞,然后在scid小鼠中产生畸胎瘤或对eb衍生细胞上代表所有三个胚层的标记物进行染色(实施例3)验证hes悬浮培养物的多能性。使用者可由此优化系统,以获得高生长速率并保持该细胞的完整潜能(或者至少保持该细胞分化成所需的感兴趣组织的能力)。
可能获益于进一步优化的培养系统的方面包括营养培养基。前一章节中列出了替代的基础培养基和替代的fgf添加剂。采样如下所述的一种或多种额外添加剂也可能是有利的:
·干细胞因子(scf、青灰因子)、使c-kit二聚化的其它配体或抗体、以及同一信号转导途径的其它激活物
·其它酪氨酸激酶相关受体,如血小板衍生生长因子(pdgf)、巨噬细胞集落刺激因子、flt-3配体和血管内皮生长因子(vegf)的受体的配体
·提高环化amp水平的因子,如毛喉素
·gp130诱导因子,如lif或制瘤素-m;
·造血生长因子,如血小板生成素(tpo)
·转化生长因子,如tgfβ1
·其它生长因子,如表皮生长因子(egf)
·神经营养蛋白,如cntf
考虑到防止细胞互相粘附、粘附于容器壁或形成过大的细胞簇,含有抗聚集剂如英杰公司(invitrogen)(目录号0010057ae)出售的试剂可能有利。
虽然细胞能形成有限程度的自身胞外基质,但包含溶解或悬浮于培养基的一种或多种胞外基质组分也可能有利。使层粘连蛋白保持悬浮状态的合适工作范围是约10-33μg/ml。用于悬浮培养物的其它候选基质组分包括前述一些物质,具体是纤连蛋白、蛋白聚糖、玻连蛋白和其人工等同物。胞外基质可能帮助细胞形成合适大小的小聚集体。
或者或此外,该悬浮培养物可含有在悬液中建立表面的颗粒载体,但仍提供在三维空间中培养细胞的益处。以相同方式培养和传代细胞,除了在更换培养基时使颗粒保留在容器中,分瓶时加入更多颗粒。
一种类型的微载体是由玻璃、塑料、带有正电荷以增强细胞粘附的右旋糖苷(赛陶代公司(cytodex))等制成的固体球状或半球状颗粒。另一种类型是圆盘形培养塑料,如新布伦兹维克科学公司出售的fibra-celdiskstm。1克这种圆盘基料提供的表面积为1200cm2。任选地用hes细胞友好型胞外基质如层粘连蛋白包被固体载体,以使粘附的细胞与接种到固体表面上的细胞的微环境相同。
另一种类型的微载体是具有能使细胞滞留在内部和外部、以潜在地提高保护效果的不同孔径的大孔隙颗粒。为了在破坏性最小的情况下回收hes细胞,宜采用通过温和的机械或酶学作用可容易地溶解或分散、从而释放细胞用于收获或进一步培养的材料(如琼脂糖)制成的颗粒。
未分化hes细胞的特征
按照本发明培养的人es细胞具有未分化干细胞的特征性形态特征。在标准二维显微照片中,hes细胞在图像平面中具有高核/质比、明显的核仁并形成很难辨别的细胞连接的致密集落。可采用标准的g-显带技术对细胞系进行核型分型(可由提供常规核型分型服务的许多临床诊断实验室,如加利福尼亚州奥克兰的细胞遗传学实验室(cytogeneticslab)进行)并与公开的人核型作比较。有利的是,获得具有“正常核型”(指细胞是整倍体)的细胞,其中所有人染色体都存在并且没有发生显著改变。
可通过用可用抗体(流式细胞术或免疫细胞化学方法)或用逆转录酶pcr检测的细胞表达标记物表征hes细胞。hes细胞一般具有抗体-可检测的ssea-4、tra-1-60和tra-1-81,但鲜见ssea-1,该细胞具有碱性磷酸酶活性。可以在mrna水平检测的合适标记物参见美国申请2003/0224411a1(杰龙公司)。例子是畸胎癌生长因子(cripto)、胃泌素-释放肽(grp)受体、足萼蛋白(podocalyxin)-样蛋白(podxl)、人端粒酶逆转录酶(htert)和pou转录因子oct3/4。
如前所述,增殖的hes细胞的重要特征是分化成内胚层、中胚层和外胚层三个胚层的细胞的潜能。可通过在scid小鼠中形成畸胎瘤以及检测它们形成三个胚层的代表性组织来验证hes细胞的潜能。或者,使hes细胞非特异性分化(例如通过形成胚状体)、然后用免疫细胞化学方法测定培养物中代表的细胞类型,从而测定潜能(实施例3)。可按照下一章节所述的方法确定hes细胞分化成具体细胞系的潜能。
增殖的hes细胞的应用
本发明提供了可以商业规模生产大量多能细胞的方法。该细胞可以未分化形式用于多种研究和商业目的,或者可定向分化成具体细胞类型。
未分化的hes细胞可用于筛选能影响培养的hes细胞的特征的因子(如小分子药物、肽、多核苷酸等)或条件(如培养条件或操作条件)。hes培养物也可用于药物研究以检测药物化合物。候选药物化合物活性的评价通常包括将本发明分化细胞与候选化合物混合,确定得到的改变,然后将化合物作用与观察到的改变关联起来。可通过细胞活力、形态学、某些标记物、受体或酶的表达或释放、dna合成或修复等等来确定细胞毒性或代谢作用。
按照本发明培养的hes细胞可用于制备各种商业上和治疗上重要的组织类型的分化细胞。
肝细胞
可采用组蛋白脱乙酰酶抑制剂由hes细胞分化肝细胞,如美国专利6,458,589和pct公开wo01/81549(杰龙公司)所述。在组蛋白脱乙酰酶抑制剂的存在下培养未分化的hes细胞。
使hes细胞分化成肝细胞的分阶段方法参见us2005/0037493a1(杰龙公司)。依次采用分化和成熟剂的几种组合培养细胞,使hes细胞首先分化成早期内胚层或肝细胞前体,然后分化成成熟的肝细胞样细胞。简言之,可采用丁酸盐、dmso或胎牛血清(任选与成纤维细胞生长因子连用)启动向内胚层样细胞的分化。然后,可采用市售肝细胞培养基继续分化,所述培养基包含诸如肝细胞生长因子(hgf)、表皮生长因子(egf)和/或骨形态发生蛋白(如mp-2、4或7)等因子的各种组合。可通过药物如地塞米松或制瘤素m的存在提高最终成熟度。获得具有脱唾液酸糖蛋白表达、糖原储存、细胞色素p450酶表达;葡萄糖-6-磷酸酶活性和肝细胞的形态特征的细胞。
神经细胞
可按照美国专利6,833,269;carpenter等,expneurol.2001;172(2):383-97;和wo03/000868(杰龙公司)所述的方法由hes细胞产生神经细胞。用含有一种或多种神经营养蛋白和一种或多种促分裂原的培养基培养未分化的hes细胞或胚状体细胞,产生至少~60%细胞表达a2b5、聚唾液酸化ncam或干蛋白(nestin)并能够在培养过程中翻至少20倍的细胞群体。示范性促分裂原是egf、碱性fgf、pdgf和igf-1。示范性神经营养蛋白是nt-3和bdnf。tgf-β超家族拮抗剂或者camp和抗坏血酸的组合可用于提高酪氨酸羟化酶呈阳性(多巴胺能神经元的特征)的神经元细胞的比例。然后,可通过在没有促分裂原的情况下用神经营养蛋白培养使增殖细胞发生终末分化。
将hes细胞培养成细胞聚集体,并悬浮于含有促分裂原如fgf和少突胶质细胞分化因子如三碘甲腺原氨酸、硒和视黄酸的培养基中,从而由hes细胞产生少突胶质细胞。然后,将细胞接种到固体表面上,消除视黄酸,扩增该群体。可通过接种于聚-l-赖氨酸上并去除所有生长因子实现终末分化。获得的细胞群体中超过80%的细胞的少突胶质细胞标记物ng2蛋白聚糖、a2b5和pdgfrα呈阳性,而神经元标记物neun呈阴性。参见pct公开wo04/007696和keirstead等,jneurosci.2005;25(19):4694-705。
心脏细胞
可按照wo03/006950提供的方法由hes细胞产生心肌细胞或心肌细胞前体。在含有胎牛血清或血清替代物和任选的影响dna-甲基化的心脏营养因子如5-氮胞苷的悬浮液中培养所述细胞。或者,可采用活化素a和骨形态发生蛋白4的组合在固体基片上直接分化心肌细胞簇:然后,可通过密度离心将自发收缩细胞与细胞群体中的其它细胞分离。
进一步的工艺步骤可包括培养所述细胞,以便形成称为心脏体tm(cardiacbodiestm)的细胞簇,取出单个细胞,然后分散并再形成心脏体tm,连续重复这一过程。获得的细胞群体中ctni、ctnt、心脏特异性肌球蛋白重链(mhc)和转录因子nkx2.5染色阳性细胞的比例高。参见wo03/006950,xu等,circres.2002;91(6):501-8;和pct/us2005/009081(杰龙公司)。
其它细胞类型
hes细胞通过在含有选自下组的几种因子组合的培养基中培养,启动hes细胞的分化,从而由hes细胞分化岛细胞:活化素a、组蛋白脱乙酰酶抑制剂(如丁酸盐)、促分裂原(如bfgf);和tgf-β超家族拮抗剂(如头蛋白)。然后,可通过与烟酰胺一起培养使该细胞成熟,产生其中至少5%的细胞表达pdx1、胰岛素、胰高血糖素、促生长素抑制素和胰多肽的细胞群体。参见wo03/050249(杰龙公司)。
可通过共同培养hes细胞与鼠骨髓细胞或卵黄囊内皮细胞制备造血细胞,以产生具有造血细胞标记物的细胞(美国专利6,280,718)。也可通过用造血细胞因子和骨形态发生蛋白培养hes细胞来制备造血细胞,如us2003/0153082a1和wo03/050251(珞巴茨研究所(robartsinstitute))所述。
可按照wo03/004605所述的方法由hes细胞产生间充质祖细胞。然后,在含有成骨因子如骨形态发生蛋白(具体是bmp-4)、人tgf-β受体的配体、人维生素d受体的配体的培养基中使hes-衍生的间充质细胞进一步分化为成骨细胞谱系细胞(wo03/004605;sotile等,cloningstemcells2003;5(2):149-55)。可采用wo03/050250所列分化因子(杰龙公司)的有效组合培养微聚集体状态的hes细胞,从而产生软骨细胞或其祖细胞。
本领域已知和随后开发的其它分化方法可应用于按照本发明培养的hes细胞。hes衍生细胞可用于药物筛选、制备药物组合物、研究和许多其它值得的目的。
商业流通
本发明培养系统的组分可经许诺销售、出售或其它分销途径由产地供给另一实体进行任何目的的应用。也可以各种有用组合的形式出售或分销组分,如以下两种或多种物质:
·适合用悬浮因子培养hes细胞的培养基
·培养基中存在或准备加入培养基的胞外基质组分或增稠剂
·培养基中存在或准备加入培养基的微载体
·适应悬浮培养的容器
·hes细胞本身,在培养系统中培养,或以另一种形式储存,但准备用于该培养系统
将产物和产物组合包装到合适的容器中,任选为试剂盒形式,并可附有关于按照本发明使用材料—如维持或扩增hes细胞的书面信息。该信息可以任何语言书写在目标使用者可获得和理解的任何通信媒体上。它可以是容器或试剂盒上的标签的形式,或者是与容器一起包装和分销的产品插页。等同形式有使用者或目标使用者可获得的硬拷贝或电子形式书写的说明、说明书或解释书,作为商业分销产品相关的参考文献或资源。
以下实施例为说明性,不限制本发明的权利要求范围。
实施例
实施例1:用快速扩增培养基培养多能干细胞
获得最初在小鼠胚胎成纤维细胞饲养细胞上生长的hes细胞系,然后按照美国专利6,800,480和xu等,stemcells2005;23(3):315-23所述在含有
然后将hes细胞转移到拜惠特克公司的x-vivotm10扩增培养基或质量生物学公司(qualitybiologicalinc)的qbsftm-60上。为了用于这些实验,x-vivotm10培养基中补充有普通物质(goodies):即2mml-谷胺酰胺、1%非必需氨基酸(吉布科公司(gibco))、0.1mmβ-巯基乙醇和8ng/mlbfgf。该培养基还补充有8ng/ml或40ng/ml的bfgf(吉布科公司);40ng/ml的bfgf和15ng/ml的scf(r&d系统公司(r&dsystem));或40ng/mlbfgf和75ng/mlflt3配体(r&d系统公司)。qbsftm-60培养基补充有0.1mmβ-巯基乙醇、1%非必需氨基酸(吉布科公司)和40ng/ml的bfgf。在mef条件培养基中培养的hes细胞用作这些实验的对照。
首先用胶原酶iv将hes细胞传代到
图1显示了用以下培养基传代6次(足以完全适应)结束时的hes细胞集落:(a)mef条件培养基+bfgf(8ng/ml);(b)x-vivotm10+bfgf(40ng/ml);(c)x-vivotm10+bfgf(40ng/ml)+干细胞因子(scf,青灰因子)(15ng/ml);(d)x-vivotm10+bfgf(40ng/ml)+flt3配体(75ng/ml);(e)qbsftm-60+bfgf(40ng/ml)。
下表显示了在用mef条件培养基培养4代或者用x-vivotm10或qbsftm-60培养7代的未分化hes细胞中,平均每代扩增细胞的总倍数。
在x-vivotm10和qbsftm-60中平均每代扩增细胞的倍数大于用mef条件培养基培养的细胞。mef条件培养基培养的细胞平均每7天传代一次,而用x-vivotm10和qbsftm-60培养的细胞平均每5天传代一次。因此,非条件x-vivotm10或qbsftm-60中的扩增速率比mef条件es培养基中的扩增速率高~3.2-5.2倍。
图2显示了htert和oct3/4的基因表达概况。用高纯rna分离试剂盒(highpurernaisolationkit)(罗氏诊断公司(rochediagnostics))分离细胞的rna,并用taqmantm实验(实时rt-pcr)进行评估。相对于对照培养物中的表达情况对各测试条件下的基因表达情况作图。考虑到仪器误差和实验变异性,如果测试和对照样品之间的表达差异大于两倍才能认为该差异有显著性。该分析显示,适应非条件x-vivotm10或qbsftm-60培养基后,htert和oct-3/4的表达略有降低(各组的前四个柱),但当细胞回到mef条件培养基中时回复到标准水平(各组的后三个柱)。
为了验证非条件培养基中培养的细胞能保持其潜能,形成胚状体,用免疫细胞化学方法分析代表三个胚层的各个表型标记物。用扩增培养基传代7次后,用200u/ml胶原酶iv于37℃孵育10分钟,从而将细胞解离成小块,放入分化培养基(dmem+10%fbs)中分化培养4天,然后转移到聚-l-鸟氨酸氢溴酸盐包被的平板上孵育10天。用4%多聚甲醛固定,通透,并用免疫细胞化学方法标记。
图3显示结果。对用非条件x-vivotm10培养基传代7次的hes细胞上的甲胎蛋白(代表内胚层)、肌动蛋白(代表中胚层)和β-微管蛋白iii(代表外胚层)进行染色。
因此,可以在无饲养细胞的环境中用新鲜(非条件)培养基以适合商业生产的速度快速扩增hes细胞,其扩增速度比在条件培养基中或饲养细胞上的生长速率快2-5倍或更高。该细胞保持了未分化hes细胞的形态,并可分化成代表所有三个胚层的衍生细胞。
实施例2:在无动物基产品的确定系统中培养hes细胞
将
在这些条件下生长的培养物类似于或优于
*3次rt-pcr测定的平均值±sd
作为未分化hes细胞的特征的其它标记物的表达也相当:经实时pcr检测,确定培养基中的htert和畸胎癌生长因子的水平与mef-cm的相比相同或大于mef-cm中的水平,而oct3/4的表达低约28%(三次实验的平均值)。trap分析显示,细胞保持了端粒酶活性。
收获用完全确定的培养系统培养p34+11(75天)的细胞,用该细胞在scid小鼠中产生畸胎瘤以评估潜能。畸胎瘤显示出色素上皮(内胚层);肾组织(中胚层);间充质组织(中胚层);和神经管(外胚层)的证据。这证明该细胞保持了它们的潜能。
实施例3:悬浮培养hes细胞
为了提高单位培养体积的hes细胞产率,悬浮培养该细胞,然后评估其形态和形成代表所有三个胚层的分化细胞的能力。
从6孔板中收获
·容器:100ml旋转培养瓶
·接种密度:3.6x105个细胞/ml;
·培养基体积:每个旋转培养瓶中50ml
·采用的培养基:含有bfgf(8ng/ml)的mef条件培养基
·搅拌速率:20rpm(贝尔科载体磁力搅拌器(bellcocarriermagneticstirrer))
·气氛:37℃co2培养箱
·更换培养基:每隔一天(通过使细胞沉淀和更换上清液完成更换)
在这些条件下用旋转培养瓶培养h9hes细胞6天。
图4(上图)显示结果。最初下降(在这期间建立培养物)后,从第2-6天起细胞数开始增加。
此时,将细胞接种回用
图4(下图)显示结果。传代1次后,细胞生长并显示出未分化细胞的形态。
通过形成胚状体评估细胞潜能。用胶原酶iv收获汇合培养物中的细胞,并转移到含有dmem+20%fbs的低粘附6-孔板中。eb形成并维持4天。然后,再将eb接种到聚鸟氨酸-包被的培养玻片(chamberslide)上。再培养11天后,对eb生长晕中的甲胎蛋白(内胚层)、肌动蛋白(中胚层)和具有神经元形态的β-微管蛋白(外胚层)进行染色。
图5显示结果。上面一排显示了悬浮培养后在标准条件下接种回层粘连蛋白上的hes细胞分化而来的细胞。下面一排显示了完全作为平板培养细胞培养的同一hes细胞系分化而来的细胞。如图所示,悬浮培养的hes细胞完全保持了它们分化成所有三个胚层的衍生物的能力。
在另一实验中,在以下条件下培养h9hes细胞:
·容器:100ml旋转培养瓶
·接种密度:3.5x105个细胞/ml
·培养基体积:每个旋转培养瓶中50ml
·采用的培养基:mef-cm+bfgf(8ng/ml)
·搅拌速率:20rpm(同前)
·更换培养基:每3天更换一次
图6显示结果。一旦培养物建立后,细胞能恰当地维持全部12天的时间。
实施例4:长期悬浮培养
用另一hes细胞系完成此实验。用摇瓶代替旋转培养瓶在几种不同的培养条件下培养细胞,培养过程持续两个月以上。
·由6孔板收获h1hes细胞(在
·容器:100ml摇瓶
·接种密度:5.0x105个细胞/ml
·培养基体积:每个摇瓶中15ml
·搅拌速率:80rpm(来不林尼公司(labline)转头/振荡器,在37℃的co2培养箱中)
·更换培养基:最初每隔一天,随后每2-3天更换一次
所用培养基和培养时间如下:
a:mef-cm+bfgf(8ng/ml)。维持98天。
b:mef-cm+bfgf(8ng/ml)+层粘连蛋白(开始为33μg/ml,随后在其余培养过程中为~10μg/ml)。维持49天。
c:x-vivotm10+fgf(40ng/ml)+flt-3(75ng/ml)。维持11天。
d:x-vivotm10+fgf(40ng/ml)+flt-3(75ng/ml)+层粘连蛋白(开始为33μg/ml,随后在其余培养过程中为~10μg/ml)。维持11天。
培养期间的细胞数见下表。
为了测定细胞是否保持未分化表型,将用培养基a培养4周的细胞接种回
图7显示结果。传代后,衍生自悬浮培养物的细胞显示出生长并具有未分化hes细胞集落的特征。
这些数据表明,可悬浮培养hes细胞至少3个月,在培养物完全建立后可能扩增了3-40倍。
实施例5:采用新鲜培养基的悬浮培养物
下一个实验评估了用于新鲜(非条件)培养基悬浮培养的另一种添加剂。在标准条件(来自西格马公司(sigma)的人层粘连蛋白的基材,以2μg/cm2包被到6-孔板上;含有80ng/mlbfgf和0.5ng/mltgfβ1的x-vivo10tm培养基)下由新鲜培养基中的表面培养物收获hes细胞。将收获的细胞传代到100ml旋转培养瓶中的悬浮培养物中,每个培养瓶中采用50ml培养物,起始密度为~5x105个细胞/ml。评估以下培养基替代物:
1)x-vivotm10+bfgf(80ng/ml)
2)x-vivotm10+bfgf(80ng/ml)+tgfβ1(0.5ng/ml)
3)x-vivotm10+bfgf(40ng/ml)+tgfβ1(0.5ng/ml)
4)x-vivotm10+bfgf(80ng/ml)+tgfβ1(0.5ng/ml)+10μg/ml人层粘连蛋白
5)x-vivotm10+bfgf(80ng/ml)+tgfβ1(0.5ng/ml)+50μg/ml人血清白蛋白
将各旋转培养瓶放在37℃co2培养箱中的贝尔科载体磁力搅拌器(新泽西州瓦恩兰的贝尔科生物技术公司(bellcobiotechnology,vineland,nj))上,初始搅拌速率为20rpm。调节搅拌速率以保持细胞为悬浮状态并提供足够的空气,同时要最大程度降低剪切力。每2-3天更换一次培养基(同前),监测细胞数,按需分瓶培养。
以固定间隔由各培养瓶取出细胞样品,接种回层粘连蛋白包被的表面以评估形态。通过对eb衍生细胞进行免疫细胞化学染色,来监测回复到表面培养状态的细胞和直接从悬浮培养物中取出的细胞的多能性,如实施例3所述。
可在不背离本发明权利要求书和其等同范围的情况下对上述组合物和方法进行有效修改。
- 还没有人留言评论。精彩留言会获得点赞!