3‑硝基喹啉类衍生物及其制备方法和应用与流程
本发明属于有机化学和药物化学技术领域,具体涉及一种3-硝基喹啉类衍生物及其制备方法和应用。
背景技术:
癌症是当今世界严重威胁人类生命与健康的重要疾病,越来越肆虐夺去更多生命。治疗和预防癌症已成为整个社会广泛关注的问题。2014年世界卫生组织发布《世界癌症报告》称,癌症已经成为全世界人类的最大致死原因。
而结-直肠癌通常对目前可采用的化学疗法不太敏感或难于治疗,对于此类癌症唯一有效的试剂是5-氟尿嘧啶。对基于5-氟尿嘧啶的综合化学疗法无效时,目前没有其它的代替治疗手段。因此,对此类癌症具有较好疗效的新药物对于减轻患者的病痛具有重要的现实意义。
喹啉类衍生物是一类具有广泛生物活性并受到化学家及药物学家们广泛关注的含氮杂环化合物。迄今已发展了多种合成喹啉类化合物的方法,经典的合成方法有skraup,doebner-vonmiller,friedlander等。而经典的合成方法通常反应时间长,合成产率低,需要金属催化剂、需要高温等条件,在药物研究中,这些合成方法具有一定的极限性。研究开发简捷高效的喹啉酰胺合成方法具有重要意义。
喹啉酰衍生物具有广谱的生物活性包括抗疟、抗hiv、抗肿瘤(vyas,v.;variya,b.;ghate,m.eur.j.med.chem.2014,82,385;pathuri,g.;li,q.;mohammed,a.;gali,h.;pento,t.bioorg.med.chem.lett.2014,24,1380;chen,h.;yang,z.;ding,c.;chu,l.;zhang,y.;terry,k.;liu,h.;shen,q.;zhou,j.eur.j.med.chem.2013,62,498;manera,c.;malfitano,a.;parkkari,t.;lucchesi,v.;carpi,s.;fogli,s.;bertini,s.;laezza,c.;ligresti,a.;saccomanni,g.;savinainen,j.;ciaglia,e.;pisanti,s.;gazzerro,p.;marzo,v.;nieri,p.;macchia,m.;bifulco,m.;eur.j.med.chem.2015,97,10)、抗病毒、抗结核、抗真菌、抗氧化、杀虫等。国内外已有许多喹啉类化合物的专利报道。
wo2013000269(周文强)公开了一种喜树碱衍生物具有抗肺癌、抗结肠癌活性。
cn201610077368.7(周有俊)公开了一种具有抗肿瘤活性的喹啉类多靶点激酶抑制剂及其制备方法。
us9493419(johnnycheuk-ontang)公开了一种具有抗肿瘤活性的喹啉类化合物。
us4826850(masatoshiyamato)公开了一类喹啉类抗肿瘤药物。
us5112817(nobuyukifukazawa)公开了一种具有抗肿瘤活性的喹啉类化合物。
技术实现要素:
本发明的目的是为了解决现有技术的不足,提供一种3-硝基喹啉类衍生物的制备方法和应用,该类化合物具有良好的抗肿瘤活性,极具应用前景。
为实现上述目的,本发明采用的技术方案如下:
3-硝基喹啉类衍生物,该化合物的结构如式(i)所示:
式(i)中,n为0、1或2;
m为0、1或2;
r1为卤素原子、氢原子或烷基;
r2为卤素原子、氢原子或烷基;
r为苯基、卤代苯基、烷基取代苯基、烷氧基取代苯基、三氟甲基取代苯基、呋喃基或正丁基。
r'为苯基、卤代苯基、烷基取代苯基、烷氧基取代苯基、三氟甲基取代苯基、呋喃基或正丁基。
本发明还提供上述3-硝基喹啉类衍生物的制备方法,包括如下步骤:
将如式(ii)所示的靛红类化合物与如式(iii)所示的1,1-烯二胺类化合物,在非质子性溶剂中,在有机酸催化下进行加成环化和重排反应,tlc跟踪,待反应完全后,将反应物纯化,干燥,得到所述式(i)结构的3-硝基喹啉类衍生物;具体反应式如下:
式(ii)中,r1为卤素原子、氢原子或烷基;r2为卤素原子、氢原子或烷基;
式(iii)中,n为0、1或2;m为0、1或2;r为苯基、卤代苯基、烷基取代苯基、烷氧基取代苯基、三氟甲基取代苯基、呋喃基或正丁基;r'为苯基、卤代苯基、烷基取代苯基、烷氧基取代苯基、三氟甲基取代苯基、呋喃基或正丁基。
进一步,优选的是,式(ii)所示的靛红类化合物与式(iii)所示的1,1-烯二胺类化合物的摩尔比为1:1~2:1;式(ii)所示的靛红类化合物的摩尔与非质子性溶剂的体积比为1mmol:15~25ml。
进一步,优选的是,反应温度为25℃~120℃,反应时间为2~16小时。
进一步,优选的是,所述有机酸为醋酸、三氟醋酸、三氯醋酸或对甲苯磺酸;所述的有机酸与式(ii)所示的靛红类化合物的摩尔比为4:1~1:1。
进一步,优选的是,所述的非质子性溶剂为甲苯、二甲苯、乙腈或1,4-二氧六环。
进一步,优选的是,所述的干燥为真空烘干、自然干燥或红外灯下干燥。
进一步,优选的是,所述的纯化方法为首先采用有机溶剂与饱和食盐水对反应液进行萃取,有机相用无水na2so4或无水mgso4干燥,将经干燥后的有机相进行减压浓缩至干,经柱层析分离,得到如式(i)所示的3-硝基喹啉类衍生物纯品。其中,将浓缩物经柱层析分离可以采用干法上样,但不限于此,如向浓缩物中加入适量100~200目硅胶以及适量二氯甲烷或丙酮,充分混合均匀后,减压旋干,后上样。
进一步,优选的是,所述的萃取用的有机溶剂为乙酸乙酯或二氯甲烷;
所述的柱层析分离采用的洗脱剂为用体积比为10:1~2:1的石油醚和乙酸乙酯的混合溶剂;
本发明同时提供上述3-硝基喹啉类衍生物作为制备抗肿瘤活性药物的应用。
本发明与现有技术相比,其有益效果为:
本发明利用简单易得的原料:式(ii)所示的靛红类化合物与式(iii)所示的1,1-烯二胺类化合物,在非质子性溶剂中,在温度(25~120℃)条件下,进行加成环化、重排反应,tlc跟踪,待反应完全后,将反应物纯化,干燥得具有抗肿瘤活性的目标化合物即式(i)所示的3-硝基喹啉类衍生物。本发明的合成路线短(仅一步反应),操作简便,反应条件温和,不需要无水条件,不需要金属催化,产率高(75%~95%),生产成本低等特点,十分有利工业生产。本发明3-硝基喹啉类衍生物具有良好的抗肿瘤活性,应用前景显著。
所发明化合物具有对人结-直结肠癌(hct116)、人结肠癌(ht29),较好的抗肿瘤活性。实验研究表明,化合物5、6、30和39对hct116细胞株的ic50(μmol/l)分别为5.02、8.13、6.05、6.25均小于顺铂的ic50(μmol/l)=8.74,且都小于10μmol/l,相对于顺铂显示出优越的抗癌活性。这4个化合物同时对hct116(人结-直肠癌)细胞株也表现出优越的抗癌活性,ic50分别为7.15μmol/l、9.56μmol/l、9.20μmol/l、8.36μmol/l,均小于阳性对照药物顺铂的ic50=12.78μmol/l,且都小于10.0μmol/l。
附图说明
图1为化合物16的单晶图。
图2为化合物21的氢谱。
图3为化合物21的碳谱。
具体实施方式
下面结合实施例对本发明作进一步的详细描述。
本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂、仪器等未注明生产厂商者,均为可以通过购买获得的常规产品。
本发明原料可通过本领域的公知的方法来制备或通过市售产品获得。
以下进一步解释本发明的3-硝基喹啉类衍生物的合成的一般方法,但本发明3-硝基喹啉类衍生物的制备方法不局限于此。
合成本发明的3-硝基喹啉类衍生物的方法如下:
将如式(ii)所示的靛红类化合物与如式(iii)所示的1,1-烯二胺类化合物,在非质子性溶剂中,在有机酸催化下进行加成环化和重排反应,tlc跟踪,待反应完全后,将反应物纯化,干燥,得到所述式(i)结构的3-硝基喹啉类衍生物;具体反应式如下:
式(ii)中,r1为卤素原子、氢原子或烷基;r2为卤素原子、氢原子或烷基;
式(iii)中,n为0、1或2;m为0、1或2;r为苯基、卤代苯基、烷基取代苯基、烷氧基取代苯基、三氟甲基取代苯基、呋喃基或正丁基;r'为苯基、卤代苯基、烷基取代苯基、烷氧基取代苯基、三氟甲基取代苯基、呋喃基或正丁基。
式(ii)所示的靛红类化合物与式(iii)所示的1,1-烯二胺类化合物的摩尔比为1:1~2:1;式(ii)所示的靛红类化合物的摩尔与非质子性溶剂的体积比为1mmol:15~25ml。
反应温度为25℃~120℃,反应时间为2~16小时。
所述有机酸为醋酸、三氟醋酸、三氯醋酸或对甲苯磺酸;所述的有机酸与式(ii)所示的靛红类化合物的摩尔比为4:1~1:1。
所述的非质子性溶剂不作具体规定,优先选择为甲苯、二甲苯、乙腈或1,4-二氧六环,优选式(ii)所示的靛红类化合物的摩尔与非质子性溶剂的体积比为1mmo:15~25ml。
所述的干燥可采用真空烘干、自然干燥、红外灯下干燥等干燥方法。
所述的纯化方法为首先采用有机溶剂与饱和食盐水对反应液进行萃取,有机相用无水na2so4或无水mgso4干燥,将经干燥后的有机相进行减压浓缩至干,经柱层析分离,得到如式(i)所示的3-硝基喹啉类衍生物纯品。其中,将浓缩物经柱层析分离可以采用干法上样,但不限于此,如向浓缩物中加入适量100~200目硅胶以及适量二氯甲烷或丙酮,充分混合均匀后,减压旋干,后上样。
所述的萃取用的有机溶剂为乙酸乙酯或二氯甲烷;
所述的柱层析分离采用的洗脱剂为用体积比为10:1~2:1的石油醚和乙酸乙酯的混合溶剂;
式(ii)所示的化合物按照公知的方法,式(iii)所示的化合物是公知的,是可商购或可按照公知的方法制备。
对本发明的化合物进行人类肿瘤细胞株实验:hct116(人结直结肠癌),ht29(结肠癌)。将细胞测试用化合物孵育144小时,然后采用mtt测定法测量细胞毒性(mossman,t.j.immunol.methods1983,65,55“细胞活力的快速比色测试法;细胞毒性和生长抑制淋巴因子定量的应用”。green,l.m.j.immunol.methods1984,70,257“细胞活力的快速比色测试法;细胞毒性和生长抑制淋巴因子定量的应用”)。
所得数据证实,本发明的化合物对实体肿瘤、特别是结-直结肠癌和结肠癌有明显的活性。
本发明化合物的日给药剂量为0.01mg-10mg/kg。优选的日给药剂量为约0.2mg至2mg/kg体重,对于体重约70kg的患者来说,采用在24小时内单次剂量给药约14mg至约140mg的活性物质。该剂量范围可进行调整以获得更好的治疗效果。本发明的活性化合物可通过口服、静脉内给药、肌内给药、皮下给药等方式给药。
本发明的化合物可与其它用于导致肿瘤退化的试剂组合给药,以协同增加所述化合物的抗肿瘤效果。本发明的化合物可分别与不同抗癌药物,如:顺铂、沙利铂、5-氟尿嘧啶、阿霉素、吉西他滨、紫杉酚、长春新碱、羟基喜树碱、拓扑替康、伊立替康组合给药(组合给药比例1:10~10:1)。
本发明的药物组合物包含治疗有效量的至少一种发明的化合物与可药用的混合物。
口服组合物包含适用于口服给药的胶囊、片剂、丸剂、悬浮液或糖浆。
为制备用于肠胃外给药的药物组合物,可将活性成分掺入溶液或悬浮液中。
下面结合部分具体实施方案对本发明进行详述。这些实施例仅用于说明本发明,而不用于限制本发明的范围。实施例中的制备方案仅为优选方案,但本发明并不局限于优选制备方案。
第一部分合成实施例
实施例1:合成6-氟-3-硝基-n-(4-(三氟甲基)苄基)-2-(4-(三氟甲基)苄基氨基)喹啉-4-甲酰胺(化合物1)
在25毫升圆底烧瓶中加入2-硝基-n,n'-双(4-(三氟甲基)苄基)乙烯-1,1-二胺(1毫摩尔)和5-氟二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(4毫摩尔)磁力搅拌下加热至回流,回流反应16小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离,真空干燥得黄色固体产品6-氟-3-硝基-n-(4-(三氟甲基)苄基)-2-(4-(三氟甲基)苄基氨基)喹啉-4-甲酰胺(化合物1),产率80%。熔点:193~194℃。
核磁共振氢谱(氘代二甲亚砜,brukeram600仪):δ=4.64(d,j=4.7hz,2h,nch2),4.82(d,j=5.2hz,2h,nch2),7.24(d,j=9.1hz,1h,arh),7.61–7.68(m,8h,arh),7.76(d,j=8.0hz,2h,arh),8.33(t,j=5.2hz,1h,nh),9.52(t,j=5.3hz,1h,conh)。
核磁共振碳谱(氘代二甲亚砜,brukeram600仪):δ=43.0,44.3,110.2(d,j=22.5hz),118.7(d,j=10.5hz),123.5(d,j=24.0hz),123.9(d,j=9.0hz),125.5(d,j=4.5hz),127.5,127.8,128.0,128.3,128.5,128.6,129.0,129.3(d,j=9.0hz),130.7,140.8(d,j=4.5hz),144.4(d,j=228.0hz),146.8(d,j=208.5hz),158.5(d,j=241.5hz),163.3。
高分辨质谱c26h17f7n4o3,理论值567.1262;实测值,567.1262。
实施例2:合成6-氟-n-(4-氟苄基)-2-(4-氟苄基氨基)-3-硝基喹啉-4-甲酰胺(化合物2)
在25毫升圆底烧瓶中加入n,n'-双(4-氟苄基)-2-硝基乙烯-1,1-二胺(1毫摩尔)和5-氟二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(20毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,反应14小时。tlc监测反应,待原料点完全消失后反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入5毫升丙酮和5克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离,自然干燥得黄色固体产品6-氟-n-(4-氟苄基)-2-(4-氟苄基氨基)-3-硝基喹啉-4-甲酰胺(化合物2),产率90%。熔点:193.0~193.2℃。
核磁共振氢谱(氘代二甲亚砜,brukeram500仪):δ=4.51(d,j=5.5hz,2h,nch2),4.70(d,j=6.0hz,2h,nch2),7.10(t,j=8.5hz,2h,arh),7.19–7.23(m,3h,arh),7.40(q,j=5.5hz,2h,arh),7.46(q,j=6.0hz,2h,arh),7.65(t,j=2.5hz,2h,arh),8.19(br,1h,nh),9.40(br,1h,conh)。
核磁共振碳谱(氘代二甲亚砜,brukeram500仪):δ=42.6,43.9,110.2(d,j=23.8hz),115.4(q,j=21.3hz),118.7(d,j=10.0hz),123.6(d,j=26.3hz),129.3(d,j=8.8hz),130.0(d,j=8.8hz),130.3(d,j=8.8hz),130.7,135.0(d,j=2.5hz),136.2(d,j=2.5hz),140.9(d,j=5.0hz),146.1,147.5,158.4(d,j=241.3hz),161.6(d,j=240.0hz),160.9(d,j=241.3hz),163.1。
高分辨质谱c24h17f3n4o3[(m+h)-],理论值465.1175;实测值,465.1180。
实施例3:合成n-苄基-2-(苄基氨基)-6-氟-3-硝基喹啉-4-甲酰胺(化合物3)
在25毫升圆底烧瓶中加入n,n'-二苄基-2-硝基乙烯-1,1-二胺(1毫摩尔)和5-氟二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入二甲苯(15毫升)和乙酸(2毫摩尔)磁力搅拌下加热至120℃下,反应2小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入2毫升丙酮和2克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离干燥得黄色固体产品n-苄基-2-(苄基氨基)-6-氟-3-硝基喹啉-4-甲酰胺(化合物3),产率80%。熔点:183.0~183.2℃。
核磁共振氢谱(氘代二甲亚砜,brukeram500仪):δ=4.54(d,j=5.5hz,2h,nch2),4.74(d,j=6.0hz,2h,nch2),7.23–7.45(m,11h,arh),7.63(t,j=5.5hz,2h,arh),8.16(br,1h,nh),9.46(br,1h,conh)。
核磁共振碳谱(氘代二甲亚砜,brukeram500仪):δ=43.3,44.6,110.2(d,j=23.8hz),118.7(d,j=8.8hz),120.6,123.4(d,j=25.0hz),127.2,127.7,128.0(d,j=25.0hz),128.7,128.9,129.3(d,j=8.8hz),130.8,138.8,140.0,140.9(d,j=5.0hz),146.2,147.6,158.3(d,j=241.3hz),163.1。
高分辨质谱c24h19fn4o3[(m+h)+],理论值431.1514;实测值,431.1514。
实施例4:合成6-氟-n-(4-甲氧基苄基)-2–((4-甲氧基苄基)氨基)-3-硝基喹啉-4-甲酰胺(化合物4)
在25毫升圆底烧瓶中加入n,n'-双(4-甲氧基苄基)-2-硝基乙烯-1,1-二胺(1毫摩尔)和5-氟二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入1,4-二氧六环(15毫升)和乙酸(2毫摩尔)磁力搅拌下加热至100℃下反应16小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离,红外灯下干燥得黄色固体产品6-氟-n-(4-甲氧基苄基)-2–((4-甲氧基苄基)氨基)-3-硝基喹啉-4-甲酰胺(化合物4),产率85%。熔点:190.7~190.9℃。
高分辨质谱c26h23fn4o5[(m+h)-],理论值489.1574;实测值,489.1582。
实施例5:合成n-(2,4-二氟苄基)-2-(2,4-二氟苄基氨基)-6-氟-3-硝基喹啉-4-甲酰胺(化合物5)
在25毫升圆底烧瓶中加入n,n'-双(2,4-二氟苄基)-2-硝基乙烯-1,1-二胺(1毫摩尔)和5-氟二氢吲哚-2,3-二酮(2.0毫摩尔)后,加入乙腈(25毫升)和乙酸(1毫摩尔)磁力搅拌下加热至25℃下反应16小时后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入5毫升丙酮和5克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离干燥得黄色固体产品n-(2,4-二氟苄基)-2-(2,4-二氟苄基氨基)-6-氟-3-硝基喹啉-4-甲酰胺(化合物5),产率85%。熔点:186.0~186.2℃。
核磁共振氟谱(氘代二甲亚砜,brukeram500仪):δ=-116.8,-114.3(d,j=4.8hz),-113.8(d,j=4.8hz),-112.4(d,j=4.8hz),-111.2(d,j=9.5hz)。
核磁共振氢谱(氘代二甲亚砜,brukeram500仪):δ=4.55(d,j=5.0hz,2h,nch2),4.73(d,j=5.0hz,2h,nch2),7.00(d,j=1.5hz,1h,arh),7.13(d,j=1.5hz,1h,arh),7.20–7.24(t,2h,arh),7.28(s,1h,arh),7.50–7.54(q,2h,arh),7.64(d,j=7.0hz,2h,arh),8.18(br,1h,nh),9.40(br,1h,conh)。
核磁共振碳谱(氘代二甲亚砜,brukeram500仪):δ=36.9(d,j=3.8hz),38.2,103.8(d,j=26.3hz),104.1(t,j=13.8hz),104.5,110.2(d,j=23.8hz),111.5(d,j=2.5hz),111.6(d,j=3.8hz),111.7(d,j=2.5hz),111.9(d,j=2.5hz),118.8(d,j=10.0hz),122.4(d,j=187.5hz),123.5,123.7,129.3(d,j=8.8hz),130.6,131.2(d,j=6.3hz),131.3(q,j=6.3hz),132.2(d,j=6.3hz),132.3(d,j=6.3hz),140.9(d,j=6.3hz),146.1,147.4,158.5(d,j=242.5hz),159.8(d,j=7.5hz),159.9(d,j=7.5hz),161.7(d,j=242.5hz),161.8(d,j=243.8hz),162.7(d,j=12.5hz),163.1(t,j=6.3hz),163.2.。
高分辨质谱c24h15f5n4o3[(m+h)+],理论值503.1137;实测值,503.1136。
实施例6:合成(n-(3,4-二氟苄基)-2-(3,4-二氟苄基氨基)-6-氟-3-硝基喹啉-4-甲酰胺(化合物6)
在25毫升圆底烧瓶中加入n,n'-双(3,4-二氟苄基)-2-硝基乙烯-1,1-二胺(1毫摩尔)和5-氟二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升二氯甲烷和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离干燥得黄色固体产品(n-(3,4-二氟苄基)-2-(3,4-二氟苄基氨基)-6-氟-3-硝基喹啉-4-甲酰胺(化合物6),产率90%。熔点:187.2~187.4℃。
核磁共振氟谱(氘代二甲亚砜,brukeram500仪):δ=-141.7(d,j=23.8hz),-141.0(d,j=23.8hz),-139.2(d,j=19.0hz),-138.9(d,j=38.0hz),-116.8。
核磁共振氢谱(氘代二甲亚砜,brukeram500仪):δ=4.54(d,j=5.0hz,2h,nch2),4.70(d,j=5.5hz,2h,nch2),7.25–7.29(q,3h,arh),7.34–7.43(m,1h,arh),7.44–7.48(t,3h,arh),7.66(m,j=4.5hz,2h,arh),8.25(d,j=5.5hz,1h,nh),9.44(d,j=5.5hz,1h,conh)。
核磁共振碳谱(氘代二甲亚砜,brukeram500仪):δ=42.3,43.7,110.2(d,j=23.8hz),117.0,117.1(d,j=16.3hz),117.5(d,j=16.3hz),117.8(d,j=17.5hz),118.7(d,j=10.0hz),123.5(d,j=26.3hz),124.7(q,j=2.5hz),125.0(q,j=2.5hz),129.3(d,j=8.8hz),130.7,136.6(t,j=5.0hz),138.0(t,j=3.8hz),140.8(d,j=5.0hz),146.1,147.4,147.8(d,j=12.5hz),149.1(d,j=242.5hz),149.2(d,j=242.5hz),149.6(d,j=243.8hz),149.7(d,j=245.0hz),149.8(d,j=243.8hz),158.5(d,j=241.3hz),163.3。
高分辨质谱c24h15f5n4o3[(m+h)+],理论值503.1137;实测值,503.1135。
实施例7:合成6-氟-n-(4-氟苯乙基)-2-(4-氟苯乙基氨基)-3-硝基喹啉-4-甲酰胺(化合物7)
用n,n'-双(4-氟苯乙基)-2-硝基乙烯-1,1-二胺代替实施例1中的2-硝基-n,n'-双(4-(三氟甲基)苄基)乙烯-1,1-二胺,进行反应可得到黄色固体6-氟-n-(4-氟苯乙基)-2-(4-氟苯乙基氨基)-3-硝基喹啉-4-甲酰胺(化合物7),产率85%。熔点:181.1~181.3℃。
高分辨质谱c26h21f3n4o3[(m+h)-],理论值495.1639;实测值,495.1636。
实施例8:合成6-氟-3-硝基-n-苯乙基-2-(苯乙基氨基)喹啉-4-甲酰胺(化合物8)
用2-硝基-n,n'-二苯乙烯-1,1-二胺代替实施例1中的2-硝基-n,n'-双(4-(三氟甲基)苄基乙烯-1,1-二胺,可得到红色固体6-氟-3-硝基-n-苯乙基-2-(苯乙基氨基)喹啉-4-甲酰胺(化合物8),产率80%。熔点:158.5~158.8℃。
高分辨质谱c26h23fn4o3[(m+h)+],理论值459.1827;实测值,495.1826。
实施例9:合成6-氟-n-(2-氟苯乙基)-2-(2-氟苯乙基氨基)-3-硝基喹啉-4-甲酰胺(化合物9)
用n,n'-双(2-氟苯乙基)-2-硝基乙烯-1,1-二胺代替实施例1中的2-硝基-n,n'-双(4-(三氟甲基)苄基)乙烯-1,1-二胺,可得到黄色固体-6-氟-n-(2-氟苯乙基)-2-(2-氟苯乙基氨基)-3-硝基喹啉-4-甲酰胺(化合物9),产率85%。熔点:160.1~160.4℃。
高分辨质谱c26h21f3n4o3[(m+h)+],理论值495.1639;实测值,495.1634。
实施例10:合成6-氟-3-硝基-n–((四氢呋喃-2-基)甲基)-2–((四氢呋喃-2-基)甲基氨基(喹啉-4-甲酰胺(化合物10)
用2-硝基-n,n'-双((四氢呋喃-2-基)甲基)乙烯-1,1-二胺代替实施例1中的2-硝基-n,n'-双(4-(三氟甲基)苄基)乙烯-1,1-二胺,进行反应可得到黄色固体6-氟-3-硝基-n–((四氢呋喃-2-基)甲基)-2–((四氢呋喃-2-基)甲基氨基(喹啉-4-甲酰胺(化合物10),产率80%。熔点:136.5~136.7℃。
高分辨质谱c20h23fn4o3[(m+h)+],理论值419.1725;实测值,419.1728。
实施例11:合成n-丁基-2-(丁基氨基)-6-氟-3-硝基喹啉-4-甲酰胺(化合物11)
用n,n'-二丁基-2-硝基乙烯-1,1-二胺代替实施例1中的2-硝基-n,n'-双(4-(三氟甲基)苄基)乙烯-1,1-二胺进行反应可得到红色固体n-丁基-2-(丁基氨基)-6-氟-3-硝基喹啉-4-甲酰胺(化合物11),产率95%。熔点:126.0~126.3℃。
高分辨质谱c18h23fn4o3[(m+h)+],理论值363.1827;实测值,363.1830。
实施例12:合成n-苄基-2-(苄基氨基)-6-溴-3-硝基喹啉-4-甲酰胺(化合物12)
在25毫升圆底烧瓶中加入n,n'-二苄基-2-硝基乙烯-1,1-二胺(1毫摩尔)和5-溴二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入乙腈(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至75℃下反应16小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升二氯甲烷和3克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离干燥得红色固体产品n-苄基-2-(苄基氨基)-6-溴-3-硝基喹啉-4-甲酰胺(化合物12),产率80%。熔点:201.5~201.7℃。
高分辨质谱c24h19brn4o3[(m+h)-],理论值489.0564;实测值,489.0562。
实施例13:合成6-溴-n-丁基-2-(丁基氨基)-3-硝基喹啉-4-甲酰胺(化合物13)
用n,n'-二丁基-2-硝基乙烯-1,1-二胺代替实施例12中的n,n'-二苄基-2-硝基乙烯-1,1-二胺,进行反应可得到黄色固体6-溴-n-丁基-2-(丁基氨基)-3-硝基喹啉-4-甲酰胺(化合物13),产率90%。熔点:161.4~161.6℃。
高分辨质谱c18h23brn4o3[(m+h)-],理论值421.0875;实测值,421.0880。
实施例14:合成(4-(三氟甲基)苄基)-2-(4-(三氟甲基)苄基氨基)喹啉-4-甲酰胺(化合物14)
用二氢吲哚-2,3-二酮代替实施例1中的5-氟二氢吲哚-2,3-二酮,进行反应可得到黄色固体(4-(三氟甲基)苄基)-2-(4-(三氟甲基)苄基氨基)喹啉-4-甲酰胺(化合物14),产率80%。熔点:219.7~219.9℃。
高分辨质谱c26h18f6n4o3[(m+h)+],理论值549.1356;实测值,549.1355。
实施例15:合成n-(4-氟苄基)-2-(4-氟苄基氨基)-3-硝基喹啉-4-甲酰胺(化合物15)
用二氢吲哚-2,3-二酮代替实施例2中的5-氟二氢吲哚-2,3-二酮,进行反应可得到黄色固体n-(4-氟苄基)-2-(4-氟苄基氨基)-3-硝基喹啉-4-甲酰胺(化合物15),产率90%。熔点:183.3~183.5℃。
高分辨质谱c24h18f2n4o3[(m+h)+],理论值449.1420;实测值,449.1419。
实施例16:合成n-苄基-2-(苄基氨基)-3-硝基喹啉-4-甲酰胺(化合物16)
用二氢吲哚-2,3-二酮代替实施例3中的5-氟二氢吲哚-2,3-二酮,进行反应可得到黄色固体n-苄基-2-(苄基氨基)-3-硝基喹啉-4-甲酰胺(化合物16),产率80%。熔点:195.2~195.5℃。其单晶如图1所示。
高分辨质谱c24h20n4o3[(m+h)-],理论值411.1457;实测值,411.1465。
实施例17:合成n-(4-甲基苄基)-2-(4-甲基苄基氨基)-3-硝基喹啉-4-甲酰胺(化合物17)
在25毫升圆底烧瓶中加入n,n'-双(4-甲基苄基)-2-硝基乙烯-1,1-二胺(1毫摩尔)和二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入5毫升二氯甲烷和5克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离干燥得红色固体产品n-(4-甲基苄基)-2-(4-甲基苄基氨基)-3-硝基喹啉-4-甲酰胺(化合物17),产率85%。熔点:208.6~208.8℃。
高分辨质谱c26h24n4o3[(m+h)+],理论值441.1921;实测值,441.1920。
实施例18:合成n-(4-甲氧基苄基)-2-(4-甲氧基苄基氨基)-3-硝基喹啉-4-甲酰胺(化合物18)
用二氢吲哚-2,3-二酮代替实施例4中的5-氟二氢吲哚-2,3-二酮,进行反应可得到红色固体n-(4-甲氧基苄基)-2-(4-甲氧基苄基氨基)-3-硝基喹啉-4-甲酰胺(化合物18),产率80%。熔点:214.4~214.6℃。
高分辨质谱c26h24n4o5[(m+h)-],理论值471.1675;实测值,411.1675。
实施例19:合成n-(2,4-二氟苄基)-2-(2,4-二氟苄基氨基)-3-硝基喹啉-4-甲酰胺(化合物19)
用二氢吲哚-2,3-二酮代替实施例5中的5-氟二氢吲哚-2,3-二酮,进行反应可得到黄色固体n-(2,4-二氟苄基)-2-(2,4-二氟苄基氨基)-3-硝基喹啉-4-甲酰胺(化合物19),产率90%。熔点:214.4~214.6℃。
高分辨质谱c24h16f4n4o3[(m+h)-],理论值483.1086;实测值,483.1081。
实施例20:合成n-(3,4-二氟苄基)-2-(3,4-二氟苄基氨基)-3-硝基喹啉-4-甲酰胺(化合物20)
用二氢吲哚-2,3-二酮代替实施例6中的5-氟二氢吲哚-2,3-二酮,可得到黄色固体n-(3,4-二氟苄基)-2-(3,4-二氟苄基氨基)-3-硝基喹啉-4-甲酰胺(化合物20),产率90%。熔点:185.0~185.2℃。
高分辨质谱c24h16f4n4o3[(m+h)-],理论值483.1086;实测值,483.1084。
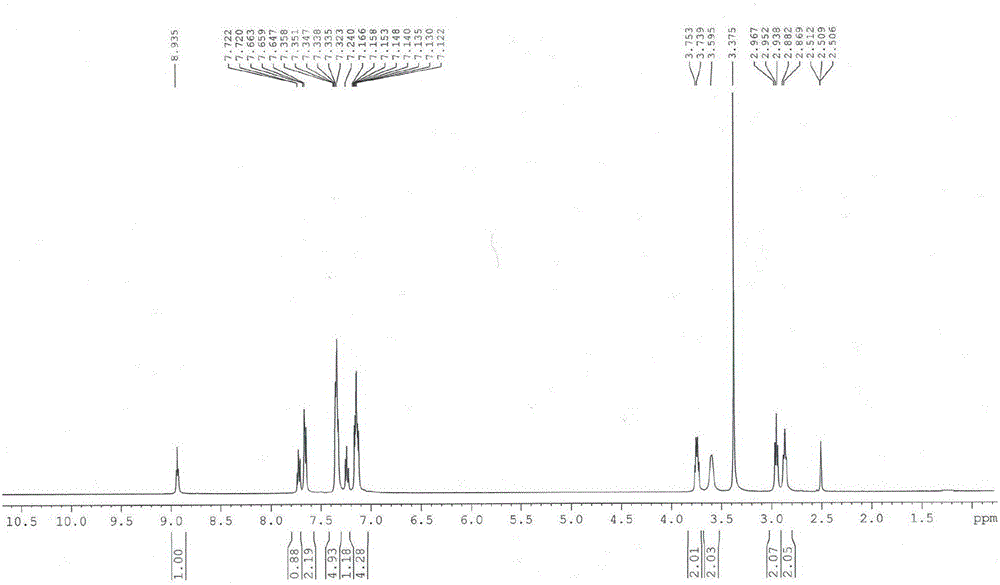
实施例21:合成n-(4-氟苯乙基)-2-(4-氟苯乙基氨基)-3-硝基喹啉-4-甲酰胺(化合物21)
用二氢吲哚-2,3-二酮代替实施例7中的5-氟二氢吲哚-2,3-二酮,可得到红色固体n-(4-氟苯乙基)-2-(4-氟苯乙基氨基)-3-硝基喹啉-4-甲酰胺(化合物21),产率85%。熔点:155.5~155.7℃。其核磁氢谱如图2所示和核磁碳谱如图3所示。
高分辨质谱c26h22f2n4o3[(m+h)+],理论值477.1733;实测值,477.1735。
实施例22:合成3-硝基-n-苯乙基-2-(苯乙基氨基)喹啉-4-甲酰胺(化合物22)
用二氢吲哚-2,3-二酮代替实施例8中的5-氟二氢吲哚-2,3-二酮,可得到黄色固体3-硝基-n-苯乙基-2-(苯乙基氨基)喹啉-4-甲酰胺(化合物22),产率80%。熔点:155.5~155.6℃。
高分辨质谱c26h24n4o3[(m+h)-],理论值439.1770实测值,439.1776。
实施例23:合成n-(2-氟苯乙基)-2-(2-氟苯乙基氨基)-3-硝基喹啉-4-甲酰胺(化合物23)
用二氢吲哚-2,3-二酮代替实施例9中的5-氟二氢吲哚-2,3-二酮,可得到黄色固体n-(2-氟苯乙基)-2-(2-氟苯乙基氨基)-3-硝基喹啉-4-甲酰胺(化合物23),产率85%。熔点:152.3~152.5℃。
高分辨质谱c26h22f2n4o3[(m+h)+],理论值477.1733;实测值,477.1726。
实施例24:合成3-硝基-n–((四氢呋喃-2-基)甲基)-2–((四氢呋喃-2-基)甲基氨基)喹啉-4-甲酰胺(化合物24)
用二氢吲哚-2,3-二酮代替实施例10中的5-氟二氢吲哚-2,3-二酮,可得到红色固体3-硝基-n–((四氢呋喃-2-基)甲基)-2–((四氢呋喃-2-基)甲基氨基)喹啉-4-甲酰胺(化合物24),产率80%。熔点:147.7~147.9℃。
高分辨质谱c20h24n4o5[(m+h)+],理论值401.1819;实测值,401.1817。
实施例25:合成n-丁基-2-(丁基氨基)-3-硝基喹啉-4-甲酰胺(化合物25)
用二氢吲哚-2,3-二酮代替实施例11中的5-氟二氢吲哚-2,3-二酮,可得到红色固体n-丁基-2-(丁基氨基)-3-硝基喹啉-4-甲酰胺(化合物25),产率90%。熔点:128.0~128.3℃。
高分辨质谱c18h24n4o3[(m+h)+],理论值345.1921;实测值,345.1919。
实施例26:合成n-(4-氟苄基)-2-(4-氟苄基氨基)-6-甲基-3-硝基喹啉-4-甲酰胺(化合物26)
在25毫升圆底烧瓶中加入n,n'-双(4-氟苄基)-2-硝基乙烯-1,1-二胺(1毫摩尔)和5-甲基二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=5:1的洗脱液硅胶柱分离干燥得红色固体产品n-(4-氟苄基)-2-(4-氟苄基氨基)-6-甲基-3-硝基喹啉-4-甲酰胺(化合物26),产率85%。熔点:237.2~237.5℃。
高分辨质谱c25h20f2n4o3[(m+h)-],理论值461.1425;实测值,461.1429。
实施例27:合成n-(4-氟苯乙基)-2-(4-氟苯乙基氨基)-6-甲基-3-硝基喹啉-4-甲酰胺(化合物27)
在25毫升圆底烧瓶中加入n,n'-双(4-氟苯乙基)-2-硝基乙烯-1,1-二胺(1毫摩尔)和5-甲基二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离干燥得红色固体产品n-(4-氟苯乙基)-2-(4-氟苯乙基氨基)-6-甲基-3-硝基喹啉-4-甲酰胺(化合物27),产率85%。熔点:151.7~151.9℃。
高分辨质谱c27h24f2n4o3[(m+h)-],理论值491.1889;实测值,491.1888。
实施例28:合成n-(2-氟苯乙基)-2-(2-氟苯乙基氨基)-6-甲基-3-硝基喹啉-4-甲酰胺(化合物28)
在25毫升圆底烧瓶中加入n,n'-双(2-氟苯乙基)-2-硝基乙烯-1,1-二胺(1毫摩尔)和5-甲基二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离干燥得黄色固体产品n-(2-氟苯乙基)-2-(2-氟苯乙基氨基)-6-甲基-3-硝基喹啉-4-甲酰胺(化合物28),产率80%。熔点:143.2~143.5℃。
高分辨质谱c27h24f2n4o3[(m+h)+],理论值491.1889;实测值,491.1885。
实施例29:合成n-丁基-2-(丁基氨基)-6-甲基-3-硝基喹啉-4-甲酰胺(化合物29)
在25毫升圆底烧瓶中加入n,n'-二丁基-2-硝基乙烯-1,1-二胺(1毫摩尔)和5-甲基二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离干燥得红色固体产品n-丁基-2-(丁基氨基)-6-甲基-3-硝基喹啉-4-甲酰胺(化合物29),产率90%。熔点:135.0~135.3℃。
高分辨质谱c19h26n4o3[(m+h)+],理论值359.2078;实测值,359.2078。
实施例30:合成n-(4-氯苄基)-2-(4-氯苄基氨基)-7-氟-3-硝基喹啉-4-甲酰胺(化合物30)
在25毫升圆底烧瓶中加入(e)-n-4-氯苄基)-n-(4-甲基苄基)-2-硝基乙烯-1,1-二胺(1毫摩尔)和7-氟二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水mgso4进行干燥,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离干燥得黄色固体产品n-(4-氯苄基)-2-(4-氯苄基氨基)-7-氟-3-硝基喹啉-4-甲酰胺(化合物30),产率75%。熔点:214.5~214.7℃。
高分辨质谱c24h17cl2fn4o3[(m+h)-],理论值497.0583;实测值,497.0588。
实施例31:合成n-苄基-2-(苄基氨基)-7-氟-3-硝基喹啉-4-甲酰胺(化合物31)
在25毫升圆底烧瓶中加入n,n'-二苄基-2-硝基乙烯-1,1-二胺(1毫摩尔)和7-氟二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离干燥得黄色固体产品n-苄基-2-(苄基氨基)-7-氟-3-硝基喹啉-4-甲酰胺(化合物31),产率80%。熔点:182.5~182.7℃。
高分辨质谱c24h20fn4o3[(m+h)-],理论值429.1363;实测值,429.1370。
实施例32:合成n-丁基-2-(丁基氨基)-7-氟-3-硝基喹啉-4-甲酰胺(化合物32)
在25毫升圆底烧瓶中加入n,n'-二丁基-2-硝基乙烯-1,1-二胺(1毫摩尔)和7-氟二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离干燥得红色固体产品n-丁基-2-(丁基氨基)-7-氟-3-硝基喹啉-4-甲酰胺(化合物32),产率90%。熔点:122.5~122.7℃。
高分辨质谱c18h23fn4o3[(m+h)-],理论值361.1676;实测值,361.1684。
实施例33:合成n-(4-氟苄基)-3-硝基-2-(苯基氨基)喹啉-4-甲酰胺(化合物33)
在25毫升圆底烧瓶中加入(e)-n-(4-氟苄基)-2-硝基-n-苯基乙烯-1,1-二胺(1毫摩尔)和二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=5:1的洗脱液硅胶柱分离干燥得红色固体产品n-(4-氟苄基)-3-硝基-2-(苯基氨基)喹啉-4-甲酰胺(化合物33),产率58%。熔点:147.2–148.5℃。
核磁共振氢谱(氘代二甲亚砜,brukeram500仪):δ=4.47(d,j=6.0hz,2h,nch2),7.03(s,1h,arh),7.14(t,j=8.5hz,2h,arh),7.29–7.32(m,2h,arh),7.36–7.39(m,3h,arh),7.60–7.66(m,2h,arh),7.72–7.74(m,2h,arh),9.21(s,1h,nh),9.43(s,1h,conh);
核磁共振碳谱(氘代二甲亚砜,brukeram500仪):δ=42.6,115.5(d,j=21.3hz),119.5,121.6,123.7,125.6,127.1(d,j=11.3hz),129.1,130.2(d,j=7.5hz),131.1,133.7,135.0,139.9,141.4,145.2,147.9,160.9(d,j=245.0hz),163.2.
高分辨质谱c23h17fn4o3[(m+h)+],理论值417.1357;实测值,417.1360。
实施例34:合成n-(4-氟苄基)-3-硝基-2-(对甲苯基氨基)喹啉-4-甲酰胺(化合物34)
在25毫升圆底烧瓶中加入(e)-n-(4-氟苄基)-2-硝基-n-(对甲苯基)乙烯-1,1-二胺(1毫摩尔)和二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=5:1的洗脱液硅胶柱分离干燥得红色固体产品n-(4-氟苄基)-3-硝基-2-(对甲苯基氨基)喹啉-4-甲酰胺(化合物34),产率62%。熔点:175.2–176.5℃。
核磁共振氢谱(氘代二甲亚砜,brukeram500仪):δ=2.23(s,3h,ch3),4.47(d,j=5.5hz,2h,nch2),7.10–7.17(m,4h,arh),7.34–7.39(m,3h,arh),7.58–7.61(m,4h,arh),7.68–7.71(m,1h,arh),9.13(s,1h,nh),9.40(t,j=6.0hz,1h,conh);
核磁共振碳谱(氘代二甲亚砜,brukeram500仪):δ=21.0,42.6,115.6(d,j=21.3hz),119.6,121.9,125.3,127.1,129.5,130.2(d,j=7.5hz),131.0,132.8,133.7,135.1,137.3,141.4,145.4,148.1,161.0(d,j=241.3hz),163.3.
高分辨质谱c24h19fn4o3[(m+h)+],理论值431.1514;实测值,431.1519。
实施例35:合成n-苄基-6-甲基-3-硝基-2-(苯基氨基)喹啉-4-甲酰胺(化合物35)
在25毫升圆底烧瓶中加入(e)-n-苄基-2-硝基-n-苯基乙烯-1,1-二胺(1毫摩尔)和5-甲基二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=5:1的洗脱液硅胶柱分离干燥得红色固体产品n-苄基-6-甲基-3-硝基-2-(苯基氨基)喹啉-4-甲酰胺(化合物35),产率52%。熔点:208.0–208.5℃。
核磁共振氢谱(氘代二甲亚砜,brukeram500仪):δ=2.30(s,3h,ch3),4.70(t,j=5.5hz,2h,nch2),7.08–7.26(m,2h,arh),7.31–7.40(m,2h,arh),7.48–7.50(m,5h,arh),7.51–7.53(m,2h,arh),7.60–7.61(m,2h,arh),8.18(t,j=6.0hz,1h,nh),10.80(s,1h,conh);
核磁共振碳谱(氘代二甲亚砜,brukeram500仪):δ=21.3,44.6,118.4,120.2,124.8,125.5,126.7,127.2,128.1,128.7,129.3,129.5,134.0,136.3,138.9,140.2,141.2,147.8,148.1,162.3.
高分辨质谱c24h20n4o3[(m+h)+],理论值413.1608;实测值,413.1607。
实施例36:合成2-(苄基氨基)-6-甲基-3-硝基-n-苯基喹啉-4-甲酰胺(化合物36)
在25毫升圆底烧瓶中加入(e)-n-苄基-2-硝基-n-苯基乙烯-1,1-二胺(1毫摩尔)和5-甲基二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=10:1的洗脱液硅胶柱分离干燥得红色固体产品n-苄基-6-甲基-3-硝基-2-(苯基氨基)喹啉-4-甲酰胺(化合物36),产率40%。熔点:188.2–189.5℃。
核磁共振氢谱(氘代二甲亚砜,brukeram500仪):δ=δ=2.28(s,3h,ch3),4.49(d,j=5.0hz,2h,nch2),7.0(s,1h,arh),7.25–7.37(m,8h,arh),7.55(d,j=2.0hz,2h,arh),7.72(d,j=7.5hz,2h,arh),9.14(br,1h,nh),9.42(s,1h,conh);
核磁共振碳谱(氘代二甲亚砜,brukeram500仪):δ=21.3,43.3,119.5,121.3,123.4,125.7,127.0,127.7,128.3,128.6,128.9,129.0,131.1,134.9,135.7,139.0,140.1,140.9,144.8,146.4,163.3.
高分辨质谱c24h20n4o3[(m+h)+],理论值413.1608;实测值,413.1606。
实施例37:合成n-(4-氟苄基)-6-甲基-3-硝基-2-(苯基氨基)喹啉-4-甲酰胺(化合物37)
在25毫升圆底烧瓶中加入(e)-n-(4-氟苄基)-2-硝基-n-苯基乙烯-1,1-二胺(1毫摩尔)和5-甲基二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和、对甲苯磺酸(1毫摩尔)磁力搅拌下加热至110℃下,回流反应14小时。tlc监测反应,待原料点完全消失后反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=5:1的洗脱液硅胶柱分离干燥得红色固体产品n-(4-氟苄基)-6-甲基-3-硝基-2-(苯基氨基)喹啉-4-甲酰胺(化合物37),产率50%。熔点:235.2–236.5℃。
高分辨质谱c24h19fn4o3[(m+h)+],理论值431.1514;实测值,431.1512。
实施例38:合成2–((4-氟苄基)氨基)-6-甲基-3-硝基-n-苯基喹啉-4-甲酰胺(化合物38)
在25毫升圆底烧瓶中加入(e)-n-(4-氟苄基)-2-硝基-n-苯基乙烯-1,1-二胺(1毫摩尔)和5-甲基二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升)和乙酸(1毫摩尔)磁力搅拌下加热至110℃下,回流反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=2:1的洗脱液硅胶柱分离干燥得红色固体产品n-(4-氟苄基)-6-甲基-3-硝基-2-(苯基氨基)喹啉-4-甲酰胺(化合物38),产率30%。熔点:191.2–192.5℃。
高分辨质谱c24h19fn4o3[(m+h)+],理论值431.1514;实测值,431.1511。
实施例39:合成n-苄基-8-氟-3-硝基-2-(苯基氨基)喹啉-4-甲酰胺(化合物39)
在25毫升圆底烧瓶中加入(e)-n-苄基-2-硝基-n-苯基乙烯-1,1-二胺(1毫摩尔)和7-氟二氢吲哚-2,3-二酮(1.1毫摩尔)后,加入甲苯(15毫升),三氯醋酸(1毫摩尔)磁力搅拌下加热至110℃下,回流反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升二氯甲烷和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离干燥得红色固体产品n-苄基-8-氟-3-硝基-2-(苯基氨基)喹啉-4-甲酰胺(化合物39),产率70%。熔点:218.2–219.5℃。
高分辨质谱c23h17fn4o3[(m+h)+],理论值417.1357;实测值,417.1362。
实施例40:合成n-苄基-8-氟-3-硝基-2-(对甲苯基氨基)喹啉-4-甲酰胺(化合物40)
在25毫升圆底烧瓶中加入(e)-n-苄基-2-硝基-n-(对甲苯基)乙烯-1,1-二胺(1毫摩尔)和7-氟二氢吲哚-2,3-二酮(1毫摩尔)后,加入甲苯(15毫升)和三氟醋酸(1毫摩尔)磁力搅拌下加热至110℃下,回流反应14小时。tlc监测反应,待原料点完全消失后,反应液中加入50毫升乙酸乙酯和50毫升饱和氯化钠水溶液进行萃取,有机层用无水na2so4进行干燥,将经过干燥的有机相减压浓缩至干,之后对浓缩蒸干物加入3毫升丙酮和4克100~200目硅胶搅拌均匀后,减压蒸干,上样,用石油醚/乙酸乙酯=7:1的洗脱液硅胶柱分离干燥得红色固体产品n-苄基-8-氟-3-硝基-2-(对甲苯基氨基)喹啉-4-甲酰胺(化合物40),产率65%。熔点:220.2–221.5℃。
高分辨质谱c24h19fn4o3[(m+h)+],理论值431.1514;实测值,431.1520。
以上所合成的3-硝基喹啉类衍生物结构如表1所示:
表13-硝基喹啉类衍生物结构式
第二部分本发明化合物的抗肿瘤活性:
应用例
随机选择对本发明6个化合物进行针对三种人类肿瘤细胞株实验:hct116(人结直肠癌),、ht29(结肠癌)。将细胞测试用化合物孵育144小时,然后采用mtt测定法测量细胞毒性(mossman,t.j.immunol.methods1983,65,55“细胞活力的快速比色测试法;细胞毒性和生长抑制淋巴因子定量的应用”。green,l.m.j.immunol.methods1984,70,257“细胞活力的快速比色测试法;细胞毒性和生长抑制淋巴因子定量的应用”),结果如表2所示。
所得数据证实,所发明化合物具有对人结-直结肠癌(hct116)、人结肠癌(ht29),较好的抗肿瘤活性。实验研究表明,化合物5、6、30和39对hct116细胞株的ic50(μmol/l)分别为5.02、8.13、6.05、6.25均小于顺铂的ic50(μmol/l)=8.74,且都小于10μmol/l,相对于顺铂显示出优越的抗癌活性。这4个化合物同时对hct116(人结-直肠癌)细胞株也表现出优越的抗癌活性,ic50分别为7.15μmol/l、9.56μmol/l、9.20μmol/l、8.36μmol/l,均小于阳性对照药物顺铂的ic50=12.78μmol/l,且都小于10.0μmol/l。
表2本发明化合物对人体肿瘤细胞株的细胞毒素活性
注:表中ic50值单位为μmol/l。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!
- 阿加曲班中间体酯化物4‑甲基‑2‑哌啶甲酸乙酯的制备方法与流程
- 一种吲哚啉‑2‑酮类化合物的合成方法与流程
- 一种环件粗加工冲压成型装置的制造方法
- 一种含噁嗪草酮和异丙甲草胺的除草剂组合物及其应用的制造方法与工艺
- 一种含噁嗪草酮和二甲四氯二甲胺盐的除草剂组合物的制造方法与工艺
- (2S,3S)‑7‑氟‑2‑(4‑氟苯基)‑3‑(1‑甲基‑1H‑1,2,4‑三唑‑5‑基)‑4‑氧代‑1,2,3,4‑四氢喹啉‑5‑羧酸甲酯的共形成体盐及其制备方法与流程
- 苄基取代的吲唑类化合物的制造方法与工艺
- 作为新抗癌药的被取代的2,4二氨基‑喹啉的制造方法与工艺
- 一种(R)-吡喹酮胺盐及左旋吡喹酮的制备方法与流程
- 一种左旋吡喹酮的制备方法与流程