一种可视检测铜离子的荧光探针及其制备方法和应用与流程
本发明属于分析化学技术领域,尤其涉及一种可视检测铜离子的荧光探针及其制备方法和应用。
背景技术:
铜离子(cu2+)是人体中第三丰富的元素,并且在生物体的各种基本生理过程中具有重要作用。但是细胞中cu2+的浓度变化会导致各种疾病,包括阿尔茨海默病、缅克斯综合症、肝豆状核变性病,甚至癌症等。此外,cu2+被广泛的运用到工业和农业中,所以它也是一种严重的环境污染物。因此,寻找一种简便、快捷检测方法对cu2+进行分析检测具有重要意义。现有测定cu2+的方法主要是原子吸收光谱法和分光光度法,但前者需要复杂的仪器及熟练的技术人员及高昂的检测费用,后者需要繁琐的操作,所以都不是理想的cu2+检测方法。荧光探针具有灵敏度高、选择性好等优点,并已成为检测重金属离子的有效手段。
目前关于cu2+荧光探针的研究中,大多是基于荧光或比色的原理。而可视化的荧光探针不仅具有荧光探针的优点,而且具有比色检测的优点,如成本低,操作简单,方便等。因此,开发可视检测cu2+的荧光探针越来越受到重视。
技术实现要素:
本发明要解决的技术问题是克服现有技术的不足,提供一种灵敏度高、选择性好和响应时间短的可视检测铜离子的荧光探针,还相应提供该可视检测铜离子的荧光探针的制备方法及应用。
为解决上述技术问题,本发明采用以下技术方案:
一种可视检测铜离子的荧光探针,所述可视检测铜离子的荧光探针为2-(4-吡啶甲酸酯苯乙烯基)-1,3,3-三甲基-3h-吲哚碘盐,结构式如式(1):
作为一个总的发明构思,本发明还提供一种上述的可视检测铜离子的荧光探针的制备方法,包括以下步骤:
(1)4-羟基苯甲醛和2-吡啶甲酸发生酯化反应,得到4-吡啶甲酸酯苯甲醛,结构式如式(2):
(2)4-吡啶甲酸酯苯甲醛与1,2,3,3-四甲基-3h-吲哚碘盐发生缩合反应,得到式(1)所示的化合物。
优选的,所述步骤(1)的具体过程为:
将4-羟基苯甲醛溶于有机溶剂中,并加入2-吡啶甲酸、脱水剂和催化剂,在保护气氛下搅拌1.5~2h,淬灭,有机溶剂萃取,所得有机相经后处理,得到4-吡啶甲酸酯苯甲醛。
优选的,所述脱水剂为1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐,所述催化剂为4-二甲氨基吡啶;所述后处理具体过程为:将所得有机相分别用0.1n盐酸和饱和盐水洗涤,无水硫酸钠干燥后,蒸发,得到粗固体,过硅胶色谱柱纯化,得到4-吡啶甲酸酯苯甲醛。
优选的,所述4-羟基苯甲醛、2-吡啶甲酸、1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐和4-二甲氨基吡啶的摩尔比为1∶1.2~1.5∶1.2~1.5∶0.3~0.6;柱色谱分离洗脱剂为乙酸乙酯和石油醚,所述乙酸乙酯与石油醚的体积比为1∶2~4。
优选的,所述步骤(2)的具体过程为:
将4-吡啶甲酸酯苯甲醛、1,2,3,3-四甲基-3h-吲哚碘盐和无水醋酸钠溶于无水醋酐中,在氩气保护下加热至70~80℃反应4~6h,冷却至室温,淬灭,过滤,洗涤后得到2-(4-吡啶甲酸酯苯乙烯基)-1,3,3-三甲基-3h-吲哚碘盐。
优选的,所述4-吡啶甲酸酯苯甲醛、1,2,3,3-四甲基-3h-吲哚碘盐和无水醋酸钠的摩尔比为1.2~1.5∶1∶1.2~1.5。
作为一个总的发明构思,本发明还提供一种如上述的可视检测铜离子的荧光探针或上述的制备方法制得的可视检测铜离子的荧光探针的应用,将可视检测铜离子的荧光探针与hepes和乙腈的缓冲液混合,再加入待测溶液,得到混合溶液,利用混合溶液的颜色变化以及荧光变化来检测铜离子的存在与否。
优选的,所述待测溶液中无铜离子时,所述混合溶液为无色并且无荧光发射,所述待测溶液中有铜离子时,所述混合溶液颜色变为粉红色,并且发出荧光。
优选的,所述可视检测铜离子的荧光探针检测铜离子的检出浓度下限为0.2μm。
与现有技术相比,本发明的优点在于:
1、本发明的一种可视检测铜离子的荧光探针,是以2-(4-羟基苯乙烯基)-1,3,3-三甲基-3h-吲哚碘盐作为荧光团,以吡啶甲酸酯作为识别单元的荧光探针。基于吲哚盐的2-(4-羟基苯乙烯基)-1,3,3-三甲基-3h-吲哚碘盐不仅具有良好水溶性,而且具有典型的“推-拉”结构,表现出优良的光学性能。当羟基被吸电子基团2-吡啶甲酰基保护后,使其“推”电子的能力降低,并伴随吸收光谱和荧光光谱的变化,同时吡啶甲酸酯基团很容易被cu2+水解。
2、本发明的可视检测铜离子的荧光探针的制备方法,只需两步就可以完成,且后处理过程简单。
3、本发明的可视检测铜离子的荧光探针的应用中,当该荧光探针分子在铜离子与其他阳离子共存体系中,表现出较高的选择性和灵敏度。
附图说明
图1为实施例1的式(1)所示的化合物(即可视检测铜离子的荧光探针)的合成路线图。
图2为实施例1制备的式(2)所示的化合物的1hnmr图谱。
图3为实施例1制备的式(2)所示的化合物的13cnmr图谱。
图4为实施例1制备的式(2)所示的化合物的esi-ms图谱。
图5为实施例1制备的式(1)所示的化合物的1hnmr图谱。
图6为实施例1制备的式(1)所示的化合物的13cnmr图谱。
图7为实施例1制备的式(1)所示的化合物的esi-ms图谱。
图8为不同ph值对实施例1的式(1)所示的化合物与cu2+反应前后荧光强度的影响示意图。
图9为实施例1的式(1)所示的化合物与cu2+反应前后的吸收光谱图。
图10为实施例1的式(1)所示的化合物与cu2+反应后的荧光光谱图;其中,(a)图为式(1)所示的化合物与cu2+反应后不同光谱条件下荧光光谱的变化,(b)图为式(1)所示的化合物与cu2+反应后在557nm处的荧光强度随时间的变化。
图11为实施例1的式(1)所示的化合物与cu2+反应的原理图。
图12为实施例1的式(1)所示的化合物加入不同金属离子溶液中前后的颜色变化图。
图13为实施例1的式(1)所示的化合物加入不同金属离子溶液中前后的吸收光谱图;其中(a)图为式(1)所示的化合物加入单一金属离子溶液中前后的吸收光谱图,(b)图为式(1)所示的化合物加入含cu2+和另一不同金属离子溶液中前后的吸收光谱图。
图14为实施例1的式(1)所示的化合物加入不同金属离子溶液中前后的荧光强度变化图(灰柱代表探针只经标注的金属离子处理,黑柱代表探针经cu2+处理后再添加标注的金属离子;其中,横坐标各数字具体代表如下:1.无金属离子,2.na+,3.k+,4.ca2+,5.mg2+,6.ag+,7.zn2+,8.cd2+,9.hg2+,10.ba2+,11.pb2+,12.mn2+,13.ni2+,14.co2+,15.fe3+,16.al3+,17.以上所有离子混合,18.cu2+)。
图15为不同cu2+浓度对实施例1的式(1)所示的化合物与cu2+反应后557nm处荧光强度的影响示意图;其中(a)图为不同cu2+浓度条件下式(1)所示的化合物与cu2+反应后在557nm处荧光强度随时间的变化,(b)图为式(1)所示的化合物在557nm处的荧光强度随cu2+浓度的变化。
具体实施方式
以下结合具体优选的实施例对本发明作进一步描述,但并不因此而限制本发明的保护范围。
实施例1:
一种本发明的可视检测铜离子的荧光探针,为2-(4-吡啶甲酸酯苯乙烯基)-1,3,3-三甲基-3h-吲哚碘盐,分子式为c25h23in2o2,结构式如式(1)所示:
上述本发明的可视检测铜离子的荧光探针的制备方法,其合成路线如图1所示,包括以下步骤:
(1)合成化合物4-吡啶甲酸酯苯甲醛,结构式如式(2):
反应式如式(3):
具体过程为:将4-羟基苯甲醛(1.95g,16mmol)溶于无水二氯甲烷,再加入2-吡啶甲酸(2.44g,20mmol)、1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(edci,3.83g,20mmol)和4-二甲氨基吡啶(dmap,0.73g,6mmol),将所得的混合溶液在氩气保护及室温下搅拌2h以进行酯化反应,反应完全后,用水淬灭,再采用二氯甲烷(dcm)分两次萃取,每次萃取剂用量10ml,合并有机相,有机相分别用0.1n盐酸和饱和盐水洗涤,无水硫酸钠干燥后,蒸发,得到粗固体,过硅胶色谱柱纯化,柱色谱分离洗脱剂为乙酸乙酯和石油醚梯度洗脱,所述乙酸乙酯与石油醚的体积比为1∶4~2,得到4-吡啶甲酸酯苯甲醛,产率为76%。
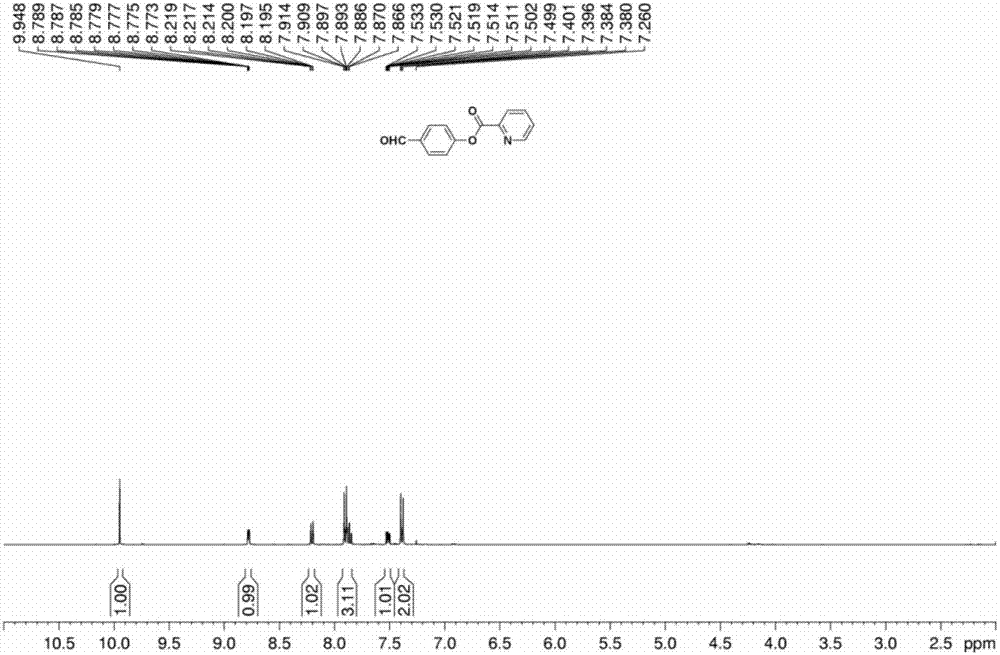
所得的4-吡啶甲酸酯苯甲醛的1hnmr图谱如图2所示,1hnmr(400mhz,cdcl3,ppm)δ9.95(s,1h),8.88-8.77(m,1h),8.22-8.19(m,1h),7.91-7.87(m,3h),7.53-7.50(m,1h),7.40-7.38(m,2h)。
所得的4-吡啶甲酸酯苯甲醛的13cnmr图谱如图3所示,13cnmr(100mhz,cdcl3,ppm)δ190.81,163.17,155.54,150.18,146.86,137.33,134.29,131.21,127.73,126.00,122.52。
所得的4-吡啶甲酸酯苯甲醛的esi-ms图谱如图4所示,esi-msm/zforc13h10no3+([m+h]+):calcd:228.1,found:228.1。
(2)合成结构式如式(1)所示的2-(4-吡啶甲酸酯苯乙烯基)-1,3,3-三甲基-3h-吲哚碘盐:
反应式如式(4):
具体过程为:将步骤(1)所得的4-吡啶甲酸酯苯甲醛(340mg,1.5mmol),1,2,3,3-四甲基-3h-吲哚碘盐(301mg,1mmol)和无水醋酸钠(123mg,1.5mmol)溶于无水醋酐(2ml)中,在氩气保护下加热至80℃反应6h,反应完全后,冷却至室温,用水(8ml)淬灭,有固体析出,过滤并用乙酸乙酯洗涤,收集固体即为铜离子荧光探针,即式(1)所示的化合物,产率为35%。
式(1)所示的化合物的1hnmr图谱如图5所示,1hnmr(400mhz,cdcl3,ppm)δ8.86(d,j=4.0hz,1h),8.29-8.23(m,4h),7.97(t,j=8.0hz,1h),7.80(d,j=16.4hz,1h),7.67(t,j=3.6hz,1h),7.60-7.57(m,4h),7.43(d,j=8.8hz,2h),4.46(s,3h),1.88(s,6h)。
式(1)所示的化合物的13cnmr图谱如图6所示,13cnmr(100mhz,cdcl3,ppm)δ182.89,163.36,155.24,153.05,150.42,147.12,143.22,141.73,137.51,132.92,131.93,130.30,129.88,127.86,126.22,123.09,122.74,115.33,113.79,52.98,37.73,26.87。
式(1)所示的化合物的esi-ms图谱如图7所示,esi-msm/zforc25h23n2o2+([m-i]+):calcd:383.2,found:383.2。
上述本实施例制得的可视检测铜离子的荧光探针的应用,将在10mmhepes,h2o/ch3cn体积比为4∶1,ph7.0的缓冲溶液2ml加入比色皿中,加入本实施例制得的可视检测铜离子的荧光探针均匀混合后,再加入待测溶液进行测试,该待测溶液中无铜离子时,混合溶液为无色并且无荧光发射,该待测溶液中有铜离子时,反应溶液颜色变为粉红色,并且发出荧光。
上述本发明的可视检测铜离子的荧光探针的应用研究:
1、ph值对式(1)所示的化合物与cu2+反应前后荧光强度的影响研究
取式(1)所示的化合物溶于二甲基亚砜中,制成2mmol/l的储备液。当ph值不同时,在室温下以500nm为激发光测量式(1)所示的化合物与cu2+反应前后的荧光性质,结果如图8所示。实验结果表明,当ph=7.0时,式(1)所示的化合物与cu2+反应的荧光强度变化最大而且速度最快。
2、式(1)所示的化合物与cu2+反应前后的吸收光谱和荧光光谱研究
在最佳测试条件下,即10mmhepes,h2o/ch3cn,4∶1,v/v,ph7.0,25℃,研究式(1)所示的化合物与cu2+反应前后的吸收光谱和荧光光谱性质,结果如图9和图10所示。图9为式(1)所示的化合物与cu2+反应前后吸收光谱的变化;图10中(a)图为式(1)所示的化合物与cu2+反应后不同光谱条件下荧光光谱的变化,即荧光强度随时间不断增强,最后达到稳定,(b)图为式(1)所示的化合物与cu2+反应后在557nm处的荧光强度随时间的变化。实验结果证明,式(1)所示的化合物与cu2+的反应会引起吡啶甲酸酯基的水解,释放荧光团2-(4-羟基苯乙烯基)-1,3,3-三甲基-3h-吲哚碘盐,其原理图如图11所示。因此,式(1)所示的化合物适用于cu2+的快速检测。
3、式(1)所示的化合物对cu2+的选择性研究
为测试式(1)所示的化合物对cu2+的选择性,对式(1)所示的化合物与不同重金属离子反应前后的颜色、吸收光谱和荧光强度(f557nm)的变化进行了实验研究,结果如图12、13和14所示,由图12、13和14可知,式(1)所示的化合物对cu2+检测不受其他具有潜在竞争性的金属离子的干扰,对cu2+检测具有高度的选择性。
4、式(1)所示的化合物检测cu2+的灵敏度研究
不同cu2+浓度条件(0-30μm)下式(1)所示的化合物与cu2+反应后在557nm处荧光强度随时间的变化(图15(a)图)及式(1)所示的化合物在557nm处的荧光强度随cu2+浓度的变化(15(b)图)都进行了实验研究。图15(a)图可知,高浓度cu2+提供更快和更戏剧性的荧光增强。由图15(b)图可以推算出式(1)所示的化合物检测cu2+的检测限为0.2μm,远低于who标准(31μm)和美国环境标准(20μm)。
以上所述,仅是本申请的较佳实施例,并非对本申请做任何形式的限制,虽然本申请以较佳实施例揭示如上,然而并非用以限制本申请,任何熟悉本专业的技术人员,在不脱离本申请技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
- 还没有人留言评论。精彩留言会获得点赞!