EML4‑ALK融合基因无创检测试剂盒的制作方法
本发明属于生物
技术领域:
,涉及一种eml4-alk融合基因无创检测试剂盒。
背景技术:
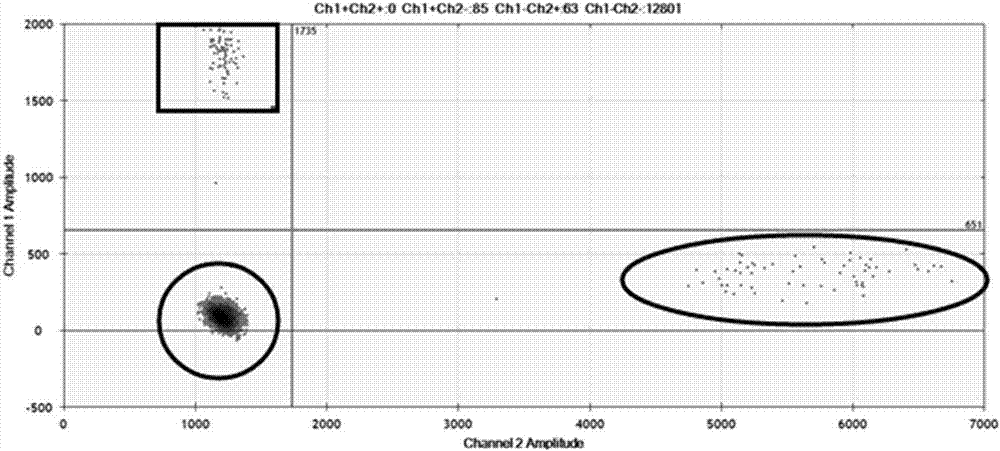
:肺癌是全球发病率和致死率最高的疾病之一,其中非小细胞肺癌约占肺癌的80-85%。目前,约有10种驱动基因在肺腺癌中被发现。临床使用针对这些驱动基因的分子靶向治疗药物,使肺癌的治疗和生存期的延长取得了显著进展,因此寻找更多新的治疗靶点成为当今肺癌研究的热点。除了egfr、kras等熟知的基因突变外,eml4-alk融合基因也被证实为非小细胞肺癌的治疗靶点。eml4-alk在非小细胞肺癌患者中的发生率约为4%~5%,并且在不伴有表皮生长因子受体egfr突变或k-ras突变的腺癌患者中的表达率约为42.80%。已发现的eml4-alk融合方式有十多种,其中以v1(eml4的13号外显子断裂)、v2(eml4的20号外显子)和v3变体(eml4的6号外显子断裂)最为常见。准确鉴定出eml4-alk融合基因的nsclc,并给予相应的治疗是急需的。eml4-alk可以从肿瘤组织、ctcs或从全血中提取的mrna中检测到,但是这些方法有实质性的限制,比如活检评估肿瘤的分子进化和异质性是具有侵入性的,而且并不总是可行,分离ctcs的成本和复杂性很高,从全血中提取mrna具有低灵敏度的缺点。因此需要开发一种无创、简便且灵敏度高的检测方法。血浆外泌体mrna检测融合基因突变是一种很好的方法,可以用于非侵入性的检测疾病进展。外泌体是直径在30-150nm的细胞外囊泡,能通过所有类型细胞进行分泌,并且通过内涵物将信息转运至身体的其他细胞,其内涵物包括:蛋白,脂类和核酸。外泌体在普通的生理学过程以及在疾病的发展中都发挥着作用。目前常用于检测肺癌中alk基因融合的技术有多种,包括免疫组织化学方法(ihc)、荧光原位杂交技术(fish)和逆转录聚合酶链式反应(rt-pcr);此三种检测方法所使用的样本均为组织样本,为有创取样。因为使用dna进行检测融合基因,比较繁琐,需知道内含子的具体断点才可以检测,而内含子的断点非常多且多是未知的。数字pcr是近年来引起重视并迅速发展起来的核酸分子绝对定量技术,由于生物学研究的需要和多学科技术的交叉融合,pcr已经迈入第三代——微滴式数字pcr(dropletdigitalpcr,ddpcr)时代。ddpcr技术是一种通量较高、成本较低的绝对定量技术,可作为基因检测的初筛技术。该技术与传统方法的检测结果符合率高,方法一致性好,相比于目前主流的ngs,数字pcr在如下方面优势突出:操作快速、简便,无需复杂的生物信息学分析,检测灵敏度高。该技术基于单分子pcr方法来进行计数,主要采用当前分析化学热门研究领域的微流控或微滴化方法,将大量稀释后的核酸溶液分散至芯片的微反应器或微滴中,每个反应器的核酸模板数少于或者等于1个。这样经过pcr循环之后,对微滴的荧光信号逐个分析统计。根据相对比例和反应器的体积,就可以推算出原始溶液的核酸浓度,不再依赖ct值或内参基因即可确定低至单拷贝待检靶分子的绝对数目。ddpcr是定量检测的一个敏感的方法,只需极少量的样本即可检测,且灵敏度高和所需样本量少,大大满足了临床珍贵样本如穿刺样本、胸腹水、外周血中靶标序列的微量检测的需求。上述四种方法的优缺点如下表1:表1所以,若想通过dna来检测融合基因的所有类型非常困难,且因使用探针较多,会导致成本较高;若有一种无创的方法获得足够的rna,则可以减少很多成本,且可以检测的相对全面,这就成为研究的热点。技术实现要素:本发明一个目的是提供用于数字pcr检测eml4-alk融合基因突变的成套引物。本发明提供的成套引物,包括内参上游引物eftud2-f1、内参下游引物eftud2-r1、扩增eml4-alk融合基因的正向引物eml4(13)-alk-f2、扩增eml4-alk融合基因的正向引物eml4(20)-alk-f3、扩增eml4-alk融合基因的正向引物eml4(6)-alk-f4、扩增eml4-alk融合基因的反向引物eml4(6/13/20)-alk-r、检测探针alk-eml4(6/13/20)-tar和内参探针eftud2-ref;所述内参上游引物eftud2-f1的核苷酸序列为序列1;所述内参下游引物eftud2-r1的核苷酸序列为序列2;所述扩增eml4-alk融合基因的正向引物eml4(13)-alk-f2的核苷酸序列为序列3;所述扩增eml4-alk融合基因的正向引物eml4(20)-alk-f3的核苷酸序列为序列4;所述扩增eml4-alk融合基因的正向引物eml4(6)-alk-f4的核苷酸序列为序列5;所述扩增eml4-alk融合基因的反向引物eml4(6/13/20)-alk-r的核苷酸序列为序列6;所述检测探针alk-eml4(6/13/20)-tar的核苷酸序列为序列7;所述内参探针eftud2-ref的核苷酸序列为序列8。上述成套引物中,所述检测探针alk-eml4(6/13/20)-tar和所述内参探针eftud2-ref末端标记不同的荧光基团;在实施例中,检测探针alk-eml4(6/13/20)-tar的5'端标记vic,内参探针eftud2-ref的5'端标记fam。或,所述内参上游引物eftud2-f1、内参下游引物eftud2-r1、扩增eml4-alk融合基因的正向引物eml4(13)-alk-f2、扩增eml4-alk融合基因的正向引物eml4(20)-alk-f3、扩增eml4-alk融合基因的正向引物eml4(6)-alk-f4、扩增eml4-alk融合基因的反向引物eml4(6/13/20)-alk-r、检测探针alk-eml4(6/13/20)-tar和探针eftud2-ref的配比为1:1:1:1:1:1:0.25:0.25。本发明另一个目的是提供用于数字pcr检测eml4-alk融合基因突变的试剂。本发明提供的试剂,包括上述成套引物、反转录酶、二硫苏糖醇和含有反转录引物缓冲液(bio-rad公司试剂bio-radsupermix(含有反转录引物))。上述试剂中,所述成套引物中的内参上游引物eftud2-f1、内参下游引物eftud2-r1、扩增eml4-alk融合基因的正向引物eml4(13)-alk-f2、扩增eml4-alk融合基因的正向引物eml4(20)-alk-f3、扩增eml4-alk融合基因的正向引物eml4(6)-alk-f4、扩增eml4-alk融合基因的反向引物eml4(6/13/20)-alk-r、检测探针alk-eml4(6/13/20)-tar和探针eftud2-ref在所述试剂中的浓度分别为1um、1um、1um、1um、1um、1um、0.25um和0.25um。含有上述的成套引物或上述试剂的试剂盒也是本发明保护的范围。上述试剂盒还包括富集外泌体所需试剂和提取外泌体rna的试剂;所述富集外泌体所需试剂(exoquick-tm/tc(sbi))具体来自exoquicktcexosomesprecipitationsolution试剂盒;所述提取外泌体rna的试剂(exorneasyserum/plasmamidikit(qiagen,去除外泌体富集部分))具体来自exorneasyserum/plasmamidikit试剂盒。上述的成套引物或上述试剂的试剂盒在制备数字pcr检测待测样本外泌体中eml4-alk融合基因突变情况或突变频率的产品中的应用也是本发明保护的范围;或,上述的成套引物或上述试剂的试剂盒在数字pcr检测待测样本外泌体中eml4-alk融合基因突变情况或突变频率中的应用也是本发明保护的范围。本发明第3个目的是提供一种数字pcr检测待测样本中eml4-alk融合基因突变情况的方法。本发明提供的方法,包括如下步骤:1)用上述试剂盒中的所述外泌体富集试剂富集待测样本外泌体,再用所述提取外泌体rna的试剂提取待测样本外泌体rna;2)以所述rna为模板,用上述的成套引物进行数字pcr检测,实现数字pcr检测待测样本中eml4-alk融合基因突变情况。上述方法中,在富集和提取之间还包括如下步骤:将上述富集得到的外泌体中加入pbs缓冲液温育(37℃温育3min)。上述中,所述待测样本为离体血浆或尿液。上述数字pcr检测待测样本中eml4-alk融合基因突变情况的判断标准如下:阳性样本有vic荧光信号和fam荧光信号产生,其中vic荧光信号越强阳性样本突变频率越高;阴性样本只有fam荧光信号产生。上述试剂盒还包括对照品和质控品。a.对照品即正常人的rna提取,测浓度后并将其稀释至10ng/ul待用;b.质控品订购及测试:质控品序列首先通过在ncbi数据库中查找到对应的序列,并根据融合类型进行拼接为对应的突变类型,然后发给商业公司进行合成;质控品收到后加入一定量的超纯水,采用q-bit定量后,-20度保存;用时进一步等梯度稀释到工作液浓度。本发明的技术路线如图3所示。本发明的实验证明,使用无创取样血浆外泌体检测eml4-alk融合基因,并摸索了最佳的rna提取试剂组合,并将其作为模板,用摸索的最佳引物和探针进行数字pcr检测,其检测灵敏度高、快速、方便且绝对定量,为针对eml4-alk融合基因的药物使用提供指导。附图说明图1为ddpcr检测示意图。图2为ddpcr检测二维示意图。图3为本发明的技术路线。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例1、用于数字pcr检测eml4-alk融合基因的引物的设计和筛选1、引物探针的设计根据eml4-alk融合基因variant1/2/3三种突变(表2)设计合成用于检测其的引物和探针。表2为融合基因的类型在ncbi数据库,找到每个基因核苷酸序列,采用软件oligo7进行引物及探针的设计,尽可能满足重要原则的基础上,要求上下引物扩增产物小于200bp,探针退火温度比引物高出5℃,预计每个基因设计各5-6套引物,探针1套,另外设计内参引物和内参探针(具体见表3所示):表3为设计的引物序列及探针序列:本研究设计了内参的引物、探针和目标区域的引物、探针,内参基因是一段保守序列基本不会发生变异,选择内参的目的是为了评判野生型的存在。无论阴性或阳性样本(只要不是纯阳性)都会存在野生型的扩增,本研究设计野生型的目的,是为了评判最终样本的突变频率。2、引物的筛选分别以含有融合基因eml4(13)-alk(20)部分序列的阳性质粒、含有融合基因eml4(20)-alk(20)部分序列的阳性质粒和含有融合基因eml4(6)-alk(20)部分序列的阳性质粒为模板,采用上述表3中各个融合基因对应的各套引物分别进行pcr扩增,得到pcr扩增产物。琼脂糖凝胶电泳检测上述pcr扩增产物,结果表明:pcr扩增得到的条带与预期一致且条带单一,说明引物特异性好。含有融合基因eml4(13)-alk(20)部分序列的阳性质粒为将表4所示的融合基因eml4(13)-alk(20)部分序列克隆到puc57载体(金斯瑞标准载体)上,得到的质粒。含有融合基因eml4(20)-alk(20)部分序列的阳性质粒为将表4所示的融合基因eml4(20)-alk(20)部分序列克隆到puc57载体(金斯瑞标准载体)上,得到的质粒。含有融合基因eml4(6)-alk(20)部分序列的阳性质粒为将表4所示的融合基因eml4(6)-alk(20)部分序列克隆到puc57载体(金斯瑞标准载体)上,得到的质粒。表4为克隆阳性质粒所需的融合基因部分序列再用表3所示的各个融合基因对应的各套引物分别结合内参引物、内参探针、1套探针对阳性样本(含有eml4(13)-alk(20)融合基因部分序列的阳性质粒、含有eml4(20)-alk(20)融合基因部分序列的阳性质粒、含有eml4(6)-alk(20)融合基因部分序列的阳性质粒等质量混合得到阳性样本)进行数字pcr扩增。结果表明:eml4(13)-alk-f2、eml4(20)-alk-f3、eml4(6)-alk-f4和eml4(6/13/20)-alk-r这组引物pcr扩增得到的条带与预期一致且条带单一,说明引物特异性好;分析阴性、阳性、水三者的结果区分明显为合格,说明检测alk-eml4(6/13/20)-tar探针的特异性佳。因此,数字pcr检测eml4-alk融合基因variant1/2/3三种突变的最佳引物和探针序列如表5和表6所示:表5为数字pcr检测eml4-alk融合基因最佳引物序列表6为数字pcr检测eml4-alk融合基因探针序列探针5'->3'eftud2-ref(5'端标记fam)ggacatcctttggcttttga(序列7)alk-eml4(6/13/20)-tar(5'端标记vic)cttgcagctcctggtgcttcc(序列8)实施例2、数字pcr检测eml4-alk融合基因方法的建立一、外泌体rna提取待测样本为eml4-alk融合基因突变细胞系(购自南京科佰生物科技有限公司;细胞系本身的eml4-alk突变频率是已经通过二代测序证明了,其突变频率在45%)的外泌体,外泌体富集和外泌体rna提取所用的试剂筛选如下:1、外泌体富集使用exoquicktcexosomesprecipitationsolution,exotc10a-1,systembioscience(sbi)试剂盒进行外泌体富集:1)10ml细胞培养液离心(3000g,15min,4℃),取上清液(沉淀为细胞或细胞碎片);2)转移上清液至无菌试管,加入2ml的exoquick-tc,颠倒试管混匀。3)4℃冷藏过夜(至少12h)(冷藏期间试管需静置,勿旋转)。4)离心(1500g,30min,4℃或室温),离心后,外泌体为管底的米黄色/白色小球。5)去除上清,再次离心(1500g,5min),尽量去除所有的液体,小心别碰到沉淀,得到富集外泌体。2、外泌体rna的提取分别用如下qiagen公司exorneasyserum/plasmamidikit试剂盒提取细胞nci-h2228(出售公司为南京科佰生物科技有限公司)培养上清外泌体的rna,具体步骤如下:1)向上述外泌体沉淀中加入100ul的pbs(购自),37℃温育3min;因外泌体沉淀直接使用qiazollysis直接溶解,非常难容,且qiazollysis易挥发,如果吹打太久,影响提取效率,而且即使吹打混合物很久也是难于完全溶解;但加入pbs,进行37℃温浴,然后震荡,则非常有利于溶解。2)加入5倍体积的qiazollysis至上述管中,斡旋混匀;3)室温孵育5min;4)将柱子装入收集管,将600ul上述溶液转移到柱子中;5)加入初始样本同体积的三氯甲烷(比如200ul的样本,加入200ul的三氯甲烷),剧烈震荡;6)室温孵育2-3min;7)12000g4℃离心5min;8)转移上清,注意不要吸到中间层,加入1.5倍体积的无水乙醇,吹打混匀;9)吸取700ul样品至吸附柱中,室温8000g,离心15s,弃废液;10)剩余样品用同样方法吸附到同一个柱子中;11)加入700ul的rwtbuffer,8000g离心15s,弃废液;12)加入500ul的rpebuffer,8000g离心15s,弃废液;13)加入500ul的rpebuffer,8000g离心2min,弃废液;14)开盖全速离心5min,便于干燥膜,弃废液;15)换用新的1.5ml离心管,加入14ul的rnase-freewater至膜上,全速离心1min;16)弃柱子,将提取的rna立即放-80℃。得到sbi法富集外泌体+qiagen提取外泌体rna。以sbi公司的exoquicktcexosomesprecipitationsolution,exotc10a-1,systembioscience(sbi)试剂盒进行外泌体富集和外泌体rna提取,得到sbi公司富集提取外泌体rna。以qiagen公司exorneasyserum/plasmamidikit试剂盒进行外泌体富集和外泌体rna提取,得到qiagen公司富集提取外泌体rna。二、数字pcr检测分别以提取的rna作为模板,用表5所示的最佳引物和表6所示的探针进行一步法ddpcr检测(使用bio-rad公司的one-steprt-ddpcradvancedkitforprobes试剂盒),具体如下:1、配制反应液:将4对最佳引物、2条探针、上述一得到的rna、ddpcrsupermix(biorad)、reversetranscriptase、dtt配制成22ul反应液,加入到微滴发生卡上。反应液具体如下表7所示:表7为一步法ddpcr检测反应液上述反应液中eml4(6/13/20)-alk-f是将eml4(13)-alk-f2、eml4(20)-alk-f3和eml4(6)-alk-f4等摩尔混合得到。上述反应液中,各个引物在反应液中的终浓度为1um,各个探针在反应液中的终浓度为0.25um。2、制备微滴:将微滴发生卡放入微滴生成器内,在2.5分钟内将每个22微升反应液分成20000个液滴;3、pcr扩增:将微滴转移到96孔板上,于pcr仪上进行扩增;4、检测微滴:将96孔板放入微滴分析仪,顺序吸取每个样品的微滴并随载液流逐一通过双色检测器。有vic荧光信号和fam荧光信号的微滴为含有3种至少一种突变,为阳性,即为突变型微滴;其中vic荧光信号越强阳性样本突变频率越高;只有fam荧光信号的微滴为不含有3种任一种突变,为阴性,即为野生型微滴。5、分析数据:软件记录每个样品里阳性微滴数量的比例。6、显示结果:软件自动分析数据,并以多种方式显示检测结果。sbi法富集外泌体+qiagen提取外泌体rna结果如图1和图2所示,图1中,a09:单一使用sbi法富集提取外泌体rna检测结果;c09:单一使用qiagen法富集提取外泌体rna提取后检测结果;e09:sbi法富集外泌体+qiagen提取外泌体rna检测结果;f09:阳性样本(将含有eml4(13)-alk(20)融合基因部分序列的阳性质粒、含有eml4(20)-alk(20)融合基因部分序列的阳性质粒、含有eml4(6)-alk(20)融合基因部分序列的阳性质粒等质量混合得到阳性样本);g09:阴性对照(yh细胞(炎黄一号”细胞系)提取的rna);h09:水。1)上图表示五个样本的fam通道扩增效果,下图为vic通道扩增效果;2)eventnumber:总反应数;3)ch1amplitude:指fam荧光通道扩增效果;4)ch1pos:9890neg:58527:fam荧光通道中有荧光信号总反应数为9890,无信号总反应数为58527;5)图中每个点意思:图中每个点代表微滴扩增情况;图1中的ch2通道,该通道主要为突变型的荧光通道,从ch2通道的f09(阳性对照,即为有突变)和g09(阴性样本,即为无突变)这两个样本的微滴扩增情况可以看出,在基线之上,阳性样本有明显扩增,阴性样本无扩增,所以野生型和突变型可以明显区分。图2中,纵坐标为通道1(fam荧光检测通道);横坐标为通道2(vic荧光检测通道);正方形圈起来的微滴为野生型微滴,椭圆形圈起来的微滴为突变型微滴;圆形圈起来的微滴为未包含dna的微滴。从图中的结果可以看出,最佳引物和探针特异性较好,野生型和突变型可以明显区分。采用同样的方法检测sbi法富集提取外泌体rna和qiagen法富集提取外泌体rna。统计sbi法富集提取外泌体rna、qiagen法富集提取外泌体rna和sbi法富集外泌体+qiagen提取外泌体rna的突变频率。突变频率=突变型微滴数量/(突变型微滴数量+野生型微滴数量)的百分比;突变频率结果如表8所示。表8为ddpcr检测结果从表8中可以看出单独使用sbi或者qiagen法提取外泌体rna进行数字pcr检测,其检测突变频率非常低或者没有,而两者结果使用,检测的突变频率高达42%,与细胞系本身的eml4-alk突变频率非常接近,说明两者结合提取的外泌体rna比较适合用于数字pcr检测融合基因突变。因此,sbi法富集外泌体+qiagen提取外泌体rna为最佳外泌体rna提取试剂组合。三、用于数字pcr检测eml4-alk融合基因的试剂盒的制备将实施例1筛选得到的最佳引物和最佳探针、exoquicktcexosomesprecipitationsolution试剂盒中外泌体富集相关试剂和exorneasyserum/plasmamidikit试剂盒中去除外泌体富集的其余试剂,制备用于数字pcr检测eml4-alk融合基因的试剂盒。本试剂盒的组分如表9所示:表9为试剂盒的组分实施例3、数字pcr检测eml4-alk融合基因方法一、血浆外泌体rna提取用实施例2筛选出的sbi法富集外泌体+qiagen提取外泌体rna提取肺癌eml4-alk融合基因突变病人(经测序已经确定含有eml4(13)-alk(20)一种融合基因突变)的外泌体rna。二、数字pcr检测按照实施例2的二的方法用最佳引物和最佳探针对血浆外泌体rna进行数字pcr检测。有vic荧光信号和fam荧光信号的微滴为含有3种至少一种突变,为阳性,即为突变型微滴;其中vic荧光信号越强阳性样本突变频率越高;只有fam荧光信号的微滴为不含有3种任一种突变,为阴性,即为野生型微滴。结果肺癌eml4-alk融合基因突变病人检测结果中含有vic荧光信号和fam荧光信号的微滴,为阳性,即含有eml4-alk融合基因突变。序列表<110>深圳华大生命科学研究院<120>eml4-alk融合基因无创检测试剂盒<160>8<170>patentinversion3.5<210>1<211>20<212>dna<213>人工序列<220><223><400>1ggtcttgccagacaccaaag20<210>2<211>20<212>dna<213>人工序列<220><223><400>2tgagaggacacacgcaaaac20<210>3<211>21<212>dna<213>人工序列<220><223><400>3actactgtagagcccacacct21<210>4<211>21<212>dna<213>人工序列<220><223><400>4gtctaactcgggagactatga21<210>5<211>21<212>dna<213>人工序列<220><223><400>5gttaccaaaactgcagacaag21<210>6<211>19<212>dna<213>人工序列<220><223><400>6tctgcagctccatctgcat19<210>7<211>20<212>dna<213>人工序列<220><223><400>7ggacatcctttggcttttga20<210>8<211>21<212>dna<213>人工序列<220><223><400>8cttgcagctcctggtgcttcc21当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1