梓醇在促进神经干细胞向少突胶质细胞分化中的应用的制作方法
本发明属于干细胞治疗领域相关药物评价及筛选,具体涉及梓醇在促进神经干细胞向少突胶质细胞分化中的应用。
背景技术:
中枢神经系统脱髓鞘疾病,是中枢神经系统以广泛的原发性脱髓鞘为主的一组疾病。该疾病源于少突胶质细胞受损或发育障碍导致髓鞘损伤或脱失,从而影响神经冲动的传导、使得神经功能失调。少突胶质细胞作为中枢神经系统髓鞘形成所必需的细胞,能够维持神经系统正常功能与结构,同时也可以为中枢神经系统提供神经生长因子与营养因子。目前,多数脱髓鞘疾病只能对症治疗,缺乏根治手段,且致残率很高,给患者及其家庭带来了沉重的负担。因此,探究少突胶质细胞的再生、调控情况,对中枢神经系统脱髓鞘疾病的治疗有重要意义。
国内外研究表明,干细胞治疗是一种极具潜力的治疗中枢神经系统疾病的方法。其中,神经干细胞(neuralstemcells,nscs)来源于中枢神经系统,具有自我更新、增殖,分化为神经元、星型胶质细胞和少突胶质细胞的能力。作为神经组织特有的细胞,nscs能向神经细胞分化,从而代替缺失或损伤的神经元和胶质细胞,重塑健康的细胞群,给中枢神经系统损伤疾病和神经退行性疾病的治疗带来了希望。nscs通过分化为少突胶质细胞的这种潜能,可能成为神经系统脱髓鞘疾病新的治疗方法,也显示了nscs治疗脱髓鞘疾病的应用前景。然而,目前应用nscs临床治疗仍有许多困难,源于对nscs分化条件不清楚、调控机制不明、缺乏控制移植后nscs分化和生长情况的方法等。因此,确立nscs向少突胶质细胞定向分化的诱导条件成为研究者们亟待解决的问题。
技术实现要素:
为了解决上述问题,本发明利用药物浓度梯度微流控芯片,评估不同浓度的天然活性药物梓醇对nscs向少突胶质细胞分化的作用。结果表明,梓醇在低于3mg/ml的浓度下,对nscs没有毒性作用,梓醇能促进nscs向少突胶质细胞分化。尤其是3mg/ml的梓醇能够明显促进nscs向少突胶质细胞分化,为临床前期开展nscs替代治疗中枢神经系统脱髓鞘疾病提供依据和可行的技术支撑。本发明技术方案包括构建浓度梯度微流控芯片,验证梓醇对nscs活性的影响,明确梓醇通过抑制cav-1表达,诱导nscs向少突胶质细胞分化。
上述技术方案中,所述浓度梯度微流控芯片,是一种带有浓度梯度生成器并且能够培养nscs、观察nscs对药物诱导反应的微流控芯片,包含上游的浓度梯度生成器、下游的细胞培养模块和覆盖于细胞培养模块上的玻璃片。由于能够在芯片中进行集成操作(梯度浓度刺激和细胞接种培养等),可以同时记录在不同药物浓度刺激下的细胞多种反应。
所述微流控芯片上游的浓度梯度生成器,包括两个液体入口池和与之贯通的多个浓度梯度稀释通道;
所述下游的细胞培养模块是与所述浓度梯度稀释通道贯通的细胞培养开放小室,所述开放小室以阵列排列,每个细胞培养开放小室分别通过连接通道与设置于端部的出口池连通。
所述玻璃片表面旋涂有疏水材料聚二甲基硅氧烷,用于接种细胞,接种细胞的位置与细胞培养开放小室的排列方式一致;在玻璃片接种与芯片开放小室阵列位置及排列方式一致的nscs微球阵列,反扣于芯片下游位置,封盖了芯片下游开放小室使其紧密贴合,并使nscs微球相应地培养于各个小室单元中。
上述技术方案中,所述微流控芯片上游的浓度梯度生成器,通道宽可设计为10~1000μm,液体存在层流特性;所述浓度梯度稀释通道为蛇形弯道,蛇形弯道剪切力能让进液口的两种流体,多次稀释、分离、混合,从而形成连续浓度梯度。
上述技术方案中,所述下游开放小室(直径5mm、高度2mm)、芯片下游连接通道(高度和宽度为300μm)。
上述技术方案中,所述微流控芯片下游的细胞培养模块中,每组串联的细胞培养小室与上游的浓度梯度生成器通道分别连接。当梓醇药物引入芯片,流经上游的浓度梯度生成器,生成不同浓度梓醇溶液,向和其相连的细胞培养小室内持续渗透,对nscs进行持续的灌流诱导刺激。
上述技术方案中,所述梓醇药物引入芯片,是指自芯片两个入口,分别引入nscs自然分化培养基及加有梓醇的nscs自然分化培养基溶液。
上述技术方案中,不同浓度梓醇对nscs进行持续的诱导刺激,通过将芯片放入二氧化碳培养箱中连续培养实现;持续灌流刺激通过外接注射泵连续泵入新鲜的nscs自然分化培养基及梓醇溶液实现。
上述技术方案中,验证梓醇对nscs活性的影响中,应用cck-8法对不同梓醇浓度下的nscs细胞活性进行初筛,结果表明,低于3mg/ml的梓醇没有明显的毒性作用,而5mg/ml的梓醇对细胞会产生一定的毒性作用;进一步,采用calcein-am/pi/hoechst33342染色计数法,评价nscs细胞的活性,通过计算活细胞数占总细胞数的百分比,发现培养4、7天后,nscs在梓醇低于3mg/ml的范围内,均有良好的活性,对nscs没有毒性。
上述技术方案中,为明确梓醇诱导nscs向少突胶质细胞分化,应用少突胶质细胞的特异性标志物mbp,sox10作为分化指标,并采用qpcr检测及免疫荧光染色方式对特异性指标进行定性、定量。mrna定量结果表明,诱导第4天,在梓醇1mg/ml、2mg/ml、3mg/ml组,sox10、mbp基因表达量均高于对照组,其中梓醇1mg/ml、3mg/ml组的sox10、mbp表达量明显高于对照组,p<0.05,p<0.01。同样,诱导第7天,sox10、mbpmrna的表达量在梓醇1mg/ml、2mg/ml、3mg/ml组均高于对照组,其中梓醇3mg/ml组的sox10、mbp表达量较对照组明显增高,p<0.01,梓醇1mg/ml组的mbp表达量明显高于对照组,p<0.01。证明3mg/ml的梓醇能够明显促进nscs向少突胶质细胞分化。免疫荧光染色定性结果进一步证实了上述结论。
上述技术方案中,分析梓醇促nscs少突胶质分化的机制中,首先检测了nscs在梓醇不同药物浓度诱导4、7天后,caveolin-1(cav-1)基因的表达量。诱导第4天,cav-1mrna的表达量在梓醇1mg/ml、2mg/ml、3mg/ml组均低于对照组,其中1mg/ml、3mg/ml组cav-1基因的表达量明显低于对照组,p<0.05。诱导第7天,梓醇1mg/ml、2mg/ml、3mg/ml组cav-1mrna的表达量明显低于对照组,p<0.01。说明随着nscs的分化,cav-1的表达量逐渐减少。
上述技术方案中,分析梓醇促nscs少突胶质分化的机制中,为了证明梓醇是通过抑制cav-1促进nscs向少突胶质细胞分化,应用cav-1特异性抑制剂,β-环糊化精(methylβ-cyclodextrin,mcd)抑制cav-1。应用qpcr和免疫荧光法,检测mcd抑制cav-1前后mbp、sox10的表达变化。结果表明,培养4天后,在梓醇加用mcd组,sox10mrna的表达量较梓醇组明显增高,p<0.001;培养7天后,在梓醇加用mcd组,mbp、sox10mrna的表达量较梓醇组明显增高,p<0.05,p<0.01;培养4天后,在对照加用mcd组,mbp、sox10的mrna的表达量较对照组明显增高,p<0.05,p<0.01;培养7天后,对照组加用mcd组mbp的mrna的表达量较对照组明显上升,p<0.05。梓醇加用mcd培养4、7天后,sox及mbpmrna的表达均较对照组及对照加用mcd组的表达高。说明梓醇通过抑制cav-1表达,促进nscs向少突胶质细胞分化。
本发明的有益效果:
1)本发明提供的中药活性成分梓醇对nscs少突胶质细胞向分化的促进效应,为临床前期开展nscs替代治疗中枢神经系统脱髓鞘疾病提供依据和可行的技术支撑,有助于推进nscs细胞治疗神经系统疾病的进程。
2)本发明中,梓醇促nscs向少突胶质分化相关的cav-1机制研究,为下一步具体研究梓醇促进nscs向少突胶质细胞分化的机制研究提供了依据。
3)本发明中,建立了一个nscs微流控芯片三维灌流培养模型,来评估梓醇对nscs向少突胶质细胞分化的影响。三维灌流培养模式,使得体外培养的nscs细胞更接近于体内微环境,其对药物的刺激反应可以更加真实地模拟实际临床用药效果。
4)本发明采用微流控芯片评价梓醇分化诱导效应,具有高通量、操作简单、节省实验时间、生成稳定的药物浓度、可以实时观察药物对细胞的作用、能够长时间持续灌流培养等优点。
附图说明
图1梓醇在促进nscs向少突胶质细胞分化中的应用装置示意图;
其中:1为上游的浓度梯度生成器,2为下游的细胞培养模块;11为芯片入口池,12为浓度梯度稀释通道,21为芯片下游开放小室,22为芯片下游连接通道,23为旋涂有疏水材料聚二甲基硅氧烷的玻璃片,24为芯片出口池,25为nscs细胞球;
图2应用cck-8法分析48小时、不同浓度梓醇培养,对nscs细胞活性的影响;
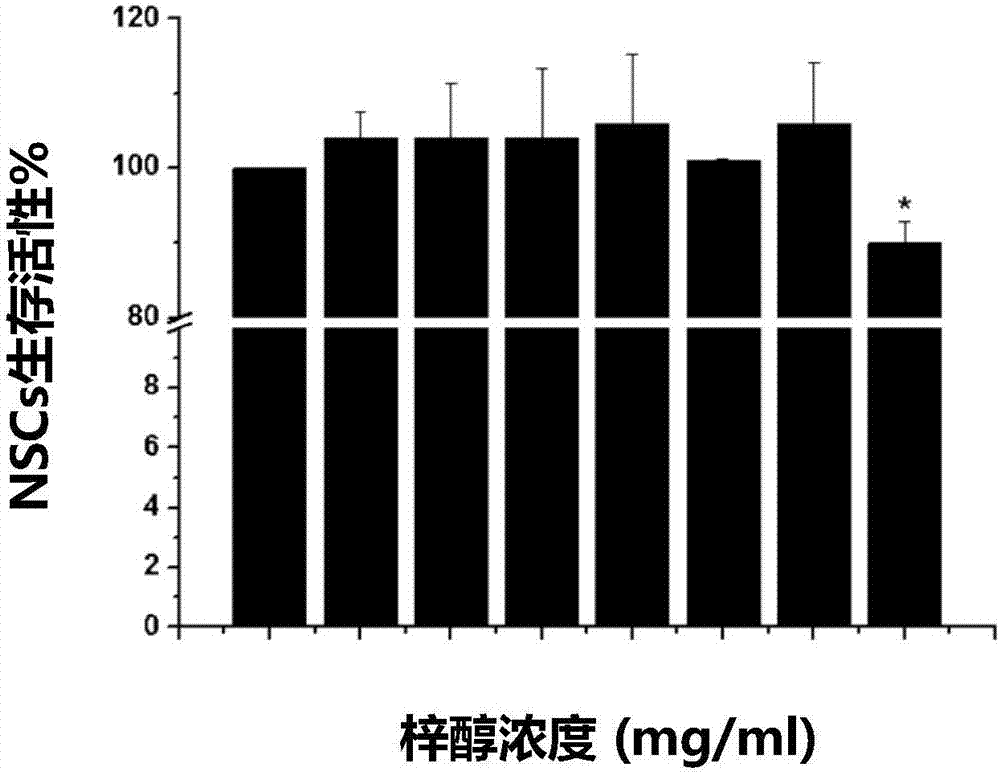
图3不同浓度梓醇灌流培养4天和7天后,nscs活细胞的百分比;
图4不同浓度梓醇灌流培养4天和7天后,nscs向少突胶质细胞分化情况的比较,sox10和mbp的mrna表达量;
图5不同浓度梓醇灌流培养4天和7天后,nscs向少突胶质细胞分化情况的比较,sox10和mbp的免疫荧光染色结果,标尺为100μm;
图6不同浓度梓醇灌流培养4天和7天后,nscs中cav-1的mrna表达;
图7梓醇和cav-1特异性抑制剂灌流培养4天和7天后,nscs向少突胶质细胞分化情况的比较,sox10和mbp的mrna表达量。
具体实施方式
实施例1
梓醇在促进nscs向少突胶质细胞分化中的应用研究。
1微流控芯片的设计与制作
1)用于研究梓醇在促进nscs向少突胶质细胞分化中的应用,采用的微流控芯片装置示意图如图1所示。整个装置是由上游的浓度梯度生成器1,下游的细胞培养模块2构成。由于能够在芯片中进行集成操作(梯度浓度生成、刺激和细胞接种、培养等),可以同时记录在不同药物浓度刺激下的多种细胞反应。浓度梯度生成器1包含芯片入口11和浓度梯度稀释通道12;通道高度和宽度为300μm。细胞培养模块2包含芯片下游开放小室21(3×4阵列),芯片下游连接通道22,旋涂有疏水材料聚二甲基硅氧烷的玻璃片23,四个阵列的细胞培养室共用一个芯片出口24;玻璃片23用于接种nscs和对开放小室21的封合。
2)应用负性光刻胶su-8,按照标准的软光刻技术制备阳膜模具,并以此阳模反转出pdms阴模。在该pdms阴模相应位置按开放小室21(3×4阵列,每个培养室直径5mm、高度2mm、间隔4mm)、芯片入口11、芯片出口24进行打孔,打孔位置形成贯通阴模的通孔结构。用一块洁净的玻璃片,与pdms阴模含通道的一面不可逆键合,将阴模所有的通道及孔洞的底面封合。
2nscs原代提取和培养
1)nscs原代提取自孕13-14天的sdspf大鼠,断颈处死,腹部剃毛,酒精消毒。取出胎鼠,置于盛有pbs和青霉素、链霉素的培养皿中清洗,剥离胎膜,剪断脐带,将胎鼠移到另一个培养皿中,颈部断头,取出胎鼠脑部,剥离脑膜及血管,取前脑皮质部位,置于提前预冷的dmem/f12中。剪刀剪碎脑组织。将dmem/f12与组织混合液移至离心管中,玻璃管轻柔吹打,静置,取上清液体移至另一个离心管中离心,弃上清,将细胞沉淀与accutasetm细胞分离液混合,移至新培养皿中,放入培养箱孵育。取出培养皿,轻柔吹打,加入dmem/f12终止消化,细胞混合液移至离心管中离心。弃上清,加入nscs培养基,细胞计数,将细胞密度调至2×105cell/ml,种于培养瓶。放入培养箱培养。每2天半定量加入nscs培养基,观察nscs成球大小。
2)当nscs细胞球直径为150μm-200μm时,可传代。将细胞悬液移至离心管中离心。弃上清,将细胞沉淀与accutasetm细胞分离液混合,移至新培养皿中,放入培养箱孵育后,轻柔吹打,加入dmem/f12终止消化,细胞混合液移至离心管中离心。弃上清,加入nscs培养基,细胞计数,将细胞密度调至2×105cell/ml,种于培养瓶,放入培养箱培养。
3cck-8药物细胞毒性检测
为了观察梓醇对nscs有无毒性作用,首先应用cck-8法对细胞活性进行初筛。收集生长期的第3代nscs,采用accutase消化液37℃,消化5分钟,将神经球机械吹打散开,制成单细胞悬液,调节细胞浓度为l×106cells/ml,取10ul滴于旋涂pdms的载玻片上,放于37℃、5%co2孵箱72小时,使nscs沉淀、聚集,形成细胞球。72小时后将nscs细胞球、梓醇药物混合液(浓度为0、0.1、0.2、0.5、1、2.5、3、5mg/ml)100ul加至96孔板,加入后培养48小时。48小时后按照cck-8试剂体积与每孔细胞液体积比为1:10的比例加入,置于37℃培养箱中孵育3小时后,用酶标仪在450nm处测od值。应用cck-8法分析48小时、不同浓度梓醇培养,对nscs细胞活性的影响,如图2所示。确定对细胞没有毒性作用的梓醇浓度(低于3mg/ml),进行后续实验。
4nscs在微流控芯片上的接种与药物施加
1)将旋涂有疏水材料聚二甲基硅氧烷的玻璃片23通过121℃、150分钟高压灭菌,再由紫外线照射消毒1小时。nscs单细胞悬液以1×106cells/ml,10ul滴于该玻璃片pdms面,接种位置与开放小室21对齐。用胶布将载玻片粘于培养皿的皿盖,培养皿盖小心的倒转,扣于含有2ml0.01mpbs培养皿的皿底,放于37℃、5%co2孵箱72小时,使nscs沉淀、聚集,形成细胞球,如图1中25所示。将载有nscs细胞球的玻璃片倒转,与开放小室对齐,盖在芯片上。在pdms-pdms表面张力作用下,两部分组装在一起,成为一个半密闭的微流控芯片细胞培养体系,仅留芯片入口11和芯片出口24为敞开孔,用于液体的引入和外排。
2)使用移液枪将培养基从芯片入口11加入,排空芯片中的气泡,使液体充满通道及细胞培养室,浸没3×4阵列所有nscs样品;采用两根无菌连接管分别连接两个芯片入口11与装有nscs培养基、3mg/ml梓醇溶液的微量注射器,该注射器由注射泵控制培养基灌流速度。通过浓度梯度生成器的蛇形通道,使得两种溶液不断的稀释、分离、混合,形成稳定的浓度梯度,浓度依次为:0mg/ml、1mg/ml、2mg/ml、3mg/ml。所有通道内,细胞诱导液(不同浓度)会向和其相连的细胞培养小室内持续渗透,对细胞分化进行持续的诱导刺激。将芯片部分放入培养箱,对nscs持续灌流培养与施加浓度梯度的梓醇药物刺激,作用时间分别为4天、7天。
5免疫荧光法检测药物细胞毒性
通过计算活细胞数占总细胞数的百分比来评定梓醇对nscs活性的影响。应用calcein-am/pi/hoechst33342染色,对培养4天、7天后的nscs生存能力进行评价。将扣于芯片的玻璃片移开,取出样本,0.01mpbs清洗1次,5分钟/次;用0.01mpbs配置calcein-am/pi/hoechst染液,样本浸泡于染液中,放入37℃、21%o2孵箱孵育30分钟。吸出并弃去染液,用pbs浸洗2次,5分钟/次;采用激光扫描共聚焦显微镜进行观察。对nscs细胞球样本分别进行三十个层面扫描,按固定间隔,将其中的五个层面扫描图片选出,进行活细胞数、细胞总数统计,进行细胞存活比例计算,结果如图3所示。在加有梓醇的芯片中,定量分析4组nscs活细胞的平均百分比,在培养4天后活细胞平均百分比分别为97.42%(0mg/ml)、97.72%(1mg/ml)、97.48%(2mg/ml)和96.75%(3mg/ml);在培养7天后,活细胞平均百分比分别为96.36%(0mg/ml)、94.16%(1mg/ml)、97.99%(2mg/ml)和97.25%(3mg/ml)。说明培养4、7天后,nscs在梓醇低于3mg/ml的范围内,均有良好的活性;灌流培养也为nscs提供了充足的营养和物质交换。
6明确梓醇诱导nscs向少突胶质细胞分化的效应
为了检测梓醇对nscs向少突胶质细胞分化的影响,应用少突胶质细胞的特异性标志物mbp,sox10作为分化的指标。
1)灌流培养结束后,回收刚性玻璃片23上不同浓度梓醇作用的细胞样品,进行总rna的提取、逆转录合成cdna和实时荧光定量pcr。选择sybrgreeni嵌合荧光法的rr082a专用试剂完成qrt-pcr实验。反应时,每个样本做3个平行样,重复3次。不同浓度梓醇灌流培养4天和7天后,nscs向少突胶质细胞分化情况的比较,sox10和mbp的mrna表达量,如图4所示。诱导第4天,在梓醇1mg/ml、2mg/ml、3mg/ml组sox10、mbp基因表达量均高于对照组,其中梓醇1mg/ml、3mg/ml组的sox10、mbp表达量明显高于对照组,p<0.05,p<0.01。同样,诱导第7天,sox10、mbpmrna的表达量在梓醇1mg/ml、2mg/ml、3mg/ml组均高于对照组,其中梓醇3mg/ml组的sox10、mbp表达量较对照组明显增高,p<0.01,梓醇1mg/ml组的mbp表达量明显高于对照组,p<0.01。证实梓醇有利于nscs向少突胶质细胞分化。
2)样品回收后,多聚甲醛固定,pbs清洗后加入triton-100,pbs清洗后加入bsa封闭。分别加入sox10和mbp一抗过夜。吸弃抗体稀释液,pbs清洗后加入二抗稀释液,避光孵育。吸弃二抗稀释液,pbs清洗后加入核染料hoechst避光孵育。吸弃核染料,pbs清洗后共聚焦荧光显微镜下观察。不同浓度梓醇灌流培养4天和7天后,nscs向少突胶质细胞分化情况的比较,sox10和mbp的免疫荧光染色结果,如图5所示。
7分析梓醇促nscs少突胶质分化的机制
1)灌流培养结束后,回收刚性玻璃片23上不同浓度梓醇作用的细胞样品,进行总rna的提取、逆转录合成cdna、实时荧光定量pcr。不同浓度梓醇灌流培养4天和7天后,nscs中cav-1的mrna表达如图6所示。诱导第4天,cav-1mrna的表达量在梓醇1mg/ml、2mg/ml、3mg/ml组均低于对照组,其中1mg/ml、3mg/ml组cav-1基因的表达量明显低于对照组,p<0.05。诱导第7天,梓醇1mg/ml、2mg/ml、3mg/ml组cav-1mrna的表达量明显低于对照组,p<0.01。说明随着nscs的分化,cav-1的表达量逐渐减少。
2)为了证明梓醇是通过抑制cav-1促进nscs向少突胶质细胞分化,应用cav-1特异性抑制剂,β-环糊化精(methylβ-cyclodextrin,mcd)抑制cav-1。梓醇和cav-1特异性抑制剂灌流培养4天和7天后,通过sox10和mbp的mrna表达量比较nscs向少突胶质细胞分化情况,如图7所示。结果表明,培养4天后,在梓醇加用mcd组,sox10的mrna的表达量较梓醇组明显增高,p<0.001;培养7天后,在梓醇加用mcd组,mbp、sox10mrna的表达量较梓醇组明显增高,p<0.05,p<0.01。培养4天后,在对照加用mcd组,mbp、sox10的mrna的表达量较对照组明显增高,p<0.05,p<0.01;培养7天后,对照加用mcd组mbp的mrna的表达量较对照组明显上升,p<0.05。梓醇加用mcd培养4、7天后,sox及mbpmrna的表达均较对照组及对照加用mcd组的表达高。说明梓醇通过抑制cav-1表达,促进nscs向少突胶质细胞分化。
本发明通过构建一种能生成连续药物浓度梯度的微流控芯片,并对nscs进行芯片上的细胞球灌流培养与药物施加,用于评估芯片上不同浓度的梓醇对nscs活性的影响以及向少突胶质细胞分化的情况。结果发现,梓醇在低于3mg/ml的浓度下,对nscs没有毒性作用,梓醇能明显促进nscs向少突胶质细胞分化。对梓醇促进nscs向少突胶质细胞分化的信号通路进行的研究发现,随着nscs向少突胶质细胞分化的增多,其cav-1的表达随之下降。应用cav-1特异性抑制剂β-环糊化精,抑制cav-1,发现少突胶质细胞的相关基因表达明显升高。由此说明梓醇通过抑制cav-1信号通路,可以促进nscs向少突胶质细胞分化。本发明提供的中药活性成分梓醇对nscs少突胶质细胞向分化的促进效应和机制研究,为临床前期开展nscs替代治疗中枢神经系统脱髓鞘疾病提供依据和可行的技术支撑,有助于推进nscs细胞治疗神经系统疾病的进程。
- 还没有人留言评论。精彩留言会获得点赞!