一种双氧水诱导猪小肠上皮细胞凋亡模型的建立方法与流程
本发明涉及细胞凋亡模型构建技术领域,特别涉及一种双氧水诱导猪小肠上皮细胞凋亡模型的建立方法。
背景技术:
我国是世界第一养猪大国,养猪业已成为关乎国计民生的重要产业。养猪业的重大难题之一是仔猪肠道健康问题,已成为制约养猪业快速健康发展的“瓶颈”,我国每年因仔猪肠道健康问题(如消化不良、腹泻、生长阻滞乃至死亡)造成的经济损失达300亿元。有研究表明,肠上皮细胞凋亡紊乱会导致猪肠黏膜结构损伤和功能障碍,而自由基代谢异常与凋亡紊乱密切相关,因此构建猪小肠上皮细胞凋亡模型对研究猪肠道损伤机制及其调控措施具有重要的理论和实践意义。
构建细胞凋亡模型需要选取模型细胞和诱导剂,其中,目前常应用于构建细胞凋亡模型的细胞多为肝细胞、癌细胞、乳腺细胞、中性粒细胞以及血细胞等,诱导剂包括融合蛋白、单克隆抗体、脂多糖等,这些诱导剂在实际应用过程中,存在制备过程复杂、诱导操作繁杂、细胞凋亡率不高等缺点。因此,现有技术中并没有适合于构建猪小肠上皮细胞凋亡模型的方法。
技术实现要素:
本发明的主要目的是提出一种双氧水诱导猪小肠上皮细胞凋亡模型的建立方法,旨在使猪小肠上皮细胞凋亡模型的构建操作简便且效果稳定可靠。
为实现上述目的,本发明提出一种双氧水诱导猪小肠上皮细胞凋亡模型的建立方法,包括如下步骤:
配制细胞培养液;
将猪小肠上皮细胞接种至细胞培养液中培养后,进行胰蛋白酶消化处理,获得待诱导细胞;
向待诱导细胞中加入含有双氧水的细胞培养液,进行双氧水诱导。
优选地,配制细胞培养液的步骤,具体包括:
向dmem/f-12培养基中加入5%的胎牛血清、1%的青链霉素混合液、1%的谷氨酰胺、0.1%的转铁蛋白以及5μg/l的表皮细胞生长因子,混合后制得细胞培养液。
优选地,将猪小肠上皮细胞接种至细胞培养液中培养后,进行胰蛋白酶消化处理,获得待诱导细胞的步骤,包括:
将猪小肠上皮细胞接种至含有细胞培养液的容器中,置于培养箱中培养;
在培养箱中培养至细胞汇合率达到70~80%后,进行传代培养;
对经过传代培养的猪小肠上皮细胞进行胰蛋白酶消化处理,获得待诱导细胞。
优选地,将猪小肠上皮细胞接种至含有细胞培养液的容器中,置于培养箱中培养的步骤,具体包括:
取冻存的猪小肠上皮细胞复苏后,接种至含有细胞培养液的容器中,置于培养箱中培养,其中,所述培养箱的培养条件为:co2的体积浓度为4.5~5.5%、培养温度为36.5~37.5℃、培养时长为2~3天,每隔20~26h更换一次培养液。
优选地,在培养箱中培养至细胞汇合率达到70~80%后,进行传代培养的步骤中:所述传代培养的培养时间为7~8天。
优选地,对经过传代培养的猪小肠上皮细胞进行胰蛋白酶消化处理,获得待诱导细胞的步骤,具体包括:
向经过传代培养的猪小肠上皮细胞中加胰蛋白酶溶液,消化1~3min后弃去胰蛋白酶溶液,并加入细胞培养液终止消化,获得待诱导细胞。
优选地,向待诱导细胞中加入含有双氧水的细胞培养液,进行双氧水诱导的步骤中:所述含有双氧水的细胞培养液中双氧水的浓度为0.2~1.0mm,诱导时长为1~6h。
优选地,向待诱导细胞中加入含有双氧水的细胞培养液,进行双氧水诱导的步骤,包括:
将待诱导细胞接种至孔板中,加入细胞培养液继续培养;
培养至细胞贴壁且长到70~80%后,吸除孔板中的细胞培养液并用磷酸盐缓冲液沿孔壁清洗;
向清洗后的孔板中加入含有双氧水的细胞培养液,进行双氧水诱导。
优选地,将待诱导细胞接种至孔板中,加入细胞培养液继续培养的步骤中:所述待诱导细胞接种至所述孔板中的接种量为1×104~1×106个/ml,所述细胞培养液在所述孔板中的添加量为0.1~1ml/孔。
本发明提供的技术方案中,首次以猪小肠上皮细胞为模型细胞建立细胞凋亡模型,并以双氧水为诱导剂,具有诱导时间短、操作简便、成本低廉且效果稳定可靠的优点,该细胞凋亡模型的建立为研究猪肠道损伤机制及其调控措施提供了一条重要途径。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅为本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实施例1中各组的ipec-1细胞活力的测试结果图;
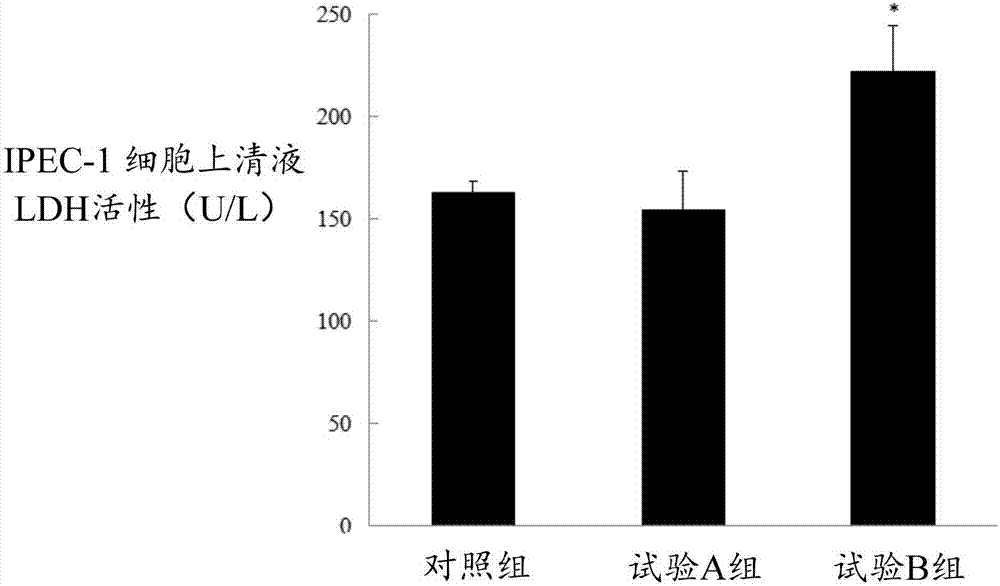
图2为本发明实施例2中各组的ipec-1细胞上清液ldh活性的测试结果图;
图3为本发明实施例3中各组的ipec-1细胞凋亡相关分子caspase3蛋白水平的测试结果图;
图4为本发明实施例3中各组的ipec-1细胞凋亡相关分子p-p38蛋白水平以及p-p38/t-p38比值的测试结果图;
图5为本发明实施例3中各组的ipec-1细胞凋亡相关分子t-p38蛋白表达量的测试结果图;
图6为本发明实施例3中各组的ipec-1细胞凋亡相关分子p-jnk蛋白水平以及p-jnk/t-jnk比值的测试结果图;
图7为本发明实施例3中各组的ipec-1细胞凋亡相关分子t-jnk蛋白表达量的测试结果图;
图8为本发明实施例4中各组的ipec-1细胞凋亡相关分子nf-κbp65蛋白的荧光显微镜测试结果图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
本发明提出一种双氧水诱导猪小肠上皮细胞凋亡模型的建立方法,所述双氧水诱导猪小肠上皮细胞凋亡模型的建立方法包括如下步骤:
步骤s10、配制细胞培养液;
其中,在本发明技术方案中,所述细胞培养液是针对小肠上皮细胞的培养而配制的。在本发明的一实施例中,步骤s10具体包括:向dmem/f-12培养基(美国hyclone公司)中加入5%的胎牛血清(美国gibco公司)、1%的青链霉素混合液(美国hyclone公司)、1%的谷氨酰胺(美国gibco公司)、0.1%的转铁蛋白(美国gibco公司)以及5μg/l的表皮细胞生长因子(美国gibco公司),混合后制得细胞培养液。具体操作时,可将如上述比例的各个组分混合均匀后置于75cm2的培养瓶中,并分装备用。
步骤s20、将猪小肠上皮细胞接种至细胞培养液中培养后,进行胰蛋白酶消化处理,获得待诱导细胞;
肠道不仅是营养物质消化吸收的主要器官,也是机体最大的免疫场所,是机体防御的首要屏障,在抵御内源性和外源性病菌等有害物质的入侵方面发挥着重要作用。对于仔猪饲养而言,肠上皮细胞凋亡紊乱会导致猪肠黏膜结构损伤和功能障碍,严重影响仔猪的健康,因此以猪小肠上皮细胞为模型细胞构建细胞凋亡模型具有重要的意义。一般而言,肠道细胞在体外培养的过程中会贴壁生长,因此为了减少反复吹打对细胞造成的伤害,在本发明技术方案中,在细胞培养后采用胰蛋白酶消化细胞,来获得待诱导细胞。
步骤s30、向待诱导细胞中加入含有双氧水的细胞培养液,进行双氧水诱导。
其中,双氧水可以通过产生活性氧,与细胞内铁离子反应形成高活性的自由基,诱导细胞损伤,常用于研究细胞的氧化损伤,双氧水不仅来源方便,价格低廉,而且性质相对稳定,对细胞的损伤作用明显。在本发明技术方案中,向待诱导细胞中加入含有双氧水的细胞培养液后,待诱导细胞在双氧水的诱导刺激下,开始进行并完成细胞凋亡,从而成功建立猪小肠上皮细胞凋亡模型。
可选地,在步骤s30中:所述含有双氧水的细胞培养液中双氧水的浓度为0.2~1.0mm,诱导时长为1~6h。其中,在本发明实施例中,以双氧水浓度为0.5mm,诱导时长为3h的条件为最佳。具体操作时,可预先配制一定浓度的双氧水储存液,然后将双氧水储存液加入步骤s10中配制的细胞培养液中,形成含有双氧水的细胞培养液,比如,先配制浓度为50mm的双氧水储存液,然后在每990μl的细胞培养液中加入10μl的双氧水储存液,即可得到双氧水浓度为0.5mm的细胞培养液。
本发明提供的技术方案中,首次以猪小肠上皮细胞为模型细胞建立细胞凋亡模型,并以双氧水为诱导剂,具有诱导时间短、操作简便、成本低廉且效果稳定可靠的优点,该细胞凋亡模型的建立为研究猪肠道损伤机制及其调控措施提供了一条重要途径。
可选地,步骤s20包括:
步骤s21、将猪小肠上皮细胞接种至含有细胞培养液的容器中,置于培养箱中培养;
其中,步骤s21具体包括:取冻存的猪小肠上皮细胞复苏后,接种至含有细胞培养液的容器中,置于培养箱中培养,其中,所述培养箱的培养条件为:co2的体积浓度为4.5~5.5%、培养温度为36.5~37.5℃、培养时长为2~3天,每隔20~26h更换一次培养液。具体操作时可采用如下方法:将液氮冻存的猪小肠上皮细胞(intestinalporcineepithelialcells,ipec-1,由texasa&muniversity提供)在37℃的水浴中复苏后,按3×105个/ml接种至含有细胞培养液的培养皿(100mm)中,然后置于培养箱中进行培养,每隔24h更换一次培养液。
步骤s22、在培养箱中培养至细胞汇合率达到70~80%后,进行传代培养;
其中,在步骤s21中:所述传代培养的培养时间为7~8天。当猪小肠上皮细胞在恒温箱中培养2~3天后,细胞汇合率达到70~80%,再对猪小肠上皮细胞进行传代培养,经7~8天后细胞传代至2~3代。
步骤s23、对经过传代培养的猪小肠上皮细胞进行胰蛋白酶消化处理,获得待诱导细胞。
其中,步骤s23具体包括:向经过传代培养的猪小肠上皮细胞中加胰蛋白酶溶液,消化1~3min后弃去胰蛋白酶溶液,并加入细胞培养液终止消化,获得待诱导细胞。具体操作时可采用如下方法:向传代培养后的猪小肠上皮细胞中加入胰蛋白酶溶液(美国gibco公司,胰蛋白酶的浓度为0.25%,含有0.9mm的edta),使胰蛋白酶溶液充分浸润贴壁细胞,消化1~3min后弃去胰蛋白酶溶液,然后加入适量的细胞培养液终止消化,从而获得待诱导细胞。
可选地,步骤s30包括:
步骤s31、将待诱导细胞接种至孔板中,加入细胞培养液继续培养;
其中,在步骤s31中:所述待诱导细胞接种至所述孔板中的接种量为1×104~1×106个/孔,所述细胞培养液在所述孔板中的添加量为0.1~1ml/孔。具体操作时可采用如下方法:将待诱导细胞接种到96孔板中,每孔加入100μl的细胞培养液,轻微摇晃使细胞均匀分散在孔板中,继续培养2~3天。
步骤s32、培养至细胞贴壁且长到70~80%后,吸除孔板中的细胞培养液并用磷酸盐缓冲液沿孔壁清洗;
将待诱导细胞在孔板中培养2~3天后,待细胞贴壁且长到70~80%时,吸除其中的旧培养基,然后用磷酸盐缓冲液(ph值为7.0,美国hyclone公司)沿孔壁清洗两遍后备用。
步骤s33、向清洗后的孔板中加入含有双氧水的细胞培养液,进行双氧水诱导。
将配制好的双氧水浓度为0.5mm的细胞培养液加入孔板中,每孔100μl,诱导刺激3h,即可完成双氧水诱导猪小肠上皮细胞凋亡模型的建立。
以下结合具体实施例和附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅用以解释本发明,并不用于限定本发明。
实施例1双氧水浓度对ipec-1细胞活力的影响
(1)将1×105个/孔的待诱导细胞接种到96孔板中,每孔加入100μl的细胞培养液,轻微摇晃使细胞均匀分散在孔板中,培养3天后待细胞贴壁且长到70%-80%时,吸除培养液,用磷酸盐缓冲液沿孔壁清洗两遍。
(2)依次将配制好细胞培养液加入到孔板中,每孔100μl,其中,细胞培养液分为对照组和试验a、b组,三组中细胞培养液中双氧水的浓度分别为0mm、0.2mm和0.5mm,每组重复8个。
(3)待双氧水刺激3h后,吸除培养液,用磷酸盐缓冲液沿孔壁清洗两遍后,测试ipec-1细胞活力。测试方法如下:向每个孔中加入100μl的含10%cck8试剂(cellcountingkit-8,武汉丁香圆科技有限公司)的细胞培养液,放置在5%co2,37℃的培养箱中孵育1h,然后将其取出,快速用酶标仪(bio-radimark,bio-rad,美国)在450nm波长下测定吸光度(od值),测试结果如表1和图1所示。
表1双氧水浓度对ipec-1细胞活力的影响
由表1和图1可知,对照组、试验a组和试验b组的ipec-1细胞的od值依次降低,且与对照组相比,试验a组和试验b组的p值均小于0.05,说明浓度分别为0.2mm和0.5mm的双氧水刺激均可以导致ipec-1细胞活力显著降低。
实施例2双氧水浓度对ipec-1细胞上清液乳酸脱氢酶活性的影响
(1)将1×105个/孔的待诱导细胞接种到12孔板中,每孔加入1ml的细胞培养液,轻微摇晃使细胞均匀分散在孔板中,培养3天后待细胞贴壁且长到70%-80%时,吸除培养液,用磷酸盐缓冲液沿孔壁清洗两遍。
(2)依次将配制好细胞培养液加入到孔板中,每孔1ml,其中,细胞培养液分为对照组和试验a、b组,三组中细胞培养液中双氧水的浓度分别为0mm、0.2mm和0.5mm,每组重复4个。
(3)待双氧水刺激3h后,吸取细胞培养上清液,转入1.5ml的无菌离心管中,用微板法乳酸脱氢酶(ldh)测定试剂盒(由南京建成生物工程研究所提供)测定细胞上清液ldh的活力。测试方法如下:样品分别设空白样、标准样、测定样和对照样。空白样加25μl双蒸水和25μl基质缓冲液;标准样加5μl双蒸水、20μl标准液(0.2mmpl/l)和25μl基质缓冲液;待测样本加20μl待测液、25μl基质缓冲液和5μl辅酶i;对照样加5μl双蒸水、20μl待测样和25μl基质缓冲液基质缓冲液;将上述样品分别混匀后在37℃温度下水浴15min,然后加入25μl的2,4-二硝基苯肼,混匀后再继续水浴15min,最后加入25μl的naoh溶液(0.4mol/l),在室温静置5min后,用酶标仪(bio-radimark,bio-rad,usa)在450nm波长下测定吸光度(od值),然后根据od值计算ipec-1细胞上清液ldh活性,结果如表2和图2所示。(其中,1000ml血清/浆在37℃温度下与基质作用15min,在反应体系中产生1μmol丙酮酸为1单位u。)
表2双氧水浓度对ipec-1细胞上清液乳酸脱氢酶活性的影响
ldh是一种稳定的细胞内酶,当细胞受到损伤时,细胞内的ldh会释放到培养液中,因此,在本实施例中,细胞培养上清液中ldh活力的增强,说明双氧水诱导导致细胞产生了损伤。由表2和图2可知,与对照组相比,试验a组的ipec-1细胞上清液ldh活性有所降低,且p值达到0.683;而试验b组ipec-1细胞上清液ldh活力显著升高,且p值小于0.042。说明双氧水的浓度为0.2mm时并不会提高ipec-1细胞上清液ldh的活性,而双氧水的浓度为0.5mm时可导致ipec-1细胞上清液ldh活性显著提高,即0.5nm浓度的双氧水诱导3h后导致细胞损伤。因此,本发明下述实施例中双氧水的浓度均设为0.5mm。
实施例3双氧水浓度对ipec-1细胞凋亡相关分子caspase3、p38和jnk蛋白表达的影响
(1)将1×106个/ml的细胞接种到60mm的培养皿中,在每个培养皿加入4ml的细胞培养液轻微摇晃使细胞均匀分散在培养皿中,培养3天后待细胞贴壁且长到70%-80%时,吸除培养液,用磷酸盐缓冲液清洗两遍。
(2)依次将配制好细胞培养液加入到孔板中,每孔4ml,其中,细胞培养液分为对照组和试验b组,两组中细胞培养液中双氧水的浓度分别为0mm和0.5mm,每组重复4个。
(3)待双氧水刺激3h后,吸除培养液,用磷酸盐缓冲液沿孔壁清洗两遍后,向每个孔中加入100μl的细胞裂解缓冲液(cellsignalingtechnology公司)后,用细胞刮将蛋白裂解液涂抹均匀,并用力将细胞刮取并集中一处,再吸取转移到1.5ml的离心管中,震荡裂解;然后4℃、12000g条件下,离心15min,吸取上清液转移到新的1.5ml的离心管中,采用westernblot方法测定细胞蛋白表达量。
其中,westernblot方法的具体测试方法如下:先用浓度为1mg/ml的牛血清白蛋白液(bsa,江苏碧云天生物技术公司)对离心管中的蛋白样品进行定量;然后分别取10μl的蛋白样品于100℃沸水中煮5~8min使蛋白变性,用十二烷基磺酸钠-聚丙烯酰胺凝胶进行电泳分离后,转至聚偏氟乙烯膜(杭州联科生物技术股份有限公司)上,加入5%脱脂奶粉(cellsignalingtechnology公司)后室温封闭1小时;再用tris-hcl缓冲液(0.1%tween-20)洗膜3次,每次10min,后孵一抗,于4℃过夜。一抗分别为caspase3(1:1000稀释,美国invitrogen公司)、总p38(t-p38)(1:1000稀释,美国cellsignalingtechnology公司)、磷酸化p38(p-p38)(1:1000稀释,美国cellsignalingtechnology公司)、总jnk(t-jnk)(1:1000稀释,美国cellsignalingtechnology公司)、磷酸化jnk(p-jnk)(1:1000稀释,美国cellsignalingtechnology公司),β-actin(1:1000稀释,美国sigma公司)。洗膜后二抗(武汉安特捷生物技术有限公司)室温下孵育2h,二抗分别为hrp-goatanti-mouseigg(1:5000稀释,武汉安特捷生物技术公司)和hrp-goatanti-rabbitigg(1:5000稀释,武汉安特捷生物技术公司)。最后用tris-hcl缓冲液(0.1%tween-20)洗膜3次,每次10min,再用ecl试剂(美国pierce公司)荧光显色,于alphainnotech成像系统(美国proteinsimple公司)中检测及分析条带强度(caspase3蛋白水平以caspase3和β-actin的蛋白条带强度比值表示,磷酸化p38和jnk蛋白水平分别与其总蛋白强度比值表示),结果如表3以及图3至图7所示。
表3双氧水浓度对ipec-1细胞凋亡相关分子caspase3、p38和jnk蛋白表达的影响
由表3以及图3至图7可知,与对照组相比,0.5mm双氧水刺激导致ipec-1细胞凋亡相关分子caspase3蛋白表达量显著升高,同时导致p-p38/t-p38和p-jnk/t-jnk比值显著升高。由于caspase3是细胞凋亡的标志性蛋白,而p38、和jnk是细胞凋亡信号通路关键分子。因此,上述结果表明0.5mm的双氧水诱导3h后,激活了细胞凋亡信号通路,从而促进了细胞凋亡。
实施例4双氧水浓度对ipec-1细胞凋亡相关分子nf-κbp65蛋白的影响
(1)将1×105个/孔的细胞接种到12孔板圆形爬片(美国corning公司)上,在每个爬片上加入1ml的细胞培养液,轻微摇晃使细胞均匀分散在爬片上,培养3天后待细胞贴壁且长到70%-80%时,吸除培养液,用磷酸盐缓冲液清洗两遍。
(2)依次将配制好细胞培养液加入到孔板中,每孔1ml,其中,细胞培养液分为对照组和试验b组,两组中细胞培养液中双氧水的浓度分别为0mm和0.5mm,每组重复4个。
(3)待双氧水刺激3h后,吸除培养液,用磷酸盐缓冲液清洗两遍。按照nf-κb激活核转运检测试剂盒(江苏碧云天生物技术公司)步骤制作细胞爬片,用荧光倒置显微镜(ix73研究级,日本olympus公司)观察细胞爬片,其中,荧光染料选用dapi(即4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole),是一种能够与dna强力结合的荧光染料,常用于荧光显微镜观测)(其中蓝色荧光为核染,红色荧光为nf-κbp65蛋白分子),结果如图8所示。图8中,图(a)为ipec-1细胞采用dapi核染的细胞核形态图,图(b)为ipec-1细胞中nf-κbp65蛋白分子的形态图,图(c)为ipec-1细胞中nf-κbp65蛋白分子进入细胞核后的细胞核形态图。
由图8可知,与对照组相比,试验b组的荧光较多,表明ipec-1细胞中nf-κbp65蛋白入核增加。通常来说,nf-κb和iκb经常以复合物的形式存在于细胞质内,iκb发生磷酸化和泛素化被降解后,nf-κb从细胞质中解离出来并转移至细胞核内,与相应位点特异性结合并调控其目的基因(如炎症、凋亡相关基因)的转录和表达。因此,上述结果表明,0.5mm的双氧水诱导刺激3h后,导致ipec-1细胞中nf-κbp65蛋白入核增加,即双氧水激活nf-κb信号,诱导细胞的凋亡。
综上所述,在本发明实施例中,0.5mm的双氧水作用于ipec-1细胞导致细胞活性下降,凋亡相关分子蛋白表达量显著上升,成功建立了ipec-1细胞的凋亡模型,且具有诱导时间短、操作简便、成本低廉且效果稳定可靠的优点,为研究猪肠道损伤机制及其调控措施提供了重要途径。
以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之类,所作的任何修改、等同替换、改进等,均应包括在本发明的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!