在细胞培养物中生产重组ADAMTS13的方法与流程
本申请是中国申请第201180043094.5号(在细胞培养物中生产重组adamts13的方法)的分案申请,申请日为2011年07月08日。相关申请的交叉引用本申请要求2010年7月8日提交的美国临时专利申请系列号61/362,635的优先权,其公开内容特此以引用的方式整体并入本文用于所有目的。
背景技术:
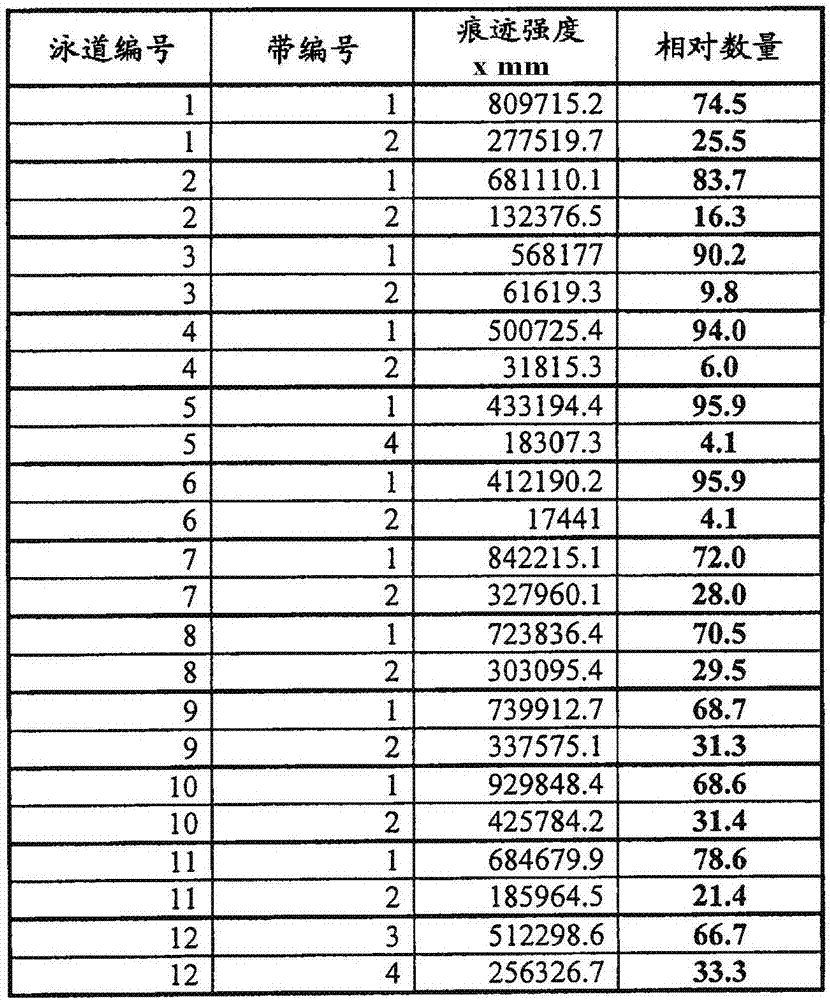
:治疗性蛋白在细胞培养物(特别是大规模细胞培养物,包括真核细胞培养物和更具体的哺乳动物细胞培养物)中的重组表达,需要使用特殊培养基,所述特殊培养基为细胞的有效生长提供营养物质。经常给细胞培养基制剂补充多种添加剂,包括胎牛血清(fcs)、动物衍生的蛋白和/或牛源蛋白水解物以及从植物或酵母衍生出的蛋白水解物。使用这种培养物的一项挑战是,甚至当细胞培养基的制剂没有变化时,在不同的细胞培养物之间,蛋白的量和生产的蛋白的总活性和比活性经常会变化。在使用10升至超过20,000升的细胞培养体积的大规模生产工艺的情况下,该变化性是特别明显的。含有水解物的细胞培养基特别易于随细胞培养物不同而变化,从而导致减少的总蛋白产量以及降低的总活性和比活性。在不同的细胞培养物之间看到的变化性的一个潜在原因是,在添加剂(诸如水解物)中的污染物随批次不同而变化。一般而言,血清或血清衍生的物质(例如白蛋白、转铁蛋白或胰岛素)可以包含不想要的试剂,所述试剂可污染细胞培养物和由其获得的生物制品。此外,必须针对所有已知病毒(包括可通过血清传播的肝炎病毒和hiv)测试人血清衍生的添加剂。此外,牛血清和从其衍生的制品具有bse污染的风险。此外,所有血清衍生的制品可被未知物质污染。当使用血清或从细胞培养中的人或动物来源衍生的蛋白添加剂时,存在许多问题(例如,不同批次的组合物的不同质量以及被支原体属、病毒或bse污染的风险),特别是如果细胞被用于制造用于人施用的药物或疫苗时。因此,已作出许多努力以提供不需要血清或其它动物蛋白化合物的有效宿主系统和培养条件。已基于衍生自植物或酵母的蛋白提取物开发了这样的无血清培养基。例如,已知大豆水解物对于发酵方法是有用的,并且可增强许多需要复杂营养的生物体、酵母和真菌的生长。wo96/26266描述了大豆粉(soymeal)的木瓜蛋白酶消化物是碳水化合物和氮的来源,并且许多组分可用于组织培养。franek等人(biotechnologyprogress(2000)16,688-692)描述了确定的大豆和小麦水解物肽级分的生长和生产力促进效应。wo96/15231公开了由合成的最低必需培养基和酵母浸出物组成的无血清培养基,其用于脊椎动物细胞的繁殖和病毒生产过程。由基础细胞培养基(其包含水稻肽和酵母提取物及其酶消化物)和/或用于培养动物细胞的植物脂质组成的培养基制剂公开于wo98/15614中。用于培养重组细胞的包含纯化的大豆水解物的培养基公开于wo01/23527中。wo00/03000公开了包含大豆水解物和酵母提取物的培养基,但是该培养基也需要重组形式的动物蛋白(例如生长因子)的存在。ep-a-0481791描述了用于培养工程改造的cho细胞的生物化学成分确定(biochemicallydefined)的培养基,其不含从动物来源分离的蛋白、脂质和碳水化合物,其还包含重组胰岛素或胰岛素类似物、1%至0.025%w/v的木瓜蛋白酶消化的大豆蛋白胨和腐胺。wo98/08934描述了一种无血清真核细胞培养物,其包含水解的大豆肽(1-1000mg/l)、0.01-1mg/l腐胺和多种动物衍生的组分(包括白蛋白、胎球蛋白、多种激素和其它蛋白)。在该背景下,应当指出,还已知腐胺以0.08mg/l的浓度包含在标准培养基(如dmem/ham'sf12)中。然而,植物和/或酵母水解物是寡肽和其它未知组分和污染物的成分不明确的混合物。此外,水解物的商购可得批次的质量变化极大。因此,重组蛋白或病毒产物的产量随着所使用的水解物的批次而存在较大变异(最高达3倍的变异)(“批间变异”)。该缺点会影响细胞的增殖以及每种细胞的蛋白表达。us2007/0212770描述了不同的不含动物蛋白的且不含寡肽的化学成分确定(chemicallydefined)的培养基,所述培养基可用于重组蛋白生物药剂的大规模生产。止血包含不同止血反应途径的相互作用,最终导致血栓形成。血栓是血液组分在血管壁的表面上的沉着物,其主要由聚集的血小板和不溶性的交联的纤维蛋白组成。纤维蛋白形成是凝血酶(一种凝结酶)对纤维蛋白原的限制性蛋白酶解的结果。凝血酶是凝血连锁和多种血管细胞的终产物,所述凝血连锁是在活化的血小板和白血球的表面上发生的一系列酶原活化(综述参见:k.g.mann等人,blood,1990,第76卷,第1-16页)。凝血连锁的一项重要功能是,通过活化的因子ix(因子ixa)和活化的因子viii(因子viiia)的复合物对因子x的活化。该复合物的组分的缺乏或功能障碍与称作血友病的血液疾病有关(j.e.sadler和e.w.davie:hemophiliaa,hemophiliab,andvonwillebrand’sdisease,g.stamatoyannopoulos等人(编):themolecularbasisofblooddiseases.w.b.saundersco.,philadelphia,1987,第576-602页)。a型血友病是与因子viii活性的缺乏有关,而b型血友病与因子ix缺乏有关。当前的治疗包括补偿疗法,其中使用包含正常凝血因子的药物制剂。在这些血小板病中,a型血友病更经常地发生,影响大约1/10,000的人。a型血友病患者的补偿疗法包括:通过静脉内输注,重复施用含有正常因子viii的制剂。输注之间之间隔随血液循环中的因子viii活性的降解而变化。在输注以后因子viii活性的半衰期随个体不同而异,在10-30小时的范围内。因而,预防性治疗需要每2-3天输注1次。这对血友病患者的生活造成沉重负担,具体地,如果静脉接入已经变得困难(由于静脉内输注进行频繁的针穿刺以后造成的局部citratization)。如果通过使用具有延长的半衰期的因子viii来降低输注频率,将是特别有利的。本领域众所周知的是,未活化的因子viii异源二聚体的半衰期强烈地依赖于vonwillebrand因子的存在,所述vonwillebrand因子表现出对因子viii的(但是对因子viiia则没有)强亲和力并充当载体蛋白(j.e.sadler和e.w.davie:hemophiliaa,hemophiliabandvonwillebrand’sdisease,g.stamatoynnopoulos等人(编):themolecularbasisofblooddiseases.w.b.saundersco.,philadelphia,1987,第576-602页)。已知的是,遭受3型vonwillebrand氏病的患者(其在血液循环中不具有可检测的vonwillebrand因子)也遭受继发性的因子viii缺乏。另外,静脉内地施用的因子viii在这些患者中的半衰期是2-4小时,这比在a型血友病患者中观察到的10-30小时明显更短。从这些发现得出结论:因子viii倾向于从血液循环中快速地清除,并且该过程在某种程度上受到与它的天然载体vonwillebrand因子的复合物形成的抑制。vonwillebrand因子(vwf)是一种作为一系列多聚体在血浆中循环的糖蛋白,所述多聚体的大小范围通常是约500-20,000kd(或vwf的2-40二聚体)。二聚体和多聚体形式的vwf由通过二硫键连接到一起的250kd多肽亚基组成。vwf介导血小板向损伤的血管壁的内皮下膜的初始附着;不过,更多的多聚体也表现出止血活性。多聚化的vwf会结合血小板表面糖蛋白gp1bα(通过在vwf的a1结构域中的相互作用),以便促进血小板附着。假定内皮细胞分泌大聚合形式的vwf,并且具有低分子量的这些vwf形式(低分子量vwf)已经从蛋白水解性裂解产生。具有大分子质量的多聚体被储存在内皮细胞的weibel-palade小体中,并在受到刺激以后释放。fviii结合活性的降低(由于降低的vwf蛋白水平或降低的fviii结合亲和力)会导致3类vonwillebrand氏病之一。额外地或或者,某些类型的vonwillebrand氏病的特征在于,gp1bα介导的血小板结合水平的增加或降低,即在2a、2b和2m型中(总结在:castaman等人,disordersofhemostasis88(1):94-108(2003))。这样,vwf与fviii和gp1bα的相互作用的调控,是用于治疗血友病和vonwillebrand氏病的可行策略。鉴于vwf的生物学重要性,本领域不断地需要改进生产用于治疗用途的vwf的方法。众所周知,vwf可以分离自内源来源诸如人血浆。分离的vwf的有利方面是,它具有高比活性用于实现它的生物学功能,且因此可以有效地用作治疗性蛋白用于治疗相关疾病诸如vonwillebrand氏病。通常,血浆vwf具有约100mu/μg的利托菌素比活性,但是从人血浆中分离具有缺点,因为例如,所述血浆可以含有多种病毒,诸如hiv和/或肝炎病毒,所述病毒可传递至患者。此外,血浆是有限的资源,并且因而血浆的短缺在提供足够用于治疗的vwf中可以成为问题。这样,在解决与依赖于血浆作为vwf来源有关的一些问题中,用于生产vwf的重组方法是有利的。就重组生产而言,克隆vwf的全长cdna;前多肽与全长前原-vwf的氨基酸残基23-764相对应(eikenboom等人,(1995)haemophilia1,77-90)。不幸的是,vwf是具有复杂的翻译后修饰的分子。并且,vwf二聚体在高尔基体中向大型和超大型多聚体的多聚化,是在哺乳动物细胞中表达的一项挑战。例如,在细胞培养物(例如,人(原代)内皮细胞的细胞培养物)中表达的高分子量vwf依赖于超大型vwf分子在weibel-palade小体中的专门储存。这样的细胞培养物不适用于生产治疗性蛋白。其它细胞培养方法已经见诸报道,并且已知细胞培养条件可以以多种方式影响vwf的生产。例如,已经证实,高浓度的铵(nh4+)会扰乱翻译后修饰。mayadas等人(j.biol.chem.,264(23):13497-13503,1989)证实,25mm的铵水平会导致内皮细胞中减少的vwf多聚化,其也不利地影响重组vwf的利托菌素比活性。多聚化的减少通常与重组vwf的活性(特别是利托菌素比活性)的降低有关。仍然难以预测哪些参数可以积极地或消极地影响特定蛋白(特别是复杂的糖蛋白,如因子viii和vwf)的生产。例如,已经证实,细胞培养基的某些组分会影响因子viii的生产。如在美国专利号5,804,420中公开的,多元醇、铜和其它微量金属的加入,可以积极地影响因子viii的生产产率。也如在wo2009/086309中描述的,已经证实,使用铜的细胞培养方法会提高因子viii的生产。mignot等人(1989)也已经报道了vwf在重组cho细胞中的表达。但是,这些实例都没有提供关于vwf的比活性或它的多聚体分布的信息。adamts(具有i型凝血酶敏感蛋白基序的解聚素和金属蛋白酶)蛋白是包含许多保守结构域(包括锌依赖性的催化结构域、富含半胱氨酸的结构域、解聚素样结构域和至少一个(在大多数情况下多个)i型凝血酶敏感蛋白重复的金属蛋白酶家族(关于综述,参见nicholson等人,bmcevolbiol.2005feb4;5(1):11)。在进化上与金属蛋白酶的adam和mmp家族相关的这些蛋白(jonesgc,currpharmbiotechnol.2006feb;7(1):25-31)是已经与许多疾病和病症相关联的分泌型酶,所述疾病和病症包括:血栓性血小板减少性紫癜(ttp)(moakejl,seminhematol.2004jan;41(1):4-14)、结缔组织障碍、癌症、炎症(nicholson等人)和严重的恶性疟原虫疟疾(larkin等人,plospathog.2009mar;5(3):e1000349)。由于这些关联,adamts酶已被公认为许多病理学的潜在治疗靶标(jonesgc,currpharmbiotechnol.2006feb;7(1):25-31)。因此,需要生产大量具有高比活性的adamts蛋白的方法,所述蛋白不含污染物诸如病毒、bse和病原体如支原体属细菌。一个adamts家族成员adamts13在残基tyr1605和met1606之间切割vonwillebrand因子(vwf),该功能负责在体内降解大vwf多聚体。adamts13活性的丧失已经与许多病症相关联,所述病症例如ttp(moakejl,seminhematol.2004jan;41(1):4-14)、急性和慢性炎症(chauhan等人,jexpmed.2008sep1;205(9):2065-74)以及最近严重的恶性疟原虫疟疾(larkin等人,plospathog.2009mar;5(3):e1000349)。adamts13蛋白酶是主要由肝产生的190kda糖基化的蛋白(levy等人,nature.2001;413:488-494;fujikawa等人,blood.2001;98:1662-1666;zheng等人,jbiolchem.2001;276:41059-41063;soejima等人,jbiochem(tokyo)。2001;130:475-480;和gerritsen等人,blood.2001;98:1654-1661)。与高阶rvwf多聚体非常类似,大adamts13在哺乳动物细胞培养物中的重组表达存在许多挑战。因此,需要提供细胞培养条件,特别是大规模生产性的培养条件,所述条件会提供在不同细胞培养物生产的蛋白之间一致的总蛋白产率和/或一致的总活性和比活性。在大规模生产工艺中培养物之间的一致性,在治疗性蛋白的生产中具有重要性。也需要用于大规模生产rvwf的细胞培养条件,所述rvwf具有与在正常人血浆中存在的vwf相当或比其更高的多聚体分布和利托菌素比活性。类似地,由于adamts蛋白已经涉入许多疾病和病症,本领域需要大规模生产具有高比活性的重组adamts蛋白的方法,所述重组adamts适合用于药物制剂和施用。本发明满足了本领域内对重组vonwillebrand因子和重组adamts13的生产的这些和其它需要。技术实现要素:在某些方面,本发明是基于下述令人惊奇的发现:用于表达重组vonwillebrand因子(rvwf)和重组adamts13(ra13)的细胞培养基的补充,会产生显著提高的蛋白表达和酶活性。在第一方面,本发明提供了一种用于生产重组vonwillebrand因子(rvwf)组合物的方法,所述方法包括下述步骤:(a)提供基础细胞培养基;(b)给所述基础细胞培养基补充铜,以提供至少2.4μg/l的最终铜浓度;(c)提供一个或多个细胞,所述细胞包含编码rvwf蛋白的核酸;(d)在补充了铜的细胞培养基中培养所述一个或多个细胞,使得所述细胞表达rvwf并将其分泌进培养物上清液中;和(e)回收所述培养物上清液的至少一部分,其中所述回收的上清液的rvwf的利托菌素辅因子比活性为至少30mu/μgrvwf。在上文提供的方法的一个实施方案中,所述方法另外包括下述步骤:在培养所述一个或多个细胞之前,用水解物补充所述基础细胞培养基。在上文提供的方法的一个实施方案中,所述水解物是植物水解物。在一个具体实施方案中,所述水解物是大豆水解物。在上文提供的方法的一个实施方案中,所述基础细胞培养基是不含动物蛋白的培养基。在上文提供的方法的一个实施方案中,所述基础细胞培养基是不含蛋白的培养基。在上文提供的方法的一个实施方案中,所述基础细胞培养基是化学成分确定的培养基。在上文提供的方法的一个实施方案中,所述补充铜的基础细胞培养基的最终铜浓度是至少4μg/l铜。在上文提供的方法的一个实施方案中,所述补充铜的基础细胞培养基的最终铜浓度是2.4μg/l至20μg/l铜。在上文提供的方法的一个实施方案中,补充基础细胞培养基的铜以铜盐、铜螯合物或它们的组合的形式提供。在上文提供的方法的一个实施方案中,所述铜盐选自:硫酸铜、醋酸铜、碳酸铜、氯化铜、氢氧化铜、硝酸铜和氧化铜。在上文提供的方法的一个实施方案中,所述一个或多个细胞是哺乳动物细胞。在一个具体实施方案中,所述哺乳动物细胞是cho细胞。在上文提供的方法的一个实施方案中,所述培养所述一个或多个细胞包括:所述细胞的分批培养。在上文提供的方法的一个实施方案中,所述培养所述一个或多个细胞包括:所述细胞的连续培养。在一个具体实施方案中,所述细胞的连续培养以恒化模式进行。在另一个具体实施方案中,所述细胞的连续培养以灌注模式进行。在上文提供的方法的一个实施方案中,在至少100l所述经补充的基础细胞培养基中培养所述一个或多个细胞。在上文提供的方法的一个实施方案中,在培养所述一个或多个细胞的步骤过程中,细胞密度维持在小于2.5x106个细胞/ml。在上文提供的方法的一个实施方案中,在培养所述一个或多个细胞的步骤过程中,细胞密度维持在小于2.0x106个细胞/ml。在上文提供的方法的一个实施方案中,在培养所述一个或多个细胞的步骤过程中,细胞密度维持在小于1.5x106个细胞/ml。在上文提供的方法的一个实施方案中,所述回收培养物上清液的至少一部分的步骤包括过滤或离心,以从培养物上清液的一部分中除去细胞。在上文提供的方法的一个实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少40mu/μgrvwf。在一个具体实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更具体的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少60mu/μgrvwf。在一个更具体的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在一个更具体的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少80mu/μgrvwf。在上文提供的方法的一个实施方案中,上清液中至少10%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在一个具体实施方案中,至少15%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少20%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少25%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少30%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在上文提供的方法的一个实施方案中,所述上清液含有14-22个二聚体的高分子量vwf多聚体。在上文提供的方法的一个实施方案中,所述培养物上清液中的nh4+含量维持在低于10mm的浓度。在上文提供的方法的一个实施方案中,所述培养物上清液中的nh4+含量维持在低于4mm的浓度。在上文提供的方法的一个实施方案中,rvwf是与重组因子viii(rfviii)共表达。在一个具体实施方案中,所述方法另外包括下述步骤:从回收的上清液中存在的至少50%的rfviii中,纯化出rvwf。在一个实施方案中,在所述纯化步骤以后,rvwf与rfviii之比是至少10:1。在上文提供的方法的一个实施方案中,所述方法另外包括rvwf富集步骤。在第二方面,本发明提供了通过本文提供的方法制备的重组vonwillebrand因子(rvwf)组合物。在上面提供的组合物的一个实施方案中,所述组合物另外包含重组因子viii(rfviii)。在一个具体实施方案中,rvwf与rfviii之比是至少10:1。在上面提供的组合物的一个实施方案中,所述组合物配制成用于药物给药。在一个具体实施方案中,所述组合物配制成用于静脉内给药。在第三方面,本发明提供了一种包含重组vonwillebrand因子(rvwf)的细胞培养物上清液,其中所述上清液是通过本文提供的方法制备。在第四方面,本发明提供了一种包含重组vonwillebrand因子(rvwf)的细胞培养物上清液,其中所述上清液中至少10%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在一个具体实施方案中,所述上清液中至少15%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,所述上清液中至少20%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,所述上清液中至少25%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,所述上清液中至少30%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在上面提供的上清液的另一个具体实施方案中,所述上清液是根据本文提供的方法制备。在第五方面,本发明提供了一种包含重组vonwillebrand因子(rvwf)的细胞培养物上清液,其中所述上清液每ml含有至少0.4iu利托菌素辅因子活性。在一个具体实施方案中,所述上清液每ml含有至少0.5iu利托菌素辅因子活性。在另一个具体实施方案中,所述上清液每ml含有至少0.6iu利托菌素辅因子活性。在另一个具体实施方案中,所述上清液每ml含有至少0.7iu利托菌素辅因子活性。在上面提供的上清液的另一个具体实施方案中,所述上清液是根据本文提供的方法制备。在第六方面,本发明提供了一种用于生产重组adamts13(ra13)组合物的方法,所述方法包括下述步骤:(a)提供基础细胞培养基;(b)给所述基础细胞培养基补充铜,以提供至少1.0μg/l的最终铜浓度;(c)提供一个或多个细胞,所述细胞包含编码ra13蛋白的核酸;(d)在补充了铜的细胞培养基中培养所述一个或多个细胞,使得所述细胞表达ra13并将其分泌进培养物上清液中;和(e)回收所述培养物上清液的至少一部分,其中在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少1500单位frets-vwf73活性。在上文提供的方法的一个实施方案中,所述基础细胞培养基是不含动物蛋白的培养基。在上文提供的方法的一个实施方案中,所述基础细胞培养基是不含蛋白的培养基。在上文提供的方法的一个实施方案中,所述基础细胞培养基是化学成分确定的培养基。在上文提供的方法的一个实施方案中,所述经补充的基础细胞培养基的最终铜浓度是至少1μg/l铜。在上文提供的方法的一个实施方案中,所述经补充的基础细胞培养基的最终铜浓度是至少2μg/l铜。在上文提供的方法的一个实施方案中,所述经补充的基础细胞培养基的最终铜浓度是至少4μg/l铜。在上文提供的方法的一个实施方案中,所述经补充的基础细胞培养基的最终铜浓度是1μg/l至6μg/l铜。在上文提供的方法的一个实施方案中,所述经补充的基础细胞培养基的最终铜浓度是2μg/l至4μg/l铜。在上文提供的方法的一个实施方案中,补充基础细胞培养基的铜以铜盐、铜螯合物或它们的组合的形式提供。在一个具体实施方案中,所述铜盐选自:硫酸铜、醋酸铜、碳酸铜、氯化铜、氢氧化铜、硝酸铜和氧化铜。在上文提供的方法的一个实施方案中,所述一个或多个细胞是哺乳动物细胞。在一个具体实施方案中,所述哺乳动物细胞是cho细胞。在上文提供的方法的一个实施方案中,所述培养所述一个或多个细胞包括:所述细胞的分批培养。在上文提供的方法的一个实施方案中,所述培养所述一个或多个细胞包括:所述细胞的连续培养。在一个具体实施方案中,所述细胞的连续培养以恒化模式进行。在另一个具体实施方案中,所述细胞的连续培养以灌注模式进行。在上文提供的方法的一个实施方案中,在至少100l所述经补充的基础细胞培养基中培养所述一个或多个细胞。在上文提供的方法的一个实施方案中,在培养所述一个或多个细胞的步骤过程中,细胞密度维持在小于4.0x106个细胞/ml。在上文提供的方法的一个实施方案中,在培养所述一个或多个细胞的步骤过程中,细胞密度维持在小于3.5x106个细胞/ml。在上文提供的方法的一个实施方案中,在培养所述一个或多个细胞的步骤过程中,细胞密度维持在小于3.0x106个细胞/ml。在上文提供的方法的一个实施方案中,在培养所述一个或多个细胞的步骤过程中,细胞密度维持在小于2.5x106个细胞/ml。在上文提供的方法的一个实施方案中,在培养所述一个或多个细胞的步骤过程中,细胞密度维持在小于2.0x106个细胞/ml。在上文提供的方法的一个实施方案中,在培养所述一个或多个细胞的步骤过程中,细胞密度维持在小于1.5x106个细胞/ml。在上文提供的方法的一个实施方案中,所述回收培养物上清液的至少一部分的步骤包括过滤或离心,以从培养物上清液的一部分中除去细胞。在上文提供的方法的一个实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2000单位frets-vwf73活性。在上文提供的方法的一个实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2500单位frets-vwf73活性。在上文提供的方法的一个实施方案中,所述回收的上清液的ra13的frets-vwf73比活性为至少800mu/μg。在上文提供的方法的一个优选的实施方案中,所述回收的上清液的ra13的frets-vwf73比活性为至少1200mu/μg。在上文提供的方法的一个更优选的实施方案中,所述回收的上清液的ra13的frets-vwf73比活性为至少1600mu/μg。在上文提供的方法的一个实施方案中,所述培养物上清液中的nh4+含量维持在低于10mm的浓度。在上文提供的方法的一个实施方案中,所述培养物上清液中的nh4+含量维持在低于5mm的浓度。在上文提供的方法的一个实施方案中,所述培养物上清液中的nh4+含量维持在低于4mm的浓度。在上文提供的方法的一个实施方案中,所述方法另外包括ra13富集步骤。在第七方面,本发明提供了一种包含重组adamts13(ra13)的细胞培养物上清液,其中所述上清液是通过本文提供的方法制备。在第八方面,本发明提供了一种包含重组adamts13(ra13)的细胞培养物上清液,其中所述上清液每ml含有至少5ufrets-vwf73活性。在一个具体实施方案中,所述上清液每ml含有至少6ufrets-vwf73活性。在另一个具体实施方案中,所述上清液每ml含有至少7ufrets-vwf73活性。在另一个具体实施方案中,所述上清液每ml含有至少8ufrets-vwf73活性。在另一个具体实施方案中,所述上清液每ml含有至少9ufrets-vwf73活性。在另一个具体实施方案中,所述上清液每ml含有至少10ufrets-vwf73活性。在上面提供的上清液的另一个具体实施方案中,所述上清液是根据本文提供的方法制备。在第九方面,本发明提供了一种包含重组adamts13(ra13)的细胞培养物上清液,其中所述上清液每ml含有至少2μgra13。在一个具体实施方案中,所述上清液每ml含有至少3μgra13。在另一个具体实施方案中,所述上清液每ml含有至少4μgra13。在另一个具体实施方案中,所述上清液每ml含有至少5μgra13。在另一个具体实施方案中,所述上清液每ml含有至少6μgra13。在上面提供的上清液的另一个具体实施方案中,所述上清液是根据本文提供的方法制备。在第十方面,本发明提供了通过根据任一种上述方法的方法制备的重组adamts13(ra13)组合物。在上面提供的组合物的一个实施方案中,所述组合物配制成用于药物给药。在一个具体实施方案中,所述组合物配制成用于静脉内给药。附图说明图1.(1a)如实施例2所述,在有低(1.0μg/l)和高(4.3μg/l)铜浓度存在下,在哺乳动物细胞培养物中表达的rvwf的低分辨率(1%)琼脂糖凝胶电泳。应当指出,培养第3天相当于表7和表8的分批培养第1天。(1b)如由图1a限定的带指示的,通过密度计分析量化的具有1-10个二聚体(带编号1)和超过10个二聚体(带编号2)的vwf多聚体的相对量。图2.(2a)在有高或低水平的铜存在下,以高和低细胞密度培养的rvwf细胞培养物上清液中存在的平均rvwf比活性的区间图。(2b)在有高或低水平的铜存在下,以高和低细胞密度培养的rvwf细胞培养物上清液中发现的平均nh4+浓度的区间图。图3.通过sds-page分析研究了在有递增水平的铜存在下表达重组adamts13的细胞培养物的上清液。通过(3a)银染色和(3b)抗-a13蛋白印迹法,在sds-page以后显影的ra13。图4.体积生产率(pfrets)数据相对于铜浓度的关系图,其显示了对ra13生产率的最佳铜浓度效应的外推(实线)。图5a-k.表达ra13的连续悬浮(恒化器)细胞培养物在8周培养时间内的条形图,所述条形图对比了基础铜水平(0.66μg/l)的影响和补充至2μg/l铜的终浓度的培养物的影响。每个条代表恒化培养1周的平均数据。图例表示在数据中代表的特定周。图6.(6a)如实施例3所述,在高和低细胞密度下,在有低(1.0μg/l)和高(4.3μg/l)铜浓度存在下,在哺乳动物细胞培养物中表达的rvwf的低分辨率(1%)琼脂糖凝胶电泳。应当指出,培养第8天和第17天(“cst8”和“cst17”)相当于表10至表13的第8天和第17天。(6b)如由图6a限定的带指示的,通过密度计分析量化的具有1-10个二聚体和超过10个二聚体的vwf多聚体的相对量。具体实施方式i.前言通过在大规模哺乳动物细胞培养物中表达,可以生产重组vwf(rvwf)和重组adamts13(ra13)。但是,当使用标准的细胞培养条件生产时,这些蛋白的活性经常在细胞培养物之间变化,甚至当培养基的一般配方没有变化时,且重组蛋白的比活性经常不等于从血浆衍生出的vwf和ra13的比活性。另外,在哺乳动物细胞培养物中表达的rvwf倾向于生产具有低(低于10%)百分比的高阶多聚体(高阶多聚体包括含有超过10个vwf二聚体的分子)的蛋白组合物。在rvwf和ra13的标准生产方法中的这些缺点,在开发用于大规模生产的培养物(即10至超过20,000升培养物)时尤其成问题。在不同细胞培养物批次中经常发现的变化性的一种可能原因是,在细胞培养基的组分中存在污染物。在不同批次中可能存在不同量的这些污染物,从而引起rvwf和ra13生产中的变化结果。在研究于各种细胞培养基添加剂中发现的不同污染物后,本发明人发现,水解物的存在会引起细胞培养基中铜浓度的变化。深入研究得出以下惊人的结果:在细胞培养基中补充铜浓度以生成至少约1μg/l至约20μg/l的总铜浓度,可一致地增加rvwf和ra13的总活性和比活性,和/或也可引起总蛋白产率增加。因而,本发明提供了用于高产率生产具有高比活性的rvwf和ra13蛋白的方法和组合物。在一个方面,本发明提供了用于生产大量rvwf和ra13的细胞培养方法和组合物,所述rvwf和ra13的活性与血浆衍生的vwf(pdvwf)或血浆衍生的adamts13(pda13)相当或比其更高。在其它方面,根据本发明生产的rvwf和ra13蛋白一致地表现出比使用标准细胞培养方法在未补充铜或本文中进一步详述的其它补充物的培养基中生产的蛋白更高的活性。有利的是,在本文中提供的方法和组合物的某些实施方案中,根据本发明生产的rvwf和ra13蛋白一致地表现出比使用标准细胞培养方法在未补充铜或本文中进一步详述的其它补充物的培养基中生产的蛋白更高的比活性(即u/mg蛋白)。同样地,与利用未补充铜或本文中进一步详述的其它补充物的培养基的标准细胞培养方法相比,本文中提供的用于生产rvwf和ra13的方法会提供更高的每体积培养物的活性产率(即u/l/d)。在另一个方面,本发明提供了细胞培养方法,其中给基础细胞培养基补充铜,使得总浓度为至少约1μg/l。在其它实施方案中,给基础细胞培养基补充铜,使得总浓度为至少约2μg/l。在其它实施方案中,给基础细胞培养基补充铜,使得总浓度为至少约1μg/l至约20μg/l。在一些实施方案中,所述铜的总浓度为约1.5-4.5μg/l。在某些实施方案中,补充细胞培养基,达到约1、1.2、1.4、1.6、1.8、2.0、2.2、2.4、2.6、2.8、3、3.2、3.4、3.6、3.8、4、4.2、4.4、4.6、4.8、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10、11、12、13、14、15、16、17、18、19、20μg/l铜或更高。基础细胞培养基通常具有低于1μg/l的微量铜浓度。在一些实施方案中,本发明提供了细胞培养方法,其中给基础细胞培养基补充约1.0μg/l至约20μg/l铜以用于生产rvwf。在其它实施方案中,给基础细胞培养基补充约1.5-15、2.0-10、2.5-8、3.0-6、4.0-5.0μg/l铜以用于生产rvwf。在其它实施方案中,除补充的铜外,基础细胞培养基还包括一种或多种水解物。在其它实施方案中,本发明提供了细胞培养方法,其中给基础细胞培养基补充约1.5μg/l至约4μg/l铜以用于生产ra13。在其它实施方案中,给基础细胞培养基补充约1.6-3.8、1.7-3.6、1.8-3.4、1.9-3.2、2.0-3.0、2.1-2.8、2.2-2.6、2.3-2.4μg/l铜以用于生产ra13。在其它实施方案中,除补充的铜外,基础细胞培养基还包括一种或多种水解物。在其它实施方案中,除铜和/或一种或多种水解物外,基础细胞培养基包括约1.0至约30μm锌。在其它实施方案中,除铜和/或一种或多种水解物和/或锌外,基础细胞培养基另外包括约0.5至约5.0mm钙。在其它方面且根据任一上述方面,本发明提供了细胞培养方法,其中细胞培养溶液的铵水平较低(低于10mm)。在某些实施方案中,本发明的细胞培养方法利用具有超过1、2、3、4或5μg/l铜和低水平的铵的细胞培养基。本发明的方法和组合物的优点之一是,它们可胜任大规模细胞培养物生产。这些大规模细胞培养物大规模细胞培养物是至少10l、50l、100l、150l、200l、250l、500l、750l、1,000l、1,500l、2,000l、5,000l、10,000l或20,000升培养物。在某些方面,本发明的方法不一定生产总量更高的重组蛋白,但所生产的重组蛋白(rvwf或ra13)显示出的总活性和比活高于使用标准细胞培养物生产的蛋白,尤其于细胞培养基未补充额外铜的细胞培养物中生产的蛋白。在其它方面,与于未补充铜的基础细胞培养基中培养的细胞相比,于补充铜的培养基中培养的细胞中生产的rvwf和ra13蛋白一致地显示出每升细胞培养物的活性提高。在其它方面,与未补充铜的培养基相比,本发明的补充铜的培养基导致蛋白产率增加、培养物中的细胞数目增加和/或每升培养物的总活性提高。本发明的方法和组合物的其它优点是,它们可生产含有高百分比(超过10%)的高度多聚化的rvwf的蛋白群。尽管本文中关于adamts蛋白的大部分论述是关于adamts13(a13),应当理解,因为所有adamts蛋白享有共同核心结构域体系结构和共同结构-功能关系,所以本文所述的方法和组合物适用于生产任何adamts蛋白,而不仅仅限于ra13。ii.定义本文使用的“重组vwf”包括经由重组dna技术获得的vwf。在某些实施方案中,本发明的vwf蛋白可以包含构建体,例如如在下述文献中制备:1986年10月23日公开的wo1986/06096,和1990年7月23日以ginsburg等人名义提交的美国专利申请系列号07/559,509(其关于生产重组vwf的方法的内容以引用的方式并入本文中)。本发明的vwf可以包括所有可能形式,包括单体形式和多聚体形式。还应当理解,本发明涵盖组合使用的不同形式的vwf。例如,本发明的vwf可以包括不同多聚体、不同衍生物和生物活性衍生物与非生物活性衍生物。在关于例如细胞或核酸、蛋白或载体使用时,术语“重组”表示这样的细胞、核酸、蛋白或载体:其已通过引入异源核酸或蛋白或改变天然核酸或蛋白而修饰,或从经如此修饰的细胞获得所述细胞。因此,例如,重组细胞表达在细胞的天然(非重组)形式内未发现的基因,或表达否则会异常表达、表达不足或完全不表达的天然基因。在本发明范围内,重组vwf涵盖来自例如哺乳动物(诸如灵长类动物、人、猴、兔、猪、啮齿动物、小鼠、大鼠、仓鼠、沙鼠、犬、猫)的vwf家族的任何成员及其生物活性衍生物。在一个优选的实施方案中,重组vwf为人vwf。也涵盖具有活性的突变体和变体vwf蛋白,以及vwf蛋白的功能片段和融合蛋白。此外,本发明的vwf可另外包含有助于纯化、检测或两者的标签。本文中所描述的vwf可进一步用治疗性部分或适于活体外或活体内成像的部分修饰。术语“高度多聚的vwf”、“高分子量vwf”和“hmwvwf”可互换使用,且表示含有超过10个vwf二聚体的共价连接的vwf多聚体。在某些实施方案中,hmwvwf含有至少11个vwf二聚体或至少12、13、14、15、16、17、18、19、20、21、22或更多个vwf二聚体。本文使用的“adamts蛋白”表示,具有i型凝血酶敏感蛋白基序的解聚素和金属蛋白酶的多肽的金属蛋白酶家族。该家族的成员包括:人蛋白adamts1(nm_006988)、adamts2(nm_014244;nm_021599)、adamts3(nm_014243)、adamts4(nm_005099)、adamts5(nm_007038)、adamts6(nm_014273)、adamts7(nm_0142727)、adamts8(nm_007037)、adamts9(nm_182920;nm_182921;nm_020249)、adamts10(nm_030957)、adamts12(nm_030955)、adamts13(nm_139025;nm_139026;nm_139027;nm_139028)、adamts14(nm_139155;nm_080722)、adamts15(nm_139055)、adamts16(nm_139056)、adamts17(nm_139057)、adamts18(nm_199355;nm_139054)、adamts19(nm_133638)和adamts20(nm_025003、nm_175851)。adamts蛋白包括:全长蛋白和显示至少部分生物活性的部分多肽,所述部分生物活性例如由全长蛋白显示的活性的至少10%、20%、30%、40%、50%、60%、70%、80%、90%或更多,特别是由全长蛋白显示的蛋白酶活性。在某些情况下,adamts蛋白将在活体内或在活体外进行翻译后修饰,例如通过酶方式或化学方式。应当理解,本发明的adamts蛋白包括交替剪接的异形体、保守修饰的蛋白、实质上相同的蛋白、同系物等。在本发明范围内,adamts蛋白涵盖来自例如哺乳动物(诸如灵长类动物、人、猴、兔、猪、啮齿动物、小鼠、大鼠、仓鼠、沙鼠、犬、猫)的adamts家族的任何成员及其生物活性衍生物。也涵盖具有活性的突变体和变体adamts蛋白,以及adamts蛋白的功能片段和融合蛋白。此外,本发明的adamts蛋白可另外包含有助于纯化、检测或两者的标签。本文中所描述的adamts蛋白可进一步用治疗性部分或适于活体外或活体内成像的部分修饰。本文使用的“adamts13蛋白”表示,具有adamts13活性、特别是切割在vwf的残基tyr-842和met-843之间的肽键的能力的任何蛋白或多肽。在一个示例性的实施方案中,adamts13蛋白表示,其氨基酸序列与np_620594(adamts13异形体1,前蛋白原)或np_620594的氨基酸75-1427(adamts13异形体1,成熟多肽)高度类似的多肽。在另一个实施方案中,adamts13蛋白表示,其氨基酸序列与np_620596(adamts13异形体2,前蛋白原)或np_620594的氨基酸75-1371(adamts13异形体2,成熟多肽)高度类似的多肽。在另一个实施方案中,adamts13蛋白包括:其氨基酸序列与np_620595(adamts13异形体3,前蛋白原)或np_620595的氨基酸75-1340(adamts13异形体1,成熟多肽)高度类似的多肽。本文使用的adamts13蛋白包括具有vwf切割活性的天然变体和具有vwf切割活性的人造构建体。如本发明中所用,adamts13涵盖保留一些基本活性的任何天然变体、替代性序列、异形体或突变蛋白。在人群体中发现的adamts13突变的实例包括,但不限于:r7w、v88m、h96d、r102c、r193w、t196i、h234q、a250v、r268p、w390c、r398h、q448e、q456h、p457l、c508y、r528g、p618a、r625h、i673f、r692c、a732v、s903l、c908y、c951g、g982r、c1024g、a1033t、r1095w、r1123c、c1213y、t1226i、g1239v、r1336w,已发现其中的许多个与血栓性血小板减少性紫癜(ttp)有关。adamts13蛋白也包括含有翻译后修饰的多肽。例如,已经证实,adamts13在残基614、667和1354处被n-乙酰基葡糖胺(glcnac)修饰,且预期还以此方式修饰残基142、146、552、579、707、828和1235。如在plaimauer等人(2002,blood.15;100(10):3626-32)和us2005/0266528(其公开内容出于所有目的以全文引用的方式并入本文中)中所描述,通过于哺乳动物细胞培养物中表达,可以制备蛋白水解活性的重组adamts13。用于在细胞培养物中表达重组adamts13的方法公开于plaimauerb,scheiflingerf.(seminhematol.2004年1月;41(1):24-33和us2011/0086413中,其公开内容出于所有目的以全文引用的方式并入本文中。在用于adamts蛋白的背景中时,本文使用的术语“生物活性衍生物”也涵盖经由重组dna技术获得的多肽。这可以包括本领域已知的用于达成以下目的的任何方法:(i)通过基因工程,例如经由rna反转录和/或dna扩增,生产重组dna;(ii)通过转染,即经由电穿孔或显微注射,将重组dna引入原核或真核细胞中;(iii)以例如连续或分批方式培养所述转化的细胞;(iv)例如组成性地或在诱导后,表达adamts蛋白;和(v)分离所述adamts蛋白,例如与培养基分离,或通过收获转化的细胞,从而(vi)获得实质上纯化的重组adamts蛋白,例如经由离子交换色谱法、尺寸排阻色谱法、亲和色谱法、疏水相互作用色谱法等。术语“生物活性衍生物”也包括嵌合分子,诸如adamts蛋白或其功能性片段,其与第二多肽(例如免疫球蛋白fc结构域或白蛋白结构域)组合以改良生物学/药理学性质,例如adamts蛋白在哺乳动物(尤其人)的循环系统中的半衰期。术语“分离的”、“纯化的”或“生物学上纯的”表示这样的物质:其实质上或基本上不含通常在其天然状态下发现伴随其的组分。通常,使用分析化学技术(诸如聚丙烯酰胺凝胶电泳或高效液相色谱法),测定纯度和均质性。在一个实施方案中,rvwf为实质上纯化的制剂中存在的主要物质。在另一个实施方案中,ra13为实质上纯化的制剂中存在的主要物质。在一些实施方案中,术语“纯化的”表示,核酸或蛋白在电泳凝胶中基本上生产1条带。在其它实施方案中,其是指,核酸或蛋白的纯度为至少50%,更优选为至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或更高。在其它实施方案中,“纯化”是指,从待纯化组合物中除去至少一种污染物。在此意义上,纯化无需所纯化化合物为均质,例如100%纯。通过已知的活体外测定法,可以测量vwf的生物活性。例如,利托菌素辅因子测定法是基于在vwf存在下抗生素利托菌素诱导的新鲜或福尔马林固定的血小板的凝集。血小板凝集度取决于vwf浓度,且可通过比浊法测量,例如通过使用凝集计(weiss等人,j.clin.invest.52:2708-2716,1973;macfarlane等人,thromb.diath.haemorrh.34:306-308,1975)。如本文中提供的,以使用活体外测定法测得的mu/μgvwf的方式,描述本发明vwf的利托菌素辅因子比活性。本文使用的“1单位adamts活性”定义为,1ml汇集的正常人血浆中的活性量,与所用测定无关。例如,当adamts蛋白为adamts13时,1单位adamts13frets-vwf73活性为切割与1ml汇集的正常人血浆切割相同量的frets-vwf73底物所需的活性量(kokame等人,brjhaematol.2005年4月;129(1):93-100)。方便地,通过功能测定,诸如使用经修饰的vonwillebrand因子肽作为adamts13的底物的功能测定(tripodi等人,jthrombhaemost.2008年9月;6(9):1534-41),可以确定adamts13活性。一种测定重组人adamts13活性的优选方法公开于gerritsen等人(assayofvonwillebrandfactor(vwf)-cleavingproteasebasedondecreasedcollagenbindingaffinityofdegradedvwf:atoolforthediagnosisofthromboticthrombocytopenicpurpura(ttp).thrombhaemost1999;82:1386-1389)中。在一个实施方案中,为了视作如上文所定义的adamts13蛋白,多肽或蛋白必须具有天然adamts13的vwf切割活性的至少1%。在其它实施方案中,adamts13蛋白将含有天然adamts13活性的至少10%。在其它实施方案中,adamts13蛋白将含有天然adamts13活性的至少5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。通过测量adamts13抗原,例如使用在rieger等人(2006,thrombhaemost.200695(2):212-20)中公开的elisa方法,也可以确定adamts13蛋白的量。本领域中的公认约定为,1ml汇集的正常人血浆含有1μgadamts13。因此,本领域中的约定为,1μg血浆衍生的adamts13具有1单位adamts13活性。术语“细胞培养溶液”、“细胞培养基或培养基”和“细胞培养物上清液”表示,在本领域中通常熟知的细胞培养过程的方面。在本发明范围内,细胞培养溶液可以包括细胞培养基和细胞培养物上清液。细胞培养基任选地与补充物一起从外部添加至细胞培养溶液中,以提供用于培养表达rvwf或ra13的细胞的营养物和其它组分。细胞培养物上清液表示包含来自细胞培养基的营养物和其它组分以及在培养期间从细胞释放、代谢和/或分泌的产物的细胞培养溶液,但其不含细胞本身。因此在一种情形下,细胞培养物上清液可指细胞培养溶液的液相(即排除细胞的细胞培养溶液)。例如,培养物上清液的铵浓度通常表示细胞培养溶液中存在的铵浓度。在其它情形下,细胞培养物上清液表示已除去细胞的细胞培养溶液(即回收的细胞培养物上清液)。本文使用的术语“维生素b3”、“烟酰胺”、“尼克酸”和“烟酸”可互换使用以表示维生素b3家族的任何成员。因此,该家族中的任何成员均可用于补充本发明方法中所用的培养基。本文使用的术语“化学成分确定的培养基”表示,其中所有组分的身分和浓度均为已知的合成生长培养基。化学成分确定的培养基不含细菌、酵母、动物或植物提取物,但其可以包括或不包括个别植物或动物衍生的组分(例如蛋白、多肽等)。商购可得的化学成分确定的培养基的非限制性实例包括各种dulbecco氏改良的伊格尔(dme)培养基(sigma-aldrichco;safcbiosciences,inc)、ham氏营养物混合物(sigma-aldrichco;safcbiosciences,inc)、它们的组合等。本领域中已知制备化学成分确定的培养基的方法,例如在美国专利号6,171,825和6,936,441、wo2007/077217和美国专利申请公开号2008/0009040和2007/0212770(它们的公开内容出于所有目的以全文引用的方式并入本文中)中的方法。本文使用的术语“无寡肽培养基”表示不包含寡肽(例如从蛋白水解物衍生的寡肽)的无蛋白培养基。在一个实施方案中,所述培养基不包含具有20个或更多个氨基酸的寡肽。在本发明的一个实施方案中,所述培养基不包含具有15个或更多个氨基酸的寡肽。在本发明的另一个实施方案中,所述培养基不包含具有10个或更多个氨基酸的寡肽。在一个实施方案中,所述培养基不包含具有7个或更多个氨基酸的寡肽。在另一个实施方案中,所述培养基不包含具有5个或更多个氨基酸的寡肽。在另一个实施方案中,所述培养基不包含具有3个或更多个氨基酸的寡肽。根据本发明的另一个实施方案,培养基不包含具有2个或更多个氨基酸的寡肽。本领域中已知制备无寡肽培养基的方法,例如在美国专利号6,171,825和6,936,441、wo2007/077217和美国专利申请公开号2008/0009040和2007/0212770(其公开内容出于所有目的以全文引用的方式并入本文中)中的方法。本文使用的术语“无血清培养基”表示未补充动物血清的培养基。尽管通常无血清培养基为化学成分确定的培养基,但无血清培养基可补充有个别动物或植物蛋白或蛋白级分。本领域中已知制备无血清培养基的方法,例如在美国专利号6,171,825和6,936,441、wo2007/077217和美国专利申请公开号2008/0009040和2007/0212770(其公开内容出于所有目的以全文引用的方式并入本文中)中的方法。本文使用的术语“无动物蛋白培养基”表示未补充动物血清、蛋白或蛋白级分的培养基。尽管通常无动物蛋白培养基为化学成分确定的培养基,但无动物蛋白培养基可以含有植物或酵母水解物。本领域中已知制备无动物蛋白培养基的方法,例如在美国专利号6,171,825和6,936,441、wo2007/077217和美国专利申请公开号2008/0009040和2007/0212770(其公开内容出于所有目的以全文引用的方式并入本文中)中的方法。本文使用的术语“基础细胞培养基”表示化学成分确定的培养基、无寡肽培养基、无血清培养基或无动物蛋白培养基,其未补充水解物,例如植物或酵母水解物。基础培养基为本领域中所熟知,例如,dmem、ham氏f12、dmem/ham氏f12、培养基199、mccoy或rpmi。基础培养基可以包括许多成分,包括氨基酸、维生素、有机和无机盐以及碳水化合物来源。各成分可以以支持细胞培养的量存在,这些量通常为本领域技术人员已知。培养基可以包括辅助物质,诸如缓冲物质(例如碳酸氢钠)、抗氧化剂、用于抵消机械应力的稳定剂或蛋白酶抑制剂。必要时,可添加非离子型表面活性剂,诸如聚乙二醇与聚丙二醇的共聚物和/或混合物。iii.细胞培养基和细胞培养物上清液本发明的一个方面涉及用于生产rvwf和/或ra13的细胞培养基,所述rvwf和/或ra13与用基础细胞培养基生产的rvwf和ra13相比活性增加。在一个方面,本发明涉及用于生产rvwf和/或ra13的细胞培养基,其中基础细胞培养基补充有一种或多种其它物质。在特定实施方案中且如下文进一步详细论述的,本发明的细胞培养条件包括经补充具有至少1.0μg/l铜的基础细胞培养基。在其它实施方案中,本发明中所用细胞培养基和从所述方法衍生出的上清液也包含低水平(低于10mm)的铵。在一个具体实施方案中,控制用于表达rvwf和/或ra13的细胞培养条件,使得细胞培养物上清液维持低水平的铵,即小于10mm和优选地小于5mm。本发明的培养基可以基于本领域中熟知的合适基础培养基,例如,dmem、ham氏f12、dmem/ham氏f12、培养基199、mccoy或rpmi。基础培养基可以包括许多成分,包括氨基酸、维生素、有机和无机盐以及碳水化合物来源。各成分可以以支持细胞培养的量存在,这样的量通常为本领域技术人员已知。培养基可以包括辅助物质,诸如缓冲物质(例如碳酸氢钠)、抗氧化剂、用于抵消机械应力的稳定剂或蛋白酶抑制剂。必要时,可添加非离子型表面活性剂,诸如聚乙二醇与聚丙二醇的共聚物和/或混合物。通常,基础培养基含有小于1μg/l的铜,例如dmem/ham氏f12具有约0.3μg/l的铜浓度。这样的铜浓度提供的铜离子不足以支持显示出高比活性的本发明rvwf和ra13蛋白的生产。可通过多种方式向本发明的细胞培养基中提供铜,诸如通过添加培养基补充物。在一些实施方案中,所述培养基补充物可以含有水解物,所述水解物可以提供用于增加培养基中的铜浓度。水解物可以包括本领域中熟知的任何水解物,诸如植物水解物、大豆水解物和面筋水解物。在某些实施方案中,添加水解物可以促成约0.2至约10μg/l的cu2+的增加的铜浓度。在一些实施方案中,由水解物提供的铜的量可以取决于水解物中铜的量以及添加的水解物量。通过元素分析,例如原子吸收光谱法(gfaa:石墨炉原子吸收)或质谱分析法(例如icp-ms),可以确定水解物的铜含量。在某些实施方案中,所述铜可单独提供至培养基中,或除水解物外,通过提供包括合适的铜盐或铜螯合物的培养基补充物来提供。合适的铜盐可以包括但不限于:硫酸铜、醋酸铜、碳酸铜、氯化铜、氢氧化铜、硝酸铜和氧化铜。合适的铜螯合剂可以包括但不限于:白蛋白、乙二胺四乙酸(edta)、多胺螯合剂、乙二胺、二亚乙基三胺、三亚乙基四胺、三亚乙基二胺、四亚乙基五胺、氨基乙基乙醇胺、氨基乙基哌嗪、五亚乙基六胺、三亚乙基四胺-盐酸盐、四亚乙基五胺-盐酸盐、五亚乙基六胺-盐酸盐、四乙基五胺、卡托普利、青霉胺(penicilamine)、n,n'-双(3-氨基丙基)-1,3-丙二胺、n,n-双(2-氨基乙基)-1,3-丙二胺、1,7-二氧杂-4,10-二氮杂环十二烷、1,4,8,11-四氮杂环十四烷-5,7-二酮、1,4,7-三氮杂环壬烷三盐酸盐、1-氧杂-4,7,10-三氮杂环十二烷、1,4,8,12-四氮杂环五癸烷和1,4,7,10-四氮杂环十二烷。在某些实施方案中,给基础细胞培养基补充铜,使得总铜浓度为约1.0μg/l至约20μg/l。在一个具体实施方案中,给基础细胞培养基补充铜,使得最终浓度介于约1.0μg/l至约10μg/l之间。在其它实施方案中,补充基础细胞培养基,使得最终铜浓度为约1.0-5.0、1.2-4.0、1.3-3.0、1.4-2.9、1.5-2.8、1.6-2.7、1.7-2.6、1.8-2.5、1.9-2.4、2.0-2.3、2.1-2.2μg/l铜。在其它实施方案中,补充在本发明的方法中所用的基础细胞培养基,达到约1.2-9.5、1.4-9、1.6-8.5、1.8-8、2.0-7.5、2.2-7、2.4-6.5、2.6-6.0、2.8-5.5、3.0-5.0、3.2-4.5、3.4-4和2-4μg/l铜。在其它实施方案中,补充在本发明的方法中所用的基础细胞培养基,达到约1-6、2-5、3-4μg/l铜。在一个实施方案中,给基础细胞培养基补充铜,使得总铜浓度为至少1μg/l。在另一个实施方案中,给基础细胞培养基补充铜,使得总铜浓度为至少2μg/l。在另一个实施方案中,给基础细胞培养基补充铜,使得总铜浓度为至少4μg/l。在某些实施方案中,给基础细胞培养基补充铜,使得总铜浓度为至少1μg/l或至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20μg/l铜或更多。在某些实施方案中且如本文中进一步详细论述的,用于生产ra13的培养物可以含有约2-4μg/l的铜,而用于生产rvwf的培养物可以含有至少2μg/l的铜。上述浓度为呈二价铜形式(cu2+)的纯铜的各个浓度。如果使用铜衍生物(例如水合盐)或含铜化合物(例如铜螯合物),则所添加的衍生物或螯合物的量使得最终铜浓度在本文中所描述的范围内。例如,2μg/l的cuso4·5h2o相当于约0.51μg/l的铜浓度(无硫酸根和5h2o)。有利的是,已经发现,在细胞培养过程中使用导致细胞培养溶液中(即培养物上清液中)的低铵(nh4+)浓度的细胞培养基,可导致具有较高比活性的重组vwf和/或ra13的表达。因此,在某些实施方案中,上清液的nh4+浓度不超过10mm。在一个优选的实施方案中,上清液的nh4+浓度不超过5mm。在一个优选的实施方案中,上清液的nh4+浓度不超过4mm。在其它实施方案中,上清液的nh4+浓度不超过10mm、9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm或更低。因此,在某些实施方案中,本文中提供的方法和组合物依赖于在方法中使用的补充有铜(例如,至至少2μg/l的终浓度)的基础细胞培养基的应用,所述铜使上清液中的nh4+浓度不超过10mm。在其它实施方案中,补充基础细胞培养基,以提供根据表1中提供的变体1至440中任一个的最终铜和铵浓度。表1.在可用于表达本文提供的重组蛋白的培养基和上清液中存在的铜和铵浓度的示例性实施方案*nd=未确定*nmt=不超过*al=至少在一些实施方案中,通过补充不含动物蛋白的和/或化学成分确定的基础培养基来生产本发明的补充铜的培养基。本领域中已知制备不含动物蛋白的和化学成分确定的培养基的方法,例如在美国专利号6,171,825和6,936,441、wo2007/077217和美国专利申请公开号2008/0009040和2007/0212770(其公开内容出于所有目的以全文引用的方式并入本文中)中的方法。在一个实施方案中,在本文所述的方法中所用的基础培养基为无动物蛋白培养基或无寡肽培养基。在某些实施方案中,所述培养基可以是化学成分确定的培养基。在某些实施方案中,所述培养基可以含有至少一种其浓度为约0.5mg/l至约10mg/l的多胺。在其它实施方案中且除上文提供的任何描述外,提供本发明的培养基,其中给基础培养基补充铜以及钙、锌和/或维生素b3中的至少一种。在某些实施方案中,所述培养基可以是无动物蛋白、无寡肽或化学成分确定的培养基。在某些实施方案中,按照在美国专利号6,171,825和6,936,441、wo2007/077217和美国专利申请公开号2008/0009040和2007/0212770(其公开内容出于所有目的以全文引用的方式并入本文中,均出于所有目的以全文引用的方式并入本文中)中的教导,制备无动物蛋白或无寡肽培养基,且补充额外的铜和任选的一种或多种钙、锌和维生素b3。在一个具体实施方案中,化学成分确定的培养基可类似于dulbecco氏改良的伊格尔培养基/ham氏f121:1混合物(dmem/ham氏f12),其已补充额外铜和任选的钙、锌和/或维生素b3,以便增加在培养基中培养的细胞中表达的rvwf或ra13的比活性。在其它实施方案中,所述培养基不含动物组分。在另一个实施方案中,所述培养基含有蛋白,例如来自血清(诸如胎牛血清)的动物蛋白。在另一个实施方案中,所述培养物具有外源添加的的重组蛋白。在另一个实施方案中,蛋白来自合格的无病原体的动物。在某些实施方案中,所述培养基含有至少一种其浓度为0.5mg/l至30mg/l或约0.5mg/l至约30mg/l的多胺。在另一个实施方案中,所述培养基含有至少一种0.5mg/l至10mg/l或约0.5mg/l至约10mg/l的多胺。在一个实施方案中,所述培养基含有至少一种2mg/l至8mg/l或约2mg/l至约8mg/l的多胺。在某些实施方案中,多胺来自鸟氨酸、腐胺、精胺或精脒等。在一个优选的实施方案中,多胺为腐胺。在一个具体实施方案中,所述培养基含有2mg/l至8mg/l或约2mg/l至约8mg/l的腐胺。在一个实施方案中,所述培养基含有至少一种其浓度为0.5mg/l至30mg/l或约0.5mg/l至约30mg/l的多胺以及根据表1所示的变体1至440中任一个的铜与铵组合。在另一个实施方案中,所述培养基含有至少一种0.5mg/l至10mg/l或约0.5mg/l至约10mg/l的多胺以及根据表1所示的变体1至440中任一个的铜与铵组合。在一个实施方案中,所述培养基含有至少一种2mg/l至8mg/l或约2mg/l至约8mg/l的多胺以及根据表1所示的变体1至440中任一个的铜与铵组合。在某些实施方案中,多胺来自鸟氨酸、腐胺、精胺或精脒等。在一个优选的实施方案中,多胺为腐胺。在一个具体实施方案中,所述培养基含有2mg/l至8mg/l或约2mg/l至约8mg/l的腐胺以及根据表1所示的变体1至440中任一个的铜与铵组合。在其它方面,除铜外,本发明中所用细胞培养基可另外包括以下一种或多种:额外的钙、锌、一种或多种维生素和它们的任意组合。通常,任何钙盐均可用于补充本发明的培养基,可接受的盐的非限制性实例包括cacl2、cacl2、cafpo3·2h2o、cai2、cabr2、(c2h3o2)2ca、(cho2)2ca、(c6h7o6)2ca、(c6h5o7)2ca3·2h2o等。在某些实施方案中,使用药学上可接受的钙盐补充本发明的培养基。通常,任何锌盐均可用于补充本发明的培养基,可接受的盐的非限制性实例包括znso4·7h2o、znso3·2h2o、(c6h5o7)2zn3·2h2o、znbr2、znbr2·2h2o、zncl2、zn(no3)2·6h2o、zn(h2po4)2·h2o、(c2h3o2)2zn·2h2o等。在某些实施方案中,使用药学上可接受的锌盐补充本发明的培养基。在其它实施方案中,可使用含锌的肽或蛋白制剂(例如胰岛素)补充本文中提供的培养物。在其它方面,上述补充有铜和一种或多种其它物质的基础细胞培养基可进一步用于在上清液中具有低铵水平的培养物中。在某些实施方案中,本发明中所用的经补充的细胞培养基导致细胞培养溶液中的铵水平低于10mm。在其它实施方案中,本发明的经补充的细胞培养基与约0.5–9.5、1.0–9.0、1.5–8.5、2.0–8.0、2.5–7.5、3.0–7.0、3.5–6.5、4.0–6.0、4.5–5.5mm的细胞培养物铵水平一起使用。在一个实施方案中,在生产工艺期间长时间维持细胞培养基和细胞培养物上清液的铜和铵浓度。在一个具体实施方案中,在生产工艺期间,即在rvwf或ra13被表达且从大规模细胞培养物回收的时间期间,维持细胞培养物的铜和铵浓度。在某些实施方案中,将培养溶液中铜和铵浓度维持在根据表1所示的变体1至440中任一个的水平。在一个优选的实施方案中,在这样的生产工艺的整个时间内维持铜和铵浓度。在一些实施方案中,本发明提供的培养基可以液体形式或干燥或粉末形式提供。培养基可预先等分成适于单次使用的量,或以可用于一次以上细胞培养的更大量提供。通常,本发明的培养基将以无菌方式提供。下文论述用于生产rvwf或ra13的细胞培养基的具体细节。尽管下文围绕rvwf或ra13进行论述,应当理解,下文提供的任何关于rvwf的论述均适用于ra13,且反之亦然。a.重组vwf细胞培养基本发明的一个方面涉及用于生产重组vwf、更具体地具有高比活性的高分子量vwf(在本文中另外描述)的细胞培养溶液。在一个实施方案中,本发明提供了用于生产高分子量重组vwf的细胞培养溶液,所述细胞培养溶液包含含有至少约2.4μg/l的铜浓度的细胞培养基和多个细胞,所述细胞表达高度多聚vwf,所述高度多聚vwf包含约14个至约22个二聚体且具有至少约30mu/μg的利托菌素辅因子比活性。在一个实施方案中,所述细胞培养溶液另外包含小于10mm的铵浓度。在一个优选的实施方案中,所述细胞培养物包含不超过5mm的铵浓度。在其它实施方案中,所述细胞培养物包含不超过10mm或不超过9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm或1mm以下的铵浓度。在其它实施方案中,所述细胞培养物具有根据表1所示的变体1至440中任一个的铜和铵浓度。在某些实施方案中,所述细胞培养物的铵浓度长时间维持于以上提供的浓度。例如,在一个实施方案中,铵浓度在低浓度维持至少3天或至少4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、28、35、42、49、56、63、70或更多天。在一个具体实施方案中,所述细胞培养物的铵浓度在不超过5mm的铵浓度维持至少7天。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过4mm的铵浓度维持至少7天。在一个具体实施方案中,所述细胞培养物的铵浓度在不超过5mm的铵浓度维持至少14天。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过4mm的铵浓度维持至少14天。在另一个实施方案中,所述细胞培养物的铵浓度在过程期间(即在所述培养物用于生产rvwf的整个时间内)维持在低水平。在本发明的一个实施方案中,所述细胞培养基可以包含至少约2.4μg/l的铜浓度,在另一个实施方案中至少约3μg/l,在另一个实施方案中至少约4μg/l,在另一个实施方案中至少约8μg/l,在另一个实施方案中至少约10μg/l,在另一个实施方案中至少约15μg/l,和在另一个实施方案中至少约20μg/l。在其它实施方案中,在本发明的细胞培养基中的铜浓度的范围可以是约2.4μg/l至约20μg/l,在另一个实施方案中约2.4μg/l至约15μg/l,在另一个实施方案中约2.4μg/l至约10μg/l,在另一个实施方案中约2.4μg/l至约8μg/l,在另一个实施方案中约2.4μg/l至约6μg/l,在另一个实施方案中约2.4μg/l至约4μg/l,在另一个实施方案中约4μg/l至约20μg/l,在另一个实施方案中约4μg/l至约15μg/l,在另一个实施方案中约4μg/l至约10μg/l,在另一个实施方案中约4μg/l至约8μg/l,和在另一个实施方案中约4μg/l至约6μg/l。本发明也提供了用于表达或生产rvwf的试剂盒,所述试剂盒包括适用于表达具有高比活性的rvwf的培养基。b.adamts13(a13)细胞培养基在一个方面,本发明提供了可用于表达具有高比活性的adamts蛋白的培养基。有利地,已经发现,通过给培养基补充铜,可极大增强在经补充的培养基中培养的细胞中表达的重组adamts(例如,radamts13)酶的活性,同时酶的表达水平若未比于未经补充的培养基中培养的细胞高,则与其同样高。在一个方面,本发明提供了用于表达具有高比活性的重组adamts13蛋白的补充有铜的细胞培养基。在一个实施方案中,补充所述培养基,使得总铜浓度为约2至约4μg/l。在其它实施方案中,补充所述培养基,使得总铜浓度为约1-3、2-3、3-4μg/l。在一个实施方案中,所述培养基含有至少1μg/l的铜浓度。在另一个实施方案中,所述培养基含有至少2μg/l铜。在另一个实施方案中,所述培养基含有至少4μg/l铜。在其它实施方案中,所述培养基含有2μg/l至20μg/l铜。在另一个实施方案中,所述培养基含有1μg/l至6μg/l铜。在另一个实施方案中,所述培养基含有2μg/l至5μg/l铜。在另一个实施方案中,所述培养基含有3μg/l至4μg/l铜。在其它实施方案中,所述培养基含有至少1μg/l铜或至少2μg/l、3μg/l、4μg/l、5μg/l、6μg/l、7μg/l、8μg/l、9μg/l、10μg/l、11μg/l、12μg/l、13μg/l、14μg/l、15μg/l、16μg/l、17μg/l、18μg/l、19μg/l、20μg/l或更高浓度的铜。在一个实施方案中,所述细胞培养溶液另外包含小于10mm的铵浓度。在一个优选的实施方案中,所述细胞培养溶液包含不超过5mm的铵浓度。在其它实施方案中,所述细胞培养溶液包含不超过10mm或不超过9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm或更低的铵浓度。在其它实施方案中,所述细胞培养溶液具有根据表1所示的变体1至440中任一个的铜和铵浓度。在某些实施方案中,所述细胞培养物的铵浓度长时间维持在以上提供的浓度。例如,在一个实施方案中,所述铵浓度在低浓度维持至少3天或至少4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、28、35、42、49、56、63、70或更多天。在一个具体实施方案中,所述细胞培养物的铵浓度在不超过5mm的铵浓度维持至少7天。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过4mm的铵浓度维持至少7天。在一个具体实施方案中,所述细胞培养物的铵浓度在不超过5mm的铵浓度维持至少14天。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过4mm的铵浓度维持至少14天。在另一个实施方案中,所述细胞培养物的铵浓度在过程期间(即在所述培养物用于生产ra13的整个时间内)维持在低水平。在一个实施方案中,提供含有至少1μg/l铜和至少2μm锌的培养基来表达重组adamts蛋白(例如radamts13)。在其它实施方案中,所述培养基含有至少2μg/l铜或至少4μg/l铜。在给培养基补充铜的另一个实施方案中,所述培养基也含有至少5μm或至少约5μm锌。在一个实施方案中,所述培养基也含有2μm至12μm或约2μm至约12μm锌。在另一个实施方案中,所述培养基也含有5μm至12μm或约5μm至约12μm锌。在其它实施方案中,所述培养基还可以含有至少2μm或至少约2μm锌,或至少3μm、4μm、5μm、6μm、7μm、8μm、9μm、10μm、11μm、12μm、13μm、14μm、15μm、20μm、25μm、30μm或更多的锌,或者至少约3μm、4μm、5μm、6μm、7μm、8μm、9μm、10μm、11μm、12μm、13μm、14μm、15μm、20μm、25μm、30μm或更多的锌。在一个实施方案中,所述培养基含有根据表2所示的变体441至880中任一个的铜和锌浓度。表2.在可用于表达重组adamts13蛋白的培养基中存在的铜和锌浓度的示例性实施方案*al=至少在一个实施方案中,所述细胞培养溶液另外包含低铵浓度。在一个实施方案中,所述细胞培养溶液包含小于10mm的铵浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在一个具体实施方案中,铵在不超过10mm的浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过6mm的铵浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在一个具体实施方案中,铵在不超过6mm的浓度维持至少7天。在另一个优选的实施方案中,所述细胞培养溶液包含不超过5mm的铵浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在一个具体实施方案中,铵在不超过5mm的浓度维持至少7天。在另一个优选的实施方案中,所述细胞培养溶液包含不超过4mm的铵浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在一个具体实施方案中,铵在不超过4mm的浓度维持至少7天。在其它实施方案中,所述细胞培养溶液包含不超过10mm或不超过9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm或更低的铵浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在另一个具体实施方案中,所述细胞培养物的铵浓度在过程期间(即在所述培养物用于生产ra13的整个时间内)维持在低水平。在一个实施方案中,提供含有至少1μg/l铜和至少0.5mm或至少约0.5mm钙的培养基来表达重组adamts蛋白(例如radamts13)。在其它实施方案中,所述培养基含有至少2μg/l铜或至少4μg/l铜。在给培养基补充铜的另一个实施方案中,所述培养基也含有至少1.5mm钙。在一个实施方案中,所述培养基含有0.5mm至1.5mm或约0.5mm至1.5mm钙。在其它实施方案中,所述培养基可以含有至少0.5mm或至少约0.5mm的钙,或至少0.6mm、0.7mm、0.8mm、0.9mm、1.0mm、1.1mm、1.2mm、1.3mm、1.4mm、1.5mm、1.6mm、1.7mm、1.8mm、1.9mm、2.0mm、2.25mm、2.5mm、2.75mm、3.0mm、3.5mm、4.0mm、4.5mm、5.0mm或更高的钙,或者至少约0.6mm、0.7mm、0.8mm、0.9mm、1.0mm、1.1mm、1.2mm、1.3mm、1.4mm、1.5mm、1.6mm、1.7mm、1.8mm、1.9mm、2.0mm、2.25mm、2.5mm、2.75mm、3.0mm、3.5mm、4.0mm、4.5mm、5.0mm或更高的钙。在一个实施方案中,所述培养基含有根据表3所示的变体881至1320中任一个的铜和钙浓度。表3.在可用于表达重组adamts13蛋白的培养基中存在的铜和钙浓度的示例性实施方案*al=至少在一个实施方案中,所述细胞培养溶液另外包含低铵浓度。在一个实施方案中,所述细胞培养溶液包含小于10mm的铵浓度以及根据表3所示的变体881至1320中任一个的铜和钙浓度。在一个具体实施方案中,铵在不超过10mm的浓度维持至少7天。在一个优选的实施方案中,所述细胞培养基包含不超过6mm的铵浓度以及根据表3所示的变体881至1320中任一个的铜和钙浓度。在一个具体实施方案中,铵在不超过6mm的浓度维持至少7天。在另一个优选的实施方案中,所述细胞培养基包含不超过5mm的铵浓度以及根据表3所示的变体881至1320中任一个的铜和钙浓度。在一个具体实施方案中,铵在不超过5mm的浓度维持至少7天。在另一个优选的实施方案中,所述细胞培养基包含不超过4mm的铵浓度以及根据表3所示的变体881至1320中任一个的铜和钙浓度。在一个具体实施方案中,铵在不超过4mm的浓度维持至少7天。在其它实施方案中,所述细胞培养基包含不超过10mm、或不超过9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm、或更低的铵浓度以及根据表3所示的变体881至1320中任一个的铜和钙浓度。在另一个具体实施方案中,所述细胞培养物的铵浓度在过程期间(即在所述培养物用于生产ra13的整个时间内)维持在低水平。在一个实施方案中,给细胞培养基补充铜、锌和钙。在一个具体实施方案中,所述培养基具有至少0.5mm的钙浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在另一个具体实施方案中,所述培养基具有至少1.5mm的钙浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在另一个具体实施方案中,所述培养基具有0.5mm至1.5mm的钙浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在其它实施方案中,培养基具有至少0.6mm、0.7mm、0.8mm、0.9mm、1.0mm、1.1mm、1.2mm、1.3mm、1.4mm、1.5mm、1.6mm、1.7mm、1.8mm、1.9mm、2.0mm、2.25mm、2.5mm、2.75mm、3.0mm、3.5mm、4.0mm、4.5mm、5.0mm或更高的钙浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在一个实施方案中,提供含有至少1μg/l铜和至少2mg/l烟酰胺(维生素b3)的培养基来表达重组adamts蛋白(例如radamts13)。在其它实施方案中,所述培养基含有至少2μg/l铜或至少4μg/l铜。在给培养基补充铜的另一个实施方案中,所述培养基也含有至少7mg/l烟酰胺(维生素b3)。在一个实施方案中,所述培养基含有2mg/l至10mg/l或约2mg/l至约10mg/l烟酰胺(维生素b3)。在其它实施方案中,所述培养基可以含有至少2mg/l、3mg/l、4mg/l、5mg/l、6mg/l、7mg/l、8mg/l、9mg/l、10mg/l、15mg/l、20mg/l或更高浓度的烟酰胺(维生素b3),或至少约2mg/l、3mg/l、4mg/l、5mg/l、6mg/l、7mg/l、8mg/l、9mg/l、10mg/l、15mg/l、20mg/l或更高浓度的烟酰胺(维生素b3)。在一个实施方案中,所述培养基含有根据表4所示的变体1321至1760中任一个的铜和烟酰胺浓度。表4.在可用于表达重组adamts13蛋白的培养基中存在的铜和烟酰胺浓度的示例性实施方案*al=至少在一个实施方案中,所述细胞培养溶液另外包含低铵浓度。在一个实施方案中,所述培养基包含小于10mm的铵浓度以及根据表4所示的变体1321至1760中任一个的铜和烟酰胺浓度。在一个具体实施方案中,铵在不超过10mm的浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过6mm的铵浓度以及根据表4所示的变体1321至1760中任一个的铜和烟酰胺浓度。在一个具体实施方案中,铵在不超过6mm的浓度维持至少7天。在另一个优选的实施方案中,所述细胞培养溶液包含不超过5mm的铵浓度以及根据表4所示的变体1321至1760中任一个的铜和烟酰胺浓度。在一个具体实施方案中,铵在不超过5mm的浓度维持至少7天。在另一个优选的实施方案中,所述细胞培养溶液包含不超过4mm的铵浓度以及根据表4所示的变体1321至1760中任一个的铜和烟酰胺浓度。在一个具体实施方案中,铵在不超过4mm的浓度维持至少7天。在其它实施方案中,所述细胞培养溶液包含不超过10mm、或不超过9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm、或更低的铵浓度以及根据表4所示的变体1321至1760中任一个的铜和烟酰胺浓度。在另一个具体实施方案中,所述细胞培养物的铵浓度在过程期间(即在所述培养物用于生产ra13的整个时间内)维持在低水平。在一个实施方案中,给细胞培养基补充铜、锌和烟酰胺。在一个具体实施方案中,所述培养基具有至少2mg/ml的烟酰胺浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在另一个具体实施方案中,所述培养基具有至少7mg/mlmm的烟酰胺浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在另一个具体实施方案中,所述培养基具有2mg/ml至10mg/ml的烟酰胺浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在其它实施方案中,所述培养基具有至少2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、11mg/ml、12mg/ml、13mg/ml、14mg/ml、15mg/ml或更高的烟酰胺浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在一个实施方案中,给细胞培养基补充铜、钙和烟酰胺。在一个具体实施方案中,所述培养基具有至少2mg/ml的烟酰胺浓度以及根据表3所示的变体881至1320中任一个的铜和钙浓度。在另一个具体实施方案中,所述培养基具有至少7mg/mlmm的烟酰胺浓度以及根据表3所示的变体881至1320中任一个的铜和钙浓度。在另一个具体实施方案中,所述培养基具有2mg/ml至10mg/ml的烟酰胺浓度以及根据表3所示的变体881至1320中任一个的铜和钙浓度。在其它实施方案中,培养基具有至少2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、11mg/ml、12mg/ml、13mg/ml、14mg/ml、15mg/ml或更高的烟酰胺浓度以及根据表3所示的变体881至1320中任一个的铜和钙浓度。iv.生产具有高比活性的血液因子的方法a.细胞培养方法本发明提供了大规模生产重组蛋白(诸如rvwf和ra13)的方法。在某些实施方案中,这些大规模生产方法利用搅拌/搅动槽反应器来制造这些治疗性重组蛋白。在某些实施方案中,本发明的方法可以包括:使用在分批或连续操作模式下操作的细胞培养系统。例如,当利用分批细胞培养时,其可在单批、补料分批或重复分批模式下操作。同样地,连续细胞培养可在例如灌注、恒浊或恒化模式下操作。分批和连续细胞培养可在悬浮或附着条件下进行。当在悬浮条件下操作时,细胞将在培养基内自由悬浮和混合。或者,在附着条件下,细胞将结合于固相,例如微载体、多孔微载体、盘式载体、陶瓷筒、中空纤维、平板、凝胶基质等。分批培养通常为大规模细胞培养,其中在槽或发酵罐中培养细胞接种物至最大密度,且单批收获和处理。补料分批培养通常为分批培养,给其供应新鲜营养物(例如生长限制底物)或添加剂(例如产物的前体)。补料溶液通常高度浓缩,以避免生物反应器的稀释。在重复分批培养中,细胞放置于培养基中,并培养至所需细胞密度。为避免衰退期和细胞死亡的开始,接着在细胞达到其最大浓度前用完全生长培养基稀释培养物。稀释的量和频率广泛变化,且取决于细胞系的生长特征和培养过程的便利性。可视需要重复该过程多次,且除非在继代培养中废弃细胞和培养基,否则培养物体积将随每次稀释而逐步增加。通过使用大小足以允许在其内部稀释的反应器,或通过将稀释的培养物分至若干个容器中,可以处理体积增加。这类培养的基本原理是,维持细胞处于指数生长状态。连续继代培养的特征在于,培养物体积总是逐步增加,可进行多次收获,细胞持续生长,和过程可持续所需要的长时间。在某些实施方案中,在收获分批培养物的上清液以后,可以回收重组adamts蛋白(例如radamts13)。在其它实施方案中,在收获分批培养物的上清液以后,可以回收重组vwf。连续培养可以是悬浮培养,其通过流入新鲜培养基来连续供应营养物,其中培养物体积通常伴随着用过的培养基的除去而保持恒定。在恒化和恒浊方法中,提取的培养基含有细胞。因此,在细胞培养容器中的剩余细胞必须生长以维持稳定状态。在恒化方法中,通常通过控制稀释速率(即添加新鲜培养基的速率)来控制生长速率。通过改变稀释速率,可以控制培养物中细胞的生长速率处于例如次最大生长速率。相反地,在恒浊方法中,设定稀释速率,以实现细胞在既定操作条件(诸如ph值和温度)下可达到的最大生长速率。在某些实施方案中,在收获连续培养物的上清液以后,回收rvwf或ra13。连续细胞培养的一种示例性方法描述于wo/2011/012725(grillberger等人)中,其内容出于所有目的以全文引用的方式并入本文中。在灌注培养中,提取的培养基不含细胞,这些细胞被留存于培养容器中,例如通过过滤或通过离心法(使细胞再次引入培养物中)。然而,通常,用于过滤的膜不留存100%的细胞,因此一部分细胞在提取培养基时被除去。此情况在以极高生长速率操作灌注培养时并不重要,因为大部分细胞仍留存于培养容器中。在某些实施方案中,在收获灌注培养物的上清液以后,回收rvwf或ra13。搅拌罐反应器系统可用于以悬浮或附着模式操作的分批和连续细胞培养。通常,搅拌罐反应器系统可以作为具有任何类型搅拌器(诸如rushton、水翼、斜叶桨或船推进器型搅拌器(marine))的任何常规搅拌罐反应器来操作。在某些实施方案中,本发明的细胞培养方法可以包括使用微载体。在一些实施方案中,可在大型生物反应器中在适于提供高体积-培养物比表面积的条件下进行实施方案的细胞培养,以获得高细胞密度和蛋白表达。一种用于提供这样的生长条件的方式为,在搅拌罐生物反应器中使用细胞培养物的微载体。在微载体上的细胞生长概念由vanwezel(vanwezel,a.l.,nature216:64-5(1967))首先描述,且允许细胞附着到悬浮在生长培养基中的小固体颗粒的表面上。这些方法提供高表面积-体积比,因此实现有效的营养物利用。此外,对于真核细胞系中的分泌蛋白的表达而言,增加的表面积-体积比可使分泌水平更高,因此培养物上清液中的蛋白产率更高。最后,这些方法使真核表达培养物易于扩大。在细胞培养生长期间,表达vwf和/或ra13的细胞可结合于球形或多孔微载体上。微载体可以是选自下述的微载体:基于葡聚糖、胶原、塑料、明胶和纤维素的微载体,和在butler(1988.见:spier和griffiths,animalcellbiotechnology3:283-303)中描述的其它微载体。也可能使细胞在球形微载体上生长至特定生物量,并在它们已经达到最终发酵罐生物量时继代培养这些细胞,随后在多孔微载体上生产表达的蛋白,或反之亦然。合适的球形微载体可以包括光滑表面微载体诸如cytodextm1、cytodextm2和cytodextm3(gehealthcare)和巨孔微载体诸如cytoporetm1、cytoporetm2、cytolinetm1和cytolinetm2(gehealthcare)。如上所述,本发明包括具有增加的铜浓度的细胞培养基。应当理解,在以上的“细胞培养基”部分中描述的所有实施方案和浓度均可用于本文中描述的本发明方法。在某些实施方案中,所述培养物可维持至少约7天,或至少约14天、21天、28天或至少约5周、6周、7周、8周、9周或至少约2个月,或3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18个月或更久。用于生产重组vwf或重组ra13蛋白的细胞培养物所维持的细胞密度将取决于用于蛋白表达的培养条件和培养基。本领域技术人员能够容易地确定生产rvwf或ra13的细胞培养物的最佳细胞密度。在一个实施方案中,所述培养物长时间维持于约0.5x106至4x107个细胞/ml的细胞密度。在其它实施方案中,将细胞密度长时间维持于约1.0x106至约1.0x107个细胞/ml的浓度。在其它实施方案中,将细胞密度长时间维持于约1.0x106至约4.0x106个细胞/ml的浓度。在其它实施方案中,将细胞密度长时间维持于约1.0x106至约4.0x106个细胞/ml的浓度。在其它实施方案中,可将细胞密度长时间维持于约2.0x106至约4.0x106个细胞/ml、或约1.0x106至约2.5x106个细胞/ml、或约1.5x106至约3.5x106个细胞/ml或任何其它类似范围内的浓度。在一个实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过4.0x106个细胞/ml的浓度维持至少7天。在一个具体实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过4.0x106个细胞/ml的浓度维持至少14天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过4.0x106个细胞/ml的浓度维持至少21天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过4.0x106个细胞/ml的浓度维持至少28天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过4.0x106个细胞/ml的浓度维持至少5周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过4.0x106个细胞/ml的浓度维持至少6周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过4.0x106个细胞/ml的浓度维持至少7周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过4.0x106个细胞/ml的浓度维持至少8周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过4.0x106个细胞/ml的浓度维持至少9周。在一个实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.5x106个细胞/ml的浓度维持至少7天。在一个具体实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.5x106个细胞/ml的浓度维持至少14天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.5x106个细胞/ml的浓度维持至少21天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.5x106个细胞/ml的浓度维持至少28天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.5x106个细胞/ml的浓度维持至少5周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.5x106个细胞/ml的浓度维持至少6周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.5x106个细胞/ml的浓度维持至少7周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.5x106个细胞/ml的浓度维持至少8周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.5x106个细胞/ml的浓度维持至少9周。在一个实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.0x106个细胞/ml的浓度维持至少7天。在一个具体实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.0x106个细胞/ml的浓度维持至少14天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.0x106个细胞/ml的浓度维持至少21天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.0x106个细胞/ml的浓度维持至少28天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.0x106个细胞/ml的浓度维持至少5周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.0x106个细胞/ml的浓度维持至少6周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.0x106个细胞/ml的浓度维持至少7周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.0x106个细胞/ml的浓度维持至少8周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过3.0x106个细胞/ml的浓度维持至少9周。在一个实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.5x106个细胞/ml的浓度维持至少7天。在一个具体实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.5x106个细胞/ml的浓度维持至少14天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.5x106个细胞/ml的浓度维持至少21天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.5x106个细胞/ml的浓度维持至少28天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.5x106个细胞/ml的浓度维持至少5周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.5x106个细胞/ml的浓度维持至少6周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.5x106个细胞/ml的浓度维持至少7周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.5x106个细胞/ml的浓度维持至少8周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.5x106个细胞/ml的浓度维持至少9周。在另一个实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.0x106个细胞/ml的浓度维持至少7天。在一个具体实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.0x106个细胞/ml的浓度维持至少14天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.0x106个细胞/ml的浓度维持至少21天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.0x106个细胞/ml的浓度维持至少28天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.0x106个细胞/ml的浓度维持至少5周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.0x106个细胞/ml的浓度维持至少6周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.0x106个细胞/ml的浓度维持至少7周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.0x106个细胞/ml的浓度维持至少8周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过2.0x106个细胞/ml的浓度维持至少9周。在一个实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过1.5x106个细胞/ml的浓度维持至少7天。在一个具体实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过1.5x106个细胞/ml的浓度维持至少14天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过1.5x106个细胞/ml的浓度维持至少21天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过1.5x106个细胞/ml的浓度维持至少28天。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过1.5x106个细胞/ml的浓度维持至少5周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过1.5x106个细胞/ml的浓度维持至少6周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过1.5x106个细胞/ml的浓度维持至少7周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过1.5x106个细胞/ml的浓度维持至少8周。在一个更具体的实施方案中,本文中提供的连续细胞培养物的细胞密度在不超过1.5x106个细胞/ml的浓度维持至少9周。以下提供有关用于生产rvwf和ra13的方法的具体细节。应当理解,尽管这些条件具体地关于rvwf或ra13而呈现,但用于rvwf的条件可用于生产ra13,且反之亦然。b.生产高分子量重组vwf的方法在另一个方面,本发明另外涉及方法在包含具有增加的铜浓度的细胞培养基的细胞培养条件下生产vwf的方法。在某些实施方案中,所述培养物也包含低铵浓度。本文使用的术语“细胞培养物”和“细胞培养溶液”可互换使用。在一个实施方案中,本发明提供了一种生产高分子量重组vwf的方法,所述方法包括:a)提供细胞培养物;b)引入编码vwf的核酸序列;c)选择携带所述核酸序列的细胞;和d)在包含铜浓度为至少约2.4μg/l的细胞培养基和包含铵浓度小于约10mm的细胞培养物上清液的细胞培养条件下在细胞中表达vwf,其中所述vwf为包含约14至约22个二聚体且具有至少约30mu/μg的利托菌素比活性的高度多聚vwf。在其它实施方案中,使用本发明的方法生产的多聚rvwf包含约10-30、12-28、14-26、16-24、18-22、20-21个二聚体。在其它实施方案中,根据本发明生产的rvwf的比活性为至少约20、22.5、25、27.5、30、32.5、35、37.5、40、42.5、45、47.5、50、52.5、55、57.5、60、62.5、65、67.5、70、72.5、75、77.5、80或更高的mu/μg。在一个具体实施方案中,用于生产rvwf的连续细胞培养物的细胞密度长时间维持在不超过2.5x106个细胞/ml的浓度。在其它具体实施方案中,所述细胞密度维持在不超过2.0x106个细胞/ml、1.5x106个细胞/ml、1.0x106个细胞/ml、0.5x106个细胞/ml或更低。在一个实施方案中,所述细胞密度维持在1.5x106个细胞/ml至2.5x106个细胞/ml。在一个实施方案中,本发明提供了一种用于生产重组vonwillebrand因子(rvwf)组合物的方法,所述方法包括下述步骤:(a)提供基础细胞培养基;(b)给所述基础细胞培养基补充铜,以提供至少2.0μg/l的最终铜浓度;(c)提供一个或多个细胞,所述细胞包含编码rvwf蛋白的核酸;(d)在补充了铜的细胞培养基中培养所述一个或多个细胞,使得所述细胞表达rvwf并将其分泌进培养物上清液中;和(e)回收所述培养物上清液的至少一部分,其中所述回收的上清液的rvwf的利托菌素辅因子比活性为至少30mu/μgrvwf。在一个实施方案中,所述细胞培养溶液另外包含小于10mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过10mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过5mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过5mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过4mm的铵浓度。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过4mm的铵浓度维持至少7天。在其它实施方案中,所述细胞培养溶液包含不超过10mm、或不超过9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm、或更低的铵浓度。在另一个实施方案中,所述细胞培养物的铵浓度在过程期间(即在所述培养物用于生产rvwf的整个时间内)维持在低水平。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,给基础细胞培养基补充铜,以提供至少2.4μg/l的最终铜浓度。在一个实施方案中,所述细胞培养溶液另外包含小于10mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过10mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过5mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过5mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过4mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过4mm的铵浓度维持至少7天。在其它实施方案中,所述细胞培养溶液包含不超过10mm、或不超过9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm、或更低的铵浓度。在另一个实施方案中,所述细胞培养溶液的铵浓度在过程期间(即在所述培养物用于生产rvwf的整个时间内)维持在低水平。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,给基础细胞培养基补充铜,以提供至少3μg/l的最终铜浓度。在一个实施方案中,所述细胞培养溶液另外包含小于10mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过10mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过5mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过5mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过4mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过4mm的铵浓度维持至少7天。在其它实施方案中,所述细胞培养溶液包含不超过10mm、或不超过9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm、或更低的铵浓度。在另一个实施方案中,所述细胞培养溶液的铵浓度在过程期间(即在所述培养物用于生产rvwf的整个时间内)维持在低水平。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,给基础细胞培养基补充铜,以提供至少4μg/l的最终铜浓度。在一个实施方案中,所述细胞培养溶液另外包含小于10mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过10mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过5mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过5mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过4mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过4mm的铵浓度维持至少7天。在其它实施方案中,所述细胞培养基包含不超过10mm、或不超过9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm、或更低的铵浓度。在另一个实施方案中,所述细胞培养溶液的铵浓度在过程期间(即在所述培养物用于生产rvwf的整个时间内)维持在低水平。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,给基础细胞培养基补充铜,以提供约4.3μg/l的最终铜浓度。在一个实施方案中,所述细胞培养溶液另外包含小于10mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过10mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过5mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过5mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过4mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过4mm的铵浓度维持至少7天。在其它实施方案中,所述细胞培养溶液包含不超过10mm、或不超过9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm、或更低的铵浓度。在另一个实施方案中,所述细胞培养溶液的铵浓度在过程期间(即在所述培养物用于生产rvwf的整个时间内)维持在低水平。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,给基础细胞培养基补充铜,以提供2μg/l至20μg/l的最终铜浓度。在一个实施方案中,所述细胞培养溶液另外包含小于10mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过10mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过5mm的铵浓度。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过5mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过4mm的铵浓度。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过4mm的铵浓度维持至少7天。在其它实施方案中,所述细胞培养溶液包含不超过10mm、或不超过9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm、或更低的铵浓度。在另一个实施方案中,所述细胞培养物的铵浓度在过程期间(即在所述培养物用于生产rvwf的整个时间内)维持在低水平。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,给基础细胞培养基补充铜,以提供3μg/l至10μg/l的最终铜浓度。在一个实施方案中,所述细胞培养溶液另外包含小于10mm的铵浓度。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过10mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过5mm的铵浓度。在另一个具体实施方案中,所述细胞培养溶液的铵浓度在不超过5mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过4mm的铵浓度。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过4mm的铵浓度维持至少7天。在其它实施方案中,所述细胞培养溶液包含不超过10mm、或不超过9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm、或更低的铵浓度。在另一个实施方案中,所述细胞培养溶液的铵浓度在过程期间(即在所述培养物用于生产rvwf的整个时间内)维持在低水平。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,给基础细胞培养基补充铜,以提供4μg/l至7.5μg/l的最终铜浓度。在一个实施方案中,所述细胞培养溶液另外包含小于10mm的铵浓度。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过10mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过5mm的铵浓度。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过5mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过4mm的铵浓度。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过4mm的铵浓度维持至少7天。在其它实施方案中,所述细胞培养溶液包含不超过10mm、或不超过9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm、或更低的铵浓度。在另一个实施方案中,所述细胞培养物的铵浓度在过程期间(即在所述培养物用于生产rvwf的整个时间内)维持在低水平。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在一个实施方案中,本发明提供了一种用于生产重组vonwillebrand因子(rvwf)组合物的方法,所述方法包括下述步骤:(a)提供基础细胞培养基;(b)给所述基础细胞培养基补充铜;(c)提供一个或多个细胞,所述细胞包含编码rvwf蛋白的核酸;(d)在补充了铜的细胞培养基中培养所述一个或多个细胞,使得所述细胞表达rvwf并将其分泌进培养物上清液中;和(e)回收所述培养物上清液的至少一部分,其中所述上清液的nh4+浓度在低水平维持至少7天,且另外其中所述回收的上清液的rvwf的利托菌素辅因子比活性为至少30mu/μgrvwf。在一个具体实施方案中,所述细胞培养溶液的铜浓度和nh4+浓度维持在根据表1所示的变体1至440中任一个的浓度。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,所述细胞培养物的铜浓度和nh4+浓度在根据表1所示的变体1至440中任一个的浓度维持至少14天。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,所述细胞培养物的铜浓度和nh4+浓度在根据表1所示的变体1至440中任一个的浓度维持至少21天。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,所述细胞培养物的铜浓度和nh4+浓度在根据表1所示的变体1至440中任一个的浓度维持至少28天。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,所述细胞培养物的铜浓度和nh4+浓度在根据表1所示的变体1至440中任一个的浓度维持至少5周。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,所述细胞培养物的铜浓度和nh4+浓度在根据表1所示的变体1至440中任一个的浓度维持至少6周。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,所述细胞培养物的铜浓度和nh4+浓度在根据表1所示的变体1至440中任一个的浓度维持至少7周。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,所述细胞培养物的铜浓度和nh4+浓度在根据表1所示的变体1至440中任一个的浓度维持至少8周。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,所述细胞培养物的铜浓度和nh4+浓度在根据表1所示的变体1至440中任一个的浓度维持至少9周。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在一个实施方案中,本发明提供了一种用于生产重组vonwillebrand因子(rvwf)组合物的方法,所述方法包括下述步骤:(a)提供基础细胞培养基;(b)给所述基础细胞培养基补充铜,以提供至少2.0μg/l的最终铜浓度;(c)提供一个或多个细胞,所述细胞包含编码rvwf蛋白的核酸;(d)在补充了铜的细胞培养基中培养所述一个或多个细胞,使得所述细胞表达rvwf并将其分泌进培养物上清液中;(e)监测所述培养物上清液的铵浓度;和(f)回收所述培养物上清液的至少一部分,其中包含超过10mm的铵浓度的培养物上清液不用于生产rvwf组合物,且另外其中所述回收的上清液的rvwf的利托菌素辅因子比活性为至少30mu/μgrvwf。在某些实施方案中,经补充的基础培养基的最终铜浓度为至少2.4μg/l、3μg/l、4μg/l、5μg/l、6μg/l、7μg/l、8μg/l、9μg/l、10μg/l、15μg/l、20μg/l或更高。在其它实施方案中,经补充的基础培养基的最终铜浓度为2-20μg/l、2-10μg/l、3-8μg/l或4-6μg/l。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,包含超过6mm的铵浓度的培养物上清液不用于生产rvwf组合物。在某些实施方案中,经补充的基础培养基的最终铜浓度为至少2.4μg/l、3μg/l、4μg/l、5μg/l、6μg/l、7μg/l、8μg/l、9μg/l、10μg/l、15μg/l、20μg/l或更高。在其它实施方案中,经补充的基础培养基的最终铜浓度为2-20μg/l、2-10μg/l、3-8μg/l或4-6μg/l。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,包含超过5mm的铵浓度的培养物上清液不用于生产rvwf组合物。在某些实施方案中,经补充的基础培养基的最终铜浓度为至少2.4μg/l、3μg/l、4μg/l、5μg/l、6μg/l、7μg/l、8μg/l、9μg/l、10μg/l、15μg/l、20μg/l或更高。在其它实施方案中,经补充的基础培养基的最终铜浓度为2-20μg/l、2-10μg/l、3-8μg/l或4-6μg/l。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。在上述方法的一个实施方案中,包含超过4mm的铵浓度的培养物上清液不用于生产rvwf组合物。在某些实施方案中,经补充的基础培养基的最终铜浓度为至少2.4μg/l、3μg/l、4μg/l、5μg/l、6μg/l、7μg/l、8μg/l、9μg/l、10μg/l、15μg/l、20μg/l或更高。在其它实施方案中,经补充的基础培养基的最终铜浓度为2-20μg/l、2-10μg/l、3-8μg/l或4-6μg/l。在一个优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少50mu/μgrvwf。在一个更优选的实施方案中,所述回收的上清液的rvwf的利托菌素辅因子比活性为至少70mu/μgrvwf。通过在合适的真核宿主系统中表达,可以生产重组vwf。真核细胞的实例包括,但不限于:哺乳动物细胞,诸如cho、cos、hek293、bhk、sk-hep和hepg2;昆虫细胞,例如,sf9细胞、sf21细胞、s2细胞和highfive细胞;和酵母细胞,例如,酵母菌(saccharomyces)或裂殖酵母(schizosaccharomyces)细胞。在一个实施方案中,可以在酵母细胞、昆虫细胞、禽细胞、哺乳动物细胞等中表达vwf。例如,在人细胞系、仓鼠细胞系或鼠细胞系中。在一个具体实施方案中,所述细胞系是cho、bhk或hek细胞系。通常,哺乳动物细胞(例如来自连续细胞系的cho细胞)可用于表达本发明的vwf。在某些实施方案中,包含编码vwf的序列的核酸序列可以是载体。载体可由病毒递送,或可以是质粒。编码蛋白的核酸序列可以是特定基因或其生物功能部分。在一个实施方案中,蛋白至少为vwf的生物活性部分。多种载体可用于表达vwf,且可选自真核表达载体。用于真核表达的载体的实例包括:(i)对于在酵母中的表达,诸如pao、ppic、pyes、pmet等载体,使用诸如aox1、gap、gal1、aug1等启动子;(ii)对于在昆虫细胞中的表达,诸如pmt、pac5、pib、pmib、pbac等载体,使用诸如ph、p10、mt、ac5、opie2、gp64、polh等启动子,和(iii)对于在哺乳动物细胞中的表达,诸如psvl、pcmv、prc/rsv、pcdna3、pbpv等载体,和来源于诸如痘苗病毒、腺相关病毒、疱疹病毒、反转录病毒等病毒系统的载体,使用诸如cmv、sv40、ef-1、ubc、rsv、adv、bpv和β-肌动蛋白的启动子。用于表达rvwf的一种示例性载体由kaufman等人(molcellbiol.1989年3月;9(3):1233-42)描述,其内容出于所有目的以全文引用的方式并入本文中。在本发明的一些实施方案中,核酸序列另外包含适用于蛋白的受控表达的其它序列,诸如启动子序列、增强子、tata盒、转录起始位点、多接头、限制位点、聚-a-序列、蛋白加工序列、选择标志物和本领域普通技术人员通常已知的其类似物。除包含增加的铜浓度的细胞培养基外,本发明的细胞培养条件可在培养系统的整个上游过程中始终包括小于约25mm的铵浓度。在一个实施方案中,所述细胞培养条件包括小于约25mm的铵浓度,在另一个实施方案中小于约20mm,在另一个实施方案中小于约15mm,在另一个实施方案中小于约10mm,且在另一个实施方案中小于约5mm。在一些实施方案中,本发明的铵浓度在细胞培养系统的整个上游过程中始终保持恒定。例如,通过与常规分批培养和补料分批培养(各自通常为本领域中已知)相比经改良的方法,可以培养根据本发明使用的细胞。然而,这样的常规技术可在培养结束时产生高浓度的铵。通过使用可连续供应培养基的生产系统(通过诸如灌注或恒化培养等技术),本发明的方法克服了此问题。在培养宿主细胞后,使用标准方法(诸如超滤或离心),可以从用过的培养基回收vwf。必要时,通过例如离子交换和/或尺寸排阻色谱法等,可以纯化vwf。连续培养(例如灌注或恒化培养)可以是通过流入新鲜培养基来连续供应营养物的悬浮培养,其中培养物体积通常恒定。类似地,连续发酵可以表示这样的过程:通过连续添加新鲜培养基,使细胞或微生物在培养物中维持在指数生长期,通过从生物反应器除去细胞悬浮液来精确平衡。此外,搅拌罐反应器系统可用于悬浮、灌注、恒化和/或微载体培养。通常,搅拌罐反应器系统可以作为具有任何类型搅拌器(诸如rushton、水翼、斜叶桨或船推进器型搅拌器)的任何常规搅拌罐反应器来操作。c.生产重组adamts13(a13)的方法在另一个方面,本发明另外涉及在包含具有增加的铜浓度的细胞培养基的细胞培养条件下生产ra13的方法。在某些实施方案中,所述培养物也包含低铵浓度。在一个实施方案中,本发明提供了一种用于生产重组adamts13(ra13)组合物的方法,所述方法包括下述步骤:(a)提供基础细胞培养基;(b)给所述基础细胞培养基补充铜,以提供至少1.0μg/l的最终铜浓度;(c)提供一个或多个细胞,所述细胞包含编码ra13蛋白的核酸;(d)在补充了铜的细胞培养基中培养所述一个或多个细胞,使得所述细胞表达ra13并将其分泌进培养物上清液中;和(e)回收所述培养物上清液的至少一部分,其中在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少1500单位frets-vwf73活性(即每天每升细胞培养物1500单位frets-vwf73活性;pfrets)。在某些实施方案中,经补充的基础培养基的最终铜浓度为至少2μg/l、3μg/l、4μg/l、5μg/l、6μg/l或更高。在其它实施方案中,经补充的基础培养基的最终铜浓度为1-6μg/l、2-5μg/l、2-4μg/l或3-4μg/l。在一个优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2000单位frets-vwf73活性。在一个更优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2500单位frets-vwf73活性。在一个最优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少3000单位frets-vwf73活性。在某些实施方案中,所述方法会提供大幅提高的frets-vwf73体积生产率(pfrets)。例如,在某些实施方案中,每天回收的每升经补充的基础细胞培养基含有至少1500单位frets-vwf73活性,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个优选的实施方案中,每天回收的每升经补充的基础细胞培养基含有至少2000单位frets-vwf73活性,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个更优选的实施方案中,每天回收的每升经补充的基础细胞培养基含有至少2500单位frets-vwf73活性,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个最优选的实施方案中,每天回收的每升经补充的基础细胞培养基含有至少3000单位frets-vwf73活性,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个具体实施方案中,用于生产ra13的连续细胞培养物的细胞密度长时间维持在不超过4.0x106个细胞/ml的浓度。在其它具体实施方案中,所述细胞密度维持在不超过3.5x106个细胞/ml、3.0x106个细胞/ml、2.5x106个细胞/ml、2.0x106个细胞/ml、1.5x106个细胞/ml、1.0x106个细胞/ml或更低。在一个实施方案中,所述细胞密度维持在3.0x106个细胞/ml至4.0x106个细胞/ml。在上述方法的一个实施方案中,回收的上清液中的每ml上清液具有至少4单位frets-vwf73活性(frets)。在一个优选的实施方案中,回收的上清液中的每ml上清液具有至少6单位frets-vwf73活性。在一个更优选的实施方案中,回收的上清液中的每ml上清液具有至少8单位frets-vwf73活性。在一个最优选的实施方案中,回收的上清液中的每ml上清液具有至少10单位frets-vwf73活性。在某些实施方案中,所述方法会提供大幅提高的frets产率。例如,在某些实施方案中,每天回收的每ml上清液具有至少4单位frets-vwf73活性,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个优选的实施方案中,每天回收的每ml上清液具有至少6单位frets-vwf73活性,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个更优选的实施方案中,每天回收的每ml上清液具有至少8单位frets-vwf73活性,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个最优选的实施方案中,每天回收的每ml上清液具有至少10单位frets-vwf73活性,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在上述方法的一个实施方案中,所述细胞培养导致每106个存在于培养物中的细胞每天生产至少800mufrets-vwf73活性(即qfrets)。在一个优选的实施方案中,所述细胞培养导致每106个存在于培养物中的细胞每天生产至少1ufrets-vwf73活性。在一个更优选的实施方案中,所述细胞培养导致每106个存在于培养物中的细胞每天生产至少1.2ufrets-vwf73活性。在一个最优选的实施方案中,在一个更优选的实施方案中,所述细胞培养导致每106个存在于培养物中的细胞每天生产至少1.4ufrets-vwf73活性。在某些实施方案中,所述方法会提供大幅提高的细胞的frets-vwf73比生产率(qfrets)。例如,在某些实施方案中,所述细胞培养导致每106个存在于培养物中的细胞每天生产至少800mufrets-vwf73活性,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个优选的实施方案中,所述细胞培养导致每106个存在于培养物中的细胞每天生产至少1ufrets-vwf73活性,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个更优选的实施方案中,所述细胞培养导致每106个存在于培养物中的细胞每天生产至少1.2ufrets-vwf73活性,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个最优选的实施方案中,所述细胞培养导致每106个存在于培养物中的细胞每天生产至少1.4ufrets-vwf73活性,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在上述方法的一个实施方案中,通过elisa测得,所述细胞培养导致每升培养物每天生产至少1mgra13(pelisa)。在一个优选的实施方案中,通过elisa测得,所述细胞培养导致每升培养物每天生产至少1.5mgra13。在一个更优选的实施方案中,通过elisa测得,所述细胞培养导致每升培养物每天生产至少2mgra13。在某些实施方案中,所述方法会提供大幅提高的ra13产量。例如,在某些实施方案中,通过elisa测得,所述细胞培养导致每升培养物每天生产至少1mgra13,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个优选的实施方案中,通过elisa测得,所述细胞培养导致每升培养物每天生产至少1.5mgra13,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个更优选的实施方案中,通过elisa测得,所述细胞培养导致每升培养物每天生产至少2mgra13,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在上述方法的一个实施方案中,通过elisa测得,所述细胞培养导致每106个存在于培养物中的细胞每天生产至少0.5μgra13(即qelisa)。在一个优选的实施方案中,通过elisa测得,所述细胞培养导致每106个存在于培养物中的细胞每天生产至少0.7μgra13。在一个更优选的实施方案中,通过elisa测得,所述细胞培养导致每106个存在于培养物中的细胞每天生产至少0.9μgra13。在某些实施方案中,所述方法会提供大幅提高的qelisa产量。例如,在某些实施方案中,通过elisa测得,所述细胞培养导致每106个存在于培养物中的细胞每天生产至少0.5μgra13,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个优选的实施方案中,通过elisa测得,所述细胞培养导致每106个存在于培养物中的细胞每天生产至少0.7μgra13,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个更优选的实施方案中,通过elisa测得,所述细胞培养导致每106个存在于培养物中的细胞每天生产至少0.9μgra13,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在上述方法的一个实施方案中,通过elisa测得,回收的上清液中的每ml上清液具有至少3μgra13。在一个优选的实施方案中,通过elisa测得,回收的上清液中的每ml上清液具有至少4μgra13。在一个更优选的实施方案中,通过elisa测得,回收的上清液中的每ml上清液具有至少5μgra13。在一个最优选的实施方案中,通过elisa测得,回收的上清液中的每ml上清液具有至少6μgra13。在某些实施方案中,所述方法会提供大幅提高的ra13产量。例如,在某些实施方案中,每天回收的每ml上清液具有至少3μgra13,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个优选的实施方案中,每天回收的每ml上清液具有至少4μgra13,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个更优选的实施方案中,每天回收的每ml上清液具有至少5μgra13,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在一个最优选的实施方案中,每天回收的每ml上清液具有至少6μgra13,持续至少7天或至少14、21、28、35、42、49、56、63、70或更多天。在上述方法的一个实施方案中,所述细胞培养溶液另外包含小于10mm的铵浓度。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过10mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过5mm的铵浓度。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过5mm的铵浓度维持至少7天。在一个优选的实施方案中,所述细胞培养溶液包含不超过4mm的铵浓度。在另一个具体实施方案中,所述细胞培养物的铵浓度在不超过4mm的铵浓度维持至少7天。在其它实施方案中,所述细胞培养溶液包含不超过10mm、或不超过9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm、或更低的铵浓度。在另一个实施方案中,所述细胞培养物的铵浓度在过程期间(即在所述培养物用于生产ra13的整个时间内)维持在低水平。在一个具体实施方案中,所述培养物溶液具有根据表1中提供的变体1至440中任一个的铜和铵浓度。在一个实施方案中,本发明提供了一种用于生产重组adamts13(ra13)组合物的方法,所述方法包括下述步骤:(a)提供基础细胞培养基;(b)给所述基础细胞培养基补充铜和锌;(c)提供一个或多个细胞,所述细胞包含编码ra13蛋白的核酸;(d)在补充了铜的细胞培养基中培养所述一个或多个细胞,使得所述细胞表达ra13并将其分泌进培养物上清液中;和(e)回收所述培养物上清液的至少一部分,其中在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少1500单位frets-vwf73活性。在一个实施方案中,所述培养基含有至少1μg/l铜和至少2μm锌。在其它实施方案中,所述培养基含有至少2μg/l铜或至少4μg/l铜。在给培养基补充铜的一个实施方案中,所述培养基也含有至少5μm或至少约5μm锌。在一个实施方案中,所述培养基也含有2μm至12μm或约2μm至约12μm锌。在另一个实施方案中,所述培养基也含有5μm至12μm或约5μm至约12μm锌。在其它实施方案中,所述培养基还含有至少2μm或至少约2μm锌,或至少3μm、4μm、5μm、6μm、7μm、8μm、9μm、10μm、11μm、12μm、13μm、14μm、15μm、20μm、25μm、30μm或更多的锌,或至少约3μm、4μm、5μm、6μm、7μm、8μm、9μm、10μm、11μm、12μm、13μm、14μm、15μm、20μm、25μm、30μm或更多的锌。在一个实施方案中,所述培养基含有根据表2所示的变体441至880中任一个的铜和锌浓度。在一个优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2000单位frets-vwf73活性。在一个更优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2500单位frets-vwf73活性。在一个最优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少3000单位frets-vwf73活性。在一个实施方案中,本发明提供了一种用于生产重组adamts13(ra13)组合物的方法,所述方法包括下述步骤:(a)提供基础细胞培养基;(b)给所述基础细胞培养基补充铜和钙;(c)提供一个或多个细胞,所述细胞包含编码ra13蛋白的核酸;(d)在补充了铜的细胞培养基中培养所述一个或多个细胞,使得所述细胞表达ra13并将其分泌进培养物上清液中;和(e)回收所述培养物上清液的至少一部分,其中在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少1500单位frets-vwf73活性。在一个实施方案中,所述培养基含有至少1μg/l铜和至少0.5mm钙。在其它实施方案中,所述培养基含有至少2μg/l铜或至少4μg/l铜。在给培养基补充铜的另一个实施方案中,所述培养基也含有至少1.5mm钙。在一个实施方案中,所述培养基含有0.5mm至1.5mm或约0.5mm至约1.5mm钙。在其它实施方案中,所述培养基可以含有至少0.5mm或至少约0.5mm钙,或至少0.6mm、0.7mm、0.8mm、0.9mm、1.0mm、1.1mm、1.2mm、1.3mm、1.4mm、1.5mm、1.6mm、1.7mm、1.8mm、1.9mm、2.0mm、2.25mm、2.5mm、2.75mm、3.0mm、3.5mm、4.0mm、4.5mm、5.0mm或更高的钙,或至少约0.6mm、0.7mm、0.8mm、0.9mm、1.0mm、1.1mm、1.2mm、1.3mm、1.4mm、1.5mm、1.6mm、1.7mm、1.8mm、1.9mm、2.0mm、2.25mm、2.5mm、2.75mm、3.0mm、3.5mm、4.0mm、4.5mm、5.0mm或更高的钙。在一个实施方案中,所述培养基含有根据表3所示的变体881至1320中任一个的铜和钙浓度。在一个优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2000单位frets-vwf73活性。在一个更优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2500单位frets-vwf73活性。在一个最优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少3000单位frets-vwf73活性。在一个实施方案中,本发明提供了一种用于生产重组adamts13(ra13)组合物的方法,所述方法包括下述步骤:(a)提供基础细胞培养基;(b)给所述基础细胞培养基补充铜、锌和钙;(c)提供一个或多个细胞,所述细胞包含编码ra13蛋白的核酸;(d)在补充了铜的细胞培养基中培养所述一个或多个细胞,使得所述细胞表达ra13并将其分泌进培养物上清液中;和(e)回收所述培养物上清液的至少一部分,其中在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少1500单位frets-vwf73活性。在一个实施方案中,所述培养基具有至少0.5mm的钙浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在另一个具体实施方案中,所述培养基具有至少1.5mm的钙浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在另一个具体实施方案中,所述培养基具有0.5mm至1.5mm的钙浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在其它实施方案中,培养基具有至少0.6mm、0.7mm、0.8mm、0.9mm、1.0mm、1.1mm、1.2mm、1.3mm、1.4mm、1.5mm、1.6mm、1.7mm、1.8mm、1.9mm、2.0mm、2.25mm、2.5mm、2.75mm、3.0mm、3.5mm、4.0mm、4.5mm、5.0mm或更高的钙浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在一个优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2000单位frets-vwf73活性。在一个更优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2500单位frets-vwf73活性。在一个最优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少3000单位frets-vwf73活性。在一个实施方案中,本发明提供了一种用于生产重组adamts13(ra13)组合物的方法,所述方法包括下述步骤:(a)提供基础细胞培养基;(b)给所述基础细胞培养基补充铜和烟酰胺;(c)提供一个或多个细胞,所述细胞包含编码ra13蛋白的核酸;(d)在补充了铜的细胞培养基中培养所述一个或多个细胞,使得所述细胞表达ra13并将其分泌进培养物上清液中;和(e)回收所述培养物上清液的至少一部分,其中在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少1500单位frets-vwf73活性。在一个实施方案中,所述培养基含有至少1μg/l铜和至少2mg/l烟酰胺(维生素b3)。在其它实施方案中,所述培养基含有至少2μg/l铜或至少4μg/l铜。在给培养基补充铜的另一个实施方案中,培养基也含有至少7mg/l烟酰胺(维生素b3)。在一个实施方案中,所述培养基含有2mg/l至10mg/l或约2mg/l至约10mg/l烟酰胺(维生素b3)。在其它实施方案中,所述培养基可以含有至少2mg/l、3mg/l、4mg/l、5mg/l、6mg/l、7mg/l、8mg/l、9mg/l、10mg/l、15mg/l、20mg/l或更高浓度的烟酰胺,或至少约2mg/l、3mg/l、4mg/l、5mg/l、6mg/l、7mg/l、8mg/l、9mg/l、10mg/l、15mg/l、20mg/l或更高浓度的烟酰胺(维生素b3)。在一个实施方案中,所述培养基含有根据表4所示的变体1321至1760中任一个的铜和烟酰胺浓度。在一个优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2000单位frets-vwf73活性。在一个更优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2500单位frets-vwf73活性。在一个最优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少3000单位frets-vwf73活性。在一个实施方案中,本发明提供了一种用于生产重组adamts13(ra13)组合物的方法,所述方法包括下述步骤:(a)提供基础细胞培养基;(b)给所述基础细胞培养基补充铜、锌和烟酰胺;(c)提供一个或多个细胞,所述细胞包含编码ra13蛋白的核酸;(d)在补充了铜的细胞培养基中培养所述一个或多个细胞,使得所述细胞表达ra13并将其分泌进培养物上清液中;和(e)回收所述培养物上清液的至少一部分,其中在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少1500单位frets-vwf73活性。在一个实施方案中,所述细胞培养基具有至少2mg/ml的烟酰胺浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在另一个具体实施方案中,所述培养基具有至少7mg/mlmm的烟酰胺浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在另一个具体实施方案中,所述培养基具有2mg/ml至10mg/ml的烟酰胺浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在其它实施方案中,培养基具有至少2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、11mg/ml、12mg/ml、13mg/ml、14mg/ml、15mg/ml或更高的烟酰胺浓度以及根据表2所示的变体441至880中任一个的铜和锌浓度。在一个优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2000单位frets-vwf73活性。在一个更优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2500单位frets-vwf73活性。在一个最优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少3000单位frets-vwf73活性。在一个实施方案中,本发明提供了一种用于生产重组adamts13(ra13)组合物的方法,所述方法包括下述步骤:(a)提供基础细胞培养基;(b)给所述基础细胞培养基补充铜、钙和烟酰胺;(c)提供一个或多个细胞,所述细胞包含编码ra13蛋白的核酸;(d)在补充了铜的细胞培养基中培养所述一个或多个细胞,使得所述细胞表达ra13并将其分泌进培养物上清液中;和(e)回收所述培养物上清液的至少一部分,其中在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少1500单位frets-vwf73活性。在一个实施方案中,所述细胞培养基具有至少2mg/ml的烟酰胺浓度以及根据表3所示的变体881至1320中任一个的铜和钙浓度。在另一个具体实施方案中,所述培养基具有至少7mg/mlmm的烟酰胺浓度以及根据表3所示的变体881至1320中任一个的铜和钙浓度。在另一个具体实施方案中,所述培养基具有2mg/ml至10mg/ml的烟酰胺浓度以及根据表3所示的变体881至1320中任一个的铜和钙浓度。在其它实施方案中,培养基具有至少2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、11mg/ml、12mg/ml、13mg/ml、14mg/ml、15mg/ml或更高的烟酰胺浓度以及根据表3所示的变体881至1320中任一个的铜和钙浓度。在一个优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2000单位frets-vwf73活性。在一个更优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少2500单位frets-vwf73活性。在一个最优选的实施方案中,在所述回收的培养物上清液中存在每天每升经补充的基础细胞培养基至少3000单位frets-vwf73活性。通过在任意合适的原核或真核宿主系统中表达,可以生产重组adamts蛋白。真核细胞的实例包括,但不限于:哺乳动物细胞,诸如cho、cos、hek293、bhk、sk-hep和hepg2;昆虫细胞,例如sf9细胞、sf21细胞、s2细胞和highfive细胞;和酵母细胞,例如,酵母菌(saccharomyces)或裂殖酵母(schizosaccharomyces)细胞。在一个实施方案中,可以在细菌细胞、酵母细胞、昆虫细胞、禽细胞、哺乳动物细胞等中表达adamts蛋白。例如,在人细胞系、仓鼠细胞系或鼠细胞系中。在一个具体实施方案中,所述细胞系是cho、bhk或hek细胞系。在一个优选的实施方案中,所述细胞系是cho细胞系。在一个具体实施方案中,如下制备能够稳定表达ra13的cho克隆:用ra13和二氢叶酸还原酶的编码序列(例如鼠dhfr基因)共转染cho细胞,并在有递增水平的甲氨蝶呤存在下进行生长选择。在一个实施方案中,所述细胞可以是任何哺乳动物细胞,这些哺乳动物细胞可优选在生产工艺(即至少10升,优选至少100升)中培养,以生产所需的adamts蛋白,诸如adamts13。实例包括:被sv40转化的猴肾cv1细胞系(cos-7,atcccrl1651);人胚肾细胞系(293细胞或经亚克隆以在悬浮培养中生长的293细胞,graham等人,j.genvirol.,36:59(1977));幼仓鼠肾细胞(bhk,atccccl10);中国仓鼠卵巢细胞/-dhfr,诸如dukx-b11亚克隆(cho,uriaub和chasin,proc.natl.acad.sci.usa,77:4216(1980));小鼠塞尔托利细胞(tm4,mather,biol.reprod,23:243-251(1980));猴肾细胞(cv1atccccl70);非洲绿猴肾细胞(vero-76,atcccrl-1587);人子宫颈癌细胞(hela,atccccl2);犬肾细胞(mdck,atccccl34);水牛鼠肝细胞(brl3a,atcccrl1442);人肺细胞(w138,atccccl75);人肝细胞(hepg2,hb8065);小鼠乳腺肿瘤(mmt060562,atccccl51);tri细胞(mather等人,annalsn.y.acad.sci.,383:44-68(1982));mrc5细胞;fs4细胞;和人肝细胞瘤细胞系(hepg2)。优选地,细胞系是啮齿动物细胞系,特别是仓鼠细胞系诸如cho或bhk。多种载体可用于表达adamts蛋白(例如adamts13),且可选自真核和原核表达载体。在某些实施方案中,预见到质粒载体用于表达adamts蛋白(例如adamts13)。通常,来源于与宿主细胞兼容的物种的含有复制子和控制序列的质粒载体与这些宿主结合使用。载体可携带复制位点以及标记序列,所述标记序列能够提供转化细胞中的表型选择。质粒将包含编码adamts蛋白(例如adamts13)的核苷酸序列,所述核苷酸序列与一个或多个控制序列(例如启动子)可操作地连接。制备表达重组adamts蛋白的稳定cho细胞克隆的一种优选方法如下。用dhfr表达载体转染dhfr缺陷型cho细胞系dukx-b11,以允许相关的重组蛋白表达。plaimauer等人(blood.2002年11月15日;100(10):3626-32.2002年7月12日电子公开)描述一种示例性方法,其内容出于所有目的以全文引用的方式并入本文中。通过在不含次黄嘌呤/胸苷(ht)的培养基中培养,进行选择,并且通过在递增浓度的甲氨蝶呤中繁殖细胞,扩增编码重组adamts蛋白和dhfr基因的表达的相关区域。在适当时,cho细胞系可适合在不含血清和/或蛋白的培养基中生长,基本上如在us6,100,061(reiter等人,lmmunoaktiengesellschaft)中所述。在另一个优选的实施方案中,通过用含有潮霉素选择标记的构建体转染,并通过抗生素抗性来选择转化体,制备稳定的hek293细胞。某些病毒的感染细胞、或经由受体介导的胞吞作用进入细胞中、以及整合进宿主细胞基因组中且稳定并有效地表达病毒基因的能力,已经使得其成为用于将外来核酸转移进细胞(例如哺乳动物细胞)中的具有吸引力的候选物。因此,在某些实施方案中,使用病毒载体将编码adamts蛋白(例如adamts13)的核苷酸序列引入宿主细胞中进行表达。病毒载体将包含编码adamts蛋白(例如adamts13)的核苷酸序列,所述核苷酸序列与一个或多个控制序列(例如启动子)可操作地连接。或者,病毒载体可不含控制序列,且将替代性地依赖于宿主细胞内的控制序列来驱动adamts蛋白的表达。可用于传递核酸的病毒载体的非限制性实例包括:腺病毒载体、aav载体和反转录病毒载体。在一个实施方案中,腺病毒表达载体包括下述构建体:所述构建体含有足以支持构建体的封装和最终表达已经克隆在其中的adamts构建体的腺病毒序列。腺病毒载体允许引入高达7kb的外来序列(grunhaus等人,seminarinvirology,200(2):535-546,1992))。在另一个实施方案中,腺相关病毒(aav)可用于将编码adamts蛋白(例如adamts13)的核苷酸序列引入宿主细胞中进行表达。aav系统已于先前描述,且通常为本领域中熟知(kelleher和vos,biotechniques,17(6):1110-7,1994;cotten等人,procnatlacadsciusa,89(13):6094-6098,1992;curiel,natimmun,13(2-3):141-64,1994;muzyczka,currtopmicrobiolimmunol,158:97-129,1992)。有关raav载体的制备和使用的细节,描述于例如美国专利号5,139,941和4,797,368中,每篇出于所有目的以全文引用的方式并入本文中。在一个实施方案中,反转录病毒表达载体可用于将编码adamts蛋白(例如adamts13)的核苷酸序列引入宿主细胞中进行表达。这些系统已于先前描述,且通常在本领域中熟知(mann等人,cell,33:153-159,1983;nicolas和rubinstein,见:vectors:asurveyofmolecularcloningvectorsandtheiruses,rodriguez和denhardt编,stoneham:butterworth,第494-513页,1988;temin,见:genetransfer,kucherlapati(编),newyork:plenumpress,第149-188页,1986)。在一个具体实施方案中,反转录病毒载体为慢病毒载体(参见,例如,naldini等人,science,272(5259):263-267,1996;zufferey等人,natbiotechnol,15(9):871-875,1997;blomer等人,jvirol.,71(9):6641-6649,1997;美国专利号6,013,516和5,994,136)。用于原核表达的载体的非限制性实例包括质粒,诸如prset、pet、pbad等,其中用于原核表达载体的启动子包括lac、trc、trp、reca、arabad等。用于真核表达的载体的实例包括:(i)对于在酵母中表达,诸如pao、ppic、pyes、pmet等载体,使用诸如aox1、gap、gal1、aug1等启动子;(ii)对于在昆虫细胞中表达,诸如pmt、pac5、pib、pmib、pbac等载体,使用诸如ph、p10、mt、ac5、opie2、gp64、polh等启动子,和(iii)对于在哺乳动物细胞中表达,诸如psvl、pcmv、prc/rsv、pcdna3、pbpv等载体和来源于诸如痘苗病毒、腺相关病毒、疱疹病毒、反转录病毒等病毒系统的载体,使用诸如cmv、sv40、ef-1、ubc、rsv、adv、bpv和β-肌动蛋白的启动子。plaimauer等人(blood.2002年11月15日;100(10):3626-32.2002年7月12日电子公开)描述了用于表达ra13的一种示例性载体,其内容出于所有目的以全文引用的方式并入本文中。在某些实施方案中,本发明的细胞培养方法可以包括使用微载体。在其它方面,本发明提供了大规模adamts蛋白表达的方法。在一些实施方案中,可在大型生物反应器中在适于提供高体积-培养物比表面积的条件下进行细胞培养实施方案,以获得高细胞密度和蛋白表达。一种提供这样的生长条件的方式是,在搅拌罐生物反应器中使用细胞培养物的微载体。在另一个实施方案中,经由使用悬浮细胞培养,满足这些生长要求。v.具体实施方案a.重组vonwillebrand因子(rvwf)重组vwf可在哺乳动物细胞中表达,但vwf的比活性可随细胞培养条件而广泛变化,且未证实与从血浆分离的vwf的比活性相当或相等。本发明部分地基于下述惊人结果:具有至少2.4μg/l铜的细胞培养基会提供促进具有高比活性的高分子量vwf的表达的有利作用。具体地,本发明的高分子量重组vwf可以包括高度多聚形式,所述高度多聚形式包含约14至约22个二聚体,且具有至少约30mu/μg的利托菌素比活性。根据本发明的细胞培养过程也允许在细胞培养系统的上游过程期间维持低nh4+含量(例如小于10mm),由此减少对翻译后修饰的有害影响。据信,本发明首次提供了这样的细胞培养条件:其包含具有合适铜浓度的培养基以及上清液中的适当铵水平,以表达具有高比活性的高度多聚vwf。在一个方面,本发明涉及用于生产具有高比活性的重组高分子量vwf的细胞培养条件。本发明的细胞培养条件可以包括,例如,具有增加的铜浓度的细胞培养基和/或具有低铵(nh4+)浓度的细胞培养物上清液。本发明也提供了在细胞培养条件中培养细胞以表达具有高比活性的高分子量vwf的方法。在一个方面,本发明提供了用于生产高分子量重组vwf蛋白的细胞培养溶液,所述细胞培养溶液包含:包含至少约2.4μg/l的铜浓度的细胞培养基;包含小于10mm的铵浓度的细胞培养物上清液;和多个表达高度多聚vwf蛋白的细胞,其中所述vwf蛋白具有至少约30mu/μg的利托菌素比活性。在上述细胞培养物的一个具体实施方案中,所述细胞培养溶液包含含铜的培养基补充物。在上述细胞培养物的一个具体实施方案中,所述培养基补充物包含水解物,任选地为大豆水解物。在上述细胞培养物的一个具体实施方案中,所述培养基补充物包含铜盐、铜螯合物或它们的组合。在上述细胞培养物的一个具体实施方案中,所述铜盐选自:硫酸铜、醋酸铜、碳酸铜、氯化铜、氢氧化铜、硝酸铜和氧化铜。在上述细胞培养物的一个具体实施方案中,所述铜浓度是至少约4μg/l。在上述细胞培养物的一个具体实施方案中,所述铜浓度是约2.4μg/l至约20μg/l。在上述细胞培养物的一个具体实施方案中,所述vwf蛋白包含约14至约22个二聚体。在一个方面,本发明提供了一种生产高分子量重组vwf蛋白的方法,所述方法包括下述步骤:a)提供包含编码重组vwf蛋白的核酸的细胞培养物;b)在包含铜浓度为至少约2.4μg/l的细胞培养基和铵浓度小于约10mm的细胞培养物上清液的细胞培养条件下在细胞中表达vwf蛋白,其中所述vwf蛋白为高度多聚的vwf蛋白,且具有至少约30mu/μg的利托菌素比活性。在上述方法的一个具体实施方案中,所述细胞是哺乳动物细胞。在上述方法的一个具体实施方案中,所述细胞来自连续细胞系。在上述方法的一个具体实施方案中,所述细胞是cho细胞。在上述方法的一个具体实施方案中,所述铜浓度是至少约4μg/l。在上述方法的一个具体实施方案中,所述铜浓度是约2.4μg/l至约20μg/l。在上述方法的一个具体实施方案中,所述重组vwf蛋白具有至少约50mu/μg的利托菌素辅因子比活性。在上述方法的一个具体实施方案中,所述重组vwf蛋白具有约30mu/μg至约100mu/μg的利托菌素辅因子比活性。在上述方法的一个具体实施方案中,所述重组vwf蛋白包含约14至约22个二聚体。在一个方面,本发明提供了通过一种方法生产的高分子量重组vwf蛋白,所述方法包括下述步骤:a)提供包含编码重组vwf蛋白的核酸的细胞培养物;和b)在包含铜浓度为至少2.4μg/l的细胞培养基和铵浓度小于10mm的细胞培养物上清液的细胞培养条件下在细胞中表达vwf蛋白,其中vwf蛋白为高度多聚vwf蛋白,且具有至少约30mu/μg的利托菌素比活性。在上述rvwf组合物的一个具体实施方案中,重组vwf蛋白具有至少约50mu/μg的利托菌素辅因子比活性。在上述rvwf组合物的一个具体实施方案中,重组vwf蛋白具有约30mu/μg至约100mu/μg的利托菌素辅因子比活性。在上述rvwf组合物的一个具体实施方案中,重组vwf蛋白包含约14至约22个二聚体。在一个方面,本发明提供了一种用于生产高分子量重组vwf蛋白的细胞培养溶液,所述细胞培养溶液包含:包含至少约2.4μg/l的铜浓度的细胞培养基;包含小于10mm的铵浓度的细胞培养物上清液;和多个表达高度多聚vwf蛋白的细胞,其中vwf蛋白包含约14至约22个二聚体和至少约30mu/μg的利托菌素比活性。在一个方面,本发明涉及用于生产呈具有高比活性的高度多聚形式的重组高分子量vwf的细胞培养条件。本发明的细胞培养条件可以包括,例如,具有增加的铜浓度的细胞培养基和具有低铵(nh4+)浓度的细胞培养物上清液。本发明也提供了在细胞培养条件中培养细胞以表达具有高比活性的高分子量vwf的方法。在一个方面,本发明包括用于生产高分子量重组vwf的细胞培养溶液,所述细胞培养溶液包含:包含至少约2.4μg/l的铜浓度的细胞培养基;包含小于10mm的铵浓度的细胞培养物上清液;和多个表达高度多聚vwf的细胞,所述高度多聚vwf包含约14至约22个二聚体和至少约30mu/μg的利托菌素比活性。在上述细胞培养溶液的一个实施方案中,至少10%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在一个具体实施方案中,至少15%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少20%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少25%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少30%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在某些实施方案中,所述铜浓度可以是至少约4μg/l,或铜浓度可以在约2.4μg/l至约20μg/l的范围内。在一些实施方案中,所述细胞培养基包含含有铜的培养基补充物。在某些实施方案中,所述培养基补充物可以包含水解物或铜盐、铜螯合物或它们的组合。在一些实施方案中,所述铜盐可以包括硫酸铜、醋酸铜、碳酸铜、氯化铜、氢氧化铜、硝酸铜或氧化铜。在某些实施方案中,所述细胞可以来自连续细胞系,且可以包括哺乳动物细胞,诸如cho细胞。在一些实施方案中,所述重组vwf具有至少约50mu/μg的利托菌素辅因子比活性,或利托菌素辅因子比活性可以在约30mu/μg至约100mu/μg范围内。在另一个方面,本发明包括一种生产高分子量重组vwf的方法,所述方法包括:a)提供细胞培养物;b)引入编码vwf的核酸序列;c)选择携带所述核酸序列的细胞;和d)在包含铜浓度为至少约2.4μg/l的细胞培养基和铵浓度小于约10mm的细胞培养物上清液的细胞培养条件下在细胞中表达vwf,其中所述vwf为包含约14至约22个二聚体和至少约30mu/μg的利托菌素比活性的高度多聚vwf。在上述细胞培养物上清液的一个实施方案中,至少10%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在一个具体实施方案中,至少15%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少20%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少25%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少30%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在一些实施方案中,所述细胞可以来自连续细胞系,且可以包括哺乳动物细胞,诸如cho细胞。在某些实施方案中,所述铜浓度可以是至少约4μg/l,或铜浓度可以在约2.4μg/l至约20μg/l的范围内。在一些实施方案中,所述细胞培养基包含含有铜的培养基补充物。在某些实施方案中,所述培养基补充物可以包含水解物或铜盐、铜螯合物或它们的组合。在一些实施方案中,所述铜盐可以包括硫酸铜、醋酸铜、碳酸铜、氯化铜、氢氧化铜、硝酸铜或氧化铜。在一些实施方案中,所述重组vwf具有至少约50mu/μg的利托菌素辅因子比活性,或利托菌素辅因子比活性可以在约30mu/μg至约100mu/μg范围内。在另一个方面,本发明包括通过一种方法生产的高分子量重组vwf,所述方法包括下述步骤:a)提供细胞培养物;b)引入编码vwf的核酸序列;c)选择携带所述核酸序列的细胞;和d)在包含铜浓度为至少2.4μg/l的细胞培养基和铵浓度小于10mm的细胞培养物上清液的细胞培养条件下在细胞中表达vwf,其中所述vwf为包含约14至约22个二聚体和至少约30mu/μg的利托菌素比活性的高度多聚vwf。在上述细胞培养物上清液的一个实施方案中,至少10%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在一个具体实施方案中,至少15%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少20%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少25%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少30%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在一些实施方案中,所述细胞可以来自连续细胞系,且可以包括哺乳动物细胞,诸如cho细胞。在某些实施方案中,所述铜浓度可以是至少约4μg/l,或铜浓度可以在约2.4μg/l至约20μg/l的范围内。在一些实施方案中,所述细胞培养基包含含有铜的培养基补充物。在某些实施方案中,所述培养基补充物可以包含水解物或铜盐、铜螯合物或它们的组合。在一些实施方案中,所述铜盐可以包括硫酸铜、醋酸铜、碳酸铜、氯化铜、氢氧化铜、硝酸铜或氧化铜。在一些实施方案中,所述重组vwf具有至少约50mu/μg的利托菌素辅因子比活性,或利托菌素辅因子比活性可以在约30mu/μg至约100mu/μg范围内。在一个方面,本发明提供了一种包含重组vonwillebrand因子(rvwf)的组合物,所述组合物具有至少30mu/μg的利托菌素辅因子比活性。在一个优选的实施方案中,所述组合物具有至少40mu/μg的利托菌素辅因子比活性。在一个更优选的实施方案中,所述组合物具有至少50mu/μg的利托菌素辅因子比活性。在一个更优选的实施方案中,所述组合物具有至少60mu/μg的利托菌素辅因子比活性。在一个更优选的实施方案中,所述组合物具有至少70mu/μg的利托菌素辅因子比活性。在一个更优选的实施方案中,所述组合物具有至少80mu/μg的利托菌素辅因子比活性。在上述组合物的一个实施方案中,所述组合物中的至少10%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在一个具体实施方案中,至少15%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少20%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少25%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在另一个具体实施方案中,至少30%的rvwf是以超过10个二聚体的高分子量vwf多聚体的形式存在。在上述组合物的一个实施方案中,所述组合物包含培养物上清液。在一个具体实施方案中,所述培养物上清液为哺乳动物细胞培养物上清液。在一个更具体的实施方案中,哺乳动物细胞培养物上清液为cho细胞上清液。在上述组合物的一个实施方案中,在包含至少2.4μg/l铜的细胞培养物中表达rvwf。在一个具体实施方案中,所述细胞培养物包含至少4μg/l铜。在一个更具体的实施方案中,所述培养物包含2.4μg/l至20μg/l铜。在一个实施方案中,所述铜以铜盐、铜螯合物或它们的组合的形式提供。在一个具体实施方案中,所述铜盐选自:硫酸铜、醋酸铜、碳酸铜、氯化铜、氢氧化铜、硝酸铜和氧化铜。在上述组合物的一个实施方案中,所述细胞培养是分批培养。在上述组合物的一个实施方案中,所述细胞培养是连续培养。在一个具体实施方案中,所述连续培养以恒化模式进行。在另一个具体实施方案中,所述连续培养以灌注模式进行。在上述组合物的一个实施方案中,所述培养物中nh4+的水平维持在低于4mm的浓度。在上述组合物的一个实施方案中,所述培养物的细胞密度维持在小于2.5x106个细胞/ml。在上述组合物的一个实施方案中,所述培养物的细胞密度维持在小于2.0x106个细胞/ml。在上述组合物的一个实施方案中,所述培养物维持在小于1.5×106个细胞/毫升。在上述组合物的一个实施方案中,rvwf与重组因子viii(rfviii)共表达。在一个具体实施方案中,已经除去大部分共表达的rfviii。在一个更具体的实施方案中,所述组合物中rvwf与rfviii之比为至少10:1。在上述组合物的一个实施方案中,所述组合物配制成用于药物给药。在一个具体实施方案中,所述组合物配制成用于静脉内、皮下或肌肉内给药。在上述组合物的一个实施方案中,所述组合物经低压冻干。在另一个方面,本发明包括通过一种方法生产的高分子量重组vwf,所述方法包括下述步骤:a)提供细胞培养物;b)引入编码vwf的核酸序列;c)选择携带所述核酸序列的细胞;和d)在包含铜浓度为至少2.4μg/l的细胞培养基和铵浓度小于10mm的细胞培养物上清液的细胞培养条件下在细胞中表达vwf,其中所述vwf为包含约14至约22个二聚体和至少约30mu/μg的利托菌素比活性的高度多聚vwf。应当理解,上面在“细胞培养基”和“生产重组vwf的方法”部分中描述的所有实施方案和浓度均可适用于此处。本发明的重组vwf可以包括具有高比活性的高分子量重组vwf。在一个实施方案中,本发明的vwf为vwf的高度多聚形式。在一些实施方案中,vwf的高度多聚形式包括至少多达约14个二聚体,且在其它实施方案中,包括至少多达约22个二聚体。在其它实施方案中,vwf的高度多聚形式可在约10至约20个二聚体,或约15至约25个二聚体,或约20至约40个二聚体范围内。在某些实施方案中,重组vwf可与血浆vwf相当。如本文所述,本发明提供了下述惊人结果:细胞培养基中增加的铜浓度可生产具有高比活性的高分子量vwf。与无铜培养基相比,包含例如大于约2.4μg/l的铜浓度的细胞培养基可增加重组多聚vwf的产率。在某些实施方案中,多聚vwf(即包含至少2个二聚体的rvwf)的百分比可以大于约50%、或大于约75%、或大于约90%。使用标准技术,诸如在非还原条件下在琼脂糖电泳中,可以分析vwf的多聚体分布。如本文中提供的,通过本发明方法生产的重组vwf可以具有高比活性,例如高利托菌素辅因子比活性。在一个实施方案中,通过本发明方法生产的重组vwf可以具有至少30mu/μg的利托菌素辅因子比活性,且在另一个实施方案中,至少50mu/μg。在其它实施方案中,利托菌素辅因子比活性可在约30mu/μg至约100mu/μg、或约50mu/μg至约100mu/μg范围内。b.重组adamts13(ra13)adamts蛋白(即adamts-1至adamts-20)为分泌型锌金属蛋白酶家族,该家族享有共同的模块结构域组构(关于综述,参见,flanneryc.r.,frontbiosci.2006jan1;11:544-69)。所有adamts蛋白均享有共同的核心结构域体系结构,该体系结构由信号肽、接着前结构域、锌依赖性的金属蛋白酶催化域、解聚素样结构域、i型凝血酶敏感蛋白重复、半胱氨酸富集结构域和间隔物结构域组成(aptes.s.,jbiolchem.2009nov13;284(46):31493-7)。另外,除了adamts-4以外的所有adamts蛋白均含有至少一个额外的i型凝血酶敏感蛋白重复结构域,且许多adamts蛋白含有一个或多个额外辅助结构域。值得注意的是,已经报道,所有adamts蛋白似乎均含有位于金属蛋白酶催化域内的至少1个钙结合位点和至少1个锌结合位点(andreini等人,j.proteomeres.,2005,4(3),第881-888页)。已经报导adamts蛋白对多种疾病和病症的生物学作用,所述疾病和病症包括抗血管生成、肾间质性纤维化、骨重塑、卵巢滤泡生成、动脉粥样硬化、泌尿生殖器发育和肿瘤生长/重塑(adamts-1);7c型ehler–danlos综合征和牛皮肤脆裂症(bovinedermatopraxis)(adamts-2);关节炎、动脉粥样硬化和肌腱病(adamts-4);关节炎和胶质母细胞瘤(adamts-5);关节炎(adamts-7);抗血管生成、脑恶性肿瘤、关节炎和动脉粥样硬化(adamts-8);关节炎(adamts-9、adamts-12);血栓性血小板减少性紫癜(adamts-13);和抗血栓形成/中风(adamts18)(关于综述,参见,lin和liu,openaccessrheumatologyresearchandreviews2009:1121–131)。先前已在哺乳动物细胞中表达重组adamts13(a13),然而比活性随细胞培养条件而广泛变化。已经发现,许多商购可得的培养基不足以表达具有高比活性的ra13,比活性表示为活性(通过frets-vwf73测定法测量)与抗原含量(通过elisa确定)的比率。在一个方面,本文中提供的方法是基于若干有利发现,所述发现允许细胞培养物表达具有增加的总活性和比活性水平的ra13。因此,由于分泌型金属蛋白酶的adamts家族之间共享的结构功能关系,本发明提供的方法使所有adamts蛋白均可在细胞培养物中表达并从细胞培养基回收。在一个方面,本发明提供了一种包含重组adamts13(ra13)的组合物,所述重组adamts13(ra13)具有至少1600mu/μg的frets-vwf比活性。在上述组合物的一个实施方案中,所述ra13具有至少800mu/μg的frets-vwf比活性。在上述组合物的一个实施方案中,所述组合物包含培养物上清液。在一个具体实施方案中,所述培养物上清液为哺乳动物细胞培养物上清液。在一个更具体的实施方案中,哺乳动物细胞培养物上清液为cho细胞上清液。在上述组合物的一个实施方案中,在包含至少1μg/l铜的细胞培养物中表达ra13。在一个具体实施方案中,所述细胞培养物包含至少2μg/l铜。在一个更具体的实施方案中,所述培养物包含2μg/l至20μg/l铜。在上述组合物的一个实施方案中,所述铜以铜盐、铜螯合物或它们的组合的形式提供。在一个具体实施方案中,所述铜盐选自:硫酸铜、醋酸铜、碳酸铜、氯化铜、氢氧化铜、硝酸铜和氧化铜。在上述组合物的一个实施方案中,所述细胞培养是分批培养。在上述组合物的一个实施方案中,所述细胞培养是连续培养。在一个具体实施方案中,所述连续培养以恒化模式进行。在另一个具体实施方案中,所述连续培养以灌注模式进行。在上述组合物的一个实施方案中,所述培养物中nh4+的水平维持在低于5mm的浓度。在上述组合物的一个实施方案中,所述培养物中nh4+的水平维持在低于4mm的浓度。在上述组合物的一个实施方案中,所述培养物的细胞密度维持在小于4.0x106个细胞/ml。在一个具体实施方案中,所述培养物的细胞密度维持在小于3.0x106个细胞/ml。在一个具体实施方案中,所述培养物的细胞密度维持在小于2.0x106个细胞/ml。在一个更具体的实施方案中,所述培养物的细胞密度维持在小于1.5x106个细胞/ml。在上述组合物的一个实施方案中,所述组合物配制成用于药物给药。在一个具体实施方案中,所述组合物配制成用于静脉内、皮下或肌肉内给药。在上述组合物的一个实施方案中,所述组合物经低压冻干。vi.制剂在一个方面,包含本发明的重组治疗性蛋白rvwf或ra13的制剂在施用前经低压冻干。使用本领域中的常用技术进行低压冻干,且应针对研发的组合物优化[tang等人,pharmres.21:191-200,(2004)和chang等人,pharmres.13:243-9(1996)]。制备药物制剂的方法可以包括以下步骤中的一个或多个:在低压冻干前,向所述混合物中添加本文所述的稳定剂;在低压冻干前,向所述混合物中添加至少一种选自填充剂、渗量调节剂和表面活性剂(各如本文所述)的试剂。在一个方面,低压冻干制剂至少包含缓冲剂、填充剂和稳定剂中的一种或多种。在该方面,评价表面活性剂的效用,且在低压冻干步骤期间或重构期间凝集造成问题的情况下选择使用。包括适当的缓冲剂,以使制剂在低压冻干期间维持在稳定的ph区域内。低压冻干物质的标准重构实践是,加回一定体积的纯水或无菌注射用水(wfi)(通常等于低压冻干期间除去的体积),不过在用于肠胃外施用的药物的生产中有时使用稀抗菌剂溶液[chen,drugdevelopmentandindustrialpharmacy,18:1311-1354(1992)]。因此,提供了用于制备重构的重组vwf组合物的方法,所述方法包括向本发明的低压冻干的重组vwf组合物中添加稀释剂的步骤。低压冻干的物质可重构为水溶液。可使用多种水性载体,例如无菌注射用水、用于多次给药用途的含防腐剂的水,或含适量表面活性剂的水(例如,含有与赋形剂混合的活性化合物的水性悬浮液,所述赋形剂适用于制造水性悬浮液)。在不同的方面,这样的赋形剂是助悬剂,例如且不限于羧甲基纤维素钠、甲基纤维素、羟丙甲基纤维素、海藻酸钠、聚乙烯吡咯烷酮、黄蓍树胶和金合欢树胶;分散剂或润湿剂是天然存在的磷脂,例如且不限于卵磷脂,或环氧烷烃与脂肪酸的缩合产物,例如且不限于聚氧乙烯硬脂酸酯,或环氧乙烷与长链脂族醇的缩合产物,例如且不限于十七乙烯氧基鲸蜡醇(heptadecaethyleneoxycetanol),或环氧乙烷与源自脂肪酸和己糖醇的偏酯的缩合产物,诸如聚氧乙烯山梨醇单油酸酯,或环氧乙烷与源自脂肪酸和己糖醇酸酐的偏酯的缩合产物,例如且不限于聚乙烯脱水山梨糖醇单油酸酯。在不同的方面,水性悬浮液也含有一种或多种防腐剂,例如且不限于对羟基苯甲酸乙酯或对羟基苯甲酸正丙酯。为了给人或试验动物施用组合物,在一个方面,所述组合物包含一种或多种药学上可接受的载体。短语“药学上”或“药理学上”可接受的表示这样的分子实体和组合物:当使用如下文描述的本领域中熟知的途径施用时,其是稳定的,会抑制蛋白降解(诸如聚集)和切割产物,且此外不产生变应性反应或其它不良反应。“药学上可接受的载体”包括任何和所有临床上有用的溶剂、分散介质、包衣剂、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等,包括上文公开的那些试剂。静脉内地、口服地、局部地、透皮地、肠胃外地、通过吸入喷雾、阴道地、直肠地或通过颅内注射,施用药物制剂。本文使用的术语“肠胃外”包括皮下注射、静脉内的、肌肉内的、脑池内的注射或输注技术。也预见到通过静脉内、皮内、肌肉内、乳房内、腹膜内、鞘内、眼球后、肺内注射和/或在特定部位处的外科手术植入来施用。通常,组合物基本上不含热原以及可能对受体有害的其它杂质。以治疗医师选择的剂量水平和模式,进行组合物的单次或多次施用。对于疾病的预防或治疗,适当的剂量取决于所治疗疾病的类型、疾病的严重性和病程、施用药物是为了预防目的还是治疗目的、先前的治疗、患者临床史和对药物的反应以及主治医师的判断。在一个方面,通过最初快速推注(bolus)接着连续输注来施用本发明制剂,以维持药物产品的治疗循环水平。作为另一个实例,本发明的化合物以单次剂量施用。本领域普通技术人员将易于优化有效剂量和施用方案,这根据优良医疗实践和个别患者的临床病状确定。给药频率取决于药剂的药代动力学参数和施用途径。由本领域技术人员根据施用途径和所需剂量确定最佳药物制剂。参见例如,remington'spharmaceuticalsciences,第18版(1990,mackpublishingco.,easton,pa.18042)第1435-1712页,其公开内容通过引用并入本文中。这样的制剂影响所施用的药剂的物理状态、稳定性、体内释放速率和体内清除速率。取决于施用途径,根据体重、体表面积或器官大小计算合适的剂量。通过使用用于测定血液水平剂量的经确立的测定法,结合适当的剂量-反应数据,可以确定适当的剂量。最终剂量方案由主治医师考虑改变药物作用的多种因素来确定,所述因素例如:药物的比活性,损伤的严重性和患者的反应,患者的年龄、病状、体重、性别和饮食,任何感染的严重性,施用时间及其它临床因素。作为实例,本发明的重组vwf的典型剂量为约50u/kg,等于500μg/kg。随着研究的进行,将出现关于治疗各种疾病和病症的适当剂量水平和持续时间的其它信息。vii.治疗方法本发明另外预见到治疗患者的方法,所述患者需要根据本文所述的方法生产的rvwf或ra13。这样的治疗方法可以包括:施用包含本发明的重组ra13或高分子量重组vwf的药物制剂。在另一个方面,本发明提供了用于治疗性或预防性处理的方法,所述方法包括:施用本文中提供的rvwf或ra13组合物。通常,对于治疗性应用,以“治疗有效剂量”将制剂施用给受试者,所述受试者具有与adamts13或vwf功能障碍有关的疾病或病症或以其它方式有此需要。对于这些用途而言有效的制剂和量,将取决于疾病或病症的严重性和患者的一般健康状况。根据患者所需的和耐受的剂量和频率,可以单次或多次施用制剂。在一个实施方案中,本发明提供了治疗或预防与adamts13或vwf功能障碍有关的疾病或病症的方法。在另一个实施方案中,可以施用包含重组vwf的药物制剂以治疗与vwf有关的疾病,诸如vonwillebrand氏病或血友病。在另一个实施方案中,本发明提供了治疗或预防与一个或多个血栓的形成和/或存在有关的疾病或病症的方法,所述方法包括:施用本文中提供的ra13组合物。在另一个实施方案中,本发明提供了使有此需要的受试者中的一个或多个血栓崩解的方法。在其它实施方案中,本发明提供了治疗或预防有此需要的受试者的梗塞的方法。通常,本发明提供的方法包括:给有此需要的受试者施用本文中提供的radamts13组合物。与一个或多个血栓的形成和/或存在有关的障碍的非限制性实例是:遗传性血栓性血小板减少性紫癜(ttp)、获得性ttp、动脉血栓形成、急性心肌梗塞(ami)、中风、脓毒症和弥漫性血管内凝血(dic)。与梗塞有关的障碍的非限制性实例包括,但不限于:心肌梗塞(心脏病发作)、肺栓塞、脑血管事件(诸如中风)、周围动脉阻塞性疾病(诸如坏疽)、抗磷脂综合征、脓毒症、巨细胞动脉炎(gca)、疝气和肠扭转。viii.实施例现将在以下实施例中进一步说明本发明,本发明不限于这些实施例。实施例1使用表达vwf的重组cho细胞系的培养物,进行连续细胞培养实验。基础培养基是dmem/f12,其含有约0.3μg/l的cu2+。给该培养基补充大豆水解物和硫酸铜(cuso4·5h2o),使得培养基中的最终铜浓度大于至少2.4μg/l。通过连续细胞培养,培养表达vwf的重组cho细胞,使得铵水平(nh4+)保持在小于约10mm的浓度。经发现,提供连续供应的培养基的生产系统(例如灌注或恒化培养)为优选,因为常规分批或补料分批技术在培养结束时会产生高nh4+浓度。在培养结束时,分离高度多聚的vwf,并测量vwf的利托菌素辅因子比活性。实施例2在gd8/6细胞的分批培养物中共表达重组因子viii(rfviii)和vonwillebrand因子(rvwf),以确定培养基的组成对vwf表达和活性的影响。简而言之,在补充和未补充额外铜的情况下,在由改良的dmem/f12基本粉末(表5)和也含有4g/l大豆水解物的其它补充物(参见表6)构成的bav-sp培养基中分批培养gd8/6细胞。为测试低铜浓度对rvwf表达和活性的影响,使用基础bav-sp培养基。基础培养基含有0.3μg/l铜,且补充了大豆水解物(其贡献额外的0.7μg/l铜,如以实验方式测定),使得最终铜浓度为1.0μg/l。作为比较,给用于分批培养的bav-sp培养基进一步补充额外的3.3μg/l的cu2+,使得最终铜浓度为4.3μg/l,以确定高铜浓度对vwf表达和活性的影响。表5.bav-sp培养基的组成表6.bav-sp补充物的组成最终制剂的组分l-谷氨酰胺600.00乙醇胺1.530synperonicf68250.000碳酸氢钠(nahco3)2000.000大豆蛋白胨4000.00总制剂18596.8在低铜培养基(表7)或高铜培养基(表8)中培养表达rvwf的gd8/6细胞7天。2天后,对培养物进行传代培养,以进行为期5天的分批培养。通过利托菌素辅因子测定法,每天测试培养物上清液样品的rvwf含量(vwfelisa)、总活性(利托菌素)和比活(比活性)。还每天(除分批培养第3天和第4天外)监测各种培养物参数,包括细胞计数、细胞活力和铵浓度。意外地,在高铜浓度下培养的细胞培养物生产含有显著更高rvwf总活性和rvwf比活性的上清液(比较结果在表7和表8中)。例如,在分批培养第4天,与低铜培养物的0.2iurvwf活性/ml相比,在高铜浓度下培养的细胞培养物含有1.52iurvwf活性/ml。这与低铜细胞培养物生产的rvwf量几乎是高铜细胞培养物的2倍的事实无关。此外,从高铜培养物获得的上清液的比活性是低铜培养物上清液的比活性的13倍(831mu/10μgrvwf相对于62mu/10μgrvwf)。如表7和表8中所示,在分批培养第1天,高铜培养物的利托菌素辅因子总活性和比活性是低铜培养物的2倍。此外,与高铜培养物中观测到的活性随后增加相反,在分批培养第1天以后,在低铜细胞培养物中未发现利托菌素辅因子活性量的增加。与此结果相一致,rvwf多聚体状态的琼脂糖凝胶电泳分析表明,在分批培养第1天,低铜细胞培养物的上清液中存在低浓度的高分子量rvwf(相对于低分子量rvwf物质的浓度),且所述相对浓度随时间进一步降低(图1a和1b)。相反,给培养基补充cu2+会导致一致地形成利托菌素辅因子(ricof)活性抗原至第4天。一致地,至分批培养的第4天,稳定的高分子量rvwf多聚体的量没有损失(图1a和1b)。在图1b中显示的琼脂糖电泳凝胶的密度测定结果表明,在低铜条件下,所述培养物仅能在分批培养的1天内生产rvwf群体(即图1a的琼脂糖凝胶的泳道2中的“第3天”样品),其中超过10%(即16.3%)的rvwf以具有超过10个二聚体的分子形式存在,值得注意的是,该群体在分批培养培养第5天降至仅4%(泳道6中的“第7天”样品)。相反,在高铜条件下,至分批培养第4天,具有超过10个二聚体的vwf多聚体的相对量一致地为约30%(在泳道7-10中的“第3天”至“第6天”;28%至31.4%)。值得注意的是,在高铜分批培养的第5天开始,当nh4+水平超过100mg/l(大于约5.0mm)时,额外抗原(18.3至35.4μg/l;比较表8的分批培养第4天与第5天)的表达未引起上清液中存在的ricof活性的伴随增加。与此结果相一致,相对于低分子量rvwf多聚体的浓度,在分批培养第5天(培养第7天)时高分子量rvwf多聚体的水平降低。也仅在分批培养第5天(泳道11中的培养物的“第7天”样品),具有超过10个二聚体的vwf的相对量降至21.4%。总之,以上提供的数据表明,给表达rvwf的细胞培养物补充铜浓度,可显著增加rvwf利托菌素辅因子总活性和比活性,以及稳定地生产高分子量rvwf多聚体。此外,数据显示出高nh4+浓度在细胞培养物中的存在与rvwf利托菌素辅因子活性损失和高分子量rvwf多聚体产量降低之间的相关性。表7.使用含有低铜浓度(1.0μg/l)的bav-sp培养基以分批模式进行的哺乳动物细胞培养物中的rvwf的表达表8.使用含有高铜浓度(4.3μg/l)的bav-sp培养基以分批模式进行的哺乳动物细胞培养物中的rvwf的表达实施例3在恒化条件下操作的gd8/6细胞的连续培养物中共表达重组因子viii(rfviii)和vonwillebrand因子(rvwf),以确定培养基的组成对vwf表达和活性的影响。简而言之,在实施例2所述的补充铜和未补充铜的情况下,在含有4g/l的大豆水解物的bav-sp培养基中培养gd8/6细胞。为了测试低铜浓度对rvwf表达和活性的影响,使用基础bav-sp培养基。所述基础培养基含有0.3μg/l铜,且补充了大豆水解物(其贡献额外0.7μg/l铜),使得最终铜浓度为1.0μg/l。作为比较,向用于分批培养的bav-sp培养基中进一步补充额外的3.3μg/l的cu2+,使得最终铜浓度为4.3μg/l,以确定高铜浓度对vwf表达和活性的影响。在高(2.8x106个细胞/ml)和低(约1.4x106个细胞/ml)细胞密度下,培养在有高和低铜浓度存在下生长的培养物。同前面一样,经由利托菌素辅因子测定法,测试培养物上清液样品的rvwf含量(vwfelisa)、总活性(利托菌素)和比活(比活性)。也监测多种培养物参数,包括细胞计数、细胞活力和铵浓度。从恒化培养的第2周和第3周稳态阶段,获得数据(表9至表13)。表9.在第2周和第3周期间恒化细胞培养物中的rvwf表达的平均数据表10.在第2周和第3周期间在高细胞计数、低铜条件下的恒化细胞培养物中的rvwf表达表11.在第2周和第3周期间在高细胞计数、高铜条件下的恒化细胞培养物中的rvwf表达表12.在第2周和第3周期间在低细胞计数、低铜条件下的恒化细胞培养物中的rvwf表达表13.在第2周和第3周期间在低细胞计数、高铜条件下的恒化细胞培养物中的rvwf表达如图2a所示,从在低细胞密度和高铜浓度下生长的连续rvwf细胞培养物收获的上清液含有高比活性(平均值为600mu/10μg),而从下述培养物收获的上清液含有低比活性(小于100mu/10μg):在高或低铜浓度下以高细胞密度生长的rvwf细胞培养物,和在低铜浓度下以低细胞密度生长的rvwf细胞培养物。与分批培养的观测结果相一致,图2b表明,表达具有高比活性的rvwf的连续哺乳动物细胞培养物的nh4+浓度低于生产具有低比活性的rvwf的培养物。该数据进一步强化了细胞培养物中的nh4+浓度与培养物生产的rvwf的比活性之间的相关性。值得注意的是,细胞培养物中的高铜浓度与低铵浓度的组合,可显著提高rvwf活性。与此结果相一致,恒化培养物的rvwf多聚体状态的琼脂糖凝胶电泳分析(图6)表明,仅来自在高铜和低细胞密度下且因此在低铵浓度下操作的培养物的上清液一致地表达高度多聚的vwf(在cst第8、17和24天时约23%至27%,分别在泳道4、8和12中)。所有其它条件均未在长时间培养期内一致地获得超过10%的高量的具有超过10个二聚体的vwf。实施例4为了确定培养基铜浓度对ra13的表达和比活性的影响,在adamts13培养基中在恒化连续培养条件下培养表达ra13的哺乳动物细胞培养物4周,所述adamts13培养基包含改良的dmem/f12基础培养基besp845和额外的补充物,所述补充物含有在0.66μg/l(无额外铜补充)至额外铜补充至4μg/l范围内的铜浓度(表14)。如表15中所示,增加细胞培养基中的铜浓度,会引起体积生产率(p)和比生产率(q)的显著增加,所述体积生产率和比生产率分别表示为:每升培养物每天生产的总ra13活性,和每个细胞每天生产的总ra13活性。表14.adamts13培养基的组成为了确定增加的铜浓度是否影响表达的ra13的完整性,通过sds-page分析,检查从在含有0.66μg/l、1μg/l和4μg/l铜的培养基中生长的ra13细胞培养物收获的上清液。如图3a(银染色)和图3b(抗-a13蛋白印迹)所示,通过凝胶电泳未观察到产物质量的明显变化。具体地,在有增加的铜浓度存在下,截短的170kd或其它低分子量ra13变体的水平未增加,且ra13表达未造成其它额外的或增加的hcp带。为了估计对ra13活性而言的最佳铜浓度,来自表15的pfrets相对于铜浓度的数据的外推(图4)表明,可能在约2μg/l处达到最佳效果,且保守估计在高于约4μg/l时出现负面效应。表15.使用含有不同铜浓度的培养基以恒化连续培养模式进行的哺乳动物细胞培养物中的ra13的表达基于以上所得结果,进行另一个实验,该实验比较含有0.66μg/l铜的细胞培养基中ra13的表达与含有2.0μg/l铜的细胞培养基中ra13的表达。如表16所示,给基础细胞培养基补充铜至2.0μg/l铜的终浓度,会在8周时间内引起体积生产率(p)和比生产率(q)的显著增加,所述体积生产率和比生产率分别表示为:每升培养物每天生产的总ra13活性,和每个细胞每天生产的总ra13活性。两种培养物中每周的ra13生产的具体数据显示在图5中。从这些数据可见,铜补充对细胞代谢、比生长速率和ra13生产率具有可测量的有益效果。表16.使用含有不同铜浓度的培养基以恒化连续培养模式进行的哺乳动物细胞培养物中的ra13的表达应当理解,本文所述的实施例和实施方案仅用于例证目的,并且本领域技术人员将根据它们进行各种修改或变化,这些修改或变化应当被包括在本申请的精神和范围内以及所附权利要求书的范围内。在本文中引用的所有出版物、专利和专利申请均出于所有目的以全文引用的方式并入本文中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1