螯合PSMA抑制剂的制作方法
该申请得到了美国国立卫生研究院授予的第hhsn261201500074c号合同的支持。美国政府对本发明享有一定的权利。发明背景本发明涉及对前列腺特异性膜抗原(psma)具有高亲和力和特异性的小分子,以及将它们用于诊断和治疗目的的方法。
背景技术:
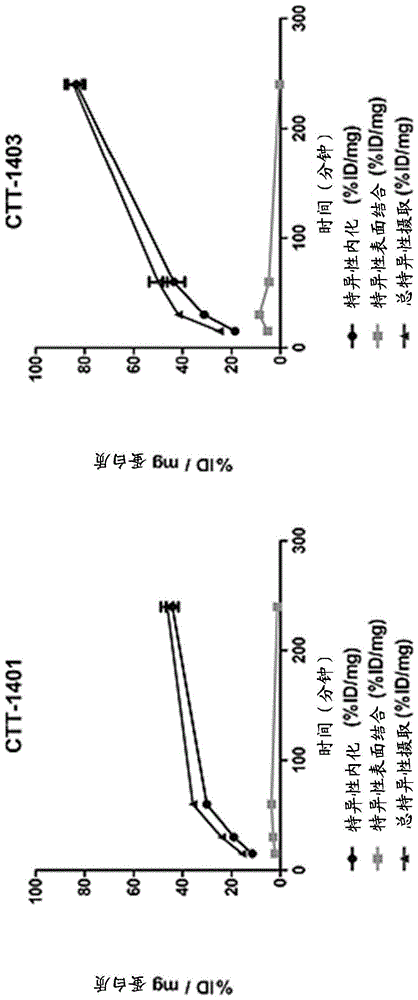
:前列腺特异性膜抗原(psma)在前列腺癌细胞表面以及各种实体瘤的新生血管系统中独特地过表达。因此,psma作为检测和控制前列腺癌的临床生物标志物已引起关注。通常,这些方法利用特异性靶向psma的抗体来指引成像剂或治疗剂。例如,已被fda批准用于检测和成像前列腺癌的prostascint(cytogen,philadelphia,pa)利用抗体递送螯合的放射性同位素(铟-111)。然而,现在认识到prostascint技术仅限于检测死细胞,因此其临床相关性值得怀疑。使用抗体进行癌症诊断和治疗的成功受到诸如免疫原性和血管通透性差等挑战的限制。另外,与细胞表面靶标结合的大抗体呈现为其它抗体在相邻细胞表面位点的后续结合的障碍,导致细胞表面标记减少。除了作为递送诊断或治疗剂的抗体的细胞表面靶标之外,psma的一个很大程度上被忽视和独特的特性是其酶活性。也就是说,psma能够识别和处理像二肽一样小的分子。尽管存在这种性质,但在开发新的诊断和治疗策略方面,它基本上尚未被开发。文献中有一些最近的实例描述了使用标记的psma小分子抑制剂检测前列腺癌细胞的结果。某些氨基磷酸酯和磷酸酯psma抑制剂已描述于第7,696,185号、第8,293,725号、第re42,275号美国专利以及第us-2014-0241985-a1号和第us-2016-0030605-a1号美国专利申请公开中。技术实现要素:本文提供了前列腺癌的成像诊断和治疗,其利用小分子抑制剂对psma的效力和特异性亲和力。诊断剂可用于监测和分类患者以用适当的治疗剂治疗。因此,在一个方面,本公开提供了式(i*)的化合物或其药学上可接受的盐,其中l1和l2独立地为二价连接基团;r是螯合剂,其任选地螯合治疗性放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素;每个r1和r2独立地为氢、c1-c6烷基或保护基团;和x是白蛋白结合部分。在另一方面,本公开提供了式(i)的化合物或其药学上可接受的盐,其中l1和l2独立地为二价连接基团;r是螯合剂,其任选地螯合治疗性放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素;和每个r1和r2独立地为氢、c1-c6烷基或保护基团。在另一方面,本公开提供了药物组合物,其包含前述方面的化合物和药学上可接受的载体。在另一方面,本公开提供了用于对患者的一个或多个前列腺癌细胞或肿瘤相关血管系成像的方法,包括向患者施用前述方面中任一方面的化合物或药物组合物。本申请中所述的所有可公开获得的文献在其教导与本公开不矛盾的程度上通过引用整体并入本文。附图说明图1显示了ctt1403在pc3-psma阳性细胞中的摄取。通过从未阻断细胞的摄取中减去用2-pmpa作为阻断剂预培养的pc3-psma阳性细胞中的摄取来确定特异性摄取。图2显示了通过每克组织的放射性测定的在携带pc3-pip和pc3-wt肿瘤的小鼠中在4和24h时的ctt1403的生物分布。图3显示了ctt1403(9只动物)相比于对照物(7只动物)在携带psma阳性(psma+)人肿瘤异种移植物的小鼠中的治疗效力。小鼠在起始肿瘤体积达到10-20mm3时接受注射。图4显示了ctt1403(实验1和2的比较)相比于对照物在携带psma+人肿瘤异种移植物的小鼠中的治疗效力。小鼠在起始肿瘤体积达到10-20mm3时接受注射。图5显示了图4的放大比例。ctt1403(2组实验)相比于对照物在携带psma+人肿瘤异种移植物的小鼠中的治疗效力。图6显示了用ctt1403治疗的小鼠的kaplanmeier生存图。与未经治疗的对照小鼠(17只动物)相比,重复治疗(8只动物)实验(截至实验的第42天)的比较。肿瘤植入后的对照物的中位生存时间为42天,实验1的ctt1403组的中位生存时间为55天。这表示生存率分别提高了14%和31%。截至实验的第42天,实验2的ctt1403治疗组没有动物牺牲。具体实施方式在一个方面,本公开提供了可用作前列腺癌的pet成像诊断剂和放射治疗剂的化合物,其利用小分子抑制剂对psma的效力和特异性亲和力。在第一方面的实施方式1*中,化合物具有结构式(i*)或其药学上可接受的盐,其中l1和l2独立地为二价连接基团;r是螯合剂,其任选地螯合治疗性放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素;每个r1和r2独立地为氢、c1-c6烷基或保护基团;和x是白蛋白结合部分。可用于本发明化合物和方法的许多白蛋白结合部分是本领域已知的,包括例如以下公开和提及的部分(每个部分通过引用并入本文):ghumanetal.,“structuralbasisofthedrug-bindingspecificityofhumanserumalbumin,”journalofmolecularbiology,353(1),14october2005,38-52;carter,d.c.andho,j.x.(1994)“structureofserumalbumin,”adv.proteinchem.,45,153–203;curry,s.(2009)“lessonsfromthecrystallographicanalysisofsmallmoleculebindingtohumanserumalbumin,”drugmetab.pharmacokinet.,24,342–357;kratochwil,n.a.etal.(2002)“predictingplasmaproteinbindingofdrugs:anewapproach,”biochem.pharmacol.,64,1355–1374;zsilaetal.(2011)“evaluationofdrug–humanserumalbuminbindinginteractionswithsupportvectormachineaidedonlineautomateddocking,”bioimformatics27(13),1806-1813;elsadeketal.,jcontrolrelease.,“impactofalbuminondrugdelivery--newapplicationsonthehorizon,”2012jan10;157(1):4-28;nematietal.,“assessmentofbindingaffinitybetweendrugsandhumanserumalbuminusingnanoporousanodicaluminaphotoniccrystals,”analchem.2016jun7;88(11):5971-80;larsen,m.t.etal.,“albumin-baseddrugdelivery:harnessingnaturetocuredisease,”molcell.ther.,2016,feb27;4:3;howard,k.a.,“albumin:thenext-generationdeliverytechnology,”ther.deliv.,2015,mar;6(3):265-8;sleepd.etal.,“albuminasaversatileplatformfordrughalf-lifeextension,”biochim.biophys.acta.,2013,dec;1830(12):5526-34;sleep,d.,“albuminanditsapplicationindrugdelivery,”expertopin.drugdeliv.,2015,may;12(5):793-812;qi,jetal.,“multidrugdeliverysystemsbasedonhumanserumalbuminforcombinationtherapywiththreeanticanceragents,”mol.pharm.,2016,aug8.,articleasapepubaheadofprint;karimim.etal.,“albuminnanostructuresasadvanceddrugdeliverysystems,”expertopin.drugdeliv.,2016,jun3:1-15,articleasapepubaheadofprint;gou,y.etal.,“developinganticancercopper(ii)pro-drugsbasedonthenatureofcancercellsandthehumanserumalbumincarrieriiasubdomain,”mol.pharm.,2015,oct5;12(10):3597-609;yang,f.etal.,“interactiveassociationsofdrug-druganddrug-drug-drugwithiiasubdomainofhumanserumalbumin,”mol.pharm.,2012,nov5;9(11):3259-65;agudelo,d.etal.,“anoverviewonthedeliveryofantitumordrugdoxorubicinbycarrierproteins,”int.j.biol.macromol.,2016,jul;88:354-60;durandin,n.a.etal.,“quantitativeparametersofcomplexesoftris(1-alkylindol-3-yl)methyliumsaltswithserumalbumin:relevanceforthedesignofdrugcandidates,”j.photochem.photobiol.b.,2016,jul18;162:570-576;khodaei,a.etal.,“interactionsbetweensirolimusandanti-inflammatorydrugs:competitivebindingforhumanserumalbumin,”adv.pharm.bull.,2016,jun;6(2):227-33;gokara,m.etal.,“unravellingthebindingmechanismandproteinstabilityofhumanserumalbuminwhileinteractingwithnefopamanalogues:abiophysicalandinsilcoapproach,”j.biomol.struct.dyn.,2016,jul25:1-44;zhang,h.etal.,“affinityofmiriplatintohumanserumalbuminanditseffectonproteinstructureandstability,”int.j.biol.macromol.,2016,jul22;92:593-599;bijelic,a.etal.,“x-raystructureanalysisofindazoliumtrans-[tetrachlorobis(1h-indazole)ruthenate(iii)](kp1019)boundtohumanserumalbuminrevealstworutheniumbindingsitesandprovidesinsightsintothedrugbindingmechanism,”j.med.chem.,2016,jun23;59(12):5894-903;fasano,m.etal.,“theextraordinaryligandbindingpropertiesofhumanserumalbumin,”life,57(12):787–796。白蛋白结合也用于许多已知药物,诸如华法林、劳拉西泮和布洛芬。在根据本发明的一些实施方式中,x是在该第一方面的实施方式i1中,化合物具有结构式(i):或其药学上可接受的盐,其中l1和l2独立地为二价连接基团;r是螯合剂,其任选地螯合治疗性放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素;和每个r1和r2独立地为氢、c1-c6烷基或保护基团。二价连接基团包括式-(c0-c10烷基-q)0-1-c0-c10烷基-的基团,其中q是化学键、芳基(例如,苯基)、杂芳基、c3-c8环烷基或杂环基;且每个烷基基团中不多于一个亚甲基任选地和独立地被如下取代:-o-、-s-、-n(r00)-、-c(h)=c(h)-、-c≡c-、-c(o)-、-s(o)-、-s(o)2-、-p(o)(or00)-、-op(o)(or00)-、-p(o)(or00)o-、-n(r00)p(o)(or00)-、-p(o)(or00)n(r00)-、-op(o)(or00)o-、-op(o)(or00)n(r00)-、-n(r00)p(o)(or00)o-、-n(r00)p(o)(or00)n(r00)-、-c(o)o-、-c(o)n(r00)-、-oc(o)-、-n(r00)c(o)-、-s(o)o-、-os(o)-、-s(o)n(r00)-、-n(r00)s(o)-、-s(o)2o-、-os(o)2-、-s(o)2n(r00)-、-n(r00)s(o)2-、-oc(o)o-、-oc(o)n(r00)-、-n(r00)c(o)o-、-n(r00)c(o)n(r00)-、-os(o)o-、-os(o)n(r00)-、-n(r00)s(o)o-、-n(r00)s(o)n(r00)-、-os(o)2o-、-os(o)2n(r00)-、-n(r00)s(o)2o-或-n(r00)s(o)2n(r00)-,其中每个r00独立地是氢或c1-c6烷基。在其它实施方式中,二价连接基团选自下式基团之一,其中在每种情况下,*-端与螯合剂连接:(a)*-(och2ch2)n-,其中n是1–20(例如,4–12,或4,或8,或12);(b)-(c(o)-(ch2)0-1-ch(r1)n(r2))m-*,其中m是1-8;每个r1独立地是天然或非天然氨基酸的侧链(例如,每个r1独立地是氢、c1-c6烷基、芳基、杂芳基、芳基c1-c6烷基或杂芳基c1-c6烷基,其中烷基、芳基烷基和杂芳基烷基基团任选地被1、2、3、4或5个r11基团取代,其中每个r11独立地是卤基、氰基、-or12、-sr12、-n(r12)2、-c(o)or12、-c(o)n(r12)2、-n(r12)c(=nr12)n(r12)2或c1-c6烷基,其中每个r12独立地是氢或c1-c6烷基);每个r2独立地是氢或与同一残基中的r1共同形成杂环基(例如,具有五元环者);(c)-(c(o)(ch2)p-(c(o))0-1-nh)-*,其中p是1–30(例如,p是1-7)(例如,6-氨基己酸、-c(o)(ch2)5nh-*);(d)-(c(o)-(ch2)r-苯基-(g)0-1-(ch2)q-(c(o))0-1-nh)-*,其中g是-o-或-n(h)-,-r和q每个独立地是0–30(例如,0–20;或0–10,或0-6,或1-6)(例如,-(c(o)-苯基-n(h)(ch2)q-(c(o))0-1-nh)-*,其中q是1-6;或-(c(o)-(ch2)r-苯基-(ch2)q-nh)-*,其中r和q每个独立地是0-6;或苯基上的两个取代基是彼此对位的,诸如在4-氨基甲基苯甲酸中,其中r是0,且q是1;或如在4-氨基乙基苯甲酸中,其中r是0且q是2);或者(e)其中l2是-(ch2)tn(h)-*,其中t是1至30;且l3是#-(ch2)u-c(o)-、#-(ch2)u-z-y-c(o)-、#-c(o)-(ch2)u-c(o)-或#-c(o)-(ch2)u-z-y-c(o)-,其中l3的#端与上述二苯并环辛炔或三唑基连接;u是1至30;y是-(ch2)u-或**-ch2ch2-(och2ch2)n-,其中u是1至30;n是1–20(例如,4–12,或4,或8,或12);和**-端与z连接;和z是-c(o)o-、-c(o)n(r00)-、-oc(o)-、-n(r00)c(o)-、-s(o)2n(r00)-、-n(r00)s(o)2-、-oc(o)o-、-oc(o)n(r00)-、-n(r00)c(o)o-或-n(r00)c(o)n(r00)-,其中每个r00独立地是氢或c1-c6烷基;(f)其中l2是-(ch2)tn(h)-*,其中t是1至30;和l3是#-(ch2)u-c(o)-、#-(ch2)u-z-y-c(o)-、#-c(o)-(ch2)u-c(o)-或#-c(o)-(ch2)u-z-y-c(o)-,其中l3的#端与上述二苯并环辛炔或三唑基连接;u是1至30;y是-(ch2)u-或**-ch2ch2-(och2ch2)n-,其中u是1至30;n是1–20(例如,4–12,或4,或8,或12);和**-端与z连接;和z是-c(o)o-、-c(o)n(r00)-、-oc(o)-、-n(r00)c(o)-、-s(o)2n(r00)-、-n(r00)s(o)2-、-oc(o)o-、-oc(o)n(r00)-、-n(r00)c(o)o-或-n(r00)c(o)n(r00)-,其中每个r00独立地是氢或c1-c6烷基;(g)其中l2是-(ch2)tn(h)-*,其中t是1至30;和l3是#-(ch2)u-c(o)-、#-(ch2)u-z-y-c(o)-、#-c(o)-(ch2)u-c(o)-或#-c(o)-(ch2)u-z-y-c(o)-,其中l3的#端与上述二苯并环辛炔或三唑基连接;u是1至30;y是-(ch2)u-或**-ch2ch2-(och2ch2)n-,其中u是1至30;n是1–20(例如,4–12,或4,或8,或12);和**-端与z连接;和z是-c(o)o-、-c(o)n(r00)-、-oc(o)-、-n(r00)c(o)-、-s(o)2n(r00)-、-n(r00)s(o)2-、-oc(o)o-、-oc(o)n(r00)-、-n(r00)c(o)o-或-n(r00)c(o)n(r00)-,其中每个r00独立地是氢或c1-c6烷基;(h)其中l2是-(ch2)tn(h)-*,其中t是1至30;和l3是#-(ch2)u-c(o)-、#-(ch2)u-z-y-c(o)-、#-c(o)-(ch2)u-c(o)-或#-c(o)-(ch2)u-z-y-c(o)-,其中l3的#端与上述二苯并环辛炔或三唑基连接;u是1至30;y是-(ch2)u-或**-ch2ch2-(och2ch2)n-,其中u是1至30;n是1–20(例如,4–12,或4,或8,或12);和**-端与z连接;和z是-c(o)o-、-c(o)n(r00)-、-oc(o)-、-n(r00)c(o)-、-s(o)2n(r00)-、-n(r00)s(o)2-、-oc(o)o-、-oc(o)n(r00)-、-n(r00)c(o)o-或-n(r00)c(o)n(r00)-,其中每个r00独立地是氢或c1-c6烷基;(i)其中l2是-(ch2)tn(h)-*,其中t是1至30;和l3是#-(ch2)u-c(o)-、#-(ch2)u-z-y-c(o)-、#-c(o)-(ch2)u-c(o)-或#-c(o)-(ch2)u-z-y-c(o)-,其中l3的#端与上述二苯并环辛炔或三唑基连接,u是1至30;y是-(ch2)u-或**-ch2ch2-(och2ch2)n-,其中u是1至30;n是1–20(例如,4–12,或4,或8,或12);和**-端与z连接;和z是-c(o)o-、-c(o)n(r00)-、-oc(o)-、-n(r00)c(o)-、-s(o)2n(r00)-、-n(r00)s(o)2-、-oc(o)o-、-oc(o)n(r00)-、-n(r00)c(o)o-或-n(r00)c(o)n(r00)-,其中每个r00独立地是氢或c1-c6烷基;(j)其中l2是-(ch2)tn(h)-*,其中t是1至30;和l3是#-(ch2)u-c(o)-、#-(ch2)u-z-y-c(o)-、#-c(o)-(ch2)u-c(o)-或#-c(o)-(ch2)u-z-y-c(o)-,其中l3的#端与上述二苯并环辛炔或三唑基连接;u是1至30;y是-(ch2)u-或**-ch2ch2-(och2ch2)n-,其中u是1至30;n是1–20(例如,4–12,或4,或8,或12);和**-端与z连接;和z是-c(o)o-、-c(o)n(r00)-、-oc(o)-、-n(r00)c(o)-、-s(o)2n(r00)-、-n(r00)s(o)2-、-oc(o)o-、-oc(o)n(r00)-、-n(r00)c(o)o-或-n(r00)c(o)n(r00)-,其中每个r00独立地是氢或c1-c6烷基;以及(k)前述的组合,其中在每种情况中,*-端与螯合剂连接,诸如:(i)-(ch2ch2o)n-(c(o)(ch2)p-(c(o))0-1-nh)-*,其中n和p如上述定义(例如,n是4且p是6);(ii)-(ch2ch2o)n-(c(o)-(ch2)0-1-ch(r1)n(r2))m-*,其中r1、r2、n和m如上述定义(例如,n是4且m是2);(iii)-(ch2ch2o)n-(c(o)-(ch2)r-苯基-(g)0-1-(ch2)q-(c(o))0-1-nh)-*,其中g、n、q和r如上述定义(例如,n是4,q是1,且r是0);(iv)-(c(o)-(ch2)0-1-ch(r1)n(r2))m-(c(o)(ch2)p-(c(o))0-1-nh)-*,其中r1、r2、m和p如上述定义(例如,m是2且p是6);(v)-(c(o)-(ch2)0-1-ch(r1)n(r2))m-(c(o)-(ch2)r-苯基-(g)0-1-(ch2)q-(c(o))0-1-nh)-*,其中g、r1、r2、m、q和r如上述定义(例如,m是2,q是1,且r是0;或m是2,q是2,和r是0);(vi)-(c(o)(ch2)p-(c(o))0-1-nh)-(c(o)-(ch2)r-苯基-(g)0-1-(ch2)q-(c(o))0-1-nh)-*,其中g、p、q和r如上述定义(例如,p是6,q是1,且r是0;p是6,q是2,且r是0;p是5,q是1,且r是0;或p是5,q是2,且r是0);(vii)-(c(o)(ch2)p-(c(o))0-1-nh)-(c(o)-(ch2)0-1-ch(r1)n(r2))m-*,其中r1、r2、m和p如上述定义(例如,m是2且p是6);(viii)-(c(o)-(ch2)r-苯基-(g)0-1-(ch2)q-(c(o))0-1-nh)-(c(o)-(ch2)0-1-ch(r1)n(r2))m-*,其中g、r1、r2、m、q和r如上述定义(例如,m是2,q是1,且r是0;或m是2,q是2,且r是0);(ix)-(c(o)-(ch2)r-苯基-(g)0-1-(ch2)q-(c(o))0-1-nh)-(c(o)(ch2)p-(c(o))0-1-nh)-*,其中g、p、q和r如上述定义(例如,p是6,q是1,且r是0;p是6,q是2,且r是0;p是5,q是1,且r是0;或p是5,q是2,且r是0);(x)-(c(o)(ch2)p-(c(o))0-1-nh)-(ch2ch2o)n-*,其中n和p如上述定义(例如,n是4且p是6);(xi)-(c(o)-(ch2)0-1-ch(r1)n(r2))m-(ch2ch2o)n-*,其中r1、r2、n和m如上述定义(例如,n是4且m是2);和(xii)-(c(o)-(ch2)r-苯基-(g)0-1-(ch2)q-(c(o))0-1-nh)-(ch2ch2o)n-*,其中g、n、q和r如上述定义(例如,n是4,q是1,且r是0;n是4,q是2,且r是0);(xiii)-(c(o)(ch2)pn(h)c(o)(ch2)pnh-)*,其中每个p独立地如上述定义(例如,每个p是5,-c(o)(ch2)5nh-c(o)(ch2)5nh-*);(xiv)共价键。在其它实施方式中,二价连接基团选自下式基团之一,其中在每种情况下,*-端与螯合剂连接:(xv)–(c(o)(ch2)p-(c(o))0-1-nh)-*,其中p是1-7(例如,6-氨基己酸,-c(o)(ch2)5nh-*);(xvi)–(c(o)-(ch2)r-苯基-(g)0-1-(ch2)q-(c(o))0-1-nh)-*,其中g是–n(h)-,r是0–6(例如,0-3,或0-2,或0,或1,或2,或1-6),q是1–6(例如,1-3,或1-2,或1,或2)(例如,苯基上的两个取代基彼此对位,诸如在4-氨基甲基苯甲酸中,其中r是0且q是1;或如在4-氨基乙基苯甲酸中,其中r是0且q是2);或(xvii)–(c(o)(ch2)p-(c(o))0-1-nh)–(c(o)-(ch2)r-苯基-(g)0-1-(ch2)q-(c(o))0-1-nh)-*,其中g、p、q和r如上述定义(例如,p是6,q是1,且r是0;p是6,q是2,且r是0;p是5,q是1,且r是0;或p是5,q是2,且r是0);(xviii)–(c(o)-(ch2)r-苯基-(g)0-1-(ch2)q-(c(o))0-1-nh)-(c(o)(ch2)p-(c(o))0-1-nh)–*,其中g、p、q和r如上述定义(例如,p是6,q是1,且r是0;p是6,q是2,且r是0;p是5,q是1,且r是0;或p是5,q是2,且r是0);(xix)–(c(o)(ch2)pn(h)c(o)(ch2)pnh-)*,其中每个p独立地如上述定义(例如,每个p是5,-c(o)(ch2)5nh-c(o)(ch2)5nh-);(xx)共价键。在其它实施方式中,二价连接基团选自下式基团之一,其中在每种情况下,*-端与螯合剂连接;(xxi)–(c(o)(ch2)p-(c(o))0-1-nh)-*,其中p是4-6(例如,6-氨基己酸,-c(o)(ch2)5nh-*);(xxii)–(c(o)-(ch2)r-苯基-(g)0-1-(ch2)q-(c(o))0-1-nh)-*,其中g是–n(h)-,r是0-6且q是1–3(例如,苯基上的两个取代基彼此对位,诸如在4-氨基甲基苯甲酸中,其中q是1;或如在4-氨基乙基苯甲酸中,其中q是2);或(xxiii)–(c(o)(ch2)p-(c(o))0-1-nh)–(c(o)-(ch2)r-苯基-(g)0-1-(ch2)q-(c(o))0-1-nh)-*,其中p、q和r如上述定义(例如,p是6,q是1,且r是0;p是6,q是2,或r是0;p是5,q是1,且r是0;或p是5,q是2,且r是0);(xxiv)–(c(o)-(ch2)r-苯基-(g)0-1-(ch2)q-(c(o))0-1-nh)-(c(o)(ch2)p-(c(o))0-1-nh)–*,其中g、p、q和r如上述定义(例如,p是6,q是1,且r是0;p是6,q是2,且r是0;p是5,q是1,且r是0;或p是5,q是2,且r是0);(xxv)–(c(o)(ch2)pn(h)c(o)(ch2)pnh-)*,其中每个p独立地如上述定义(例如,每个p是5,-c(o)(ch2)5nh-c(o)(ch2)5nh-*);(xxvi)共价键。在其它实施方式中,二价连接基团选自下式基团之一,其中在每种情况下,*-端与螯合剂连接:(i)-c(o)(ch2)5nh-*;(ii)(iii)(iv)(v)(vi)-c(o)(ch2)5nh-c(o)(ch2)5nh-*;(vii)c1-c6烷基;(viii)c1-c6烷基-nh-;(ix)共价键。在实施方式i2中,化合物为实施方式i1的化合物,其中l1是式l1a-nh-ch2ch2-(och2ch2-)y-c(o)-的部分,其中y是1、2、3、4、5、6、7、8、9、10、11或12;和l1a是二价连接基团。在实施方式i2a中,化合物为实施方式i2的化合物,其中y选自以下基团(1a)-(1x)之一:在实施方式i3中,化合物为实施方式i1或i2的化合物,其中l2是下式的基团:其中m是1、2、3或4;每个n独立地是1、2、3、4、5、6、7、8、9、10、11或12;条件是m·(n+2)大于或等于3且小于或等于21。在实施方式i3a中,化合物为实施方式i3的化合物,其中m选自以下基团(2a)-(2o)之一:(2a)1、2、3或4.(2b)1、2或3.(2c)1或2.(2d)1.(2e)2、3或4.(2f)1或3.(2g)2或4.(2h)1或2.(2i)2或3.(2j)3或4.(2k)1或4.(2l)1.(2m)2.(2n)3.(2o)4.在实施方式i3b中,化合物为实施方式i3或i3a的化合物,其中每个n独立地选自以下基团(3a)-(3x)之一:在实施方式i4中,化合物为实施方式i1-i3中任一个的化合物,其中化合物具有式i*的结构:或其药学上可接受的盐,其中l1、l2、r、r1和r2如本文所描述。在式(i*)中,1*、2*和3*是独立外消旋(rac)或s或r立体构型的手性中心。因此,根据该方面的化合物包括具有以下立体构型组合的那些及其混合物:在实施方式i5中,实施方式i1的化合物具有以下结构:式(ia)的化合物或其药学上可接受,其中l1、r、r1和r2如本文所描述。在实施方式i6中,实施方式i1的化合物具有以下结构:式(ib)的化合物或其药学上可接受的盐,其中y是2、3、4、5或6;l1a是二价连接子;和r、r1和r2如本文所描述。在实施方式i6a中,化合物为具有式(ib)结构的实施方式i1的化合物,或化合物为实施方式i2的化合物,其中l1a是:其中w是1、2、3、4、5或6;环a是杂环的;和l1b是二价连接子。在实施方式i6b中,化合物为实施方式i6a的化合物,其中l1b是c1-c6烷基-nh-。在实施方式i6c中,化合物为具有式(ib)结构的实施方式i1的化合物,或化合物为实施方式i2的化合物,其中l1a是:其中w是1、2、3、4、5或6;环a1是杂环的;和l1b是二价连接子。在实施方式i6d中,化合物为实施方式i6a的化合物,其中l1b是:c1-c6烷基-nh-。在实施方式i6e中,化合物为具有式(ib)结构的实施方式i1的化合物,或化合物为实施方式i2的化合物,其中l1a是:其中w是1、2、3、4、5或6;环a1是杂环的;和l1b是二价连接子。在实施方式i6f中,化合物为实施方式i6a的化合物,其中l1b是:c1-c6烷基-nh-。在实施方式i6g中,化合物为具有式(ib)结构的实施方式i1的化合物,或化合物为实施方式i2的化合物,其中l1a是:其中w是1、2、3、4、5或6;环a1是杂环的;和l1b是二价连接子。在实施方式i6h中,化合物为实施方式i6a的化合物,其中l1b是:c1-c6烷基-nh-。在实施方式i6i中,化合物为具有式(ib)结构的实施方式i1的化合物,或化合物为实施方式i2的化合物,其中l1a是:其中x是0、1、2、3、4、5或6;w是1、2、3、4、5或6;和环a1是杂环的。在实施方式i6j中,化合物为具有式(ib)结构的实施方式i1的化合物,或化合物为实施方式i2的化合物,其中l1a是:其中w是1、2、3、4、5或6;和环a1是杂环的。在实施方式i6k中,化合物为具有式(ib)结构的实施方式i1的化合物,或化合物为实施方式i2的化合物,其中l1a是:其中w是1、2、3、4、5或6;和环a1是杂环的。在实施方式i6l中,化合物为实施方式i6a-i6e中任一个的化合物,其中w选自以下基团(4a)-(4p)之一:(4a)1、2、3、4、5或6.(4b)1、2、3、4或5.(4c)1、2、3或4.(4d)1、2或3.(4e)1或2.(4f)2、3、4、5或6.(4g)2、3、4或5.(4h)2、3或4.(4i)2或3(4j)3或4.(4k)1.(4l)2.(4m)3.(4n)4.(4o)5.(4p)6.在实施方式i6m中,化合物为具有式(ib)结构的实施方式i1的化合物,或化合物为实施方式i2的化合物,其中l1a是:在实施方式i6n中,化合物为具有式(ib)结构的实施方式i1的化合物,或化合物为实施方式i2的化合物,其中l1a是:在实施方式i6o中,化合物为具有式(ib)结构的实施方式i1的化合物,或化合物为实施方式i2的化合物,其中l1a是:在实施方式i7中,实施方式i1的化合物具有式(ic)的结构:其中w是1、2、3、4、5或6;环a1是杂环的;和l1b是二价连接子。在实施方式i8中,实施方式i1的化合物具有式(ic′)的结构:其中w是1、2、3、4、5或6;环a1是杂环的;和l1b是二价连接子。在实施方式i9中,实施方式i1的化合物具有式(ic)的结构:其中w是1、2、3、4、5或6;环a1是杂环的;和l1b是二价连接子。在实施方式i10中,实施方式i1的化合物具有式(id)的结构:其中y是2、3、4、5或6;w是1、2、3、4、5或6;环a1是杂环的;和l1b是二价连接子。在实施方式i11中,实施方式i1的化合物具有式(id′)的结构:其中y是2、3、4、5或6;w是1、2、3、4、5或6;环a1是杂环的;和l1b是二价连接子。在实施方式i12中,实施方式i1的化合物具有式(id″)的结构:其中y是2、3、4、5或6;w是1、2、3、4、5或6;环a1是杂环的;和l1b是二价连接子。在实施方式i13中,实施方式i1的化合物具有式(ie)的结构:其中x是0、1、2、3、4、5或6;和y是2、3、4、5或6。在实施方式i13′中,实施方式i1的化合物具有式(ie)的结构,其中x是3。在实施方式i14中,实施方式i1的化合物具有式(if)的结构:其中y是2、3、4、5或6。在实施方式i15中,实施方式i1的化合物具有式(ig)的结构:其中y是2、3、4、5或6。在实施方式i15′中,实施方式i1的化合物具有式(ig)的结构,其中x是3。在实施方式i16中,实施方式i1的化合物具有式(ih)的结构:其中y是2、3、4、5或6。在实施方式i17中,化合物为实施方式i1-i9中任一个的化合物,其中y是4。在实施方式i18中,化合物为实施方式i1-i10中任一个的化合物,其中r是螯合剂,其任选地螯合治疗放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素。螯合剂可以包括任何本领域已知的螯合剂,参见,例如parus等人,“chemistryandbifunctionalchelatingagentsforbinding(177)lu,”currradiopharm.2015;8(2):86-94;等人,“chelatingagentsandtheiruseinradiopharmaceuticalsciences,”minirevmedchem.2011oct;11(11):968-83;liu,“bifunctionalcouplingagentsforradiolabelingofbiomoleculesandtarget-specificdeliveryofmetallicradionuclides,”advdrugdelivrev.2008september;60(12):1347–1370.具体实例包括,例如:例如,在实施方式i18a中,r可以是dota,通过其四个羧酸基团中的任一个键合:在实施方式i18b中,r可以是在实施方式i18c中,r可以是在实施方式i18d中,r可以是在实施方式i18e中,r可以是在实施方式i18f中,r可以是在实施方式i18g中,r可以是在实施方式i18h中,r可以是在实施方式i18i中,r可以是在实施方式i18j中,r可以是在实施方式i18k中,r可以是在实施方式i18l中,r可以是如果需要,还可以使用文献方法容易地制备其它的双功能螯合剂。在实施方式i19中,每种前述化合物可以与选自68ga、64cu、89zr、186/188re、90y、177lu、153sm、213bi、225ac和223ra的治疗放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素螯合。在实施方式i19a中,每种前述化合物可以与89zr的治疗放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素螯合。在实施方式i19b中,每种前述化合物可以与64cu的治疗放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素螯合。在实施方式i19c中,每种前述化合物可以与68ga的治疗放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素螯合。在实施方式i19d中,每种前述化合物可以与186/188re的治疗放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素螯合。在实施方式i19e中,每种前述化合物可以与90y的治疗放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素螯合。在实施方式i19f中,每种前述化合物可以与177lu的治疗放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素螯合。在实施方式i19g中,每种前述化合物可以与153sm的治疗放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素螯合。在实施方式i19h中,每种前述化合物可以与213bi的治疗放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素螯合。在实施方式i19i中,每种前述化合物可以与225ac的治疗放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素螯合。在实施方式i19j中,每种前述化合物可以与223ra的治疗放射性同位素或pet-活性、spect-活性或mri-活性的放射性同位素螯合。在实施方式i20中,化合物是实施方式i1-i19j中任一个的化合物,其中r1和r2独立地选自组(5a)-(5o)之一:(5a)氢、c1-c6烷基或保护基团。(5b)氢或c1-c6烷基。(5c)c1-c6烷基或保护基团。(5d)c1-c6烷基。(5e)氢或保护基团。(5f)氢。(5g)保护基团。(5h)组(5a)-(5d)中任一个的基团,其中c1-c6烷基为甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔丁基、正戊基或正己基。(5i)组(5a)-(5d)中任一个的基团,其中c1-c6烷基是甲基、乙基、正丙基、异丙基、正丁基、仲丁基或叔丁基。(5j)组(5a)-(5d)中任一个的基团,其中c1-c6烷基是甲基、乙基、正丙基或叔丁基。(5k)组(5a)-(5d)中任一个的基团,其中c1-c6烷基是甲基、乙基或叔丁基。(5l)组(5a)-(5d)中任一个的基团,其中c1-c6烷基是甲基或乙基。(5m)组(5a)-(5d)中任一个的基团,其中c1-c6烷基是甲基。(5n)组(5a)-(5d)中任一个的基团,其中c1-c6烷基是乙基。(5o)组(5a)-(5d)中任一个的基团,其中c1-c6烷基是叔丁基。本文使用的“保护基团”包括但不限于任选取代的苄基,叔丁基酯,烯丙基酯,烷基酯(例如甲基、乙基),芴基甲氧基羰基(fmoc),和在greene的protectivegroupsinorganicsynthesis,第4版(通过引用并入)中描述和胺、羧酸和磷酸保护基团。在一些实施方式中,r1是羧酸保护基团(例如,甲基或叔丁基酯)。在一些实施方式中,r2是氮保护基团(例如,boc或苄基)。任选地,苄基包括但不限于未取代的苄基,三苯基甲基(三苯甲基),二苯基甲基,邻硝基苄基,2,4,6-三甲基苄基,对溴苄基,对硝基苄基,对甲氧基苄基(pmb),2,6-二甲氧基苄基,4-(甲基亚磺酰基)苄基,4-磺基苄基,4-叠氮基甲氧基苄基,和greene的protectivegroupsinorganicsynthesis(其相关部分通过引用并入)中公开的羧酸和磷酸的胡椒基以及苄基保护基团。在实施方式i21中,式(i)的化合物可选自以下:或其药学上可接受的盐。在实施方式i22中,本公开提供了包括式(i)的化合物和药学上可接受的载体的药学组合物。在实施方式i23中,本公开提供了用于在患者中对一个或多个前列腺癌细胞成像的方法,包括向患者施用式(i)的化合物或其药学组合物。所述方法还包括在体内对式(i)的化合物成像。成像可以用本领域已知的任何pet-成像技术进行。在本方面的实施方式ii1中,本公开提供了式(ii)的化合物:或其药学上可接受的盐,其中:l1和l2独立地是二价连接基团;环b是杂环的;和每个r1和r2独立地是氢、c1-c6烷基或保护基团。在实施方式ii2中,l1、l2、r1和r2如上所述。在实施方式ii3中,实施方式ii1的化合物具有以下结构:式(iia)的化合物或其药学上可接受的盐。在实施方式ii4中,实施方式ii1的化合物具有以下结构:式(iib)的化合物或其药学上可接受的盐,其中y是2、3、4、5或6。在实施方式ii4a中,化合物为实施方式ii4的化合物,其中环b是:在实施方式ii5中,实施方式ii1的化合物具有以下结构:式(iic)的化合物或其药学上可接受的盐,其中y是2、3、4、5或6。在实施方式ii6中,化合物为实施方式ii1-ii5中任一个的化合物,其中y是4。在实施方式ii7中,式(ii)的化合物可以是:或其药学上可接受的盐。在本方面的实施方式iii1中,本公开提供了以下结构的化合物:或其药学上可接受的盐。在另一方面,本公开提供了制备式(i)的化合物的方法。根据本发明的化合物可以使用本领域公认的技术结合类似于下面公开的那些的方法组合制备。在本方面的实施方式iv1中,本公开提供了制备根据式(i*)或式(i)的化合物的方法,该方法包括使任选与pet-活性或治疗性放射性同位素相关的含叠氮化物或炔烃的螯合剂与式(iv)的叠氮化物或炔烃改性的pmsa抑制剂反应其中l1和l2独立地是二价连接基团;ac1包括叠氮或炔烃官能团;每个r1和r2独立地是氢、c1-c6烷基或保护基团;和x是白蛋白结合部分,条件是当ac1包括叠氮官能团时,它与任选与pet活性或治疗性放射性同位素相关的含炔烃螯合剂反应,以及当ac1包括炔烃官能团时,它与任选与pet活性或治疗性放射性同位素相关的含叠氮化物的螯合剂反应。在实施方式iv2中,实施方式iv1的叠氮化物或炔烃改性的pmsa抑制剂具有式(iva)的结构:在实施方式iv3中,实施方式iv1的叠氮化物或炔烃改性的pmsa抑制剂具有式(ivb)的结构:在实施方式iv4中,实施方式iv1的叠氮化物或炔烃改性的pmsa抑制剂具有式(ivc)的结构:其中y是2、3、4、5或6。在实施方式iv5中,实施方式iv1的炔烃改性的pmsa抑制剂具有式(ivd)的结构:其中环ac是杂环的,且w如本文描述。在实施方式iv6中,实施方式iv1的炔烃改性的pmsa抑制剂具有式(ive)的结构:在实施方式iv7中,实施方式iv1的炔烃改性的pmsa抑制剂具有式(ivf)的结构:在实施方式iv8中,实施方式iv1的炔烃改性的pmsa抑制剂具有式(ivg)的结构:在实施方式iv9中,实施方式iv1的炔烃改性的pmsa抑制剂具有式(ivh)的结构:在实施方式iv10中,实施方式iv1的炔烃改性的pmsa抑制剂具有式(ivi)的结构:在实施方式iv11中,实施方式v1的任选与pet活性或治疗性放射性同位素相关的含叠氮化物或炔烃螯合剂具有式(v)的结构:r-l1b-ac2(v)其中r是任选与pet活性或治疗性放射性同位素相关的螯合剂;l1b是二价连接子;和ac2是叠氮化物或炔烃。在实施方式iv12中,实施方式iv1的任选与pet活性或治疗性放射性同位素相关的含叠氮化物或炔烃的螯合剂具有式(va)的结构:其中x是0、1、2、3、4、5或6。在实施方式iv13中,实施方式iv1的任选与pet活性或治疗性放射性同位素相关的含叠氮化物或炔烃的螯合剂具有式(v)或式(va)的结构,其中r包括任选与89zr、64cu、68ga、186/188re、90y、177lu、153sm、213bi、225ac或223ra相关的dota,nota,pcta,do3a,hbed,nodag,cb-te2a,cb-te1k1p或去铁胺。在实施方式iv14中,实施方式iv1的任选与pet活性或治疗性放射性同位素相关的含叠氮化物或炔烃的螯合剂具有式(vb)的结构:在实施方式iv15中,实施方式iv1的任选与pet活性或治疗性放射性同位素相关的含叠氮化物或炔烃的螯合剂具有式(vc)的结构:在实施方式iv16中,实施方式iv1的任选与pet活性或治疗性放射性同位素相关的含叠氮化物的螯合剂具有式(vd)的结构:在实施方式iv17中,实施方式iv1的任选与pet活性或治疗性放射性同位素相关的含叠氮化物的螯合剂为式(ivd):并且实施方式iv1的炔烃改性的pmsa抑制剂为式(ivi):在实施方式iv18中,方法是实施方式iv17所用的,其中x是3;y是4;和w是2。在实施方式iv19中,方法是实施方式iv1所用的,其中式(i)的化合物具有以下结构:且与pet活性或治疗性放射性同位素相关的含叠氮化物的螯合剂具有以下结构:和炔烃改性的pmsa抑制剂具有以下结构:在实施方式vi中,方法是实施方式iv1所用的,其中式(i)的化合物具有以下结构:与pet活性或治疗性放射性同位素相关的含叠氮化物的螯合剂具有以下结构:和炔烃改性的pmsa抑制剂具有以下结构:在本方面的实施方式v1中,本公开提供了制备具有以下结构的化合物的方法:所述方法包括使具有以下结构的任选与pet活性或治疗性放射性同位素相关的含叠氮化物的螯合剂与具有以下结构的炔烃改性的pmsa抑制剂反应:在本方面的实施方式v2中,本公开提供了制备具有以下结构的化合物的方法:所述方法包括使具有以下结构的任选与pet活性或治疗性放射性同位素相关的含叠氮化物的螯合剂与具有以下结构的炔烃改性的pmsa抑制剂反应:实施例实施例1ctt1402的制备合成细节步骤1:(8s,11s)-甲基11-(4-(((苄氧基)羰基)氨基)丁基)-8-(3-(叔丁氧基)-3-氧丙基)-2,2-二甲基-6,9-二氧-5-氧杂-7,10-二氮杂-2-硅杂十二烷-12-酸酯(6)的合成。步骤a:向glu-(otbu)-oh(2.089g,10.28mmol)和三乙胺(0.2.15ml,15.43mmol)在1:1二恶烷:水(v/v)中的搅拌溶液(31ml)中一次性加入teoc-osu(3.2g,12.34mmol)。将混合物于室温搅拌过夜,然后用水(15ml)稀释,用4nhcl和1nhcl酸化,并用乙酸乙酯(3×40ml)萃取。将合并的有机层用盐水(60ml)洗涤,用硫酸镁干燥,过滤并蒸发,得到粗油(3.451g,96.6%产率)并干燥过夜。步骤b:向所得的在20ml无水dmf中的粗制溶液(3.451,9.929mmol)一次性加入hbtu(3.765g,9.929mmol),并在惰性气氛下于室温搅拌30分钟。30分钟后,向反应混合物中逐滴加入hcl-lys(z)-ome(3.941g,11.914mmol)和二异丙基乙胺(4.323ml,24.822mmol)在30ml无水dmf中的溶液,并于室温在惰性气氛下搅拌过夜。搅拌过夜后,将反应混合物溶于乙酸乙酯(100ml)中,用1nhcl(2x,75ml)、10%nahco3(aq)(wt/v)(2x,75ml)、然后盐水(1x,75ml)洗涤有机层。用硫酸镁干燥有机层,过滤并蒸发。经由二氧化硅色谱法(silicycle40g小柱)得到所需的化合物6,其中1:1etoac:hex(rf=0.33)作为洗脱液(4.698g,75.9%;经2步,73.2%)。步骤2:(8s,11s)-甲基11-(4-胺基丁基)-8-(3-(叔丁氧基)-3-氧丙基)-2,2-二甲基-6,9-二氧-5-氧杂-7,10-二氮杂-2-硅杂十二烷-12-酸酯(7)的合成。于室温将10%pd/c(0.797g,0.751mmol)加入到在70ml甲醇中的6(4.690g,7.518mmol)搅拌溶液中。用双层气囊(double-layeredballon)使所得溶液经受h2(g)气氛,搅拌过夜。搅拌过夜后,反应完成,通过硅藻土塞过滤,浓缩,得到定量产率的7(3.670g,99.7%)。步骤3:(8s,11s)-甲基8-(3-(叔丁氧基)-3-氧丙基)-11-(4-(4-(4-碘苯)丁酰胺基)丁基)-2,2-二甲基-6,9-二氧-5-氧杂-7,10-二氮杂-2-硅杂十二烷-12-酸酯(8)的合成。向在7ml无水dmf中的4-(4-碘苯)丁酸(0.547g,1.89mmol)溶液一次性加入hbtu(0.716g,1.89mmol),并在惰性气氛下于室温搅拌30分钟。30分钟后,向反应混合物中逐滴加入在8ml无水dmf中的7(0.770g,1.57mmol)和n,n-二异丙基乙胺(0.410ml,2.35mmol)的溶液,并于室温在惰性气氛下搅拌过夜。搅拌过夜后,将反应混合物溶于乙酸乙酯(100ml)中,用1nhcl(2x,75ml)、10%nahco3(aq)(wt/v)(2x,75ml)、然后盐水(1x,75ml)洗涤有机层。用硫酸镁干燥有机层,过滤并蒸发。经由二氧化硅色谱法(silicycle40g小柱)得到所需的化合物8,其中65%etoac:hex作为洗脱液(rf=0.33)作为洗脱液(tlc用75%etoac:hex展开,rf=0.33)(0.905g,75.6%)。步骤4:(s)-甲基2-((s)-2-氨基-5-(叔丁氧基)-5-氧代戊酰胺基)-6-(4-(4-碘苯基)丁酰胺基)己酸酯(9)的合成。于室温,在惰性气氛下,向在9ml无水thf中的8(0.710g,0.932)的搅拌溶液中加入1mtbaf的thf溶液(1.864ml,1.864mmol)。将所得溶液加热至44℃,搅拌至完成,约5小时。完成后,将反应冷却至室温并用5%khco3(aq)(wt/v)(15ml)淬灭,并用乙酸乙酯(2x,50ml)萃取。将合并的有机层用盐水(2x,25ml)洗涤,用硫酸镁干燥,过滤并蒸发,粗品不经进一步纯化用于下一步骤(tlc在20%meoh:etoac中展开,rf=0.33)(0.5538g,96.1%)。步骤5:dbco-peg4-(s)-4-氨基-5-(((s)-6-(4-(4-碘苯基)丁酰胺基)-1-甲氧基-1-氧代己-2-基)氨基)-5-氧代戊酸(11)的合成。步骤a:在4℃向5.0ml无水二恶烷中的9(0.310g,0.502mmol)溶液中逐滴加入4nhcl的二恶烷溶液(5.0ml,20.08mmol)30分钟,然后使其温热至室温。3小时后,于室温加入另一份4nhcl的二恶烷溶液(2.5ml,10.04mmol)。完成后(大约另外30分钟),将反应浓缩并在高真空下干燥过夜,不经进一步纯化用于下一步骤。步骤b:在惰性气氛下,向在1.0ml无水dmso和4ml无水二恶烷的得自步骤1的粗品羧酸(0.502mmol)和tea(0.104,0.753mmol)中逐滴加入在2ml无水二恶烷的dbco-peg4-nhs(0.300g,0.462mmol)。所得溶液搅拌过夜。搅拌过夜后,将反应物溶于100mletoac中,用1nhcl(50ml)洗涤。收集合并的有机层,水层用etoac(100ml)反萃取。合并的有机层用mgso4干燥,过滤并蒸发。用含0-4%h2o的3:7acn:meoh梯度分离化合物11,得到泡沫状粉橙色固体(0.228g,41.5%,经2步)。c52h66in5nao13[m+na]的m/z计算值为1118.36;实测[m+na]1118.56(低分辨率maldi)。步骤6:ctt-1402-ome的合成。步骤a:在惰性气氛下,向在1.0ml无水dmf中的11(0.067g,0.061mmol)溶液中加入edci-hcl(0.029g,0.153mmol),然后n-羟基琥珀酰胺(0.014g,0.122mmol)。将反应物在50℃搅拌1小时,加入另一份edci-hcl(0.029g,0.153mmol)和n-羟基琥珀酰胺(0.014g,0.122mmol)并搅拌至完全。粗混合物用20mletoac稀释,并用1nhcl(aq)洗涤以除去未反应的edci-hcl。将有机层用无水硫酸钠垫干燥,浓缩,得到玻璃状粉色固体。固体12在高真空度下干燥一小时,不经进一步纯化用于下一步。步骤b:在4℃,向在0.839ml1mtea-碳酸氢盐中的ctt1298(0.419ml,0.108mmol)搅拌溶液中逐滴加入在1ml无水dmf中的化合物12。将得到的溶液在4℃搅拌过夜。经由rp-prephplc,用10-85%acn(29.6mg,30.9%)得到所需化合物ctt-1402-ome。加入碳酸氢钠(1.2eq)以中和馏分中的乙酸铵。通过最少加热的旋转蒸发除去acn,并将剩余的水冻干。用分光光度计在310nm测定产率,ε310=11,000m-1lcm-1。对于所有批次,基于面积百分比,通过hplc确定ctt-1402的纯度大于96%,在4.8ppm和1.8ppm处的大峰分别是hod和乙酸酯峰。步骤7:ctt-1402的合成将ctt-1402-ome溶于0.9mlmq水中。加入氢氧化钠水溶液(1n)直至溶液的ph为12.5并于室温搅拌过夜。经由rp-prephplc,用10-85%acn得到最终化合物ctt-1402(16.3mg,54.7%)。加入碳酸氢钠(1.2eq)以中和馏分中的乙酸铵。通过最少加热的旋转蒸发除去acn,并将剩余的水冻干。用分光光度计在310nm测定产率,ε310=11,000m-1lcm-1。ctt1402分析(纯度和鉴别)在倒数第二个步骤中,经由1hnmr、31pnmr、hrms-maldi和hplc分析ctt1402。hplc条件分析hplc:柱:phenomenexluna5umc18(2)(目录号00f-4252-e0)尺寸:150x4.6mm波长:310nm制备hplc:柱:phenomenexluna10umc18(2)(目录号00b-4253-p0-ax)尺寸:50x21.2mm波长:310nm开发分析hplc和ms方法来表征ctt1402化合物,并确认ctt1402的结构和纯度大于96%。ctt1402的最终结构和组成(4s,9s,245)-21-(20-(11,12-二去氢二苯并[b,f]吖辛因-5(6h)-基)-17,20-二氧-4,7,10,13-四氧杂-16-氮杂二十烷酰胺)-1-(((((s)-1,3-二羧丙基)氨基)(羟基)磷酰基)氧基)-33-(4-碘苯基)-6,11,18,22,30-五氧-5,10,17,23,29-五氮杂三十三烷-4,9,24-三甲酸化学式:c72h99in9o25p准确重量:1647.55分子量:1648.48元素分析:c,52.46;h,6.05;i,7.70;n,7.65;o,24.26;p,1.881hnmr(600mhz,d2o)δ8.46(s,1h),7.51(d,j=7.7hz,2h),7.36-7.12(m,8h),7.05(d,j=7.4hz,2h),6.70(d,j=7.8hz,2h),4.87(d,j=14.1hz,1h),4.35(t,j=7.2hz,1h),4.13(dddd,j=17.6,13.5,8.7,4.9hz,3h),3.76(q,j=6.3hz,2h),3.66(q,j=5.9hz,2h),3.54-3.40(m,12h),3.31(d,j=13.9hz,2h),3.12(dt,j=31.2,7.2hz,5h),3.03-2.93(m,2h),2.48(d,j=5.9hz,2h),2.40-2.17(m,12h),2.15-2.04(m,4h),1.88-1.78(m,7h),1.74-1.56(m,8h),1.54-1.40(m,5h),1.36-1.27(m,5h).31pnmr(243mhz,d2o)δ7.47.hrms(maldi):c72h98in9o25p[m-h]的m/z计算值1646.5456;实测值1646.5381。放射性标记的ctt1403的制备溶液a:20mmctt1402在0.4mnh4oac(ph=7)中溶液b:5.3mmdota-叠氮化物(macrocyclics,dallas,tx,b-288)在0.4mnh4oac中溶液c:56mm龙胆酸在0.4mnh4oac(ph=7)中177lu-dota-叠氮化物的制备将溶液b(10μl,53nmoldota-叠氮化物)、溶液c(10μl,0.56μmol龙胆酸)和在0.5mnh4oac缓冲液(150μl,ph=4.85)中的177lucl3(10μl,14.6mci)相混合。所得的混合物在95℃加热1小时。为了质量控制,在注入hplc分析之前,将一小份(1μl)混合物用0.5mnh4oac缓冲液(20μl,ph=4.85)稀释。观察到高放射性标记产率(>95%),高放射性标记纯度(>95%)和特异活性(10.2gbq/μmol)。hplc条件列于下表:时间流率%a%b0.011.0099.01.05.001.0099.01.010.001.0090.010.014.001.0090.010.015.001.0099.01.015.100.0099.01.0用于治疗研究的177lu-ctt1403的制备将溶液a(17μl,0.34μmolctt1402)加入到177lu-dota-叠氮化物混合物中。在hplc分离之前,将所得混合物在37℃加热1小时。将含有最高放射活性的馏分组合,并使用氮气流在42℃蒸发至约0.41ml(9.07ci)。使用盐水(720μl)调节剩余溶液的盐浓度。为了质量控制,将将一小份(10μl)的混合物用于hplc分析。根据hplc结果,观察到177lu-dota-叠氮化物的高转化率(>95%)、高放射性标记产率(>95%)和高放射性标记纯度(>95%)。时间流率%a%b0.011.0095.05.03.001.0095.05.028.001.005.095.032.001.005.095.033.001.0095.05.038.001.0095.05.038.010.0095.05.0非标记的lu-ctt1403标准品的制备溶液a:20mmctt1402在0.4mnh4oac(ph=7)中溶液b:5.3mmdota-叠氮化物(macrocyclics,dallas,tx,b-288)在0.4mnh4oac中溶液c:20mmlucl3在0.4mnh4oac(ph=7)中非标记的lu-dota-叠氮化物的制备在0.5mnh4oac缓冲液(150μl,ph=4.85)中混合溶液b(10μl,53nmoldota-叠氮化物)和溶液c(10μl,0.2μmollucl3)。将所得混合物在95℃加热1小时。非标记的lu-ctt1403标准品的制备将溶液a(17μl,0.34μmolctt1402)加入到lu-dota-叠氮化物混合物中。在hplc分离之前,将所得混合物在37℃加热1小时。用水稀释小量样品用于esi-ms。测得m/z=1165.35408,对于c91h131ilun17nao32p2+的计算m/z(m+h+na)2+=1165.36282。仅使用dota-叠氮化物类似地制备不含lu的ctt1403。ctt1403分析(纯度和鉴别)hplc分析条件时间流率%a%b10.011.0095.05.023.001.0095.05.0328.001.005.095.0432.001.005.095.0533.001.0095.05.0638.001.0095.05.0738.010.0095.05.0ctt1403的最终结构和组成化学式:c91h130ilun17o32p准确重量:2305.7258分子量:2306.9730元素分析:c,47.38;h,5.68;i,5.50;lu,7.58;n,10.32;o,22.19;p,1.34由ctt1298合成ctt1400,总产率为42.65%。将ctt1298溶解在ddh2o中以制成0.43m溶液。将125μl该溶液加入1ml锥形小瓶中。将1mtea碳酸氢盐缓冲液加入到含有ctt1298溶液的1ml锥形小瓶中。将1.8当量的dbco-peg4-nhs溶解在dmso中(制成0.26m溶液)并逐滴加入到小瓶中。该反应物在4℃剧烈搅拌过夜。然后经由制备型hplc纯化反应物并通过冻干干燥。在冻干之前,加入1.2当量的nahco3以中和ph。通过uv吸光度定量产物。通过ms和分析型hplc方法确认所需产物。重量:20.43mg,产率:42.65%。ctt1400的分析(纯度和鉴别)开发了分析型hplc、1h和31pnmr以及ms方法以表征ctt1400化合物,并且确认ctt1400结构,对于所产生的每个批次,确认纯度>99%。1hnmr(400mhz,d2o)δ7.45(d,j=7.4,1h),7.36-7.20(m,6h),7.16(dd,j=7.3,1.6hz,1h),4.91(d,j=14.3hz,1h),3.95(ddd,j=13.9,8.5,4.9hz,2h),3.58(ddd,j=9.6,5.6,3.3hz,5h),3.51-3.38(m,12h),3.33(dt,j=9.1,6.2hz,1h),3.07?2.88(m,4h),2.32(t,j=6.1hz,2h),2.26-2.01(m,10h),1.91(d,j=0.7hz,2h),1.74-1.60(m,4h),1.62-1.27(m,8h),1.15(p,j=7.6,7.1hz,2h).31pnmr(162mhz,d2o)δ7.39.hrms(maldi):c51h72n6o20p的m/z[m+h]计算值为1119.4539;实测值1119.4542。通过ctt1400的hrms(maldi)光谱计算的c51h70n6o20p-m/z[m-h]=1117.4388;实测m/z=1117.1624。ctt1400前驱体的最终结构和组成(2s)-(((((29s,34s)-29,34-二羧基-1-(11,12-二去氢二苯并[b,f]吖辛因-5(6h)-基)-1,4,20,27,32-戊代氧-8,11,14,17-四氧杂-5,21,28,33-四氮杂三十七烷-37-基)氧基)(羟基)磷酰基)胺基)戊二酸化学式:c51h71n6o20p准确重量:1118.45分子量:1119.11元素分析:c,54.74;h,6.39;n,7.51;o,28.59;p,2.77放射标记的ctt1401的制备制备177lu标记的dota叠氮化物,并与ctt1400合并产生ctt1401。溶液a:20mmctt1400在0.4mnh4oac(ph=7)中溶液b:5.3mmdota-叠氮化物(macrocyclics,dallas,tx,b-288)在0.4mnh4oac中溶液c:56mm龙胆酸在0.4mnh4oac(ph=7)中将溶液a(17μl,0.34μmolctt1400)加入到177lu-dota-叠氮化物的混合物中。在hplc分离前,将所得的混合物在37℃加热1小时。收集177lu-ctt1401馏分200μl份。将具有最高放射活性的馏分整理成三个样品。第一样品(2.24mci)在41℃使用氮流浓缩成剩余130μl。然后将混合物分离到四个管(30μl,500μci)中。每个管用盐水稀释至1.0ml用于注入(50μci/100μl)。第二样品(2.22mci)被类似加工以生成另外两个管用于注入和质量控制hplc。最后的样品(2.49mci)被最小化并分离到五个管中。每个管被调节至250μl,并其中加入抗坏血酸钠(3.5mm)、龙胆酸(3.5mm)和乙醇(10%)以最小化放射性分解。根据hplc结果,观察到了177lu-dota-叠氮化物的高转化率(>95%)、高放射标记产率(>95%)和高放射标记纯度(>95%)。ctt1401非标记的标准品(纯度和鉴别)hplc分析条件:非标记ctt1401的ms(esi):实测m/z=1777.4727,计算的c70h104lun14o27p+m/z(m+h)+=1777.6257。实测m/z=889.2218,计算的c70h104lun14o27p2+m/z(m+2h)2+=889.3165。ctt1401的最终结构和组成化学式:c70h102lun14o27p准确重量:1776.6184分子量:1777.5976元素分析:c,47.30;h,5.78;lu,9.84;n,11.03;o,24.30;p,1.74用叠氮树脂纯化放射治疗剂为了除去任何未标记的psma靶向平台,将反应混合物施加到装有含叠氮化物树脂的seppak小柱上。预计所有“未点击”的psma靶向平台将被叠氮树脂清除。该清除步骤被优化用于有效去除未点击的psma靶向平台而不损失所需的组装的psma-靶标放射治疗剂。叠氮-琼脂糖树脂研究方案:产品信息:公司:clickchemistrytools产品名称:叠氮-琼脂糖产品编号:1038活化水平:每ml树脂22.0μmol炔烃基团,以50%浆液供应载体:6%交联琼脂糖珠粒尺寸:球形,50-150μm外观:灰白色浆液保存:20%乙醇水溶液方法:将5mgdbco-peg4-nhs酯溶于800μlddh2o和200μldmso中(以提高溶解度)。将溶液分成5个小瓶,每个小瓶含200μl溶液。向每个小瓶中添加不同量的树脂:标准品=0μl树脂5当量=350μl树脂10当量=700μl树脂15当量=1045μl树脂20当量=1400μl树脂样品瓶(rockvials)放置在定轨震荡器上(没有搅拌棒)。在15、30和60分钟后从每个小瓶中取出15μl等分试样。使15μl等分试样通过已用甲醇活化的0.2μm过滤器。在分析型hplc上运行所有纯化的样品,注射为5μl。该方法可以在30分钟时除去高达99%的至多20当量的未反应的nhs酯psma支架,并且可以用于从放射性标记的最终产物中除去未点击的ctt1402。内化研究和细胞特异性ctt1403的摄取和内化将稳定表达人psma的阳性对照pc3-pip(pip)细胞与阴性对照pc3(psma-)细胞系进行比较。将pip和pc3细胞分别接种在12孔板(4.0×105细胞/孔)中并孵育过夜。用内化缓冲液(50mmhepes,100mmnacl,1%fbs)洗涤细胞x1,并在内化缓冲液或带有2μg2-pmpa作为封断剂的内化缓冲液中孵育30分钟。将孔洗涤x1,然后加入177lu-ctt1403(8ng)并在37℃孵育15、30、60、120和240分钟。为了在每个时间点收集表面结合的馏分,用内化缓冲液洗涤样品x2,然后用在hbss中的20mm乙酸钠(ph4.0)孵育10分钟。除去溶液并保存,然后在不孵育的情况下用在hbss中的20mm乙酸钠洗涤,并将两种溶液集中。然后通过用在ddh2o中的0.5%sds冲洗每个孔x2来裂解细胞。使用cobraii自动伽马计数器计数所有样品。ctt1403的摄取和内化随着时间的推移而增加,非特异性摄取非常低(见下文)。近100%的与靶标细胞结合的ctt1403被内化(见下表)。这些结果表明ctt1403在psma表达细胞上成功结合其靶标,迅速内化,并持续增加超过4小时(图1)。含有白蛋白结合基序的psma靶向放射治疗平台的体内性能。psma靶向放射治疗剂ctt1403的生物分布对30只ncr裸鼠在右肩皮下注射1×106个pc3(psma+)细胞。使肿瘤生长至沿最长测量轴约0.8cm(注射后21天)。经由尾静脉向小鼠注射50μci(±2μci)的177lu-ctt1403。通过在注射177lu-ctt1403之前钟用2-(膦酰基甲基)戊烷-1,5-二酸(pmpa)预处理小鼠30分来进行阻断。对动物实施安乐死,并在注射后1小时、4小时、4小时(阻断)、24小时、48小时和72小时收获组织。此外,还在120小时和168小时测定ctt1403的生物分布。收获血液、肾脏、肝脏、肺脏、脾脏、肌肉、心脏、骨骼、肿瘤、前列腺、小肠、大肠、胃和泪腺。将组织样品在γ计数器中计数各3分钟。采用称重重量(post-weights)来确定组织的质量。组织重量和cpm177lu用于计算生物分布。作为对照实验,对10只ncr裸鼠在右肩皮下注射皮下注射1×106个pc3(psma-)细胞。使肿瘤生长至沿最长测量轴约0.8cm(注射后34天)。经由尾静脉向小鼠注射50μci(±2μci)的177lu-ctt1403示踪剂。对动物实施安乐死,并在注射后4和24小时收获组织。收获血液、肾脏、肝脏、肺脏、脾脏、肌肉、心脏、骨骼、肿瘤、前列腺、小肠、大肠、胃和泪腺。将组织样品在γ计数器中计数各3分钟。采用后重量来确定组织的质量。组织重量和cpm用于计算生物分布(图2)。177lu-ctt1403在肾脏、肺脏、前列腺、胃肠道、泪腺和pc3(+)肿瘤中显示出显著的摄取。不表达前列腺特异性膜抗原(psma)的pc3(-)肿瘤具有低至可忽略的摄取。正常小鼠前列腺确实显示出一些示踪剂的摄取。177lu-ctt1403的肿瘤和肾脏摄取在注射后48-72小时最大,肿瘤:背景比率在72小时持续升高。177lu-ctt1403的肿瘤:肾脏比率比其它已知的示踪迹高2-4倍。177lu-ctt1403的较慢清除率与lu-177的较长半衰期更好地对应。pc3-pip细胞中177lu-ctt1403的生物分布数据:上述生物分布数据表明,4小时和24小时观察到ctt1403的特异性肿瘤摄取,psma阴性肿瘤摄取具有最小摄取。使用天然底物pmpa,肿瘤摄取和肾脏摄取被阻断高达50%。pmpa是psma的可逆抑制剂并且预计不会完全阻断所有特异性psma依赖性摄取。应该注意的是,与人肾脏不同,啮齿动物肾脏显示出显著水平的psma表达,并且肾脏清除动力学在某种程度上被这种特异性psma摄取所掩盖。ctt1403肿瘤摄取随着时间的推移持续增加(4小时为17%),注射后48-72小时达到最大值(72小时为35%)。在同一时期,肾脏结合显示预期的清除率。注射ctt1403后的前72小时,肿瘤与血液和肿瘤与肌肉的比率持续增加。ctt1403(单剂量)的治疗效果在使用177lu-ctt1403治疗开始前7天(10只小鼠),对15只ncr裸鼠在右肩皮下注射3×105个pc3(psma+)细胞。治疗开始时的平均起始肿瘤体积为10-20mm3。经由尾静脉向每只小鼠注射790μci(±10μci)的ctt1403示踪剂。对照小鼠(2)经由尾静脉注射盐水。在注射前测量体重和肿瘤体积作为第7天,然后每周测量三次。根据等式[v=(π÷6)×l×w×h]确定肿瘤体积(v),其中l是最长轴,w是与l的垂直轴,且h是与l和w平面的垂直轴。终点标准定义为肿瘤的最长测量轴超出1.5cm或肿瘤的活性溃疡(图3)。还记录了小鼠重量,但没有观察到任何重量的异常变化(正常生长没有减少)。用ctt1403重复治疗实验(第二次实验的纯度增加至95%[ctt1403治疗2],而第一次实验的纯度为85-90%[ctt1403治疗])以确认结果。在使用177lu-ctt1403开始治疗前10天,对十五只ncr裸鼠在右肩皮下注射3×105个pc3(psma+)细胞。对8只对照动物,仅经由尾静脉注射盐水。对8只小鼠,经由尾静脉注射790μci(±10μci)的177lu-ctt1403示踪剂。在注射前测量体重和肿瘤体积作为第0天,然后每周测量三次。根据等式[v=π÷6×l×w×h]确定肿瘤体积(v),其中l是最长轴,w是与l的垂直轴,h是与l和w平面的垂直轴。终点标准定义为肿瘤的最长测量轴超出1.5cm或肿瘤的活性溃疡。在ctt1403(具有白蛋白结合基序)的生物分布实验中观察到的增加的肿瘤摄取解释为ctt1403在psma+人异种移植肿瘤模型中的优异治疗功效,通过以下所示:显著增加的肿瘤倍增时间,在肿瘤生长的前3周内肿瘤体积减少90-95%,根据如图5和图6所示的kaplanmeier生存图,基于第一次1403治疗实验(第二次1403治疗实验的中位生存时间,在实验的第42天,生存率仍为100%),中位生存时间增加31%。定义如本文所用,术语“细胞”意指体外、离体或体内的细胞。在一些实施方式中,离体细胞可以是从诸如哺乳动物的生物体切除的组织样品的一部分。在一些实施方式中,体外细胞可以是细胞培养物中的细胞。在一些实施方式中,体内细胞是生活在诸如哺乳动物的生物体中的细胞。如本文所用,术语“接触”是指在体外系统或体内系统中将指定部分聚集在一起。例如,将psma与化合物“接触”包括将本文所述的化合物施用给个体或患者,诸如人,以及例如将化合物引入含有psma的细胞或纯化制剂的样品中。如本文所用,术语“个体”或“患者”可互换使用,是指任何动物,包括哺乳动物,优选小鼠、大鼠、其它啮齿动物、兔、狗、猫、猪、牛、羊、马或灵长类动物,且最优选人类。如本文所用,短语“药学上可接受的盐”是指药学上可接受的酸和碱加成盐和溶剂化物。这些药学上可接受的盐包括酸的盐,诸如盐酸、磷酸、氢溴酸、硫酸、亚磺酸、甲酸、甲苯磺酸、甲磺酸、硝酸、苯甲酸、柠檬酸、酒石酸、马来酸、氢碘酸、链烷酸(如乙酸,hooc-(ch2)n-cooh,其中n为0-4)等。无毒的药学碱加成盐包括碱的盐,诸如钠、钾、钙、铵等。在某些实施方式中,药学上可接受的盐是钠盐。本领域技术人员将认识到多种无毒的药学上可接受的加成盐。适用于肠胃外施用诸如,例如通过关节内(在关节处)、静脉内、肌内、皮内、腹膜内和皮下途径的药物组合物包括水性和非水性、等渗无菌注射溶液(其可含有抗氧化剂、缓冲液、抑菌剂和溶质,使配方与预期接受者的血液等渗),水性和非水性无菌悬浮液(其包括悬浮剂、增溶剂、增稠剂、稳定剂和防腐剂)。可以例如通过静脉内输注、口服、局部、腹腔内、膀胱内或鞘内施用组合物。除非另有说明,本文所用的术语“烷基”是指含有1至10个碳原子的直链或支链烃。烷基的代表性实例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、正戊基、异戊基、新戊基、正己基、3-甲基己基、2,2-二甲基戊基、2,3-二甲基戊基、正庚基、正辛基、正壬基和正癸基。当“烷基”基团是两个其它部分之间的连接基团时,它也可以是直链或支链;实例包括但不限于-ch2-、-ch2ch2-、-ch2ch2chc(ch3)-、-ch2ch(ch2ch3)ch2-。如本文所用的术语“杂环基”是指单环杂环或双环杂环。单环杂环是3、4、5、6或7元环,其含有至少一个独立地选自o、n和s的杂原子,其中环是饱和的或不饱和的,但不是芳族的。3或4元环含有1个选自o、n和s的杂原子。5元环可含有0或1个双键,和1个、2个或3个选自o、n和s的杂原子。6或7元环含有0、1或2个双键,和1个、2个或3个选自o、n和s的杂原子。单环杂环通过单环杂环中含有的任何碳原子或任何氮原子与母体分子部分连接。单环杂环的代表性实例包括但不限于氮杂环丁烷基、氮杂环庚烷基、氮丙啶基、二氮杂环庚烷基、1,3-二恶烷基、1,3-二氧戊环基、1,3-二硫杂环戊基、1,3-二噻烷基、咪唑啉基、咪唑烷基、异噻唑啉基、异噻唑烷基、异恶唑啉基、异恶唑烷基、吗啉基、恶二唑啉基、恶二唑烷基、恶唑啉基、恶唑烷基、哌嗪基、哌啶基、吡喃基、吡唑啉基、吡唑烷基、吡咯啉基、吡咯烷基、四氢呋喃基、四氢噻吩基、噻二唑啉基、噻二唑烷基、噻唑啉基、噻唑烷基、硫代吗啉基、1,1二氧代硫代吗啉基(硫代吗啉砜)、硫代吡喃基和三硫杂环戊烷。双环杂环是与苯基、单环环烷基、单环环烯基、单环杂环或单环杂芳基稠合的单环杂环。双环杂环通过双环系统的单环杂环部分中包含的任何碳原子或任何氮原子与母体分子部分连接。双环杂环基的代表性实例包括但不限于2,3-二氢苯并呋喃-2-基、2,3-二氢苯并呋喃-3-基、吲哚-1-基、吲哚-2-基、吲哚-3-基、2,3-二氢苯并噻吩-2-基、十氢喹啉基、十氢异喹啉基、八氢-1h-吲哚基和八氢苯并呋喃基。杂环基任选被一个或两个独立地为氧代或硫杂的基团取代。在某些实施方式中,双环杂环基是与苯环稠合的5或6元单环杂环基、5或6元单环环烷基、5或6元单环环烯基、5或6元单环杂环基或5或6元单环杂芳基,其中双环杂环基任选被一个或两个独立地为氧代或硫杂的基团取代。本文所用的术语“氧代”是指=o基团。本文所用的术语“饱和的”是指所提及的化学结构不含任何多重碳-碳键。例如,如本文所定义的饱和环烷基包括环己基,环丙基等。本文所用的术语“硫杂”表示=s基团。本文所用的术语“不饱和的”是指所提及的化学结构含有至少一个多重碳-碳键,但不是芳族的。例如,如本文所定义的不饱和环烷基包括环己烯基、环戊烯基、环己二烯基等。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- SPNP‑I在制备Nav1.7通道工具试剂中的应用的制造方法与工艺
- SPNP‑I在制备Nav1.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- SGLT‑2糖尿病抑制剂及其中间体的制备方法与流程