一种牛奶中A2-β-酪蛋白的分离方法与流程
本发明涉及分离提纯领域,具体涉及一种牛奶中A2-β-酪蛋白的分离方法。
背景技术:
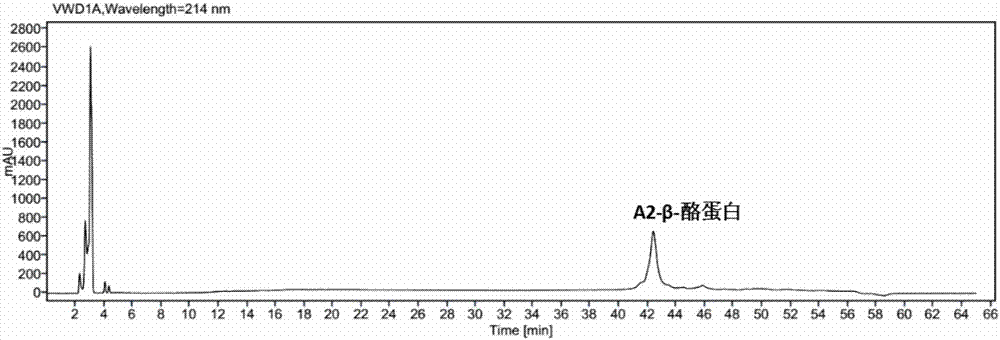
:酪蛋白是牛乳中含量最高的蛋白质,占牛乳蛋白含量的80%左右。根据氨基酸组成和电泳行为的不同,酪蛋白可分为αs-酪蛋白、β-酪蛋白和κ-酪蛋白,其中β-酪蛋白约占牛乳酪蛋白总量的30-35%。β-酪蛋白又存在多种变体,最常见的是A1-β-酪蛋白和A2-β-酪蛋白,两者的区别在于氨基酸链的第67位存在变异,前者为组氨酸,后者为脯氨酸。研究发现,A1-β-酪蛋白在生物体内会水解产生β-酪啡肽(BCM-7),该活性肽能够导致缺血性心脏病、动脉粥样硬化、I型糖尿病、新生儿猝死症及一些精神方面的疾病,因此含有A2-β-酪蛋白的乳制品更加健康安全,在国内外市场上也更受欢迎。由于奶牛的基因决定了所产牛乳中β-酪蛋白是A1型或者A2型,所以目前主要通过牛只基因鉴定法来判断牛乳中β-酪蛋白的种类,该法不能判断未知奶牛基因型的牛乳样品。为了定性定量检测未知牛奶中β-酪蛋白的类型及其含量,首要的获得A2-β-酪蛋白,然而由于工艺或者成本等因素,市场上并没有售卖A2-β-酪蛋白的标准化商品,需要从A2型牛奶中分离制备。然而现有的分离纯化酪蛋白的方法不仅步骤繁琐、耗时长、花费高昂,而且对β-酪蛋白的分离纯化效果差。因此,迫切需要一种对牛奶中β-酪蛋白,尤其是A2-β-酪蛋白的高效便捷、廉价易行提纯分离方法。技术实现要素:针对现有技术中存在的不足之处,本发明的目的就是提供简单、便宜的牛乳β-酪蛋白的分离方法。本发明提供了一种A2-β-酪蛋白的分离方法,包括下述步骤:1)将脱脂的A2型牛奶在25-35℃下碱调pH值到10.5-11.5;2)在搅拌条件下向脱脂奶中加入钙盐,使脱脂奶体系中钙离子浓度在0.05-0.08mol/L,酸调体系pH值至中性,离心,保留沉淀;3)用纯净水洗涤沉淀1-2次,向沉淀中加入pH值为10.5-11.5的碱溶液,并在2-4℃下冷冻搅拌2h,得到蛋白溶液;4)酸调蛋白溶液pH值到4-5,在2-4℃下冷冻离心,收集上清液并转移至另一烧杯中,在25-35℃下保持25-35min,离心,保留沉淀;5)洗涤沉淀,干燥后得到目标蛋白,并在-20℃冷冻保存目标蛋白。优选的是,步骤1)中所述脱脂的A2型牛奶的制备方法:将A2型牛奶在2℃下冷冻离心,留取下层的脱脂奶。优选的是,步骤1)中所述碱为1mol/L氢氧化钠溶液,碱调温度为30℃,碱调pH值到11。优选的是,步骤2)中所述钙盐为0.5mol/L氯化钙溶液,脱脂奶体系中钙离子浓度为0.065mol/L;所述酸为1mol/L盐酸;所述离心时间10min,转速4000r/min。优选的是,步骤3)中所述洗涤为向沉淀中加入纯净水并搅拌至呈乳浊液,将该乳浊液在4000r/min下离心10min,保留沉淀,即为固体蛋白。优选的是,步骤3)中所述碱溶液的pH值为11,冷冻搅拌温度为2℃。优选的是,步骤4)中所述酸为1mol/L或者0.5mol/L盐酸,酸调蛋白溶液pH值到4.6;所述冷冻离心转速6000r/min,时间10min,温度2℃。优选的呢是,步骤4)中所述转移后的上清液水浴升温至30℃,并保持30min,然后在不低于15℃的温度下以6000r/min离心10min,保留沉淀。优选的是,步骤5)中所述洗涤沉淀为用纯净水和丙酮各洗涤两遍;所述干燥为在45℃下烘干或者冷冻干燥。优选的是,所述分离方法能用于分离A1-β-酪蛋白或者同时含有A1-β-酪蛋白和A2-β-酪蛋白的混合β-酪蛋白。对本发明及其有益效果的阐述:本发明成功地从A2型牛奶中分离出了A2-β-酪蛋白,其纯度大于85%,该A2-β-酪蛋白可以用于高效液相测试以获取其浓度与峰面积的对应关系,进而用于定量检测出未知牛奶中是否含有A2-β-酪蛋白,及A2-β-酪蛋白的含量;为了定量检测乳制品中β-酪蛋白的类型及含量,必须要获得高纯度的A2-β-酪蛋白用作标样,然而由于工艺或者成本等因素,市场上并没有售卖A2-β-酪蛋白的标准化商品,致使在A2-β-酪蛋白定量检测方面存在一定的技术空白;本发明人结合了β-酪蛋白的等电点、Ca2+离子敏感、低温低酸游离等特性,探索出β-酪蛋白的提纯方法,能够快速分离富集得到纯度在85%以上的β-酪蛋白,该方法不仅能够用于A2-β-酪蛋白的分离提纯,也能够用于A1-β-酪蛋白或者同时含有A1-β-酪蛋白和A2-β-酪蛋白的混合β-酪蛋白的分离提纯,克服了现有技术中β-酪蛋白分离时间长、步骤繁琐以及耗费高昂的问题,为检测乳制品中β-酪蛋白种类提供了条件;本发明中的提纯方法工艺简单、成本低,适于大规模生产,可以用作未知奶样的β-酪蛋白分型鉴定及含量检测的测定标准品。附图说明图1为A2型牛奶的高效液相色谱图;图2为从A2型牛奶中分离提纯的A2-β-酪蛋白的高效液相色谱图;图3为样品牛奶的高效液相色谱图;图4为从样品牛奶中分离提纯的β-酪蛋白的高效液相色谱图。具体实施方式下面结合附图对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。实施例11)将A2型牛奶在2℃冷冻离心,除去牛奶中的脂肪成分,留取下层的脱脂奶,将该脱脂奶升温至30℃,并用氢氧化钠溶液调节pH值到11,以促进牛奶中蛋白质充分溶解于溶液之中;2)在搅拌条件下向脱脂奶中加入氯化钙溶液,控制体系中氯化钙浓度在0.065mol/L,用盐酸调节体系pH值到7,离心分层,保留沉淀;牛奶酪蛋白中αs-酪蛋白和β-酪蛋白容易与钙离子结合沉淀,而κ-酪蛋白不易于钙离子结合沉淀,申请人经过长时间实验探索发现,当氯化钙浓度在0.065mol/L时,既能够保证κ-酪蛋白不沉淀,同时还使αs-酪蛋白和β-酪蛋白沉淀收率最高;3)向沉淀中加入纯净水并搅拌至呈乳浊液,将该乳浊液离心分层,保留沉淀;重复该离心操作一次,所得到沉淀为固体蛋白质;本步的目的是用纯净水洗涤离心所得蛋白质固体沉淀,充分将蛋白沉淀中残留的乳糖和乳清蛋白冲洗掉;4)将固体蛋白质转移至烧杯中,加入pH值为11的碱溶液,搅拌至完全溶解得到蛋白溶液,在搅拌条件下将该蛋白溶液在2℃冷冻2h;申请人经过长时间实验探究发现,酪蛋白的在pH值为11的碱溶液中溶解效果最佳,能够有效保证β-酪蛋白溶解度和最终收率;5)用盐酸调节蛋白溶液pH值到4.6,然后在2℃下冷冻离心,收集上清液并转移至另一干净烧杯中;低温低酸的条件下β-酪蛋白在水溶液中溶解度较大,且远大于αs-酪蛋白在此条件下的溶解度,因此本步通过控制环境温度和酸度实现β-酪蛋白与αs-酪蛋白的分离以及β-酪蛋白的富集;将该富集有β-酪蛋白的上清液在30℃下保持30min,然后在室温离心分层,保留沉淀,该沉淀的主要成分即为β-酪蛋白;室温离心温度不得低于15℃,如温度低于15℃β-酪蛋白容易复溶,导致收率降低;6)用纯净水和丙酮各洗涤沉淀两次,用以清洗最终产物中杂质,干燥后得到目标蛋白,并在-20℃冷冻保存,所得目标蛋白纯度大于85%。实施例2本案中使用的高效液相色谱仪为安捷伦1260,色谱条件如下:色谱柱:VydacEverestC18column,250×4.6mm,5um,进样量:50μL;柱温:40℃;检测波长:241nm,辅助280nm;流动相A:0.1wt%三氟乙酸水溶液;流动相B:0.1wt%三氟乙酸乙腈溶液;洗脱程序:时间/min流动相A/%流动相B/%流速/mL·min-1075.724.31271.228.811764.835.213061.838.214555.045.014846.054.015346.054.015575.724.316575.724.31实施例3下面将详细阐述利用分离纯化的A2-β-酪蛋白作为测定标准品来检测未知牛奶中β-酪蛋白的类型。1)标准品前处理及检测:称取购买的Sigma品牌αs-酪蛋白、β-酪蛋白、κ-酪蛋白标准品各1mg至三个1.5mL离心管中,加入500μL缓冲液(由6mol/L盐酸胍、0.1mol/LBis-Tris、5.37mmol/L二水柠檬酸钠组成),涡旋混匀,以6000r/min离心15s,室温下静置1h;然后再以6000r/min离心10min,离心后加入490μL的4.5mol/L盐酸胍和10μL的β-巯基乙醇,涡旋混匀;最后用0.45μmPTFE滤膜过滤,滤液即可用于高效液相色谱仪检测,得到αs-酪蛋白、β-酪蛋白、κ-酪蛋白标准品的色谱出峰图;从测得的色谱出峰图中可以识别αs-酪蛋白的出峰时间在38-39min、κ-酪蛋白的出峰时间在20-21min、β-酪蛋白的出峰时间在41-42min,但无法判断该β-酪蛋白是A1型还是A2型或者两者混合物;2)A1型或A2型牛奶前处理及检测:移取200μL经脱脂的牛奶至1.5mL离心管中,加入600μL缓冲液(由6mol/L盐酸胍、0.1mol/LBis-Tris、5.37mmol/L二水柠檬酸钠组成),涡旋混匀1min,室温下静置1h;然后再以6000r/min离心10min,取下清液500μL至另一干净的1.5mL离心管中,加入490μL的4.5mol/L盐酸胍和10μL的β-巯基乙醇,涡旋混匀,用0.45μmPTFE滤膜过滤,滤液即可用于高效液相色谱仪检测,得到A1型和A2型牛奶的色谱出峰图;对照步骤1)中αs-酪蛋白、β-酪蛋白、κ-酪蛋白标准品的色谱出峰图,能够识别A1型和A2型牛奶的色谱出峰图中αs-酪蛋白、β-酪蛋白以及κ-酪蛋白的色谱峰;其中,A1型牛奶中的A1-β-酪蛋白的出峰时间在42min,A2型牛奶中的A2-β-酪蛋白的出峰时间在43min,说明本测试的色谱条件下A1-β-酪蛋白较A2-β-酪蛋白先出峰;3)A2-β-酪蛋白的分离纯化:将200mL新鲜A2型牛奶在2℃冷冻离心,取下层脱脂奶升温至30℃,用1mol/L氢氧化钠溶液调节奶样pH值至11;在搅拌条件下向脱脂奶中加入0.5mol/L氯化钙溶液使最终奶样中氯化钙浓度为0.065mol/L,用1mol/L盐酸调节奶样pH值至7,以4000r/min离心10min,倾倒上层清液,保留沉淀;向沉淀中加入30mL纯净水并强力搅拌至呈乳浊液,以4000r/min离心10min,倾倒上清液,保留沉淀;再次向沉淀中加入30mL纯净水并强力搅拌呈乳浊液,以4000r/min离心10min,倾倒上清液,保留沉淀,即为固体蛋白质;将固体蛋白转移至200mL烧杯中,加入100mLpH值为11的碱溶液,搅拌至蛋白质完全溶解,在搅拌条件下将蛋白溶液降温至2℃,并保持2h;用1mol/L(或0.5mol/L)盐酸调节蛋白溶液pH值到4.6,冷冻离心(2℃、6000r/min)10min,收集上清液并转移至另一干净烧杯中;将该上清液升温至30℃并保持30min,然后在常温条件下(不得低于15℃)以6000r/min离心10min,收集沉淀;用纯净水和丙酮各洗涤沉淀两次,将沉淀在45℃条件下烘干或者冷冻干燥,得到目标蛋白并在-20℃冷冻保存,目标蛋白的纯度不低于85%;将A2-β-酪蛋白按照步骤1)中的方法进行前处理后,进行测得并获得其高效液相色谱图,即图2,对照图1的A2型牛奶色谱出峰图,通过本提纯方法能够很好的除去A2型牛奶中的αs-酪蛋白和κ-酪蛋白,所得产品的纯度高,能够用于测定A2-β-酪蛋白在高效液相中峰面积与浓度关系,能够定量测出样品奶中A2-β-酪蛋白的含量;4)待测牛奶样品及其中β-酪蛋白的检测:首先对待测牛奶样品进行前处理,处理方法与步骤2)中相同,然后进行高效液相色谱检测,色谱出峰图如图3,能够清楚的识别出αs-酪蛋白、β-酪蛋白以及κ-酪蛋白的色谱峰,其中,该牛乳样品在42-43min先后出现了两个β-酪蛋白峰,根据图2中A2-β-酪蛋白的高效液相色谱图,能够识别待测牛奶的高效液相色谱图中上的A2-β-酪蛋白色谱峰,从而初步判断出本牛乳样品中β-酪蛋白为A1型和A2型的混合,进一步根据A2-β-酪蛋白在高效液相中峰面积与浓度关系,能够计算出牛奶样品中A2-β-酪蛋白的含量;更进一步,采用步骤3)中的分离纯化方法,分离出待测牛奶样品中的β-酪蛋白,将该β-酪蛋白单独进行高效液相检测,出峰图如图4,图中仅有β-酪蛋白的色谱峰,没有其他酪蛋白的色谱峰,说明本案中的提纯分离方法纯化效果好,还不会破坏目标蛋白的结构。尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出的实施例。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1