发光皂苷纳米颗粒的制备及生物成像应用的制作方法
本发明涉及一种发光皂苷纳米颗粒的制备及生物成像应用。
背景技术:
皂苷是一类由植物天然产生的具有生物活性和生物相容性的两亲性糖苷。广泛的研究显示皂苷的许多生物学效应都是源于他们与膜组分(例如,胆固醇和磷脂)的独特的相互作用。这些相互作用包括改变膜的动态、与脂筏作用、穿透和水解膜的特性。皂苷(例如,常春藤素)穿透膜的特性尤其有意义,因为它提供了一种生物相容的替代方法来穿透活细胞,而不用使用具有细胞毒性的离子表面活性剂(例如,tritonx-100)来穿透细胞。专门对常春藤素的研究显示了一个更加复杂的浓度依赖的穿透机理,基于常春藤素与固醇和磷脂聚集,诱导不同水平的膜的弯曲。当浓度低于0.03%的临界胶束浓度,常春藤素单体将会插入和结合到细胞的单层外膜的固醇中。当浓度高于临界胶束浓度,常春藤素将会诱导膜孔的直接形成和导致膜电势的短暂消失。利用常春藤素和其他皂苷独特的膜穿透特性,我们发明了简单而有效的基于纳米乳液和纳米颗粒的药物运送系统。这些药物运送系统的主要优点是低成本、快速运送时间、和有选择性的生物活性。在认识到皂苷运送系统的优点之后,我们想知道它能否被用于运送我们实验室研发的一些非传统的发光体进入哺乳动物细胞。我们主要感兴趣于两个特殊的运送系统。第一个运送系统包括:大分子量、高度共轭、发深红色光的、具有聚集诱导发光性质的纳米颗粒。aie是一个存在于一些含有转子的荧光分子中的光物理现象:当分子溶解时不发光,当分子聚集时发强光。这是由于分子内转动受限造成的。含有转子的分子溶解时是不发光的因为它们经历了低频运动导致非辐射衰减。当分子聚集时,这些运动因为分子间的位阻相互作用被阻碍,使得荧光分子即使在固态也能发射明亮的荧光。aie纳米颗粒相比于其他荧光系统的优势在于它们明显的光稳定性、低细胞毒性和固态亮度很高,由于它们很强的aie性质。这些纳米颗粒从多光子成像到血管成像都能找到广泛的生物成像应用。然而,许多这些aie纳米颗粒由于他们的大分子尺寸和疏水性而无法穿过细胞。为了解决这个问题,许多报道的方法使用复杂的纳米颗粒包裹方法和靶向策略。然而,这些纳米颗粒递送策略的主要缺点是它们的高成本、复杂的合成、和较长的培养时间。使用皂苷对这些aie纳米颗粒进行递送将会有利于减少成本和生物成像必要的培养时间。
我们感兴趣用皂苷递送的第二个系统是纯有机室温磷光纳米晶体(rtpncs)。最近报道了通过改变二苯甲酮的聚集行为,有望抑制非辐射衰减来实现有效的发光和长寿命磷光。这是因为改变二苯甲酮的芳香亚单元能有效地调整能级和三线态激子的轨道特征。我们的结果显示在周围室温的条件下可以实现纯有机磷光体,其平均寿命最长可以到0.23秒,发光效率最高可以达到36%。达到秒的长寿命磷光有利于生物成像,因为通过一个简单的光栅延迟就可以消除自发荧光的影响。自发荧光发生在纳秒的范围所以可以很容易从毫秒的发光寿命中区分出来。然而,由于纳米晶体无法穿过细胞,我们的纯有机纳米晶体还没有被应用于生物成像。将皂苷递送系统应用于室温有机磷光纳米晶体的细胞递送将会极大地促进磷光寿命成像。
此外,绿色荧光蛋白(gfp)的发现、优化和应用改变了我们对细胞内蛋白的生物产生、运输和定位的认识。尽管gfp技术有实实在在的优点,但是仍然存在局限性。一个重要的局限是其可以达到的分辨率,考虑到gfp先天是一个庞大的蛋白。因此,为了实现gfp标记的未知蛋白的精确亚细胞定位,我们必须观察其与另一个已知的靶向特定目标细胞器的荧光物质的共定位。用来与gfp共定位的荧光物质包括假想荧光蛋白、免疫荧光构建物、或具有靶向性的外源荧光素。文献中报道了很多使用外源小分子的荧光色素用于与位于线粒体、细胞核、细胞壁和细胞膜中的目标蛋白进行共定位。通过荧光色素与荧光蛋白之间的协同作用,有助于最小化两种技术的局限。此外,使用荧光色素结合gfp标记为复合成像提供了一个更加经济的方法。由于来自叶绿体的高自发荧光、厚细胞壁的存在、和内部的高膨压,适用于植物生物成像的符合要求的荧光色素的数量显著少于其他的模型系统。这些因素对植物生物成像造成了很大的挑战,导致只能使用相对有限的一类发射波长在自发荧光区域以外的荧光色素:包括蓝色染料(dapi)、黄色/橙色染料(rhodamines)、和长波长的染料(alexa
对这个问题的一个很大程度上未探索的解决方法是使用聚集诱导发光体(aiegens)替代传统的荧光色素用于植物生物学的复合成像。aiegens不存在acq效应,并且即使在植物细胞中这样不利于生物成像的环境也能保持明亮的发光。aie现象是源于含有旋转单元如苯环的分子的分子内旋转受限。含有转子的荧光色素在稀溶液中经历低频转动诱导激态的非辐射衰减途径导致发光减弱。然而,在聚集状态这些转动被分子内位阻相互作用阻挡,从而打开了辐射衰减的通路。根据之前的文献报道,aiegens在很多方面表现出比商用荧光色素更好的性能,并且其独特的点亮型响应可以被用于直接可视化生物分析物和过程。目前,文献中报道了大量的aiegens,但是几乎没有文献报道其应用于植物生物学。因此,基于aiegens在植物生物学中有巨大的潜力,我们首先使用发光的皂苷aie纳米颗粒系统研究了aiegens被植物细胞吞入和在植物细胞内的分布。
技术实现要素:
皂苷(例如,常春藤素)对细胞膜具有独特的相互作用。当浓度高于它们的临界胶束浓度,它们会与膜上的胆固醇作用和聚集,在细胞膜上形成短暂的孔洞。我们利用皂苷的膜可穿透性和两亲性的独特性质,将其用于胞内递送聚集诱导发光纳米颗粒(aienps)和室温纯有机磷光纳米晶体。我们发现这个方法具有生物相容性、廉价、超快,可以用于递送很多种aie纳米颗粒和纳米晶体到哺乳动物细胞中。此外,相同的方法被进一步延伸到研究aiegens和aie皂苷纳米颗粒在模式植物拟南芥中的生物成像应用。我们发现该系统具有较好的光稳定性,与荧光蛋白具有高的共定位率,以及具有独特的组织特异的点亮式发光特性。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
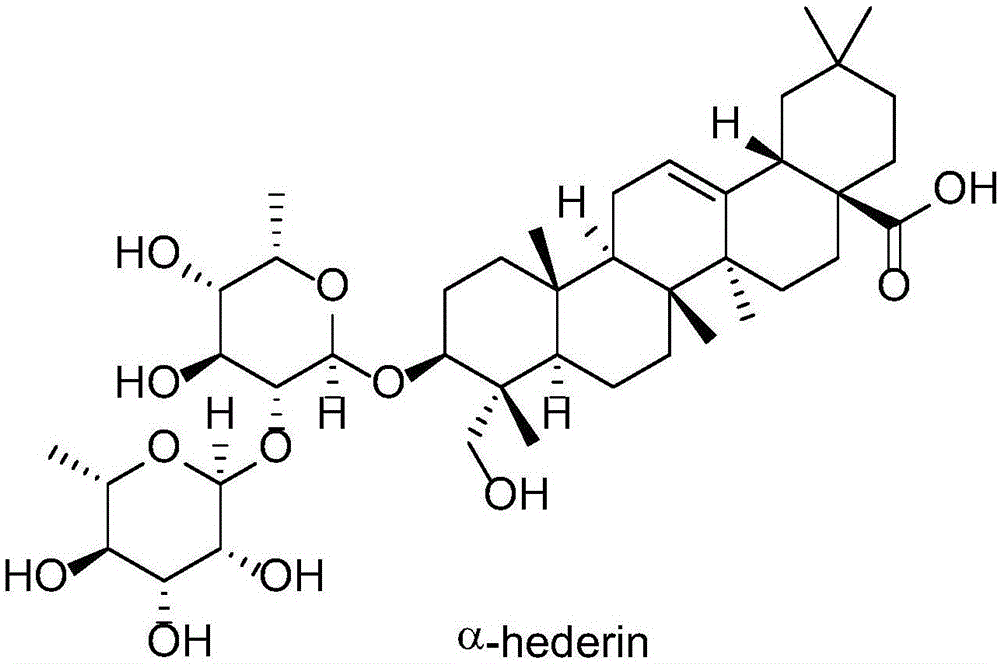
图1所示为皂苷的结构;
图2所示为制备皂苷纳米颗粒的流程示意图;
图3所示为皂苷aie纳米颗粒快速递送的细胞穿透机理;
图4所示为皂苷纳米颗粒的表征数据;
图5所示为海拉细胞与0.5μg/ml的saponin@tpe-tetrad纳米颗粒培养后的延时成像;
图6所示为海拉细胞分别与0.5μg/ml的saponin@capp和saponin@tpe-tetrad纳米颗粒培养后的优化的激光扫描共聚焦显微镜生物成像条件;
图7所示为海拉细胞与0.5μg/ml的无皂苷tpe-tetrad和capp在37摄氏度培养五分钟后的激光扫描共聚焦显微图像;
图8所示为mdck-ii肾细胞与0.5μg/ml的capp@saponin在37摄氏度培养五分钟后的激光扫描共聚焦图像;
图9所示为海拉细胞与lysotrackergreen和saponin@capp纳米颗粒共培养的激光扫描共聚焦图像;
图10所示为可穿透细胞的aiegens、商业化的荧光染料和许多aie纳米颗粒递送平台染色时间的比较;
图11所示为海拉细胞分别用不同浓度的saponin@cappnps和saponin@tpe-tetrad纳米颗粒染色后的细胞活力分析;
图12所示为海拉细胞在37摄氏度下分别用不同浓度的capp和tpe-tetrad染24小时后细胞活力分析;
图13所示为海拉细胞分别与纳米晶体@saponin和纯纳米晶体培养五分钟后的激光扫描共聚焦显微图像;
图14所示为海拉细胞内皂苷纳米晶体和mitotrackerred随着激光扫描共聚焦显微镜扫描次数的增加光稳定性的比较;
图15所示为拟南芥和洋葱表皮细胞的荧光染色过程;
图16所示为多种拟南芥植物组织包括叶、茎和根用皂苷@dpi-in染色的激光扫描共聚焦显微图像;
图17所示为拟南芥根组织用皂苷@dpi-in染;
图18所示为皂苷@dpi-in纳米颗粒和pi分别与yfp标记的pip2(a,b)水通道蛋白在拟南芥根组织的激光扫描共聚焦图像和共定位分析,分别使用488纳米和561纳米的激光(30%的激光功率)照射拟南芥植物的根组织,比较saponin@dpi-in纳米颗粒和pi的光稳定性;
图19所示为在不同的渗透压环境下使用激光扫描共聚焦显微镜对洋葱表皮细胞进行荧光染色。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
将发光的纳米颗粒是通过往液闪瓶中的1mlpbs中加入200微升的aiegens或2毫克的纳米晶体。混合物在室温下剧烈地搅拌十分钟,同时用氮气帮助缓慢地蒸发四氢呋喃和形成小的染料纳米颗粒。为了制作发光的皂苷纳米颗粒,20微升的皂苷溶液(1毫克/毫升)随后加入并在室温下继续搅拌五分钟。
图1显示了皂苷的活性结构。皂苷是一类两亲性的配糖体,通过与胆固醇的相互作用它能很容易渗透细胞膜。因为良好的生物兼容性和生物活性,皂苷被广泛的用于药物,食品和化妆品行业。α-常春藤皂苷是一种从黑色小茴香中提取出来的皂素,是实验中用到的主要化合物。
图2显示了制造纳米颗粒的流程示意图。图3显示了提出的透过细胞的示意图。图3显示了快速输送皂苷aie纳米粒子的细胞透化机理,其中,(a)皂苷aie纳米粒子通过胆固醇成键与细胞膜产生相互作用;(b)产生瞬态的孔隙有利于aie纳米粒子的快速输送;(c)细胞膜将会在复原期间被修复。
图4显示了得到的aie皂苷纳米颗粒的表征数据。其中,(a)saponin@capp和(b)saponin@tpe-tetrad纳米粒子粒径分布的动态光散射图。插图为两种皂苷的透射电子显微镜图,比例尺:(a)100nm;(b)200nm。
图5显示了海拉宫颈癌细胞潜伏在0.5μg/ml的皂苷@tpe-tetrad的纳米粒子中的激光共聚焦显微镜图,其中,(a)30秒,(b)2分钟,(c)3分钟,(d)5分钟,(e)10分钟,(f)30分钟。
图6至10显示了使用发光的aie皂苷纳米颗粒的哺乳动物细胞的生物成像数据。其中,图6为海拉宫颈癌细胞潜伏在0.5μg/ml的皂苷@capp(a-c)的纳米粒子和@tpe-tetradnpsfor(d-f)中5分钟37℃的激光共聚焦显微镜图,比例尺为20微米。图7为海拉宫颈癌细胞潜伏在0.5μg/ml的tpe-tetrad(图a和b)和capp(图d和f)中5分钟37℃的激光共聚焦显微镜图,(a,c)明场图和(b,d)荧光图,比例尺为20微米。图8为mdck-ii肾脏细胞潜伏在0.5μg/ml的capp@皂苷中5分钟37℃的激光共聚焦显微镜图,(a)明场图,(b)荧光图和(c)a与b的合并图,比例尺为20微米。图9为海拉宫颈癌细胞培养的激光共聚焦显微镜图(a)0.5μg/ml的皂苷@capp纳米颗粒(b)与50nm的溶酶体绿色荧光染料(c)两种染料共同使用图,比例尺为20微米。图10为aiegens、商业化荧光染料和不同的aie纳米粒子的细胞渗透着色时间对比图。
在图11至12中,mtt实验显示这些发光的aie皂苷纳米颗粒具有高度的生物相容性。其中,图11为37℃下海拉宫颈癌细胞着色24小时以后的细胞活性图(a)不同浓度的saponin@cappnps着色(b)不同浓度的saponin@tpe-tetradnps,实验并未观察到特别的活性差异(p<0.05)。图12为37℃下海拉宫颈癌细胞着色24小时以后的细胞活性图(a)不同浓度的capp着色(b)不同浓度的tpe-tetrad,星号标记了显著的细胞活性(p<0.05)。
图13显示了皂苷包裹的室温纯有机磷光纳米晶体的制作和应用于生物成像。其显示了与1μg/ml的纳米晶@皂苷(a-b)或者1μg/ml纯纳米晶(c-d)培养5分钟后的荧光共聚焦显微镜图,比例尺为20μm。
图14显示了:(a)皂苷纳米晶(蓝色)和mitotracker红(红色)在海拉细胞中随着荧光共聚焦显微镜扫描次数增加的的光稳定性对比,扫描能量为80%的光功率,用i/i0来表示信号的强度,i0表示初始荧光强度,i表示每一次扫描的能量;(b)bdbf纳米晶的结构,吸收发射和sem图;(c)mitotrackerred的结构,吸收和发射图。
图15显示发光的aie皂苷纳米颗粒被用于植物材料的染色。其显示了拟南芥和洋葱表皮细胞的荧光着色过程,其中:(1)植物组织提取;(2)与皂素(1mg/ml)培养10分钟;(3)与dpi-in或者saponin@dpi-innps培养10分钟;(4)荧光共聚焦显微镜样品制备和生物成像;(a)洋葱表皮细胞的荧光着色(a)没有皂素处理过的对比条件下,dpi-in荧光因静电作用与细胞壁相关;(b)在皂素处理条件下,dpi-in荧光因经典相互作用与质膜和内细胞壁相关。
图16显示它们能染许多不同的植物组织并且由于aie的特性具有独特的点亮发光响应。拟南芥植物组织包括叶子,根和茎用0.5μg/mlsaponin@dpi-in着色10分钟。根横截面的初生木质部因为高疏水的木质素浓度被显著着色。其中,(a)拟南芥茎截面图;(b)明场;(c)荧光场;(d)明场与荧光场的合并图,比例尺为200μm。
图17显示发光的aie皂苷纳米颗粒甚至能够确定根尖的分生组织区域。用0.5μg/mlsaponin@dpi-in对拟南芥根部组织着色10分钟。其中,(a-c)分生组织区,比例尺200μm;(d-f)不同区域,比例尺50μm;g)拟南芥根部结构图。
图18显示发光的aie皂苷纳米颗粒与膜荧光蛋白如水通道蛋白有着较高的亚细胞共定位。其中,pip2(a,b)水通道蛋白标记的yfp与皂苷@dpi-innpsnps(a-c,0.5μg/mlsaponin@dpi-in)和pi(d-f)在拟南芥根部组织的荧光共聚焦成像图,比例尺为50μm;(g-h)分别为皂苷@dpi-innps和pi的共生散点图;(i)数据对比表明共生速率和皮尔森纠正因子值。星号表明在95%的可信区间存在显著区别;(j)(a)在拟南芥幼苗根部组织的皂苷@dpi-innps(red)和pi(blue)通过488nm和561nm处以30%光功率连续照射的光稳定性对比,i/i0为信号强度,i0为初始的荧光强度,i是后续的扫描强度。
图19显示它们也可以被用于研究中央液泡的收缩和细胞内的膨压。洋葱表皮细胞在不同的环境下的荧光着色图,其中,(a)在等压条件无皂素处理条件下,dpi-in荧光与细胞壁存在静电力相互作用;(b)在等压条件皂素处理条件下,dpi-in荧光因静电力与质膜内细胞壁相关;(c)在高渗透压经皂素处理条件下(洋葱表皮细胞在1m蔗糖溶液中,然后水合)dpi-in荧光因细胞的质壁分离而与可伸缩的质膜和细胞质相关。染料浓度为0.5μg/ml,着色时间为10分钟,比例尺为100μm。
- 还没有人留言评论。精彩留言会获得点赞!