E3泛素连接酶ASB3在制备肝癌治疗药物中的应用的制作方法
本发明涉及生物医药技术领域,具体地说,是e3泛素连接酶asb3作为抗肿瘤新靶点在肝癌治疗中的应用。
背景技术
肝癌是常见的恶性肿瘤,在全球范围内有着较高的发病率。长期以来肝癌的发病和死亡水平居高不下,对居民生命健康造成了极大的危害。globocan2012年统计报告显示:世界肝癌2012年发病达782451例,占同期世界癌症总发病数的5.6%,世界标化发病率(asr-w)为10.1/10万,分别居同期世界男、女性和合计癌症发病顺位的第5、9及7位;中国发病384770例,占同期中国癌症发病总数的12.9%,asr-w为22.3/10万,分别居同期中国男、女性及合计癌症发病顺位的第2、5和2位。中国的肝癌发病率分别是世界、发达地区及亚洲的2.21、4.13和1.68倍。
原发性肝癌分为肝细胞肝癌(hcc)、胆管细胞癌(cc)及混合型肝癌,其中hcc占85%~90%,是最常见的病理类型。目前认为hcc的发病是由遗传和环境因素相互作用引起的,是一个多因素诱导、多基因参与的复杂过程。其中,乙肝病毒(hbv)慢性持续性感染是我国最重要的肝癌发病危险因素。
目前,早期肝癌的治疗方式主要以手术为主,由于肝癌发病隐匿,仅有不足30%的患者能够获得及时手术的机会,中晚期肝癌的治疗则侧重于非手术疗法。现有的肝癌非手术治疗方式主要有:血管介入治疗、分子靶向化疗药物治疗、放射治疗及局部消融治疗。鉴于我国肝癌病情的特点及各种治疗手段的局限性,尽管现有的各种治疗手段能够缓解患者的病情进展,对改善预后和提高生存率有一定帮助,但是目前对于肝癌的综合治疗仍未达成共识,对于肝癌治疗的长期疗效、并发症、适应症等仍然需要更多更深入的研究,亟待需要新型治疗方式攻克这一重大疾病。
泛素-蛋白酶体系统(ups)是细胞内蛋白选择性降解的重要途径,由泛素激活酶e1、结合酶e2以及连接酶e3组成,参与调节细胞内多种生理活动,对细胞生命活动的正常运行至关重要。其中e3泛素连接酶主要负责特异性识别靶蛋白,在ups系统中发挥了至关重要的作用。根据其结构特征,e3连接酶可分为hect结构域家族、ring结构域家族(包括u-box结构域)两大类,其中cullin-ring-basede3-ligases(crls)是一类重要的ringe3泛素连接酶,参与调节细胞周期蛋白、dna复制蛋白、dna损伤应答调控因子等多种底物蛋白的降解,其功能失调引起底物积聚,与肿瘤发生密切相关。
asb3是组成crle3泛素连接酶复合体的重要底物识别蛋白。asb3蛋白由c末端的socs-box及n末端的12个锚蛋白重复序列(ankyrinrepeat,ank)组成,含有518个氨基酸。2型肿瘤坏死因子受体(tnf-r2)是asb3已经明确的底物,asb3通过其部分ank与tnfr2结合并调控它的降解。此外,asb3还可能通过调节其它底物的泛素化,进而调控细胞功能。
rna干扰技术(rnai)是把与内源mrna编码区同源的小片段外源双链rna导入细胞中,导致特定基因沉默的一种技术。sirna是rnai的关键效应分子,是长度为21-23nt的双链rna。rnai技术能够沉默或降低特异性基因的表达,产生类似基因敲除的效应。在一些疾病中,rnai相关研究已进入i期和ii期临床试验。这使得以一些与肿瘤发生发展密切相关的分子作为特异性靶点,通过rnai技术使其沉默,能够达到抗肿瘤目的。
技术实现要素:
本发明的目的在于提供一种新的肝癌非手术治疗方式——使用小干扰rna沉默特异性靶基因,这种治疗方式主要是为了解决传统的肝癌治疗方式疗效及预后不佳等问题。
为了实现上述目的,本发明的第一方面,提供一种治疗肝细胞肝癌(hcc)的靶点,即e3泛素连接酶asb3。
本发明发现在肝细胞肝癌患者中,癌组织asb3的表达水平较癌旁组织高,且与患者的生存期成负相关。干扰asb3能够抑制肝癌细胞的增殖活力,诱导肝癌细胞凋亡;对裸鼠皮下肝癌种植瘤具有治疗作用;解决了中晚期肝癌现有治疗方式疗效差、预后不佳等技术问题。
本发明的第二方面,提供e3泛素连接酶asb3在制备肝癌治疗药物中的应用。
进一步的,所述的应用是指将e3泛素连接酶asb3作为肝癌治疗的干预靶点。
进一步的,所述的肝癌治疗药物是抑制或下调e3泛素连接酶asb3基因表达的药物。
本发明的第三方面,提供抑制或下调e3泛素连接酶asb3基因表达的试剂在制备肝癌治疗药物中的应用。
进一步的,所述的抑制或下调e3泛素连接酶asb3基因表达的试剂包括但不限于:特异性结合e3泛素连接酶asb3的蛋白,特异性干扰e3泛素连接酶asb3基因表达、加工的小干扰分子,如sirna分子、mirna分子、反义核苷酸等。
更优选的,所述的抑制或下调e3泛素连接酶asb3基因表达的试剂是靶向e3泛素连接酶asb3基因的小干扰rna(sirna,即siasb3),所述的小干扰rna的正义链5’-3’方向的核苷酸序列如seqidno:1所示;反义链5’-3’方向的核苷酸序列为如seqidno:2所示。
正义链:5’-gaaauauggagcccagaua-3’(seqidno:1);
反义链:5’-uaucugggcuccauauuuc-3’(seqidno:2);
正义链和反义链都在3’端再加上tt以增加sirna的稳定性。
进一步的,所述的肝癌治疗药物抑制肝癌细胞的增殖活力,阻滞肝癌细胞生长周期,诱导肝癌细胞凋亡,抑制肿瘤生长。
本发明前期筛选了4条sirna干扰序列,只有上述序列效果最好。本发明使用的针对asb3基因的sirna片段,由上海吉玛基因公司合成,经证实为有效序列,能够抑制asb3表达。
asb3sirna寡核苷酸序列:分子量为13,300(g/mole),为冻干粉剂,保存于-20℃,用前以depc水溶解。
sirna转染进入细胞后,即产生一系列的反应:首先,sirna在细胞rna解旋酶的作用下,解链成正义链和反义链;其次,反义sirna与体内一些酶(包括内切酶、外切酶、解旋酶等)结合形成rna诱导的沉默复合物(rna-inducedsilencingcomplex,risc);再次,risc与外源性基因表达的mrna的同源区进行特异性结合,并在距离sirna3’端12个碱基的位置切割mrna;最终,被切割后的断裂mrna降解。sirna不仅能引导risc切割同源单链mrna,而且可作为引物与靶rna结合并在rna聚合酶(rna-dependentrnapolymerase,rdrp)作用下合成更多新的双链rna(doublestrandedrna,dsrna),新合成的dsrna经胞质中的核酸内切酶的切割能够产生大量的次级sirna,使的rnai对靶mrna降解作用进一步放大。
本发明的第四方面,提供一种重组载体在制备肝癌治疗药物中的应用,所述的重组载体中包含上述的靶向e3泛素连接酶asb3基因的小干扰rna。
本发明的第五方面,提供一种肝癌治疗药物,所述的肝癌治疗药物中包含上述的靶向e3泛素连接酶asb3基因的小干扰rna。
本发明和已有技术相比,有着明显的效果及积极的意义。本发明的优点在于:
1、提供了一种新型的肝癌治疗方式,为中晚期肝癌的非手术治疗提供一种行之有效的治疗手段,解决了中晚期肝癌现有治疗方式疗效差、预后不佳等技术问题;
2、本发明中的小干扰rna能够抑制肝癌细胞的增殖活力,阻滞肝癌细胞生长周期,诱导肝癌细胞凋亡,且对裸鼠肝癌移植瘤具有治疗作用;
3、本发明所采用的小干扰rna针对的靶点asb3在hcc患者中表达量与生存期负相关,具有独特的应用价值。
附图说明
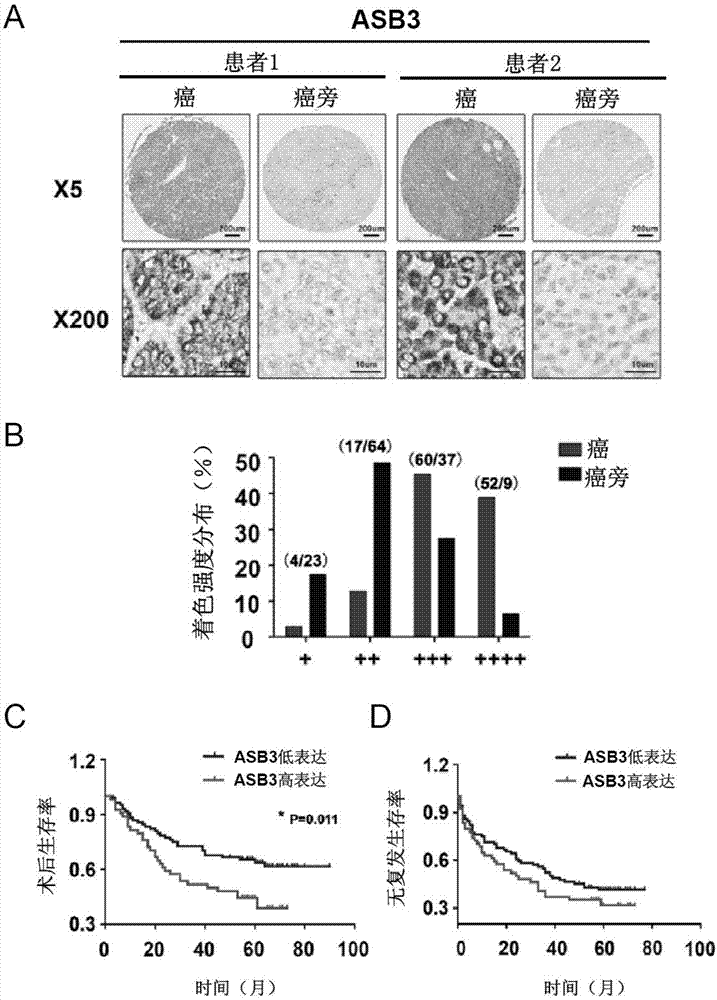
图1:显示了在肝细胞肝癌(hcc)患者中,癌组织asb3的表达水平较癌旁组织高,且与患者的生存期成负相关。将含133例癌/癌旁组织的hcc组织芯片行免疫组化染色;相关临床资料行生存分析。图1a为肝癌组织芯片免疫组化染色结果。图1b为免疫组化染色结果评分后分组统计。图1c是根据染色结果将患者分为asb3高/低表达组(低表达组:+~+++;高表达组:++++),分析其总生存期与asb3表达量的关系。图1d为无复发生存期分析。
图2:显示了应用rnai沉默asb3基因后其蛋白表达的变化情况。具体操作是应用脂质法瞬时转染人肝癌lm6细胞系,转染24,48,72,96h后分别收集样品,图2a是应用westernblot技术检测asb3蛋白的动态变化情况。图2b是以actin蛋白条带密度为标准,进行asb3蛋白密度半定量的图。
图3:显示了asb3sirna转染人肝癌lm6细胞系后抑制细胞增殖及活力。图3a是应用celltiterreagent检测细胞增殖情况的统计图。图3b是应用mts检测有活力细胞的统计图。
图4:显示了asb3sirna转染人肝癌lm6细胞系后阻滞了细胞周期。图4a是应用pi染色后行流式细胞术细胞检测细胞周期的图。图4b是对图4a中处于subg1期细胞的统计图。图4c是对图4a中处于g2/m期细胞的统计图。
图5:显示asb3sirna转染人肝癌lm6细胞系后引起细胞凋亡形态学检测的图。图5a为hoechst染色结果,在荧光显微镜下观察可见凋亡细胞的细胞核呈致密浓染。图5b为荧光面积的统计图。
图6:显示asb3sirna转染人肝癌lm6细胞系后引起细胞发生凋亡的图。图6a为annexinv-pi双染色后,流式细胞学检测细胞凋亡,发生早期凋亡的细胞位于右下象限,晚期凋亡的细胞位于右上象限。图6b为图6a中发生凋亡细胞(包括早期凋亡和晚期凋亡)的统计图。
图7:显示asb3sirna转染人肝癌lm6细胞系后引起细胞凋亡相关蛋白的变化情况。图7a为应用westernblot检测c-parp蛋白变化情况。图7b是以actin蛋白条带密度为标准,进行c-parp蛋白密度半定量的图。
图8:为原位注射asb3sirna后第1,5,10天裸鼠瘤体积变化情况。
具体实施方式
下面结合实施例对本发明提供的具体实施方式作详细说明。
实施例
一、体外实验所涉及的实验材料:
1.细胞系:人肝癌细胞lm6来自中科院细胞库。
2.实验动物:购自上海动物实验中心,5周龄健康雌性无胸腺裸鼠。
3.实验材料、试剂及试剂盒
dmem培养基:thermofisherscientific公司;opti-mem培养基:thermofisherscientific公司;胎牛血清:thermofisherscientific公司;碘化丙啶:thermofisherscientific公司;ripa裂解液:上海碧云天生物技术有限公司;pmsf:上海碧云天生物技术有限公司;蛋白酶抑制剂cocktail:sigma-aldrich公司;ecl显色液:北京康为试剂生物科技有限公司;30%丙烯酰胺:上海碧云天生物技术有限公司;1mtris溶液(ph8.8/ph6.6):上海碧云天生物技术有限公司;过硫酸铵:上海碧云天生物技术有限公司;temed:上海碧云天生物技术有限公司;dtt:sigma-aldrich公司;溴酚蓝:sigma-aldrich公司;pvdf膜:millipore公司;biostep蛋白标准分子量:上海天能科技有限公司;lipofectaminetmrnaimax转染试剂:thermofisherscientific公司;无水乙醇:国药集团化学试剂有限公司;bsa蛋白定量试剂盒:天根生化科技(北京)有限公司;celltiterreagent:美国promega公司;mts:美国promega公司;annexinv-fitc/pi凋亡检测试剂盒:东仁化学科技上海有限公司。
4.sirna干扰序列:购自广州锐博生物科技有限公司。
5.抗体:(1)asb3:购自novus公司,货号nbp-1-8812;(2)c-parp:购自cellsignalingtechnology,货号5625;(3)beta-actin:购自cellsignalingtechnology,货号nbp-1-8812。
6.主要仪器设备
heracell150i细胞培养箱:thermofisherscientific有限公司;mini-protean;tetra电泳槽系统:bio-rad公司;infinite200pro多功能微孔板检测仪:帝肯(上海)贸易有限公司;las冷光/生物发光成像分析仪:gehealthcare公司;cyanadp流式细胞仪:美国贝克曼库尔特有限公司。
二、实验操作
1、sirna转染
(1)sirna准备:依据合成sirna的剂量,加入适量depc水配制为20nm浓度,-20℃保存备用。
(2)细胞准备:将处于对数生长期、状态良好的细胞消化计数,向培养皿中加入适量细胞,使24h后转染前皿中细胞汇合度达到80%-90%。
(3)转染流程:以60mm培养皿为例。准备两支分别加入500μl无血清opti-mem培养基的离心管,其中一支再加入10μllipofectaminernaimax,轻柔吹打混匀后室温放置5min;另一只加入10ulsirna工作液。将两支液体混合、吹打混匀并在室温下孵育20min。随后,弃去待转染培养皿中培养基,加入1ml上述混合液及3ml无双抗含10%胎牛血清的培养基,移入细胞培养箱静置24h。
(4)转染后细胞处理:细胞转染24h后,弃去培养基及转染试剂,消化细胞并计数。依据目标将细胞重新种板用于后续实验。
2、mts检测细胞增殖活性
(1)将位于对数生长期、状态良好细胞消化重悬并计数。按照2000个/100μl的浓度将原始细胞悬液稀释。充分混匀后将100μl细胞悬液加入96孔板中,轻微震荡均匀后放入5%二氧化碳培养箱中37℃静止24h。在各次实验中,保留仅加入100μl培养基、无细胞的本底检测孔。
(2)待进入检测时间点后,将提前4℃融化并避光保存的mts试剂取出,向各检测孔中加入20μl。水平快速震荡96孔板,将mts试剂与培养基充分混合后,将细胞放回培养箱中静置3h。随后使用infinite200pro检测记录各孔中450nm处吸光度od450。将各孔od450扣除本底检测孔数值后,计算与阴性对照组的百分比,所得数值即为各孔细胞标准化细胞活性。
3、atplite检测细胞增殖活性
(1)将位于对数生长期、状态良好细胞消化重悬并计数。按照2000个/100μl的浓度将原始细胞悬液稀释。充分混匀后将100μl细胞悬液加入不透明的96孔板中,轻微震荡均匀后放入5%二氧化碳培养箱中37℃静止24h。在各次实验中,保留仅加入100μl培养基、无细胞的本底检测孔。
(2)待进入检测时间点后,向各检测孔中加入适量体积的celltiter试剂,水平快速震荡96孔板2min,全程注意避光,室温孵育10min。随后测量光信号,并计算相应的细胞活性。
4、细胞周期检测
(1)细胞固定:将位于对数生长期未处理或转染后的细胞消化计数。按2×105个/2ml稀释细胞,向6孔板各孔中加入2ml稀释后细胞悬液。将6孔板于细胞培养箱中静置培养。至相应检测时间点后,将细胞消化,1000rpm4℃离心5min,弃去终止用培养基。用pbs缓冲液重悬并再次离心后,弃尽上清。向细胞沉淀中加入500μl预冷的70%乙醇,迅速吹打,避免形成多细胞粘连。将固定后的细胞放入-20℃冰箱冻存至少24h后检测细胞周期。
(2)细胞染色:将5×碘化丙啶细胞周期检测溶液稀释至工作浓度后4℃预冷并避光保存。将固定后的细胞取出,1000rpm4℃离心5min后弃去乙醇上清,加入500μlpbs缓冲液重悬细胞,并置于冰上水化5min。随后再次低温离心弃去pbs,加入500-300μl碘化丙啶染液,充分重悬细胞,在室温下避光孵育15min。
(3)细胞周期检测:使用cyanadp流式细胞仪检测细胞周期,并经modfit分析原始数据,拟合并量化各周期细胞比例。
5、westernblot
(1)细胞裂解及蛋白收集:将接受处理的细胞消化后,1000rpm4℃离心5min,弃上清,pbs洗涤一次,置于冰上。按比例向ripa细胞裂解液中加入pmsf、蛋白酶抑制剂cocktail,充分混匀后加入收集到的细胞中。反复吹打重悬细胞并置于冰上孵育30min,每10min高速震荡细胞裂解液。随后将细胞裂解液4℃12000rpm离心10min,收集上清,置于冰上。
(2)bca蛋白定量:4℃融化天根bca定量试剂盒中bsa标准液配置标准曲线蛋白溶液。
(3)将各浓度标准品25μl加入96孔板中,同时将(1)中收集的蛋白溶液取5μl与20μl裂解液混合后也加入96孔板。按50:1的比例混合试剂盒中工作液a及工作液b,向每孔中加入200μl混合液。将96孔板放置于37℃恒温培养箱(无二氧化碳)中孵育30min,随后检测各孔562nm处吸光度。依据标准品吸光度绘制标准曲线,并计算各样品蛋白浓度。
(4)向各组蛋白溶液按比例加入6×上样缓冲溶液,充分混匀后100℃煮样变形15min。将样品保存于-20℃。
(5)sds-page不连续胶配制:向玻璃胶板夹层中加入4.5ml未凝固的分离胶,并使用75%乙醇溶液封闭凝胶上侧界面。待胶体凝固后,完全弃去、风干乙醇,加入配制好的浓缩胶,并插入10孔梳子。待其凝固后,用保鲜膜包裹放置于4℃冰箱保存。
(6)sds-page电泳:将配制好的sds-page不连续胶取出,结合mini-proteantetra设备组装为电泳系统。向槽内外侧加入按比例配好的电泳缓冲液。同时冰上融化蛋白样品,100℃再次煮样5min。待蛋白样品降至室温,将其高速震荡均匀。根据各样品蛋白浓度按顺序向各孔中加入30μg蛋白样品。各孔。随后接通电源,恒压80v电泳30min后改用恒压120v电压分离蛋白1h。
(7)pvdf膜蛋白转移:电泳结束后,取出凝胶。切除分离胶部分后,余下凝胶一侧紧贴经甲醇处理的pvdf膜,一同按正确电场位置置入bio-rad转膜槽中。倒入预冷的转膜缓冲液工作液直至没过pvdf膜上缘。将装置外槽没入冰水中,接通电源,恒定电流180ma转膜2h。
(8)免疫印迹:转膜结束后,取出pvdf膜,用5%脱脂奶粉tbst溶液室温封闭非特异性结合位点2h。弃去封闭缓冲液,加入由5%bsa缓冲液配制的一抗,并放于4℃环境,钟摆式摇床震荡孵育过夜。次日弃去一抗,tbst洗涤三次,每次5min。再使用对应的5%bsa缓冲液配制的二抗孵育pvdf膜。室温孵育2h后,弃去二抗。tbst洗涤三次,每次5分钟。
(9)蛋白检测:抗体标记完毕后,配制ecl显色底物,并均匀覆盖pvdf膜表面。使用las生物发光成像仪检测目标蛋白位置ecl底物反应后释放的光子,选择合适曝光时间,并保存图像为tiff格式。
6、细胞凋亡检测
将待检测细胞消化离心后用pbs缓冲液离心洗涤1次,再与300μl含有1%pi及1%annexin-v-fitc的染色缓冲液混合,用cyanadp流式细胞仪在488nm激光检测fitc-petexared细胞分布图中检测、量化凋亡及机械损伤细胞比例。
7、hoechst染色
将预先铺板的6孔板弃去上清,用pbs缓冲液洗涤2次。加入预先用pbs配置好的100ng/ml的hoechst33342染液,在37℃培养箱中避光孵育15min,弃去染料,每孔加入500ulpbs,荧光显微镜下拍照。
8、裸鼠成瘤实验
(1)建立肝癌移植瘤模型:将人肝癌细胞lm6消化后,用无血清培养基重悬成浓度为106个/100ul的细胞悬液,以微量注射器接种于裸鼠右侧腋部皮下,100ul/只。接种1周后可见注射部位形成癌结节。接种后第14天开始rnai实验。实验裸鼠分成2组:①空白对照组,仅注射生理盐水;②asb3sirna干扰组,瘤内注射asb3sirna。
(2)sirna的瞬时转染:生理盐水溶解各组sirna,以无菌微量注射器于肿瘤局部多点注射,单次用量10ug/50ul/只,隔天注射一次,共转染6次,末次转染后第2天处死实验动物。
(3)肿瘤体积计算:应用游标卡尺于rnai实验中隔天测量肿瘤大小。肿瘤最大直径为a,最小直径为b,根据公示v=0.5ab2计算肿瘤体积。
9、免疫组化染色
(1)脱蜡与水化:将组织芯片于60℃恒温箱中烘烤20min,取出后置于二甲苯中浸泡10min,更换二甲苯后再浸泡10min。
(2)抗原修复:微波炉中加热0.01枸橼酸钠缓冲液(ph6.0)至沸腾,然后将组织芯片放入,间隔5-10min,反复1-2次。
(3)封闭:滴加正常山羊血清封闭液,室温20min,甩去多余液体。
(4)一抗孵育:孵育一抗(抗asb3)37℃温箱60min,然后置于4℃湿盒中过夜。
(5)二抗孵育:pbs洗涤3次后,滴加生物素化ii抗,20℃-30℃20min.
(6)dba显色:pbs洗涤4次后,dba试剂盒显色液显色。
(7)脱水,透明,封片,镜检。
10、统计分析
实验结果采用三次独立实验的平均值和标准差表示,用t检验比较差异。p值小于0.05认为有统计学差异。统计采用spss软件。
三、结论
1、asb3在hcc中高表达,且其表达量与生存期负相关。
在对含133例肝细胞肝癌(癌/癌旁)组织芯片进行asb3免疫组化染色后,可见asb3在癌组织中表达量明显高于癌旁组织。且在asb3高表达组患者中,其生存期及无复发生存期明显高于低表达组患者。提示asb3与肝细胞肝癌的进展及预后密切相关,可能成为抗肝癌治疗的重要靶点。
2、本发明所采用的sirna能特异性干扰目标基因asb3。
本发明所采用的rnai干扰序列转染肝癌细胞系lm6,asb3的蛋白水平在转染24-96h含量下降至对照组的50%以下,说明本发明所采用的rnai序列能对靶基因asb3产生沉默效应。
3、干扰asb3能够显著抑制肝癌细胞的增殖。
在使用rnai干扰asb3后,肝癌细胞出现了明显的增殖抑制,尤其在96h时,细胞活力降至对照组50%以下。在干扰asb372h以后可见显著的周期阻滞效应:处于sub-g1期的细胞比例升高,g2/m细胞比例下降。
4、干扰asb3能够诱发肝癌细胞的凋亡。
对细胞行hochest染色可见,在干扰了asb396h之后,细胞的密度明显降低,且细胞核固缩致密,呈凋亡的形态学改变。流式检测结果表明在48h后,处于凋亡状态的细胞随时间明显增加。凋亡相关蛋白c-parp的含量在干扰asb3后24-96h梯度增加,进一步证实了干扰asb3诱发了肝癌细胞的凋亡。
5、干扰asb3对裸鼠移植瘤有治疗效应。
在裸鼠荷瘤实验中,原位注射asb3sirna10d后,处理组小鼠的肿瘤体积相较对照组较小,有显著差异,提示asb3sirna对于裸鼠荷瘤模型有显著的治疗效应。
综上所述,本发明涉及的sirna所针对的靶点asb3在肝癌中高表达,而通过rnai技术沉默asb3,能够明显抑制肝癌细胞的增殖活力,诱导肝癌细胞凋亡,对于裸鼠皮下肝癌种植瘤具有治疗作用。本发明所采用的技术方式能够为肝癌提供一种特异性的治疗手段,能够帮助解决中晚期肝癌非手术治疗效果及预后不佳等问题,具有重要的应用价值。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
sequencelisting
<110>复旦大学附属华山医院
<120>e3泛素连接酶asb3在制备肝癌治疗药物中的应用
<130>/
<160>2
<170>patentinversion3.3
<210>1
<211>19
<212>rna
<213>人工序列(artificial)
<400>1
gaaauauggagcccagaua19
<210>2
<211>19
<212>rna
<213>人工序列(artificial)
<400>2
uaucugggcuccauauuuc19
- 还没有人留言评论。精彩留言会获得点赞!